RESTELOX - Tabletas
Sustancia(s):
- Olmesartán
Presentaciones:
- 1 Caja, 7 Tabletas, 20 Miligramos
- 1 Caja, 14 Tabletas, 20 Miligramos
- 1 Caja, 28 Tabletas, 20 Miligramos
- 7 Caja, 7 Tabletas, 40 Miligramos
- 1 Caja, 14 Tabletas, 40 Miligramos
- 1 Caja, 28 Tabletas, 40 Miligramos
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA contiene:
Olmesartán medoxomilo 20 mg
Excipiente, c.b.p. 1 tableta.
Olmesartán medoxomilo 40 mg
Excipiente, c.b.p. 1 tableta.
INDICACIONES TERAPÉUTICAS: Olmesartán medoxomilo está indicado para el tratamiento de la hipertensión arterial. Puede administrarse solo o en combinación con otros agentes antihipertensivos.
FARMACOCINÉTICA Y FARMACODINAMIA:
Farmacocinética: El olmesartán medoxomilo se bioactiva rápida y completamente a través de la hidrólisis del éster, transformándose en olmesartán durante la absorción en el tracto gastrointestinal. El olmesartán parece eliminarse en forma bifásica, con una vida media de eliminación terminal de aproximadamente 13 horas. Con posterioridad a la administración de dosis orales únicas de hasta 320 mg y de dosis orales múltiples de hasta 80 mg, el olmesartán presenta una farmacocinética lineal. Los niveles de olmesartán en estado estable se alcanzan al cabo de 3 a 5 días y con la administración de una sola toma diaria no se produce acumulación plasmática.
La biodisponibilidad absoluta de olmesartán es de aproximadamente 26%. Después de la administración oral, la concentración plasmática máxima (Cmáx) de olmesartán se alcanza en el lapso de 1 a 2 horas. Los alimentos no afectan la biodisponibilidad de olmesartán.
Luego de la rápida y completa conversión de olmesartán medoxomilo en olmesartán durante la absorción, virtualmente no se produce ningún paso metabólico adicional de olmesartán. La depuración plasmática total de olmesartán es de 1.3 L/h, con una depuración renal de 0.6 L/h. Aproximadamente 35 a 50% de la dosis absorbida se recupera en la orina, en tanto que el remanente se elimina en las heces, a través de la bilis.
El volumen de distribución de olmesartán es de aproximadamente 17 litros. El olmesartán presenta una elevada unión a las proteínas plasmáticas (99%) y no penetra en los glóbulos rojos. La unión proteica es constante aún a concentraciones plasmáticas de olmesartán muy superiores al rango alcanzado con las dosis recomendadas.
En ratas, el olmesartán atravesó la barrera hematoencefálica en forma escasa; atravesó la barrera placentaria y se distribuyó en el feto. En ratas, también se distribuyó en la leche, en bajas concentraciones.
Poblaciones especiales:
Pediatría: No se investigó la farmacocinética de olmesartán en pacientes menores de 18 años de edad.
Geriatría: La farmacocinética de olmesartán se estudió en los sujetos de edad avanzada (³ 65 años). En general, las concentraciones plasmáticas máximas de olmesartán fueron similares en los adultos jóvenes y en los sujetos de edad avanzada. En los pacientes geriátricos se observó una modesta acumulación con la administración de dosis repetidas (el AUCss-t fue 33% mayor en los pacientes de edad avanzada, lo que corresponde aproximadamente a una reducción de 30% en la depuración renal).
Género: Se observaron diferencias mínimas en la farmacocinética de olmesartán en mujeres en comparación con los hombres. El AUC y la Cmáx fueron 10-15% mayor en las mujeres que en los hombres.
Insuficiencia renal: En los pacientes con insuficiencia renal, las concentraciones séricas de olmesartán resultaron elevadas en comparación con las de los individuos con función renal normal. En los pacientes con insuficiencia renal grave (depuración de creatinina < 20 ml/min), el AUC aproximadamente se triplicó después de la administracíón repetida. Aún no se ha estudiado la farmacocinética de olmesartán en pacientes sometidos a hemodiálisis.
Insuficiencia hepática: Se observaron aumentos en el AUC O-∞ y la Cmáx en pacientes con insuficiencia hepatica moderada, en comparación con los valores obtenidos en los controles equivalentes, con un aumento en el AUC de alrededor de 60%.
Farmacodlnamia: El olmesartán medoxomilo es una prodroga que durante la absorción en el tracto gastrointestinal es hidrolizada, dando lugar a olmesartán, el compuesto biológicamente activo. El olmesartán es un antagonista selectivo de los receptores de la angiotensina II subtipo AT1.
Mecanismo de acción: La angiotensina II se forma a partir de la angiotensina I a través de una reacción catalizada por la enzima convertidora de angiotensina (ECA, quininasa II). La angiotensina II es la principal sustancia presora del sistema renina-angiotensina, con efectos que incluyen vasoconstricción, estimulación de la síntesis y liberación de aldosterona, estimulación cardiaca y reabsorción renal de sodio. El olmesartán impide los efectos vasoconstrictores de la angiotensina II, al bloquear selectivamente la unión de la angiotensina II a los receptores AT1 en el músculo liso de la pared vascular. Por lo tanto, su acción es independiente de las vías seguidas para la síntesis de angiotensina II.
También se han encontrado receptores AT2 en otros tejidos, pero se desconoce su vinculación con la homeostasis cardiovascular. El olmesartán tiene una afinidad 12,500 veces superior por el receptor AT1 que por el receptor AT2.
El bloqueo del receptor de la angiotensina I inhibe la retroalimentación negativa de la angiotensina II sobre la secreción de renina, pero el incremento resultante de la actividad de la renina plasmática y de los niveles de anglotensina II circulante no supera el efecto del olmesartán sobre la presión arterial.
Farmacodinamia: Dosis de 2.5 a 40 mg de olrnesartán medoxomilo inhiben el efecto hipertensivo de la infusión de angiotensina I. La duración del efecto inhibitorio estuvo relacionada con la dosis, hallándose que dosis de olmesartán medoxomilo ?40 mg producen una inhibición ?90% a las 24 horas.
Las concentraciones plasmáticas de angiotensina I y angiotensina II, y la actividad de la renina plasmática (ARP) aumentaron con posterioridad a la administración única y repetida de ofrnesartán medoxomilo a individuos sanos y a pacientes hipertensos. La administración repetida de hasta 80 mg de olmesartán medoxomilo influyó mínimamente sobre los niveles de aldosterona y no tuvo efecto sobre el potasio sérico.
Eficacia clínica: Siete estudios han reportado los efectos antihipertensivos de olmesartán medoxomilo mediante estudios controlados por placebo con dosis que oscilaban entre 2.5 a 80 mg durante 6 a 12 semanas, en los que se comprobaron reducciones estadísticamente significativas en la presión arterial máxima y mínima. En total se estudiaron 2,693 pacientes (2,145 con olmesartán medoxomilo y 548 con placebo) con hipertensión esencial. Olmesartán medoxomilo una vez por día disminuyó la presión arterial diastólica y sistólica. La respuesta estaba relacionada con la dosis, tal como se muestra en la gráfica siguiente. Una dosis de 20 mg diarios de olmesartán medoxomilo produce una reducción de la presión arterial en sedestación en comparación con un placebo de alrededor de 10/6 mmHg y una dosis de 40 mg por día produce una reducción en la presión arterial en sedestación superior a la observada en el placebo de 12/7 mmHg. Las dosis de olmesartán medoxomilo por encima de 40 mg exhibieron escasos efectos adicionales. El inicio del efecto antihipertensivo se produjo dentro de la primera semana y se hizo notablemente manifiesto después de 2 semanas.
Respuesta a la dosis de olmesartán medoxomilo. Reducción ajustada al placebo en la presión arterial (mmHg)
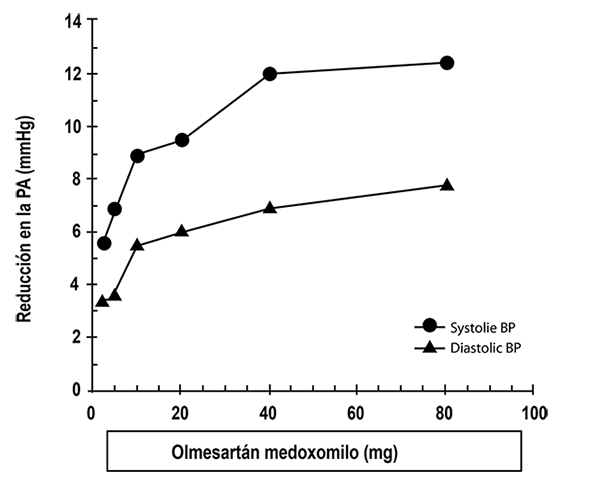
Los datos precedentes provienen de siete estudios controlados por placebo (2,145 pacientes tratados con olmesartán medoxomilo y 548 pacientes que recibieron placebo). El efecto reductor de la presión arterial se mantuvo durante un periodo de 24 horas con olmesartán medoxomilo una vez por día, observándose relaciones entre el efecto máximo y mínimo en la respuesta sistólica y diastólica entre 60 y 80%.
El efecto reductor de la presión arterial logrado con olmesartán medoxomilo, con o sin hidroclorotiazida, se mantuvo en los pacientes tratados hasta durante un año. No se observaron evidencias de taquifilaxia durante el tratamiento prolongado o el efecto de rebote al suspender el olmesartán medoxomilo después de un año de tratamiento.
El efecto antihipertensivo fue similar en uno u otro sexo, y en los pacientes mayores y menores de 65 años de edad.
Olmesartán medoxomilo tiene un efecto reductor de la presión arterial adicional si se administra concomitantemente con hidroclorotiazida.
CONTRAINDICACIONES: Olmesartán medoxomilo está contraindicado en pacientes con hipersensibilidad a cualquier componente de la medicación y durante el embarazo, lactancia, menores de 18 años.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: Se deben comunicar a las mujeres en edad fértil los riesgos de la exposición durante el segundo y tercer trimestre del embarazo a drogas que actúen sobre el sistema renina-angiotensina y también se debe avisar que estas consecuencias no parecen resultar de la exposición intrauterina al fármaco que estuvo limitada al primer trimestre.
Los médicos deben ser informados de la ocurrencia de un embarazo a la brevedad. Las drogas que actúan directamente sobre el sistema renina-angiotensina pueden causar morbilidad y muerte fetal o neonatal, cuando se las administra a mujeres embarazadas, tal como se ha comunicado en la literatura en pacientes que estaban recibiendo inhibidores de la ECA. Cuando se detecte el embarazo, la administración de olmesartán medoxomilo se debe discontinuar tan pronto como sea posible y debería considerarse la administración de terapias alternativas. No se dispone de experiencia clínica con olmesartán medoxomilo en mujeres embarazadas (véase Contraindicaciones).
Lactancia: No se sabe si olmesartán se excreta en la leche humana, pero se informó que se secreta en baja concentración en la leche de las ratas durante la lactancia. Debido al potencial para producir efectos adversos en los lactantes, se debe decidir si se discontinúa la lactancia o se interrumpe el tratamiento, teniendo en cuenta la importancia de la droga para la madre.
REACCIONES SECUNDARIAS Y ADVERSAS: En los estudios clínicos, el tratamiento con olmesartán medoxomilo fue bien tolerado, con una incidencia de eventos adversos similar a la observada con placebo. En los estudios clínicos controlados con placebo el único evento adverso que ocurrió en más de 1% de los pacientes tratados con olmesartán medoxomilo, y con una incidencia superior al placebo, fue mareo (3% vs. 1%). En general, los eventos fueron leves, transitorios y no tuvieron relación con la dosis administrada de olmesartán medoxomilo. La frecuencia general de eventos adversos no se relacionó con la dosis.
Se informaron los siguientes eventos adversos (con una incidencia mayor de 1% de los pacientes tratados con olmesartán medoxomilo): dolor lumbar, bronquitis, aumento de la creatinfosfoquinasa (CPK), diarrea, cefalea, hematuria, hiperglucemia, hipertrigliceridemia, síntomas de tipo gripal, faringitis, rinitis y sinusitis. Estos eventos ocurrieron con igual o mayor incidencia en los pacientes que recibieron placebo.
También se han comunicado los siguientes eventos adversos:
Generales: Tos, dolor torácico, edema periférico.
Sistema nervioso central y periférico: Vértigo.
Gastrointestinales: Dolor abdominal, dispepsia, gastroenteritis, náuseas.
Trastomos de la frecuencia y el ritmo cardiaco: Taquicardia.
Trastornos metabólicos y nutricionales: Hipercolesterolemia, hiperlipemia, hiperuricemia.
Musculoesqueléticos: Artralgia, artritis, mialgia.
Piel y anexos: Erupción cutánea.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Olmesartán medoxomilo no resultó carcinogénico cuando se administró a ratas durante un periodo de hasta 2 años. La dosis más alta evaluada (2,000 mg/kg/día) fue calculada sobre una base mg/m2, aproximadamente 480 veces superior a la dosis humana máxima recomendada (DHMR) de 40 mg/día. Dos estudios de carcinogenicidad conducidos en ratones, un estudio de 6 meses de administración por sonda gástrica en el ratón knockout para el gen p53, y un estudio de 6 meses de administración con la dieta en el ratón transgénico Hras2, en los cuales se administraron dosis de hasta 1,000 mg/kg/día, alrededor de unas 120 veces la dosis humana máxima recomendada (DHMR), no mostraron evidencias de un efecto carcinogénico.
Tanto olmesartán medoxomilo como olmesartán, arrojaron resultados negativos in vivo en el ensayo de transformación de células embrionarias en cobayo sirio y no demostraron evidencias de toxicidad genética en el test de AMEs (mutagénesis bacteriana). No obstante, ambos demostraron inducir aberraciones cromosómicas in vitro en un cultivo de células de pulmón de cobayo chino, y ambos dieron resultados positivos para mutaciones de la timidina quinasa in vitro en el ensayo de linfoma en ratón. Olmesartán medoxomilo resultó negativo para las mutaciones in vivo en las pruebas con intestino y riñón de MutaMouse y en la prueba de clastogenicidad en médula ósea de ratón (test de micronúcleos) con dosis orales de hasta 2,000 mg/kg (no se efectuaron estudios con olmesartan).
La fertilidad de las ratas no se vio afectada por la administración de olmesartán medoxomllo, en dosis de hasta 1,000 mg/kg/día (240 veces la DHMR) en un estudio en el cual la administración comenzó 2 semanas o 9 semanas antes del apareamiento, en hembras y machos, respectivamente.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: No se comunicaron interacciones medicamentosas significativas en los estudios en los que se administró olmesartán medoxomilo conjuntamente con digoxina o warfarina en voluntarios sanos. La biodisponibilidad de olmesartán no fue significativamente alterada por la administración concomitante de antiácidos (hidróxido de aluminio/hidróxido de magnesio). Olmesartán medoxomilo no se metaboliza a través del sistema del citocromo P-450 y no tiene efectos sobre las enzimas P-450; por lo tanto, no cabe esperar la aparición de interacciones con fármacos que inhiben, inducen o son metabolizados por esas enzimas.
El uso concomitante de olmesartán medoxomilo con otros principios activos que afecten la excreción de potasio (por ejemplo, diuréticos ahorradores de potasio, inhibidores de la ECA, betabloqueantes, antiinflamatorios no esteroides, trimetoprima, etcétera) o con suplementos orales de potasio, puede causar hipercaliemia, especialmente en pacientes diabéticos y/o en pacientes con insuficiencia renal.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Hemoglobina y hematócrito: Se observaron modestas reducciones en la hemoglobina y el hematócrito (reducciones medias de aproximadamente 0.3 g/dl y 0.3 vol %, respectivamente), que no fueron clínicamente significativas.
Pruebas de función hepática: lnfrecuentemente se informaron elevaciones de las enzimas hepáticas y/o de la bilirrubina sérica.
Durante la experiencia poscomercialización se han informado raros casos de angioedema y de rabdomiólisis en los pacientes tratados con olmesartán medoxomilo.
PRECAUCIONES GENERALES:
Alteraciones de la función renal: Como consecuencia de la inhibición del sistema renina-angiotensina-aldosterona, pueden anticiparse alteraciones de la función renal en individuos susceptibles tratados con olmesartán medoxomilo. En los pacientes cuya función renal pueda depender de la actividad del sistema renina-angiotensina-aldosterona (por ejemplo, pacientes con insuficiencia cardiaca congestiva grave), el tratamiento con inhibidores de la enzima convertidora de angiotensina y con antagonistas de los receptores de angiotensina se ha asociado con oliguria y/o hiperazoemia progresiva y (raramente) con insuficiencia renal aguda y/o muerte. Pueden esperarse resultados similares en los pacientes tratados con olmesartán medoxomilo.
En los estudios efectuados con inhibidores de la ECA en pacientes con estenosis unilateral o bilateral de la arteria renal, se informaron aumentos de la creatinina sérica o del nitrógeno ureico sanguíneo (BUN). No existe experiencia con el uso prolongado de olmesartán medoxomilo en pacientes con estenosis unilateral o bilateral de la arteria renal, pero cabe esperar resultados similares.
Hipotensión en pacientes con depreción de volumen o de sal: En pacientes cuyo sistema renina-angiotensina esté activado, como aquellos con depleción de volumen o de sal (por ejemplo, pacientes en tratamiento con altas dosis de diuréticos), puede ocurrir hipotensión sintomática una vez iniciada la terapia con olmesartán medoxomilo. El tratamiento debe comenzarse bajo una cuidadosa supervisión médica. En caso de producirse hipotensión se debe colocar al paciente en posición supina y, si es necesario, debe administrarse una infusión intravenosa de solución salina normal. La aparición de una respuesta hipotensora transitoria no constituye una contraindicación para el posterior tratamiento, el cual por lo general puede continuarse sin dificultad una vez que se haya estabilizado la presión arterial.
Uso en pacientes pediátricos: No se han llevado a cabo estudios controlados en pacientes menores de 18 años.
Uso en pacientes geriátricos: Del número total de pacientes hipertensos tratados con olmesartán medoxomilo en los estudios clínicos, más de 20% tenían 65 años de edad o más, mientras que más de 5% tenían 75 años de edad o más. No se observaron diferencias generales en la eficacia o la seguridad entre los pacientes de edad avanzada y los más jóvenes. Otras experiencias clínicas reportadas no identificaron diferencias en las respuestas entre los pacientes de edad avanzada y los pacientes más jóvenes, aunque no puede descartarse una mayor sensibilidad en algunos individuos de edad avanzada.
DOSIS Y VÍA DE ADMINISTRACIÓN: La dosis inicial usualmente recomendada de olmesartán medoxomilo es de 20 mg una vez por día, cuando se emplea como monoterapia en pacientes que no presentan depleción de volumen. En los pacientes que requieren una reducción adicional de la presión arterial luego de 2 semanas de tratamiento, la dosis puede incrementarse a 40 mg una vez por día. Dosis superiores a 40 mg no parecen tener un mayor efecto. La administración de dos dosis diarias no ofrece ventajas sobre la administración de la misma dosis total en una única toma diaria. El efecto antihipertensivo usualmente se manifiesta en la primera semana y la reducción máxima de la presión arterial por lo general se alcanza al cabo de 2 semanas de tratamiento con olmesartán medoxomilo.
No es necesario efectuar un ajuste de la dosis inicial en los pacientes de edad avanzada, pacientes con insuflcíencia renal leve a moderada o con disfunción hepática leve a moderada. En los pacientes con posible depleción del volumen intravascular (por ejemplo, pacientes tratados con diuréticos, particularmente aquellos con alteraciones de la función renal), insuficiencia renal grave (depuración de creatinina < 20 ml/min), o insuficiencia hepática grave, se debe iniciar el tratamiento bajo una cuidadosa supervisión médica y se debe considerar la posibilidad de utilizar una dosis inicial más baja.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: Los datos disponibles con relación a la sobredosis en seres humanos son limitados, Las manifestaciones más probables de una sobredosis serían hipotensión y taquicardia; podría observarse bradicardia en caso de estimulación parasimpática (vagal). Si se produce hipotensión sintomática, debe iniciarse el tratamiento de sostén. Se desconoce si el olmesartán es dializable.
PRESENTACIONES:
Cajas con 7, 14 y 28 tabletas de 20 mg.
Cajas con 7, 14 y 28 tabletas de 40 mg.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a no más de 30ºC.
LEYENDAS DE PROTECCIÓN:
No se use en el embarazo y la lactancia. Su venta requiere receta médica. Literatura exclusiva para médicos. No se deje al alcance de los niños. Prohibida la venta fraccionada del producto. Este medicamento puede producir somnolencia y afectar el estado de alerta, por lo que no deberá conducir vehículos automotores ni maquinaria pesada durante su uso.
Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx
Hecho en India por:
Hetero Labs Limited Unit-V
APIIC Formulation SEZ
S. No. 439, 440, 441 & 458
Polepally Village, Jadcherla Mandal
Mahaboob Nagar District
Andhra Pradesh, India
PIN-509301
Acondicionado por:
Hetero Labs Limited Unit-V
APIIC Formulation SEZ
S. No. 439, 440, 441 & 458
Polepally Vlllage, Jadcherla Mandal
Mahaboob Nagar District
Andhra Pradesh, India
PIN-509301
o
Wyeth, S. de R. L. de C. V.
Poniente 134 No. 740
Col. Industrial Vallejo, C.P. 02300 Deleg. Azcapotzalco, Distrito Federal
Distribuido por:
Wyeth, S. de R. L. de C. V.
Poniente 134 No. 740
Col. Industrial Vallejo, C.P. 02300
Deleg. Azcapotzalco, Distrito Federal
o
ASPEN LABS, S. A. de C. V.
Poniente 134 No. 702, Local 1
Col. Industrial Vallejo, C.P. 02300
Deleg. Azcapotzalco, Distrito Federal
Reg. Núm. 157M2015, SSA
