
REBIF NF
INTERFERÓN BETA 1A
Solución
1 Caja , 1 Cartucho(s) , 22/0.5 µg/ml
1 Caja , 4 Cartucho(s) , 22/0.5 µg/ml
1 Caja , 1 Cartucho(s) , 44/0.5 µg/ml
1 Caja , 4 Cartucho(s) , 44/0.5 µg/ml
FORMA FARMACÉUTICA Y FORMULACIÓN:
Solución inyectable libre de albúmina en cartucho
prellenado.
Cada cartucho prellenado contiene:
REBIF® NF multidosis 22 µg:
Interferón beta 1a* 66 µg
Excipientes, c.b.p. 1.5 ml.
REBIF® NF multidosis 44 µg:
Interferón beta 1a* 132 µg
Excipientes, c.b.p. 1.5 ml.
* Producido por tecnología del ADN recombinante en células de ovario de hámster chino (CHO-K1).
INDICACIONES TERAPÉUTICAS:
REBIF® NF multidosis 44 y 22 µg están indicados para el tratamiento de:
• Pacientes con esclerosis múltiple remitente-recurrente (EMRR). En los ensayos clínicos, esto se caracterizó por la aparición de dos o más brotes en los dos años previos.
No se ha demostrado su eficacia en aquellos pacientes que presentan esclerosis múltiple secundaria progresiva que dejan de presentar actividad de brotes.
REBIF® NF multidosis 44 µg está indicado para el tratamiento de:
• Pacientes con un único episodio desmielinizante con proceso inflamatorio activo, si se han excluido los diagnósticos alternativos y si se determina que presentan un alto riesgo de desarrollar esclerosis múltiple clínicamente definida (véase Propiedades farmacodinámicas).
• Pacientes con esclerosis múltiple en brotes. En los ensayos clínicos, esto se caracterizó por la aparición de dos o más brotes en los dos años previos (véase Propiedades farmacodinámicas).
No se ha demostrado su eficacia en aquellos pacientes que presentan esclerosis múltiple secundaria progresiva que dejan de presentar actividad de brotes.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: Inmunoestimulantes, interferones, código ATC: L03 AB07.
Los interferones (IFNs) son un grupo de glicoproteínas endógenas, dotadas de propiedades inmunomoduladoras, antivirales y antiproliferativas.
REBIF® NF (interferón beta-1a) comparte la misma secuencia de aminoácidos con el interferón beta humano endógeno. Se produce en células de mamífero (ovario de hámster chino), por lo que está glicosilado, como la proteína natural.
El mecanismo de acción preciso de REBIF® NF en la esclerosis múltiple todavía se está investigando.
Episodio clínico único sugestivo de esclerosis múltiple: Se realizó un ensayo clínico controlado de 2 años de duración con REBIF® NF en pacientes con un único episodio clínico sugestivo de desmielinización debido a esclerosis múltiple. Los pacientes enrolados en el estudio tenían al menos dos lesiones clínicamente silentes en la imagen por resonancia magnética (IRM) con base en lesiones T2, con un tamaño de al menos 3 mm, de las cuales al menos una es ovoidea o periventricular o infratentorial. Era necesario excluir cualquier enfermedad distinta de la esclerosis múltiple que pudiera explicar mejor los signos y síntomas del paciente.
Se aleatorizó a los pacientes, según un protocolo de doble ciego, recibiendo REBIF® NF 44 µg tres veces por semana, REBIF® NF 44 µg una vez a la semana o placebo. En caso de producirse un segundo episodio clínico desmielinizante que confirmase la existencia de una esclerosis múltiple clínicamente definida, se cambiaba a los pacientes a la posología recomendada de REBIF® NF 44 µg tres veces por semana según un protocolo de tratamiento abierto, al tiempo que se mantenía el enmascaramiento con respecto a la aleatorización inicial. Los resultados de eficacia de REBIF® NF 44 µg administrado tres veces por semana en comparación con el placebo en este estudio son los siguientes:
|
Estadísticas paramétricas |
Tratamiento |
Comparación entre tratamientos REBIF® NF 44 µg 3/s frente a placebo |
|||
|
Placebo (n = 171) |
REBIF® NF 44 µg 3/s* (n = 171) |
Reducción del riesgo |
Razón de riesgos proporcionales de Cox [IC 95%] |
Valor de p, rangos logarítmicos |
|
|
Conversión según McDonald (2005) |
|||||
|
Número de episodios |
144 |
106 |
51% |
0.49 [0.38;0.64] |
< 0.001 |
|
Estimación de Kaplan-Meier |
85.8% |
62.5% |
|||
|
Conversión a esclerosis múltiple clínicamente definida |
|||||
|
Número de episodios |
60 |
33 |
52% |
0.48 [0.31;0.73] |
< 0.001 |
|
Estimación de Kaplan-Meier |
37.5% |
20.6% |
|||
|
Media de lesiones activas únicas combinadas por sujeto y resonancia durante el periodo doble ciego |
|||||
|
Media de mínimos cuadrados (error estándar) |
2.58 (0.30) |
0.50 (0.06) |
81% |
0.19 [0.14;0.26] |
< 0.001 |
* 3/s tres veces por semana.
Por el momento, no existe una definición bien establecida de paciente de alto riesgo, aunque un enfoque más conservador es aceptar al menos nueve lesiones T2 hiperintensas en la resonancia inicial y al menos una nueva lesión T2 o una nueva lesión reforzada con gadolinio (Gd+) en una resonancia de seguimiento realizada al menos 1 mes después de la inicial. En cualquier caso, el tratamiento sólo debe considerarse en los pacientes clasificados como de alto riesgo.
Esclerosis múltiple remitente-recurrente: Se ha evaluado la seguridad y eficacia de REBIF® NF en pacientes con esclerosis múltiple remitente-recurrente, a dosis comprendidas entre 11 y 44 µg (3-12 millones de U.I.), administradas por vía subcutánea, tres veces por semana. Se ha demostrado que, a la dosis autorizada, REBIF® NF 44 µg disminuye la incidencia (aproximadamente 30% en 2 años) y la gravedad de los brotes clínicos en pacientes con al menos 2 brotes en los dos años previos y con una escala de discapacidad ampliada de Kurtzke (EDSS) de 0-5.0 al inicio. La proporción de pacientes con progresión de la incapacidad, definida por un incremento de al menos un punto en la EDSS, confirmado tres meses más tarde, se redujo desde 39% (placebo) hasta 27% (REBIF® NF 44 µg). A lo largo de 4 años, la reducción en la tasa media de brotes fue de 22% en los pacientes tratados con REBIF® NF 22 µg y de 29% en los pacientes tratados con REBIF® NF 44 µg, en comparación con un grupo de pacientes tratados con placebo durante 2 años y posteriormente con REBIF® NF 22 o REBIF® NF 44 µg durante otros 2 años.
Esclerosis múltiple secundaria progresiva: En un estudio a 3 años en pacientes con esclerosis múltiple secundaria progresiva (EDSS 3-6.5) con evidencia de progresión clínica en los dos años previos y sin brotes en las 8 semanas anteriores, REBIF® NF no tuvo efecto significativo sobre la progresión de la incapacidad, pero redujo la tasa de brotes 30% aproximadamente. Al dividir la población de pacientes en 2 subgrupos (según hubieran presentado brotes o no en los 2 años previos a la entrada en el estudio), no se observó efecto sobre la incapacidad en los pacientes sin brotes; sin embargo, en aquellos que habían tenido brotes, la proporción de pacientes con progresión de la incapacidad al final del estudio se redujo desde 70% (placebo) hasta 57% (REBIF® NF 22 y 44 µg combinados). Estos resultados obtenidos en un subgrupo de pacientes a posteriori y deben interpretarse con cautela.
Esclerosis múltiple primaria progresiva: REBIF® NF no se ha investigado todavía en pacientes con esclerosis múltiple primaria progresiva y no debe utilizarse en estos pacientes.
Propiedades farmacocinéticas: Tras la administración intravenosa en voluntarios sanos, el interferón beta-1a muestra un pronunciado descenso multiexponencial, y los niveles séricos son proporcionales a la dosis. La vida media inicial es del orden de minutos y la vida media terminal es de varias horas, con la posible existencia de un compartimento profundo. Cuando se administra por vía subcutánea o intramuscular, los niveles séricos de interferón beta permanecen bajos, pero siguen siendo detectables hasta 12-24 horas posinyección. La administración subcutánea o intramuscular de REBIF® NF produce una exposición equivalente al interferón beta.
Tras una dosis única de 60 µg, la concentración máxima, determinada por inmunoensayo, es de alrededor de 6-10 U.I./ml, y se alcanza, como promedio, unas 3 horas después de la inyección. Tras la administración subcutánea de la misma dosis, repetida cada 48 horas hasta un total de 4 dosis, se produce una acumulación moderada (aproximadamente 2.5 veces para el área bajo la curva AUC).
La administración de REBIF® NF se asocia a cambios farmacodinámicos pronunciados, independientemente de la vía utilizada. Tras una dosis única, la actividad intracelular y sérica de la 2-5A sintetasa y las concentraciones séricas de beta-2 microglobulina y neopterina aumentan en las primeras 24 horas, y comienzan a descender a los 2 días. La administración intramuscular y subcutánea da lugar a una respuesta totalmente superpuesta. Tras la administración subcutánea repetida cada 48 horas, hasta un total de 4 dosis, estas respuestas biológicas permanecen elevadas, sin signos de tolerancia. El interferón beta-1a se metaboliza y excreta principalmente por el hígado y los riñones.
CONTRAINDICACIONES:
• Inicio del tratamiento en el embarazo.
• Pacientes con historia de hipersensibilidad conocida al interferón beta natural o recombinante o a alguno de los excipientes.
• Depresión grave activa y/o ideación suicida.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: Existe información limitada sobre el uso de REBIF® NF en el embarazo. Los datos disponibles indican que puede haber un incremento del riesgo de aborto espontáneo. Por lo tanto, durante el embarazo está contraindicado el inicio del tratamiento con REBIF® NF.
Las mujeres en edad fértil deben utilizar medidas anticonceptivas apropiadas. Se debe informar a la paciente que se quede embarazada o que esté planificando un embarazo mientras está en tratamiento con REBIF® NF de los riesgos potenciales y debe considerarse la posibilidad de interrumpir el tratamiento. En pacientes embarazadas que presentan una alta tasa de brotes antes de iniciar el tratamiento, el riesgo de la aparición de un brote grave tras la interrupción del tratamiento con REBIF® NF debe tenerse en cuenta frente al posible riesgo de un aborto espontáneo.
Se desconoce si REBIF® NF se excreta en la leche humana, pero por la posibilidad de aparición de reacciones adversas graves en los lactantes se debe decidir si interrumpir la lactancia o el tratamiento con REBIF® NF.
REACCIONES SECUNDARIAS Y ADVERSAS:
La incidencia más alta de reacciones adversas asociadas a la terapia con REBIF® NF está relacionada con el síndrome pseudogripal. Los síntomas pseudogripales tienden a ser más prominentes al inicio de la terapia y disminuyen en frecuencia con el tratamiento continuado. Aproximadamente 70% de los pacientes tratados con REBIF® NF pueden presentar el típico síndrome pseudogripal durante los primeros seis meses tras iniciar el tratamiento. Aproximadamente 30% de los pacientes también presentarán reacciones en la zona de inyección, principalmente inflamación leve o eritema.
También son frecuentes las elevaciones asintomáticas de las pruebas de función hepática y los descensos de los leucocitos.
La mayoría de las reacciones adversas observadas con IFN-beta-1a suelen ser leves y reversibles, y responden bien a la disminución de la dosis. En caso de presentar efectos adversos graves o persistentes, la dosis de REBIF® NF puede disminuir o interrumpirse temporalmente, a juicio del facultativo.
Las reacciones adversas descritas a continuación se clasifican según su frecuencia de aparición del siguiente modo:
Muy frecuentes: ³ 1/10.
Frecuentes: ³ 1/100 < 1/10.
Poco frecuentes: ³ 1/1,000 < 1/100.
Raras: ³ 1/10,000 < 1/1,000.
Muy raras: < 1/10,000.
Frecuencia no conocida: no puede estimarse a partir de los datos disponibles.
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Los datos se obtuvieron de varios ensayos clínicos controlados en esclerosis múltiple y muestran la frecuencia de reacciones adversas con valores superiores a las observadas con placebo. Las reacciones adversas se enumeran a continuación por frecuencia de aparición y según la clasificación MedDRA por órganos y sistemas.
|
Clasificación por órganos y sistemas |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Frecuencia no conocida* |
|
Infecciones e infestaciones |
Absceso en el sitio de inyección |
Infecciones en el sitio de inyección, incluyendo celulitis. |
||
|
Trastornos de la sangre y del sistema linfático |
Neutropenia, linfopenia, leucopenia, trombocitopenia, anemia |
Púrpura trombocitopénica trombótica/síndrome hemolítico urémico. |
||
|
Trastornos del sistema inmunológico |
Reacciones anafilácticas. |
|||
|
Trastornos endocrinos |
Disfunción tiroidea que a menudo se presenta como hipotiroidismo o hipertiroidismo |
|||
|
Trastornos psiquiátricos |
Depresión, insomnio |
Intento de suicidio. |
||
|
Trastornos del sistema nervioso |
Cefalea |
Convulsiones, síntomas neurológicos transitorios (por ejemplo, hipoestesia, espasmo muscular, parestesia, dificultad para caminar, rigidez musculoesquelética) que pueden imitar exacerbaciones de esclerosis múltiple. |
||
|
Trastornos oculares |
Trastornos vasculares oculares (por ejemplo, retinopatía, exudados algodonosos y obstrucción de la arteria o vena retiniana). |
|||
|
Trastornos vasculares |
Fenómenos tromboembólicos. |
|||
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea. |
|||
|
Trastornos gastrointestinales |
Diarrea, vómito, náuseas |
|||
|
Trastornos hepatobiliares |
Falla hepática, hepatitis con o sin ictericia, hepatitis autoinmune. |
|||
|
Trastornos de la piel y del tejido subcutáneo |
Prurito, erupción, erupción eritematosa, exantema maculopapular |
Edema de Quincke (angioedema), urticaria, eritema multiforme, reacciones cutáneas tipo eritema multiforme, síndrome de Stevens-Johnson, alopecia. |
||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Mialgias, artralgias |
Lupus eritematoso inducido por medicamentos. |
||
|
Trastornos generales y alteraciones en el sitio de administración |
Inflamación en la zona de inyección, reacción en el sitio de inyección, síntomas pseudogripales |
Dolor en el sitio de inyección, fatiga, escalofríos, fiebre |
Necrosis en el sitio de inyección, edema en el sitio de inyección |
|
|
Exploraciones complementarias |
Elevación asintomática de las transaminasas |
Elevaciones graves de las transaminasas |
* Reacciones adversas identificadas mediante farmacovigilancia después de la comercialización (frecuencia no conocida).
El interferón beta presenta tiene cierto potencial para causar daño hepático grave. El mecanismo de los casos raros de disfunción hepática sintomática no se conoce.
La mayoría de los casos de daño hepático grave se produjeron en los primeros seis meses de tratamiento. No se han identificado factores de riesgo específicos. El tratamiento con REBIF® NF debe interrumpirse si aparece ictericia u otros síntomas clínicos de disfunción hepática.
La administración de interferones se ha asociado a anorexia, vértigo, ansiedad, arritmias, vasodilatación y palpitaciones, menorragia y metrorragia.
Puede producirse un aumento de la formación de autoanticuerpos durante el tratamiento con interferón beta.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Los datos de los estudios no clínicos no muestran riesgos especiales para los humanos según los estudios convencionales de seguridad farmacológica, toxicidad en dosis repetidas y genotoxicidad.
No se han realizado estudios de carcinogénesis con REBIF® NF.
Un estudio de toxicidad embriofetal en monos no mostró ninguna evidencia de trastornos de la reproducción.
Según las observaciones realizadas con otros interferones alfa y beta, no puede descartarse un aumento del riesgo de aborto. No se dispone de información sobre los efectos del interferón beta-1a sobre la fertilidad masculina.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: No se han realizado estudios de interacción farmacológica con interferón beta-1a en humanos.
Se ha notificado que los interferones disminuyen la actividad de las enzimas hepáticas dependientes del citocromo P-450, en humanos y en animales. Debe tenerse precaución cuando se administre REBIF® NF asociado a medicamentos con un estrecho índice terapéutico y cuya depuración dependa en gran manera del sistema hepático del citocromo P-450, por ejemplo, los antiepilépticos y algunas clases de antidepresivos.
No se ha estudiado sistemáticamente la interacción de REBIF® NF con los corticoides o la hormona adrenocorticotrópica o corticotropina (ACTH). Los estudios clínicos indican que los pacientes con esclerosis múltiple pueden recibir REBIF® NF y corticoides o ACTH durante los brotes.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Ninguna reportada.
PRECAUCIONES GENERALES: REBIF® NF debe administrarse con precaución en pacientes que presentan trastornos depresivos previos o activos, en particular en aquellos con antecedentes de ideas suicida. Se sabe que existe una mayor frecuencia de depresión e idea suicida en la población con esclerosis múltiple y en asociación con el uso de interferón. Se debe aconsejar a los pacientes tratados con REBIF® NF que notifiquen inmediatamente a su médico cualquier síntoma de depresión y/o idea suicida.
Los pacientes que presenten depresión deben controlarse estrechamente durante el tratamiento con REBIF® NF y tratarse de forma adecuada. Debe considerarse la posibilidad de interrumpir el tratamiento con REBIF® NF.
REBIF® NF debe administrarse con precaución en pacientes con historia previa de crisis epilépticas en aquellos que reciben tratamiento con antiepilépticos, en especial si su epilepsia no está convenientemente controlada con antiepilépticos.
Los pacientes que presentan cardiopatías, como angina, insuficiencia cardiaca congestiva o arritmias, deben vigilarse estrechamente para descartar un empeoramiento de su situación clínica al inicio del tratamiento con interferón beta-1a. Los síntomas del síndrome pseudogripal asociados al tratamiento con interferón beta-1a pueden alterar a los pacientes que presenten cardiopatías.
En algunos pacientes que utilizan REBIF® NF se ha notificado necrosis en la zona de inyección. Para minimizar el riesgo de necrosis en la zona de inyección se debe recomendar a los pacientes que:
• Utilicen una técnica de inyección aséptica.
• Alternen las zonas de inyección cada vez que se inyecten.
Se debe revisar periódicamente el procedimiento de auto-administración por el propio paciente, especialmente si se han producido reacciones en el lugar de la inyección.
Si el paciente presenta cualquier solución de continuidad de la piel, que pueda estar asociada a edema o exudación de líquido desde la zona de inyección, se le debe recomendar que consulte a su médico antes de continuar con las inyecciones de REBIF® NF.
Si los pacientes presentan múltiples lesiones, se debe suspender el tratamiento con REBIF® NF hasta que se hayan curado. Los pacientes con una única lesión pueden continuar el tratamiento, siempre que la necrosis no sea demasiado extensa.
En los estudios clínicos con REBIF® NF, fue frecuente el aumento asintomático de las transaminasas hepáticas (especialmente la alanina aminotransferasa [ALAT]) y 1-3% de los pacientes presentaron elevación de transaminasas hepáticas por encima de 5 veces el límite superior de la normalidad (LSN). En ausencia de síntomas clínicos, deben controlarse los niveles de ALAT antes de iniciar el tratamiento, al cabo de 1, 3 y 6 meses de tratamiento y luego periódicamente. Si la ALAT aumenta más de 5 veces el LSN, debe considerarse una reducción de la dosis de REBIF® NF, para volver a aumentarla gradualmente cuando se hayan normalizado los niveles enzimáticos.
El tratamiento con REBIF® NF debe iniciarse con precaución en pacientes con historia de hepatopatía significativa, evidencia clínica de hepatopatía activa, abuso de alcohol o ALAT sérica elevada (> 2.5 veces el LSN).
El tratamiento con REBIF® NF debe interrumpirse si aparece ictericia u otros síntomas clínicos de disfunción hepática.
REBIF® NF, como los otros interferones beta, tiene cierto potencial para causar daño hepático grave, incluyendo insuficiencia hepática aguda. El mecanismo de los casos raros de disfunción hepática sintomática no se conoce. No se han identificado factores de riesgo específicos.
El empleo de interferones puede acompañarse de alteraciones en las pruebas de laboratorio. La incidencia global de las mismas es ligeramente superior con REBIF® NF 44 que con REBIF® NF 22 µg. Por tanto, además de las pruebas de laboratorio requeridas normalmente para controlar a los pacientes con esclerosis múltiple, tras el inicio del tratamiento con REBIF® NF y en ausencia de síntomas clínicos, se recomienda realizar un control de las enzimas hepáticas y un recuento celular, fórmula leucocitaria y determinación de plaquetas a intervalos regulares (1, 3 y 6 meses) después de la introducción de la terapia con REBIF® NF y luego periódicamente después de su introducción en ausencia de síntomas clínicos. Estas determinaciones deben ser más frecuentes cuando se inicie el tratamiento con REBIF® NF 44 µg.
Los pacientes tratados con REBIF® NF pueden presentar ocasionalmente alteraciones en la función tiroidea de nuevo diagnóstico o un empeoramiento de las ya existentes. Se recomienda practicar pruebas de función tiroidea en situación basal y, si son anormales, cada 6-12 meses tras el comienzo del tratamiento. Si las pruebas basales son normales, no es necesario repetirlas de forma sistemática, pero deben realizarse si aparecen signos clínicos de disfunción tiroidea (véase Reacciones secundarias y adversas).
Se deberá tener precaución y considerar una estrecha monitorización cuando se administre interferón beta-1a en pacientes con insuficiencia renal y hepática graves y en pacientes con mielosupresión grave.
Pueden aparecer en el suero anticuerpos neutralizantes (NAb) frente al interferón beta-1a. La incidencia exacta de la formación de anticuerpos todavía no está clara.
Los datos clínicos sugieren que, después de 24 a 48 meses de tratamiento con REBIF® NF 22 µg, aproximadamente 24% y con REBIF® NF 44 µg aproximadamente 13-14% de los pacientes presentan anticuerpos en suero frente al interferón beta-1a, de forma persistente. La presencia de anticuerpos atenúa la respuesta farmacodinámica al interferón beta-1a (beta-2 microglobulina y neopterina). Aunque el significado clínico de la inducción de anticuerpos no se ha dilucidado totalmente, el desarrollo de anticuerpos neutralizantes se asocia a una reducción de la eficacia sobre los parámetros clínicos y de resonancia magnética. La terapia con interferón deberá ser inmediatamente reconsiderada si se observa una mala evolución clínica asociada a la presencia de anticuerpos neutralizantes persistentes.
Como se menciona en Interacciones medicamentosas y de otro género, se ha reportado que los interferones reducen la actividad de las enzimas hepáticas dependientes del citocromo P-450 en humanos y animales. La tabla mostrada a continuación señala algunos ejemplos tomados de Hisaka et al., 2009, revisión de sustrato típico, drogas inhibidoras e inductoras del citocromo P-450 involucradas en interacciones farmacocinéticas significativas medicamento-medicamento en humanos.
|
Sustrato |
lnhibidor |
Inductor |
|
Tizanidina |
Ciprofloxacina |
Rifampicina |
|
Fenitoína |
Fluconazol |
Ritonavir |
|
Warfarina |
Paroxetina |
Rifabutin |
|
Diazepam |
Celecoxib |
Fenobarbital |
|
Amitriptiline |
Quinidina |
Carbamazepina |
|
Alprazolam |
Fluoxetina |
Fenitoína |
|
Metilprednisolona |
Ketoconazol |
Efavirenz |
Debe tenerse precaución cuando se administra REBIF® NF en combinación con medicamentos que tienen un índice terapéutico estrecho y que dependen grandemente del sistema del citocromo P-450 para su clearance, por ejemplo, los antiepilépticos y algunas clases de antidepresivos. No se han realizado estudios de interacción con interferón beta-1a en humanos. La interacción de REBIF® NF con corticosteroides u hormona adrenocorticotrópica (ACTH) no ha sido estudiada sistemáticamente. Los estudios clínicos indican que los pacientes con esclerosis múltiple pueden recibir REBIF® NF y corticosteroides o ACTH durante las recaídas (véase Interacciones medicamentosas y de otro género).
REBIF® NF debe ser administrado con precaución en pacientes con historia de inmunogenicidad.
El empleo de diversos análisis para detectar los anticuerpos en suero y las diferentes definiciones de "anticuerpos positivos", limitan la capacidad para comparar la antigenicidad entre distintos productos.
Se dispone de escasos datos de eficacia y seguridad en pacientes con esclerosis múltiple sin capacidad ambulatoria. REBIF® NF no ha sido investigado aún en pacientes con esclerosis múltiple primaria progresiva y no se debe utilizar en estos pacientes.
Existe limitada experiencia con interferón beta-1a en niños menores de 12 años con esclerosis múltiple.
Este medicamento contiene 2.5 mg de alcohol bencílico por dosis de 0.5 ml. No se debe administrar a bebés prematuros o neonatos. Puede producir reacciones tóxicas y reacciones anafilactoides en bebés y niños de hasta 3 años de edad.
Precauciones especiales de eliminación y otras manipulaciones: La solución inyectable en un cartucho prellenado está lista para su uso con el dispositivo de autoinyección RebiSmart®.
Para consultar la conservación del dispositivo de autoinyección con el cartucho, véase Recomendaciones sobre almacenamiento. Puede que no estén disponibles todos los dispositivos en los países que se detallan como importadores.
Sólo deben utilizarse soluciones de claras a opalescentes, sin partículas y sin signos visibles de deterioro.
Para uso multidosis.
Después de la primera inyección utilizar en los siguientes 28 días.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
Efectos sobre la capacidad para conducir y utilizar máquinas: Las reacciones adversas que afectan al sistema nervioso central, relacionadas con uso de interferón beta (por ejemplo, mareo), podrían influir sobre la capacidad del paciente para conducir u operar maquinaria.
DOSIS Y VÍA DE ADMINISTRACIÓN: El tratamiento debe instaurarse bajo la supervisión de un médico con experiencia en el tratamiento de la enfermedad.
Primer episodio desmielinizante: La posología para los pacientes que han presentado un primer episodio desmielinizante es de 44 µg de REBIF® NF, administrados tres veces por semana por inyección subcutánea.
Esclerosis múltiple remitente-recurrente: La posología recomendada de REBIF® NF es de 44 µg, administrados tres veces por semana por inyección subcutánea. Una dosis más baja de 22 µg, administrada también tres veces por semana por inyección subcutánea, se recomienda para los pacientes que no toleran la dosis más alta, según considere el especialista tratante.
Inicio del tratamiento: Cuando se inicia por primera vez el tratamiento con REBIF® NF, la dosis debe irse aumentando gradualmente para lograr que aparezca la taquifilaxia (tolerancia) y que así disminuyan las reacciones adversas.
Por lo tanto, es recomendada una titulación de la dosis en la siguiente forma:
• 8.8 µg cada tercer día administrados durante las dos primeras semanas de tratamiento.
• 22 µg cada tercer día administrados durante la tercera y cuarta semanas de tratamiento.
• 44 µg cada tercer día administrados a partir de la quinta semana en adelante.
Antes de la inyección y durante 24 horas después de cada inyección, se recomienda la administración de un analgésico antipirético para reducir los síntomas pseudogripales asociados con la administración de REBIF® NF.
Forma de administración: REBIF® NF Solución para inyección subcutánea en cartucho está diseñado para uso multidosis con el dispositivo electrónico de inyección RebiSmart®, tras un entrenamiento adecuado del paciente y/o persona encargada de su cuidado. El médico debe hablar con el paciente acerca de cuál es el dispositivo más adecuado.
Para la administración, se deben seguir las instrucciones facilitadas en el prospecto y en el manual de instrucciones (instrucciones de uso) que acompañan a RebiSmart®.
Cómo debe administrarse REBIF® NF:
• REBIF® NF debe inyectarse por vía subcutánea (bajo la piel).
• La(s) primera(s) inyección(es) deben administrarse bajo la supervisión de un profesional sanitario adecuadamente cualificado.
• Tras recibir el entrenamiento adecuado, el paciente puede usar cartuchos de REBIF® NF con el dispositivo de autoinyección RebiSmartTM para administrar el medicamento en su domicilio.
• El cartucho es para ser utilizado con el dispositivo electrónico RebiSmart®.
• Con el dispositivo se incluyen unas instrucciones completas sobre su uso; el paciente debe seguirlas atentamente.
Para la administración de REBIF® NF cartuchos, el paciente debe seguir cuidadosamente las siguientes instrucciones:
Antes de empezar:
• Lavar las manos concienzudamente con agua y jabón.
• Sacar el cartucho de REBIF® NF de su envoltorio, quitando la cubierta de plástico.
• Comprobar (justo después de sacarlo del refrigerador) que el cartucho no está congelado accidentalmente en el envase o dentro del dispositivo.
• Para colocar el cartucho en el dispositivo y realizar la inyección, el paciente debe seguir el manual de instrucciones suministrado con su dispositivo.
Dónde inyectar REBIF® NF:
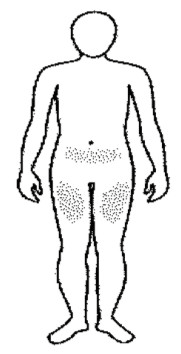
• Elegir un lugar para la inyección. El médico debe indicar dónde puede ponerse la inyección (son zonas adecuadas la parte superior de los muslos y la parte inferior del vientre).
• Se recomienda que el paciente tome nota de las zonas de inyección y las vaya alternando, de manera que no se inyecte con demasiada frecuencia en una zona determinada, a fin de reducir al mínimo el riesgo de necrosis en el lugar de la inyección.
Nota: No utilizar ninguna zona donde exista hinchazón, bultos duros o dolor; hable con su médico o profesional sanitario sobre cualquier cosa que observe.
Antes de realizar las inyecciones debe utilizarse una gasa con alcohol para limpiar la piel en el lugar de inyección. El paciente debe dejar que se seque la piel. Si queda algo de alcohol en la piel, el paciente puede notar una sensación de escozor.
Actualmente, se desconoce el tiempo durante el cual se debe tratar a los pacientes. La seguridad y eficacia de REBIF® NF no se han demostrado durante el periodo posterior a 4 años de tratamiento. Se recomienda evaluar a los pacientes al menos cada dos años en el periodo de los 4 años siguientes al comienzo del tratamiento con REBIF® NF y que el médico decida entonces de forma individualizada si conviene prolongar el tratamiento durante más tiempo.
Uso pediátrico: No se han llevado a cabo ensayos clínicos formales ni estudios farmacocinéticos en niños ni adolescentes. Sin embargo, los datos publicados limitados sugieren que el perfil de seguridad en adolescentes de 12 a 16 años tratados con REBIF® NF 22 µg, por vía subcutánea, tres veces por semana, es similar al observado en adultos. Se dispone de una información limitada sobre el uso de REBIF® NF en niños menores de 12 años y, por lo tanto, REBIF® NF no debe utilizarse en esta población.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: En caso de sobredosis, se debe hospitalizar a los pacientes para observación e instaurar el tratamiento de soporte adecuado.
PRESENTACIONES:
REBIF® NF multidosis se presenta en envases conteniendo un cartucho (de vidrio tipo 1) con tapón (de goma) y cápsula de cierre (de aluminio con goma de halobutilo), prellenados, conteniendo 66 y 132 µg de interferón beta-1a en 1.5 ml de solución inyectable libre de albúmina (que equivalen a 44 y 88 µg/respectivamente).
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Conservar en refrigeración (entre 2 y 8°C) lejos del congelador. No congelar. Conservar el cartucho en su estuche original para protegerlo de la luz.
El dispositivo de RebiSmart® con cartucho prellenado de REBIF® NF debe conservarse en refrigeración (entre 2 y 8ºC) dentro de su caja de almacenamiento de dispositivo.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. No se use después de la fecha de caducidad indicada. No se deje al alcance de los niños. Su venta requiere receta médica.
No se administre si el cierre ha sido violado.
No se use en el embarazo ni en la lactancia.
Sólo deben utilizarse soluciones de transparentes
a opalescentes, sin partículas y sin signos
visibles de deterioro.
Hecho en Italia por:
Merck Serono, S.p.A.
Vía Delle Magnolie 15, (loc. Frazione Zona Industriale)
70026 Modugno, Bari, Italia
y/o
Hecho en Suiza por:
Merck Serono, S. A.
Zone lndustrielle de l'Ouriettaz, 1170
Aubonne, Suiza
Acondicionado en Uruguay por:
Ares Trading Uruguay, S. A. (A.T.U.S.A.)
Ruta 8, Km. 17.500 Zona América
Montevideo-Uruguay
Distribuido en México por:
MERCK, S. A. de C. V.
Calle 5 No. 7
Fracc. Industrial Alce Blanco, C.P. 53370
Naucalpan de Juárez, Edo. de México
Reg. Núm. 089M2010, SSA