
NOVORAPID
INSULINA HUMANA
Solución inyectable
1 Caja, 1 Frasco(s) ámpula, 10 ml, 100 U/ml
1 Caja, 5 Cartucho(s), 3 ml, 100 U/ml
1 Caja, 1 Pluma precargada, 100 U/ml
1 Caja, 5 Pluma precargada, 100 U/ml
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada mL contiene:
Insulina asparta* 100 U
(equivalente a 3.5 mg)
Vehículo cbp 1 mL
1 mL de la solución contiene 100 U de insulina Asparta, equivalente a 3.5 mg.
Frasco Ámpula: 1 frasco ámpula contiene 10 mL equivalente a 1000 U.
Cartucho Penfill®: 1 cartucho contiene 3 mL equivalente a 300 U. Pluma precargada FlexPen®: 1 pluma precargada contiene 3 mL equivalente a 300 U.
Solución para inyección en frasco ámpula/Cartucho Penfill®/Pluma precargada FlexPen®.
* Insulina asparta es producida mediante tecnología de ADN recombinante en Saccharomyces cerevisiae.
INDICACIONES TERAPÉUTICAS: Tratamiento de la diabetes mellitus en adultos, adolescentes y niños de 2 años en adelante.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades Farmacodinámicas:
Clase farmacológica: Fármacos utilizados para diabetes. Insulinas y análogos para inyección de acción rápida.
Código ATC: A10AB05.
Mecanismo de acción: El efecto de disminución de glucosa en la sangre de insulina Asparta se debe a la captación facilitada de glucosa seguida de la unión de la insulina a los receptores en músculo, células adiposas y la inhibición simultánea de la salida de glucosa desde el hígado.
NovoRapid® produce un inicio de acción más rápido en comparación con la insulina humana soluble, conjuntamente con una concentración menor de glucosa, según lo evaluado dentro de las primeras cuatro horas después de un alimento. NovoRapid® tiene una duración de accion más corta en comparación con la insulina humana soluble tras la inyección subcutánea.
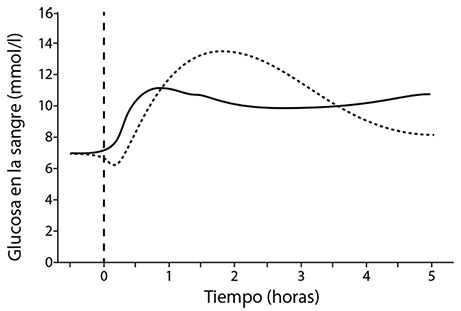
Fig. I. Concentraciones de glucosa en sangre después de una dosis pre-alimento única de NovoRapid® inyectada inmediatamente antes del alimento (curva sólida) o de insulina humana soluble administrada 30 minutos antes del alimento (curva punteada) en pacientes con diabetes mellitus tipo 1.
Cuando se inyecta NovoRapid® por vía subcutánea, el inicio de la acción se produce dentro de los 10 a 20 minutos de la inyección. El efecto máximo se alcanza entre 1 y 3 horas después de la inyección. La duración de la acción es de 3 a 5 horas.
La insulina Asparta es equivalente a la insulina humana soluble en una base molar.
Niños y adolescentes: Cuando se administra NovoRapid® a niños, se observó un control similar de la glucosa a largo plazo en comparación con la insulina humana soluble.
Se realizó un estudio clínico que comparaba la insulina humana soluble preprandial con insulina Asparta postprandial en niños pequeños (20 pacientes de 2 años a menos de 6 años, estudiados por 12 semanas; entre ellos, cuatro eran menores de 4 años de edad) y se realizó un estudio de farmacocinética y farmacodinámica de una dosis en niños (6-12 años) y adolescentes (13-17 años). El perfil farmacodinámico de insulina asparta en niños fue similar al observado en adultos.
Adultos:
Los estudios clínicos en pacientes con diabetes tipo 1 han demostrado una glucosa postprandial en sangre más baja con NovoRapid® en comparación con insulina humana soluble (Figura 1). En dos estudios a largo plazo, abiertos, en pacientes con diabetes tipo 1, que incluían 1070 y 884 pacientes respectivamente, NovoRapid® redujo la hemoglobina glucosilada en 0.12 puntos porcentuales [95% C.I. 0.03; 0.22] y en 0.15 [95% C.I. 0.05; 0.26] puntos porcentuales en comparación con insulina humana soluble; una diferencia de importancia clínica limitada.
Estudios clínicos realizados en pacientes con diabetes tipo 1 han demostrado un menor riesgo de hipoglucemia nocturna con insulina Asparta en comparación con insulina humana soluble. El riesgo de hipoglucemia durante el día no aumentó significativamente.
Adultos mayores:
Se realizó un estudio aleatorizado, doble ciego, cruzado de FC/FD para comparar insulina Asparta con insulina humana soluble en adultos mayores con diabetes tipo 2 (19 pacientes de entre 65 a 83 años, y una edad media de 70 años). Las diferencias relativas en las propiedades farmacodinámicas GIR max, AUC GIR, 0-120 min) entre insulina Asparta e Insulina humana soluble en adultos mayores fueron similares a las observadas en sujetos saludables y en pacientes más jóvenes con diabetes.
Embarazo: Un estudio clínico que comparaba la seguridad y eficacia de insulina Asparta frente a insulina humana en el tratamiento de mujeres embarazadas con diabetes tipo 1 (322 embarazadas expuestas (insulina Asparta: 157; insulina humana soluble: 165)), no mostró ningún efecto adverso de la insulina Asparta sobre el embarazo o sobre la salud de los fetos o recién nacidos.
Además, se incluyeron los datos procedentes de un estudio clínico realizado con 27 mujeres con diabetes gestacional, que fueron aleatorizadas al tratamiento con insulina Asparta vs. insulina humana (insulina Asparta: 14; insulina humana soluble: 13) mostraron perfiles de seguridad similares entre los tratamientos así como una mejoría significativa en el control de glucosa postprandial en el grupo tratado con insulina Asparta.
Propiedades farmacocinéticas: En NovoRapid®, la sustitución del aminoácido prolina por ácido aspártico en la posición B28, reduce la tendencia a formar hexámeros tal como se observa en la insulina humana soluble.
Por lo tanto, NovoRapid® se absorbe más rápidamente en la capa subcutánea en comparación con la insulina humana soluble.
El tiempo de máxima concentración es, en promedio la mitad que para la insulina humana soluble. En pacientes con diabetes tipo 1 se alcanzó la concentración media plasmática máxima de 492 ± 256 pmol/l a los 40 minutos (rango intercuartil: 30-40) después de una dosis subcutánea de 0.15 U/kg de peso corporal. Las concentraciones de insulina retornaron a los valores basales aproximadamente de 4 a 6 horas después de la dosis. La tasa de absorción fue algo más lenta en los pacientes con diabetes tipo 2, produciendo una Cmáx más baja (352 ± 240 pmol/l) y posterior tmáx (60 [rango intercuartil: 50-90] minutos). La variabilidad intraindividual en el tiempo hasta la concentración máxima es significativamente menor para NovoRapid® que para la insulina humana soluble, mientras que la variabilidad intra-individual en Cmáx para NovoRapid® es mayor.
Niños y adolescentes: Las propiedades farmacocinéticas y farmacodinámicas de NovoRapid® se investigaron en niños (6-12 años) y adolescentes (13-17 años) con diabetes tipo 1. La insulina Asparta se absorbió rápidamente en ambos grupos de edad, con un tmax similar a la de los adultos. Sin embargo, Cmáx se mostró diferente entre los dos grupos de edad, enfatizando así la importancia de una titulación individual de NovoRapid®.
Adultos mayores: Las diferencias relativas en las propiedades farmacocinéticas entre insulina Asparta e insulina humana soluble en pacientes mayores (65-83 años, edad media 70 años) con diabetes tipo 2 fueron similares a aquéllas observadas en sujetos sanos y en pacientes con diabetes más jóvenes. Se observó una tasa de disminución de la absorción en los pacientes mayores, dando lugar a un tmáx posterior (82 [rango intercuartil: 60-120] minutos), mientras que la Cmáx. fue similar a la observada en pacientes más jóvenes con diabetes tipo 2 y ligeramente menor que en pacientes con diabetes tipo 1.
Insuficiencia hepática: Se realizó un estudio de farmacocinética de dosis única de insulina Asparta en 24 sujetos con función hepática normal a gravemente afectada. En pacientes con insuficiencia hepática, el índice de absorción disminuyó y fué más variable, dando lugar a un retraso en tmáx de aproximadamente 50 minutos en pacientes con función hepática normal hasta aproximadamente 85 minutos en pacientes con insuficiencia hepática de moderada a grave. Los valores de ABC, Cmáx y CL/F fueron similares en pacientes con una función hepática reducida en comparación con sujetos con una función hepática normal.
Insuficiencia renal: Se realizó un estudio farmacocinético de dosis única con insulina Asparta en 18 sujetos con función renal normal a gravemente afectada. No se encontraron efectos aparentes en los valores de depuración de la creatinina sobre el área ABC, Cmáx, CL/F y tmáx de insulina Asparta. Los datos fueron limitados en los pacientes con insuficiencia renal moderada y grave. No se han estudiado pacientes con insuficiencia renal que requieren de tratamiento con diálisis.
CONTRAINDICACIONES: Hipersensibilidad al principio activo o a cualquiera de los excipientes.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: NovoRapid® (insulina Asparta) se puede utilizar durante el embarazo. Los datos de dos estudios clínicos controlados aleatorizados (322 + 27 embarazos expuestos) no mostraron ningún efecto adverso de la insulina Asparta sobre el embarazo o sobre la salud del feto/recién nacido en comparación con la insulina humana soluble. (Ver Propiedades farmacodinámicas).
Se recomienda intensificar el control de la glucosa en sangre y el monitoreo de mujeres embarazadas con diabetes (diabetes tipo 1, diabetes tipo 2 o diabetes gestacional) durante todo el embarazo y cuando se está planeando el embarazo. Los requerimientos de insulina normalmente disminuyen en el primer trimestre de embarazo y aumentan posteriormente durante el segundo y tercer trimestre. Después del parto, los requerimientos de insulina regresan rápidamente a los valores normales anteriores al embarazo.
Lactancia: No hay restricciones en cuanto al tratamiento con NovoRapid® en mujeres en periodo de lactancia. El tratamiento de la madre lactante con insulina no presenta ningún riesgo para el bebé. Sin embargo, puede resultar necesario ajustar la dosis de NovoRapid®.
REACCIONES SECUNDARIAS Y ADVERSAS:
Resumen del perfil de seguridad: Las reacciones adversas observadas en pacientes que usan NovoRapid® dependen principalmente al efecto farmacológico de la insulina.
La reacción adversa reportada con mayor frecuencia durante el tratamiento es la hipoglucemia. La frecuencia de hipoglucemia varía con la población de pacientes, regímenes de dosis y nivel de control glucémico, por favor consulte la Descripción general de las reacciones adversas (ADR) a continuación.
Al inicio del tratamiento con insulina pueden ocurrir alteraciones de refracción, edema y reacciones en el sitio de inyección (dolor, enrojecimiento, ronchas, inflamación, moretones, hinchazón y comezón en el sitio de inyección). Usualmente estas reacciones son de naturaleza transitoria. La rápida mejoría en el control de la glucosa en sangre puede asociarse con neuropatía aguda dolorosa, la cual es reversible usualmente. La intensificación de la terapia con insulina con mejoría abrupta del control glucémico puede asociarse con un agravamiento temporal de la retinopatía diabética, mientras que la mejoría a largo plazo del control glucémico disminuye el riesgo de progresión a retinopatía diabética.
Reacciones adversas (Siglas en inglés: ADR) de los ensayos clínicos: Las reacciones adversas enlistadas a continuación se basan en los datos obtenidos en los estudios clínicos y están clasificadas de acuerdo a la frecuencia en el MedDRA y en las Clasificación por Órganos y Sistemas. Las categorías de frecuencia se definen de acuerdo con el siguiente criterio: Muy comunes (≥ 1/10); comunes (≥ 1/100 a < 1/10); poco comunes (≥ 1/ 1,000 a < 1/100); raros (≥ 1/10,000 a < 1/1,000); muy raros (< 1/10,000), desconocidos (no se puede estimar con la información disponible).
|
Trastornos del sistema inmune |
Poco comunes - Urticaria, sarpullido, erupciones |
|
Muy raras - Reacciones anafilácticas* |
|
|
Trastornos del Metabolismo y la nutrición |
Muy comunes - Hipoglucemia* |
|
Trastornos del Sistema Nervioso |
Raros - Neuropatía periférica (neuropatía dolorosa) |
|
Trastornos Oculares |
Poco comunes - Trastornos de la refracción |
|
Poco comunes - Retinopatía diabética |
|
|
Trastornos de la piel y el tejido subcutáneo |
Poco comunes - Lipodistrofia* |
|
Trastornos generales y condiciones en el sitio de administración |
Poco comunes - Reacciones en el sitio de inyección |
|
Poco comunes - Edema |
* Ver a continuación la Descripción de las ADR seleccionadas.
Reacciones adversas de fuentes posteriores a la comercialización:
Descripción de reacciones adversas seleccionadas:
Reacciones anafilácticas: La incidencia de reacciones de hipersensibilidad generalizadas (incluyendo erupción cutánea generalizada, prurito, sudoración, malestares gastrointestinales, edema angioneurótico, dificultad para respirar, palpitaciones y reducción de la presión sanguínea) es muy rara, pero éstas pueden poner en riesgo la vida.
Hipoglucemia: La reacción adversa reportada más frecuentemente es la hipoglucemia. Puede presentarse si la dosis de insulina es muy alta en relación al requerimiento de insulina. La hipoglucemia severa puede llevar a pérdida de la conciencia y/o convulsiones y puede resultar en deterioro temporal o permanente de la función cerebral o incluso la muerte. Los síntomas de hipoglucemia usualmente ocurren de forma súbita. Pueden incluir sudor frío, palidez y frialdad de la piel, fatiga, nerviosismo o temblor, ansiedad, cansancio o debilidad inusuales, confusión, dificultad para concentrarse, somnolencia, hambre excesiva, alteraciones de la visión, cefalea, náuseas y palpitaciones.
En los estudios clínicos, la frecuencia de hipoglucemia varió según la población de pacientes, los regímenes de dosis y el nivel de control glucémico. Durante los estudios clínicos, los índices generales de hipoglucemia no difirieron entre los pacientes tratados con insulina Asparta en comparación con la insulina humana.
Lipodistrofia: La lipodistrofia (incluidas lipohipertrofia y lipoatrofia) puede presentarse en el sitio de inyección. La rotación continua del punto de inyección dentro de la zona de inyección específica puede ayudar a reducir el riesgo de desarrollar estas reacciones.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de seguridad farmacológica, toxicidad a dosis repetidas, genotoxicidad y toxicidad para la reproducción.
En ensayos in vitro, que incluyen la unión a insulina y a los sitios de unión a receptores de IGF-1 y efectos sobre el crecimiento celular, la insulina Asparta mostró un comportamiento muy parecido a la insulina humana. Los estudios también demostraron que la disociación de la unión al receptor de insulina de insulina Asparta es equivalente a la de la insulina humana.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Se conoce gran cantidad de productos medicinales que interactúan con el metabolismo de la glucosa.
Las siguientes sustancias pueden reducir los requerimientos de insulina del paciente:
Productos antidiabéticos orales, inhibidores de la monoaminooxidasa (IMAO), beta-bloqueadores, inhibidores de la enzima convertidora de la angiotensina (ECA), salicilatos, esteroides anabólicos y sulfonamidas.
Las siguientes sustancias pueden aumentar los requerimientos de insulina del paciente: Anticonceptivos orales, tiazidas, glucocorticoides, hormonas tiroideas, simpaticomiméticos, hormona de crecimiento y danazol.
Los agentes beta-bloqueadores pueden enmascarar los síntomas de hipoglucemia.
La octreótida/lanreótida pueden tanto aumentar como disminuir los requerimientos de insulina.
El alcohol puede intensificar o reducir los efectos hipoglucémicos de la insulina.
Las sustancias agregadas a NovoRapid® pueden causar la degradación de la insulina Asparta.
Este medicamento no debe diluirse o mezclarse con otros medicamentos. Las excepciones son la mezcla con insulina NPH (Protamina Neutral Hagedorn) en una jeringa para uso subcutáneo, o con fluidos de infusión como los descritos en la sección "Dosis y vía de administración".
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: No se han reportado hasta la fecha.
PRECAUCIONES GENERALES: Antes de realizar un viaje a una zona con diferente horario, el paciente debe consultar a su médico, ya que esto puede significar que el paciente tenga que tomar la insulina y las comidas a diferentes horas.
Hiperglucemia: La administración de dosis inadecuadas o la interrupción del tratamiento, especialmente en diabetes tipo 1, pueden producir hiperglucemia y cetoacidosis diabética. Usualmente los primeros síntomas de hiperglucemia se desarrollan gradualmente en un periodo de horas o días. Estos comprenden sed, aumento en la frecuencia de micción, náuseas, vómitos, somnolencia, piel seca y enrojecida, sequedad en la boca, pérdida de apetito y olor a acetona en el aliento. En la diabetes tipo 1, los eventos no tratados de hiperglucemia pueden eventualmente conducir a la cetoacidosis diabética, que es potencialmente mortal.
Hipoglucemia: La omisión de una comida o la realización de alguna actividad física extenuante no planificada pueden causar hipoglucemia.
La hipoglucemia puede presentarse si la dosis de insulina es demasiado alta con respecto a los requerimientos de insulina (Ver secciones Reacciones secundarias y adversas y Manifestaciones y manejo de la sobredosificación o ingesta accidental).
Los pacientes en los cuales el control de la glucosa en sangre ha mejorado notablemente, por ejemplo, con la intensificación de la terapia con insulina, pueden presentar un cambio en los síntomas de advertencia habituales de la hipoglucemia y se les debe dar recomendaciones al respecto. Los síntomas de advertencia habituales pueden desaparecer en los pacientes que tienen diabetes desde hace mucho tiempo.
Una consecuencia de las propiedades farmacodinámicas de los análogos de insulina de acción rápida, es que si se produce una hipoglucemia, ésta puede ocurrir poco después de la inyección en comparación con la insulina humana soluble.
Dado que NovoRapid® debe administrarse en relación inmediata con los alimentos, debe tenerse en cuenta el rápido inicio de la acción en los pacientes con enfermedades o medicamentos concomitantes en los cuales se podría esperar una absorción más lenta de los alimentos.
Las enfermedades concomitantes, especialmente las infecciones y las condiciones febriles, en general, aumentan los requerimientos de insulina del paciente. Las enfermedades concomitantes renales, hepáticas o que afecten a las glándulas suprarrenal, pituitaria o tiroides pueden requerir cambios en la dosis de insulina.
Cuando los pacientes son transferidos entre diferentes tipos de productos de insulina, los síntomas de advertencia tempranos de hipoglucemia pueden ser menos pronunciados que aquellos que se experimentaron con la insulina utilizada previamente.
Transferencia desde otros productos de insulina: La transferencia de un paciente al uso de otro tipo o marca de insulina deberá realizarse bajo estricta supervisión médica. Los cambios de concentración, marca (fabricante), tipo, origen (insulina humana, análogo de insulina) y/o método de fabricación pueden resultar en la necesidad de cambiar la dosificación. Los pacientes transferidos a NovoRapid® desde otro tipo de insulina pueden requerir de un ajuste en sus requerimientos diarios de insulina o de un cambio en la dosis de la que ellos usaban habitualmente de sus productos de insulina. Si es necesario realizar un ajuste, la dosis puede ajustarse con la primera dosis o bien durante las primeras semanas o meses.
Reacciones en el sitio de la inyección: Como con cualquier terapia con insulina, pueden producirse reacciones en el sitio de inyección que incluyen: dolor, enrojecimiento, ronchas, inflamación, hematomas, hinchazón y comezón. La continua rotación del sitio de inyección dentro de un área determinada reduce el riesgo de desarrollar estas reacciones. Las reacciones normalmente desaparecen en unos pocos días o en pocas semanas. En raras ocasiones, las reacciones en el sitio de inyección pueden requerir la interrupción de NovoRapid®.
Efectos sobre la capacidad para conducir maquinaria: La capacidad de concentración y de reacción de los pacientes puede verse afectada como resultado de la hipoglucemia. Esto puede constituir un riesgo en situaciones donde estas capacidades son de especial importancia, (por ej. conducir un automóvil o manejar maquinaria).
Debe advertirse a los pacientes que tomen las precauciones para evitar una hipoglucemia mientras conducen. Esto es particularmente importante en aquellos pacientes con reducida o nula capacidad para percibir los síntomas de alerta de hipoglucemia, o que padecen episodios frecuentes de hipoglucemia. Debe considerarse la conveniencia de manejar bajo estas circunstancias.
Combinación de tiazolidinedionas y productos medicinales de insulina: Se han reportado casos de insuficiencia cardiaca congestiva cuando se utilizaron tiazolidinedionas en combinación con insulina, especialmente en pacientes con factores de riesgo de desarrollar insuficiencia cardiaca congestiva. Esto debe tenerse en cuenta si se considera el tratamiento combinado con tiazolidinedionas y productos medicinales de insulina. Si se usa esa combinación, se debe observar a los pacientes para detectar signos y síntomas de insuficiencia cardiaca congestiva, aumento de peso y edema. En caso de presentarse algún tipo de deterioro de los síntomas cardiacos, debe interrumpirse la administración de tiazolidinedionas.
Evasión de confusiones accidentales/errores de medicación:
Se debe instruir a los pacientes para que verifiquen siempre la etiqueta de la insulina antes de cada inyección, para evitar confusiones accidentales entre NovoRapid® y otros productos insulínicos.
Anticuerpos de insulina: La administración de insulina puede causar la formación de anticuerpos a la insulina. En raras ocasiones, la presencia de dichos anticuerpos de insulina puede hacer necesario un ajuste de la dosis de insulina para corregir la tendencia a la hiper o hipoglucemia.
DOSIS Y VÍA DE ADMINISTRACIÓN: NovoRapid® es un análogo de insulina de acción rápida.
La dosificación de NovoRapid® es individual y se determina de acuerdo con las necesidades del paciente. Normalmente, debe utilizarse en combinación con insulina de acción intermedia o insulina de acción prolongada administrada por lo menos una vez por día. Adicionalmente, NovoRapid® puede utilizarse en infusiones subcutáneas continuas de Insulina (ISCI) en sistemas de bomba o ser administrada intravenosamente por profesionales de la salud. Se recomienda realizar el monitoreo de glucosa en sangre y ajustes de la dosis de insulina para lograr el control glucémico óptimo.
Los requerimientos individuales de insulina en adultos y niños se encuentran por lo general entre 0.5 y 1.0 U/kg/día.
Terapia de inyección: En un régimen de tratamiento basal-bolo, 50-70% de este requerimiento puede ser suministrado por NovoRapid® y el restante 30-50% por insulina de acción intermedia o insulina de acción prolongada.
Infusión Subcutánea Continua de Insulina (ISCI): NovoRapid® sin combinación puede utilizarse para ISCI en sistemas de bomba. En este caso, NovoRapid® cubrirá ambas, el requerimiento de bolo insulina (50-70%) y la proporción de insulina basal (30-50%). El ajuste de la dosis puede ser necesario en caso de que los pacientes aumenten su actividad física, modifiquen su dieta habitual o en el transcurso de una enfermedad concomitante.
NovoRapid® tiene un inicio de acción más rápido y una duración más breve que la insulina humana soluble.
Debido a la duración más corta, NovoRapid® tiene un menor riesgo de provocar episodios hipoglucémicos nocturnos.
Poblaciones especiales: Al igual que con todos los productos de insulina, en pacientes de edad avanzada y pacientes con insuficiencia renal o hepática, debe intensificarse el monitoreo de la glucosa y la dosis de insulina Asparta debe ajustarse de forma individual.
Población pediátrica: NovoRapid® puede utilizarse en adolescentes y niños de dos años de edad en adelante de preferencia en lugar de la insulina humana soluble cuando un inicio de acción rápido pudiera ser beneficioso, por ejemplo, en las horas de administración de las inyecciones en relación con los alimentos (ver secciones Propiedades farmacodinámicas y Propiedades farmacocinéticas).
No se ha establecido la seguridad y la eficacia de NovoRapid® en niños menores de 2 años de edad.
No se dispone de información.
Transferencia desde otros productos de insulina:
Al transferir de otros productos de insulina, puede ser necesario realizar un ajuste de la dosis de NovoRapid® y de la dosis de la insulina basal.
Vía de administración:
NovoRapid® es un análogo de insulina de acción rápida.
NovoRapid® se administra por vía subcutánea en la pared abdominal, el muslo, la parte superior del brazo, la región deltoidea o la región glútea. Los sitios de inyección siempre deben rotarse dentro de la misma región a fin de reducir el riesgo de lipodistrofia. Al igual que con todos los productos de insulina, la inyección subcutánea en la pared abdominal asegura una absorción más rápida que otros sitios de inyección.
La duración de la acción variará de acuerdo con la dosis, el sitio de inyección, el flujo sanguíneo, la temperatura y el nivel de actividad física. Sin embargo, el inicio de acción más rápido comparado con la insulina humana soluble se mantiene independientemente del sitio de inyección.
Debido al rápido inicio de la acción, NovoRapid® generalmente debe administrarse inmediatamente antes de un alimento. Si es necesario, NovoRapid® puede administrarse inmediatamente después de una comida.
Frasco Ámpula:
Administración con jeringa: NovoRapid® frasco ámpula es para uso con jeringas para insulina con la correspondiente escala de unidades.
Cartucho Penfill®:
Administración con un sistema de suministro de insulina: NovoRapid® cartucho Penfill® está diseñado para ser utilizado con un sistema de administración de insulina de Novo Nordisk y agujas NovoFine®.
NovoRapid® cartucho Penfill® viene acompañado de un instructivo con instrucciones de uso detalladas que se deberán seguir.
Pluma Precargada FlexPen®:
Administración con pluma precargada FlexPen®: NovoRapid® FlexPen® es una pluma precargada diseñada para ser utilizada con las agujas desechables NovoFine® de una longitud de hasta 8 mm.
Pluma precargada FlexPen® suministra de 1-60 unidades en incrementos de 1 unidad.
NovoRapid® pluma precargada FlexPen® está codificada por color y viene acompañada por un instructivo con instrucciones de uso detalladas que se deberán seguir.
Infusión Subcutánea Continua de Insulina (ISCI): NovoRapid® puede ser utilizada para Infusión Subcutánea Continua de Insulina (ISCI) en sistemas de bombas adecuados para la infusión de insulina. La ISCI debe administrarse en la pared abdominal. Los sitios de infusión deben rotarse.
Cuando se utilice con una bomba subcutánea de infusión de insulina, NovoRapid® no debe mezclarse con ningún otro producto medicinal.
Frasco ámpula: A los pacientes que utilicen ISCI se les debe capacitar detalladamente respecto al uso del sistema de bombeo, el uso correcto del depósito y tubería para la bomba (ver sección Leyendas de Protección). El equipo de infusión (tubería y cánula) debe cambiarse de acuerdo con las instrucciones que figuran en la información del producto suministrada con el equipo de infusión.
Cuando se utiliza con una bomba de infusión de insulina subcutánea, NovoRapid® no se debe mezclar con otros medicamentos.
Frasco ámpula: Los pacientes que se administran NovoRapid® por medio de ISCI deben tener un método de administración de insulina alternativo disponible en caso de que falle el sistema de bomba.
Uso intravenoso: En caso de ser necesario, NovoRapid® puede ser administrado por vía intravenosa por profesionales de la salud.
Para el uso intravenoso, los sistemas de infusión con NovoRapid® 100 U/mL a concentraciones de 0.05 U/mL a 1.0 U/mL de insulina Asparta en los fluidos de infusión de cloruro de sodio al 0.9%, dextrosa al 5% o dextrosa al 10% inclusive cloruro de potasio 40 mmol/l que utilizan las bolsas de polipropileno para infusión, son estables a temperatura ambiente durante 24 horas.
Aunque es estable a través del tiempo, una cierta cantidad de insulina será adsorbida inicialmente por la bolsa de infusión.
Es necesario efectuar el monitoreo de la glucosa en sangre durante la infusión de insulina.
Mezcla de dos tipos de insulinas:
NovoRapid® sólo puede ser mezclado con insulina NPH (Protamina Neutral Hagedorn) en una jeringa para uso subcutáneo. Si NovoRapid® se mezcla con la insulina NPH, NovoRapid® debe extraerse primero en la jeringa, y la mezcla debe ser inyectada inmediatamente después de la mezcla. Las mezclas de insulina no se deben administrar por vía intravenosa o utilizarse con una bomba de infusión de insulina subcutánea.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: No es posible definir específicamente la sobredosis de insulina; sin embargo, se puede desarrollar hipoglucemia en fases secuenciales si se administran dosis muy altas en relación con los requerimientos del paciente:
• Los episodios hipoglucémicos leves pueden tratarse con la administración oral de glucosa o productos azucarados. Por lo tanto, se recomienda que el paciente con diabetes lleve siempre productos que contengan azúcar.
• Los episodios hipoglucémicos severos, en los que el paciente pierde el conocimiento, pueden tratarse con inyección intramuscular o subcutánea de glucagón (0.5 a 1 mg) administrada por una persona entrenada, o bien glucosa intravenosa administrada por un profesional médico. La glucosa debe administrarse por vía intravenosa si el paciente no responde al glucagón en 10 a 15 minutos. Cuando el paciente recupere la consciencia, se recomienda administrarle carbohidratos orales para evitar una recaída.
PRESENTACIONES:
Caja con un frasco ámpula con 10 mL (100 U/mL).
Caja con 5 cartuchos Penfill® de 3 mL (100 U/mL).
Caja con 1 ó 5 pluma(s) precargada(s) FlexPen® (100 U/mL).
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese en refrigeración entre 2-8ºC. Manténgase lejos de la fuente de enfriamiento. No se congele. Protéjase de la luz.
No utilizar NovoRapid® que se haya congelado.
NovoRapid® en frasco ámpula, cartucho Penfill®: Mantenga el frasco ámpula o el cartucho en la caja de cartón a fin de proteger de la luz.
NovoRapid® en pluma precargada FlexPen®: Mantenga la tapa puesta en la Pluma precargada FlexPen® con el fin de proteger de la luz.
NovoRapid® se debe mantener protegido del exceso de calor y luz.
NovoRapid® Frasco ámpula, Cartucho Penfill® o pluma Precargada FlexPen® Una vez abierto o cuando se carga como repuesto:
-No refrigere.
-Almacenar a menos de 30ºC.
-Se conserva un máximo de 4 semanas cuando se almacena a menos de 30°C.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. No se deje al alcance de los niños. Literatura exclusiva para médicos. No se administre si la solución no es clara e incolora, si contiene partículas en suspensión, sedimentos o si el cierre ha sido violado.
Las Agujas y NovoRapid® cartucho Penfill® y pluma precargada FlexPen® no se deben compartir. Los cartuchos no se deben rellenar.
Se debe informar al paciente que deseche la aguja después de cada inyección.
En caso de emergencia en usuarios de NovoRapid® (hospitalización o mal funcionamiento del dispositivo de la insulina), NovoRapid® puede ser extraído del cartucho/pluma con una jeringa de insulina de 100 U.
Frasco ámpula: NovoRapid® puede ser utilizado en un sistema de bombeo de infusión (CSII) como se describe en la sección de Dosis y vía de administración. Las tuberías en las que los materiales de la superficie interior están hechos de polietileno o poliolefina han sido evaluadas y son compatibles con el uso de la bomba.
Lea instructivo anexo.
Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx
Titular del Registro:
Novo Nordisk A/S
Brennum Park
DK-3400 HillerØd, Dinamarca
Representante Legal:
NOVO NORDISK MÉXICO, S. A. de C. V.
Homero 1500 Piso 3
Col. Polanco, C.P. 11560
Deleg. Miguel Hidalgo, Ciudad de México, México
Reg. Núm. 102M2004, SSA IV
®Marca Registrada