NOVOMIX 30
INSULINA ASPARTA RECOMBINANTE
Suspensión inyectable
1 Caja, 1 Pluma precargada, 3 ml,
1 Caja, 5 Pluma precargada, 3 ml,
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada mL* contiene:
Insulina asparta (**30% insulina asparta soluble
y 70% insulina asparta cristalina
con protamina) 100 U (3.5 mg)
Vehículo cbp 1 mL
* 1 ml de la suspensión.
Una pluma precargada (FlexPen®) contiene 3 ml equivalentes a 300 U.
**Insulina asparta producida por tecnología de ADN recombinante en Saccharomyces cerevisiae.
INDICACIONES TERAPÉUTICAS: Tratamiento de la diabetes mellitus tipo 1 y 2 en adultos, adolescentes y niños de 10 años en adelante.
FARMACOCINÉTICA Y FARMACODINAMIA:
Farmacocinética:
Absorción, distribución y eliminación: En la insulina asparta, la sustitución del aminoácido prolina por ácido aspártico en la posición 828 reduce la tendencia a formar hexámeros como se observa en la insulina humana. La insulina asparta en la fase soluble de NOVOMIX® 30 representa un 30% de la insulina total; dicha fracción se absorbe más rápidamente de la capa subcutánea que el componente de insulina soluble de la insulina humana bifásica. El 70% restante se encuentra en forma cristalina como insulina asparta cristalizada con protamina; esta fracción presenta un perfil de absorción prolongado similar al de la insulina NPH humana.
En promedio, la máxima concentración de insulina en suero es 50% más elevada con NOVOMIX® 30 que con la insulina humana bifásica 30, el tiempo necesario para alcanzar la concentración máxima es de la mitad del necesario con la insulina humana bifásica 30.
En voluntarios sanos, se alcanzó una concentración sérica máxima media de 140 ± 32 pmol/I aproximadamente 60 minutos después de la administración de una dosis subcutánea de 0.20 U/kg de peso corporal.
La vida media (t½) de NOVOMIX® 30 refleja la velocidad de absorción de la fracción unida a protamina aproximadamente 8 a 9 horas. Los niveles de insulina en suero regresaron a los existentes en la línea de base entre 15 y 18 horas después de la administración de una dosis subcutánea. En pacientes con diabetes tipo 2, la concentración máxima fue alcanzada aproximadamente 95 minutos después de la administración de la dosis y se midieron concentraciones muy por encima de cero durante un mínimo de 14 horas después de la administración de la dosis.
Poblaciones especiales:
Ancianos:
Las propiedades farmacocinéticas de NOVOMIX® 30 no han sido investigadas en pacientes de edad avanzada. Sin embargo, las diferencias relativas entre las propiedades farmacocinéticas de la insulina asparta y la insulina humana soluble en sujetos de edad avanzada (65 a 83 años; edad promedio 70 años) con diabetes tipo 2 fueron similares a las observadas en sujetos sanos y en sujetos diabéticos más jóvenes. Los sujetos de edad avanzada exhibieron una disminución de la tasa de absorción, la cual provocó que la tmáx se presentara un poco más tarde (al cabo de 82 minutos [rango intercuartil: 60-120 minutos]), mientras que la Cmáx fue similar a la observada en sujetos con diabetes tipo 2 más jóvenes y ligeramente menor a la observada en sujetos con diabetes tipo 1.
Insuficiencia renal y hepática: Las propiedades farmacocinéticas de NOVOMIX® 30 no han sido investigadas en pacientes con insuficiencia renal o hepática.
Población pediátrica: Las propiedades farmacocinéticas de NOVOMIX® 30 no han sido investigadas en niños o en adolescentes. Sin embargo, las propiedades farmacocinéticas y farmacodinámicas de la insulina asparta soluble han sido investigadas en niños (de 6 a 12 años) y en adolescentes (de 13 a 17 años) con diabetes tipo 1. La insulina asparta fue absorbida rápidamente en ambos grupos de edad, presentando los mismos una tmáx similar a la de los adultos. Sin embargo, la Cmáx difirió en ambos grupos de edad, lo cual enfatiza la importancia del ajuste individual de la dosis de insulina asparta.
Farmacodinamia:
Clase farmacológica:
Fármacos usados para la diabetes.
Insulinas y análogos para la inyección, de acción larga o intermedia combinando con rápida acción.
Código ATC A10AD05.
NOVOMIX® 30 es una suspensión bifásica de insulina asparta soluble (análogo de insulina de acción rápida) e insulina asparta cristalina con protamina (análogo de insulina de acción intermedia). La insulina asparta es equipotente con respecto a la insulina humana en términos molares.
Mecanismo de acción: El efecto hipoglucemiante de la insulina asparta se debe a la facilitación de la absorción de glucosa después de la unión de la insulina a los receptores en las células musculares y adiposas, inhibiendo al mismo tiempo la producción de glucosa por parte del hígado.
NOVOMIX® 30 es una insulina bifásica que contiene un 30% de insulina asparta soluble, la cual comienza a actuar rápidamente, lo que hace posible su administración en forma más cercana a los alimentos (0 a 10 minutos antes de los alimentos) en comparación con la insulina humana soluble. La fase cristalina (70%) está compuesta por insulina asparta cristalizada con protamina, la cual presenta un perfil de actividad similar al de la insulina NPH humana.
Cuando NOVOMIX® 30 es inyectado por la vía subcutánea, su acción inicia entre 10 y 20 minutos después de la inyección. El efecto máximo tiene lugar entre 1 y 4 horas después de la inyección y la duración de acción es de hasta 24 horas (Figura 1).
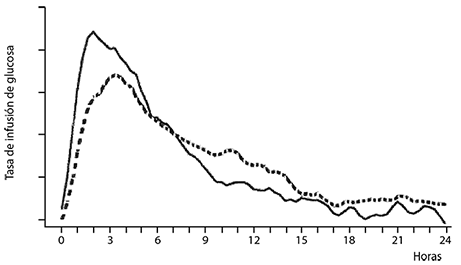
Figura 1. Perfil de actividad de NOVOMIX® 30
(línea continua) y de la insulina humana
bifásica 30 (línea interrumpida) en sujetos sanos
Glucemia postprandial versus Insulina Humana Bifásica (BHI): En un estudio a 3 meses en el que se compara NOVOMIX® 30 con insulina humana bifásica 30 administrada antes del desayuno y la cena en pacientes con diabetes tipo 1 y tipo 2, NOVOMIX® 30 redujo significativamente los niveles de glucosa post-prandial en sangre después de tomar los alimentos (desayuno y cena).
Control glucémico versus Insulina Humana Bifásica (BHI): Un metaanálisis que incluyó nueve estudios con pacientes con diabetes tipo 1 y tipo 2 muestra que la comparación entre la insulina humana bifásica 30 y la administración de NOVOMIX® 30 antes del desayuno y la cena resultó en un mejor control del nivel de glucosa postprandial en sangre (en promedio el nivel de glucosa prandial incrementa con el desayuno, la comida y la cena). Mientras que la glucosa en sangre durante el ayuno aumentó en pacientes tratados con NOVOMIX® 30, las mediciones de control glucémico por hemoglobina glicosilada, en general, se presentaron similares.
Combinación con metformina y sulfonilurea: En un estudio, 341 pacientes con diabetes tipo 2 fueron aleatorizados para recibir un tratamiento con NOVOMIX® 30 (ya fuera como monoterapia o en combinación con metformina o con metformina más sulfonilurea). La variable primaria de la eficacia –la HbA1c al cabo de 16 semanas de tratamiento– no fue diferente en los pacientes tratados con NOVOMIX® 30 en combinación con metformina y en los pacientes tratados con metformina más sulfonilurea. En dicho estudio, 57% de los pacientes presentaba un valor de HbA1c superior al 9% en la línea de base; en estos pacientes, el tratamiento con NOVOMIX® 30 en combinación con metformina produjo niveles significativamente más bajos de HbA1c que el tratamiento con metformina en combinación con sulfonilurea.
HbA1c y FPG vs insulina glargina una vez al día (OD):
En un estudio, se aleatorizó a pacientes con diabetes tipo 2 que no lograban un control suficiente con hipoglucemiantes orales por sí solos, fueron aleatorizados para recibir un tratamiento con NOVOMIX® 30 dos veces al día (117 pacientes) o con insulina glargina una vez al día (116 pacientes). Al cabo de 28 semanas de tratamiento siguiendo los lineamientos de dosificación, la reducción media de la HbA1c con NOVOMIX® 30 fue de 2.8% (media en la línea de base = 9.7%). Con NOVOMIX® 30; 66% y 42% de los pacientes alcanzaron niveles de HbA1c por debajo de 7% y 6.5%, y la FGP media fue reducida por aproximadamente 7 mmol/I (de 14 mmol/I inicial a 7.1 mmol/I) Hipoglucemia versus Insulina Humana Bifásica (BHI).
Un metaanálisis en pacientes con diabetes tipo 2 mostró una reducción en el riesgo total de presentar episodios de hipoglucemia nocturna e hipoglucemia grave cuando se trataron con NOVOMIX® 30 comparado a la insulina humana bifásica 30. El riesgo sobre los episodios de hipoglucemia diurna totales aumentó en pacientes tratados con NOVOMIX® 30.
Poblaciones especiales:
Población pediátrica: Se llevó a cabo un estudio clínico con una duración de 16 semanas en el cual se comparó el control de la glucemia postprandial obtenido con NOVOMIX® 30 con insulina humana/insulina humana bifásica 30 relacionada con alimentos e insulina NPH nocturna con 167 sujetos de 10 a 18 años de edad. El nivel medio de HbA1c se mantuvo en niveles similares a los existentes en la línea de base en ambos grupos de tratamiento a lo largo del estudio y no hubo una diferencia en cuanto a la tasa de hipoglucemia con NOVOMIX® 30 y con la insulina humana bifásica 30. En una población más reducida (54 sujetos) y más joven (rango: 6 a 12 años de edad), la cual fue tratada en un estudio cruzado con doble ciego (12 semanas con cada tratamiento), la tasa de episodios de hipoglucemia y el incremento de la glucosa postprandial fueron significativamente más bajos con NOVOMIX® 30 que con la insulina humana bifásica 30.
El nivel final de HbA1c fue más bajo en el grupo tratado con insulina humana bifásica 30 en comparación con NOVOMIX® 30.
Ancianos: Las propiedades farmacodinámicas de NOVOMIX® 30 no han sido estudiadas en adultos mayores. Sin embargo, un estudio cruzado, aleatorizado, doble ciego de farmacocinética/farmacodinamia (PK/PD) en el cual se comparó a la insulina asparta con la insulina humana soluble en 19 pacientes de edad avanzada (edad: 65 a 83 años; media: 70 años) con diabetes tipo 2. Las diferencias relativas entre la insulina asparta y la insulina humana soluble en lo que respecta a sus propiedades farmacodinámicas (*GIRmáx, ABCGIR, 0-120 min) en esta población fueron similares a las observadas en sujetos sanos y en sujetos jóvenes con diabetes.
*GIR = Tasa de infusión de glucosa (Glucose infusion rate).
Embarazo: NOVOMIX® 30 no ha sido estudiado en mujeres embarazadas. Sin embargo, un estudio clínico que comparó la seguridad y la eficacia de la insulina asparta vs insulina humana soluble en el tratamiento de mujeres embarazadas con diabetes tipo 1 (siendo expuestas 322 mujeres embarazadas, 157 a la insulina asparta y 165 a la insulina humana soluble) no indicó que la insulina asparta tuviese efecto adverso alguno sobre el embarazo o sobre la salud del feto o del recién nacido.
En forma adicional, los datos emanados de un estudio clínico que incluyó a 27 mujeres con diabetes gestacional que fueron aleatorizadas para recibir un tratamiento con insulina asparta o con insulina humana soluble (insulina asparta: n = 14; insulina humana soluble: n = 13 mujeres, respectivamente) reveló que el perfil de seguridad fue similar con ambos tratamientos.
CONTRAINDICACIONES: Hipersensibilidad a la insulina asparta o a cualquiera de los excipientes (glicerol, fenol, metacresol, cloruro de zinc, fosfato disódico dihidrato, cloruro de sodio, sulfato de protamina, ácido clorhídrico/hidróxido de sodio (para ajuste del pH), agua para inyecciones.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: NOVOMIX® 30 no ha sido investigado en mujeres embarazadas. Sin embargo, los datos de dos estudios clínicos aleatorios controlados (157 y 14 embarazos expuestos a insulina asparta, respectivamente, en régimen de bolo basal) no presentaron ningún efecto adverso en el embarazo o sobre la salud del feto/neonato cuando se comparó con tratamientos de insulina humana soluble (ver Farmacocinética y farmacodinamia).
Es limitada la experiencia clínica con NOVOMIX® 30 durante el embarazo.
En general, se recomienda intensificar el control y el monitoreo intensificado de la glucemia en mujeres embarazadas con diabetes a lo largo del embarazo y al planearlo.
Las necesidades de insulina suelen disminuir en el primer trimestre para posteriormente elevarse en el segundo y tercer trimestre. Después del parto, las necesidades de insulina regresan rápidamente a los niveles existentes en forma previa al embarazo.
Lactancia: No existen restricciones para el tratamiento con NOVOMIX® 30 durante la lactancia. El tratamiento de la madre con insulina no representa riesgo alguno para el lactante. Sin embargo, puede ser necesario ajustar la dosis de NOVOMIX® 30.
REACCIONES SECUNDARIAS Y ADVERSAS: Las reacciones adversas (ADR) enlistadas en esta sección son esperadas con este medicamento.
Resumen del perfil de seguridad: Las reacciones adversas observadas en los pacientes tratados con NOVOMIX® 30 se deben principalmente al efecto farmacológico de la insulina.
La reacción adversa reportada con mayor frecuencia durante el tratamiento es la hipoglucemia. La frecuencia de hipoglucemia puede variar con la población de los pacientes, dosis, régimen y nivel de control glucémico, favor de ver la descripción de reacciones adversas seleccionadas.
Al inicio del tratamiento con insulina pueden ocurrir alteraciones de la refracción y edema y reacciones en el sitio de inyección (dolor, enrojecimiento, urticaria, inflamación, hematomas, hinchazón y comezón en el sitio de inyección), por lo general estas reacciones son de naturaleza transitoria. La mejoría rápida del control de la glucosa en sangre puede asociarse con neuropatía aguda dolorosa, la cual es usualmente reversible.
La intensificación de la terapia con insulina con mejoría abrupta del control glucémico puede asociarse con un agravamiento temporal de la retinopatía diabética, mientras que la mejoría a largo plazo del control glucémico disminuye el riesgo de progresión a retinopatía diabética.
Reacciones adversas de estudios clínicos: Las reacciones adversas enlistadas a continuación se basan en los datos obtenidos en los estudios clínicos y están clasificadas de acuerdo a la frecuencia en el MedDRA y en las Clases de Sistemas de Órganos. Las categorías de frecuencia se definen de acuerdo con la siguiente convención: muy comunes (≥ 1/10); comunes (≥ 1/100 a < 1/10); poco comunes (≥ 1/1,000 a < 1/100); raros (≥ 1/10,000 a < 1/1,000); muy raros (< 1/10,000), desconocidos (no se puede estimar con la información disponible).
|
Desórdenes del sistema inmune |
Poco comunes: urticaria, salpullido, erupciones |
|
Muy raras: reacciones anafilácticas* |
|
|
Desórdenes del Metabolismo y Nutrición |
Muy comunes: hipoglucemia* |
|
Desórdenes del Sistema Nervioso |
Raros: neuropatía periférica (Neuropatía dolorosa) |
|
Desórdenes oculares |
Poco comunes: trastornos de la refracción |
|
Poco comunes: retinopatía diabética |
|
|
Desórdenes de la piel y de los tejidos subcutáneos |
Poco comunes: lipodistrofia* |
|
Desórdenes generales y condiciones del sitio de administración |
Poco comunes: reacción en el sitio de inyección |
|
Poco comunes: edema |
* Ver la descripción de Reacciones Adversas seleccionadas a continuación.
Reacciones Adversas (ADR) de fuentes después de la comercialización.
Descripción de reacciones adversas (ADR) seleccionadas:
Reacciones anafilácticas: La ocurrencia de reacciones generalizadas de hipersensibilidad (que incluyen sarpullido generalizado en la piel, comezón, sudoración, malestar gastrointestinal, edema angioneurótico, dificultad para respirar, palpitación y reducción de la presión sanguínea) son muy raras y pueden poner en riesgo la vida.
Hipoglucemia: La reacción adversa reportada con más frecuencia es la hipoglucemia. Puede presentarse si la dosis de insulina es muy alta en relación al requerimiento de insulina. La hipoglucemia severa puede llevar a la pérdida de la conciencia y/o convulsiones y puede resultar en deterioro temporal o permanente de la función cerebral o incluso la muerte. Los síntomas de hipoglucemia usualmente ocurren de forma súbita. Pueden incluir sudor frío, palidez y frialdad de la piel, fatiga, nerviosismo o temblor, ansiedad, cansancio o debilidad inusuales, confusión, dificultad para concentrarse, somnolencia, hambre excesiva, alteraciones de la visión, cefalea, náuseas y palpitaciones.
En los estudios clínicos, la frecuencia de hipoglucemia varía según la población de pacientes, los regímenes de dosis y el nivel de control glucémico. Durante los estudios clínicos, los índices generales de hipoglucemia no difirieron entre los pacientes tratados con insulina asparta en comparación con la insulina humana.
Lipodistrofia: Puede ocurrir lipodistrofia (que incluye lipohipertrofia, lipoatrofia) en el sitio de inyección. La rotación continua del sitio de la inyección dentro del área particular reduce el riesgo de desarrollar estas reacciones.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Los datos no clínicos revelan riesgos especiales para humanos con base en estudios convencionales en farmacología de seguridad, toxicicidad de dosis repetida, genotoxicidad y toxicidad a la reproducción
En pruebas in vitro, incluyendo fijación a sitios receptores de insulina y de IGF-1 y efectos en el crecimiento celular, la insulina asparta se comportó de manera similar a la insulina humana. Los estudios también han demostrado que la disociación de unión al receptor de la insulina de la insulina asparta es equivalente a la de la insulina humana.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: Se conocen varios productos farmacéuticos que interactúan con el metabolismo de la glucosa.
Las siguientes sustancias pueden reducir los requerimientos de insulina del paciente:
• Productos anti-diabéticos orales.
• Inhibidores de la monoaminooxidasa (IMAO).
• Beta-Bloqueadores, inhibidores de la enzima convertidora de la angiotensina (IECA).
• Salicilatos.
• Esteroides anabólicos.
• Sulfonamidas.
Las siguientes sustancias pueden aumentar los requerimientos de insulina del paciente:
• Anticonceptivos orales.
• Tiazidas.
• Glucocorticoides.
• Hormonas tiroideas.
• Simpaticomiméticos.
• Hormona de crecimiento.
• Danazol.
Los betabloqueadores pueden enmascarar los síntomas hipoglucémicos.
El octreótido/lanreótido puede tanto aumentar como disminuir los requerimientos de insulina.
El consumo de alcohol puede intensificar o reducir los efectos hipoglucémicos de la insulina.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: No se han reportado hasta la fecha.
PRECAUCIONES GENERALES:
Viajes: Antes de realizar un viaje a una zona con diferente uso horario, el paciente debe solicitar asesoría a su médico ya que esto puede requerir cambios en el horario de administración de la insulina y en el horario de las comidas.
Hiperglucemia: La dosificación inadecuada o la descontinuación del tratamiento, especialmente en el caso de los sujetos diabéticos tipo 1, pueden traer consigo hiperglucemia y cetoacidosis diabética. Por lo general, los primeros síntomas de la hiperglucemia se desarrollan gradualmente en un periodo de horas o días. Éstos incluyen sed, aumento en la frecuencia urinaria, náuseas, vómito, mareos, piel seca y enrojecida, boca seca, pérdida de apetito, así como aliento con olor a acetona. En diabetes tipo 1, los eventos hiperglucémicos sin tratar pueden conducir a cetoacidosis diabética, que es potencialmente mortal.
Hipoglucemia: La omisión de una comida o efectuar el ejercicio físico extenuante no planeado puede provocar hipoglucemia.
La hipoglucemia puede presentarse si la dosis de insulina es demasiado alta con respecto a los requerimientos de insulina (Ver Efectos adversos y Sobredosis).
NOVOMIX® 30 versus insulina humana bifásica (BHI):
NOVOMIX® 30: En comparación con la insulina humana bifásica, NOVOMIX® 30 puede tener un efecto hipoglucemiante más pronunciado hasta 6 horas después de la inyección. Esto puede necesitar ser compensado de manera individual en cada paciente a través del ajuste de la dosis de insulina y/o de la ingestión de alimentos.
Terapia de insulina intensificada: Los pacientes cuyo control de la glucosa en sangre presenta una notable mejoría, por ejemplo, a través de una intensificación de la terapia con insulina, pueden llegar a experimentar una modificación de los síntomas habituales de advertencia de hipoglucemia y deberán recibir asesoría. Estos síntomas de advertencia habituales pueden desaparecer en pacientes con diabetes de larga evolución.
Control estricto de los niveles de glucosa:
Un control más estricto de los niveles de glucosa puede aumentar el potencial de episodios de hipoglucemia y, por lo tanto, es necesario brindar una atención especial durante la intensificación de la dosis según se detalla en la sección Dosis y vía de administración.
Administración de NOVOMIX® 30:
NOVOMIX® 30 debe ser administrado en relación inmediata con los alimentos, se debe considerar el inicio rápido de la acción en pacientes que presenten enfermedades concomitantes o estén siendo tratados con medicamentos en donde se espere un retraso en la absorción de los alimentos.
Enfermedades concomitantes: Las enfermedades concomitantes, especialmente las infecciones y condiciones febriles, por lo general aumentan los requerimientos de insulina del paciente. Las enfermedades concomitantes renales, hepáticas o que afecten a las glándulas suprarrenales, hipófisis o tiroidea, quizá requieran cambios en la dosis de insulina.
Transferencia de otros productos de la insulina: Cuando se transfiere a los pacientes entre diferentes tipos de productos de insulina, los síntomas de advertencia tempranos de la hipoglucemia pueden cambiar o volverse menos pronunciados que los experimentados con su insulina anterior.
La transferencia de un paciente de otro tipo o marca de insulina deberá tener lugar bajo una estricta supervisión médica. Los cambios en la concentración, la marca (fabricante), el tipo, el origen (insulina humana, insulina análoga) y/o el método de fabricación pueden traer consigo la necesidad de una modificación de la dosis. Los pacientes transferidos a NOVOMIX® 30 de otro tipo de insulina pueden requerir un aumento en el número de inyecciones diarias o un cambio en la dosificación de aquella que usaban con sus productos de insulina habituales. En caso de ser necesario un ajuste de la dosis, éste puede efectuarse en la primera dosis o en el transcurso de las primeras semanas o meses (Ver la sección Dosis y vía de administración).
Reacción en el sitio de inyección: Tal como sucede con cualquier terapia con insulina, es posible que se presenten reacciones en el sitio de inyección, tales como: dolor, enrojecimiento, urticaria, inflamación, hematomas, hinchazón y comezón. El alternar continuamente los sitios de inyección dentro de un área determinada puede ayudar a reducir o a prevenir dichas reacciones. Por lo general, las reacciones se resuelven una vez transcurridos unos cuantos días o unas cuantas semanas. En raras ocasiones, las reacciones en el sitio de inyección pueden requerir la interrupción del uso de NOVOMIX® 30.
Combinación de tiazolidinediona y de productos farmacéuticos de insulina: Se han reportado casos de insuficiencia cardiaca congestiva cuando se utilizaron tiazolidinedionas en combinación con insulina, especialmente en pacientes con factores de riesgo de desarrollar insuficiencia cardiaca congestiva. Esto debe tenerse en cuenta si se considera el tratamiento combinado con tiazolidinedionas y medicamentos que contienen insulina. Si se usa esa combinación, se debe observar a los pacientes para detectar signos y síntomas de insuficiencia cardiaca congestiva, aumento de peso y edema. En caso de presentarse algún tipo de deterioro de los síntomas cardiacos, debe interrumpirse la administración de tiazolidinedionas.
Evitar mezclas accidentales/errores de medicación: Se debe instruir a los pacientes para que comprueben siempre la etiqueta de insulina antes de cada inyección para evitar mezclas accidentales entre NovoMix y otros productos de insulina.
Anticuerpos contra insulina: La administración de insulina puede causar la formación de anticuerpos contra insulina.
En casos raros, la presencia de estos anticuerpos contra insulina puede necesitar el ajuste de la dosis de insulina para corregir una tendencia hacia la hiperglucemia o hipoglucemia.
Efectos en la capacidad de manejar y usar maquinaria: La capacidad de los pacientes de concentrarse y reaccionar puede verse deteriorada como resultado de la hipoglucemia. Esto puede constituir un riesgo en situaciones en las que estas capacidades sean de importancia especial (p. ej. al conducir un auto u operar maquinaria).
Se debe recomendar a los pacientes tomar precauciones para evitar hipoglucemia mientras conducen o al operar maquinaria. Esto es particularmente importante en aquellas personas que tienen alteración del estado de conciencia y de los signos y síntomas de advertencia de la hipoglucemia o si tienen episodios frecuentes de hipoglucemia. La conveniencia de conducir u operar maquinaria debe considerarse bajo estas circunstancias.
DOSIS Y VÍA DE ADMINISTRACIÓN: NOVOMIX® 30 es una suspensión bifásica del análogo de insulina, insulina asparta. La suspensión contiene la insulina asparta de rápida e intermedia acción en una razón de 30/70.
La posología de NOVOMIX® 30 es individual y determinada de acuerdo con las necesidades del paciente. Se recomiendan los ajustes de la dosis de insulina y la supervisión de glucemia para alcanzar el control glucémico óptimo.
Diabetes tipo 2: En pacientes con diabetes tipo 2, NOVOMIX® 30 puede ser administrado como monoterapia o en combinación con fármacos antidiabéticos orales cuando la glucosa en sangre no sea controlada adecuadamente con los antidiabéticos orales por sí solos. En el caso de los pacientes con diabetes tipo 2, la dosis inicial recomendada de NOVOMIX® 30 es de 6 U junto con el desayuno y 6 U junto con la cena (alimentos tomados por la noche). También es posible iniciar el tratamiento con NOVOMIX® 30 administrando 12 U una vez al día junto con la cena (alimentos tomados por la noche. Cuando se utilice NOVOMIX® 30 una vez al día y se alcance una dosis de 30 unidades, generalmente se recomienda pasar a un régimen de dos inyecciones al día dividiendo la dosis en dos inyecciones equivalentes, una administrada junto con el desayuno y otra con la cena. Si la dosificación dos veces al día con NOVOMIX® 30 resulta en episodios recurrentes de hipoglucemia durante el día, la dosis de la mañana puede dividirse en dosis de la mañana y del almuerzo (dosificación tres veces al día).
Lineamientos de ajustes de dosis:
Se recomienda seguir los lineamientos que se presentan a continuación para realizar los ajustes a la dosis:
|
Nivel de glucosa en sangre |
Ajuste de la dosis de NOVOMIX® 30 |
|
|
< 4.4 mmol/L |
< 80 mg/dL |
- 2 U |
|
4.4 a 6.1 mmol/L |
80 a 110 mg/dL |
0 |
|
6.2 a 7.8 mmol/L |
111 a 140 mg/dL |
+ 2 U |
|
7.9 a 10 mmol/L |
141 a 180 mg/dL |
+ 4 U |
|
> 10 mmol/L |
> 180 mg/dL |
+ 6 U |
Se deberán utilizar los niveles más bajos de glucosa en sangre antes de los alimentos de los tres días anteriores. No se deberá incrementar la dosis si se ha presentado hipoglucemia en estos días. Se podrá ajustar la dosis una vez por semana hasta alcanzar el nivel objetivo de HbA1c. Los niveles de glucosa en sangre antes de los alimentos deberán ser utilizados para evaluar la idoneidad de la dosis precedente.
Diabetes tipo 1: En los pacientes con diabetes tipo 1, la necesidad individual de insulina suele ser de entre 0.5 y 1.0 Unidades/kg/día. NOVOMIX® 30 puede satisfacer completa o parcialmente con dicho requisito. La necesidad diaria de insulina puede ser más elevada en los pacientes con resistencia a la insulina (por ejemplo, a causa de obesidad) y más baja en los pacientes con producción endógena residual de insulina.
Actividad física, cambio de la dieta o enfermedad:. Puede ser necesario el ajuste de la dosificación si los pacientes experimentan un incremento en la actividad física, un cambio en su dieta usual o durante una enfermedad concomitante.
Transferencia de otros productos de insulina:
Al transferir a un paciente de la insulina humana bifásica a NOVOMIX® 30, debe iniciarse con la misma dosis y régimen. Después debe ajustarse según las necesidades individuales (ver los lineamientos de los ajustes de la dosis en la tabla anterior).
Como con todos los productos de insulina, se recomienda la supervisión de cerca de la glucosa durante la transferencia y en las semanas iniciales después de la misma (ver la sección Precauciones generales).
Poblaciones especiales de NOVOMIX® 30:
Ancianos: NOVOMIX® 30 puede usarse en pacientes de edad avanzada; sin embargo, existe experiencia limitada con el uso de NOVOMIX® 30 continuamente con OAD en pacientes mayores de 75 años.
Al igual que con todos los productos de insulina, en pacientes mayores el monitoreo de glucosa debe intensificarse y ajustar la dosis de insulina asparta de manera individual.
Insuficiencia renal y hepática: La necesidad de insulina puede reducirse en pacientes con deterioro renal o hepático.
Al igual que con todos los productos de insulina, los nivles de glucosa deben ser supervisados en pacientes con insuficiencia hepática o renal, el monitoreo de la glucosa se debe intensificar y ajustar la dosificación con insulina asparta de manera individual.
Población pediátrica: NOVOMIX® 30 puede ser utilizado en niños y adolescentes de 10 o más años de edad cuando se prefiere el uso de una insulina premezclada. Existen datos clínicos limitados para niños de 6 a 9 años de edad (ver Farmacocinética y farmacodinamia). No hay datos disponibles para NOVOMIX® 30 en niños de menos de 6 años de edad.
Vía de administración: NOVOMIX® 30 se debe de administrar solamente por vía subcutánea. NOVOMIX® 30 no se debe administrar vía intravenosa, puede dar lugar a hipoglucemia grave. La administración intramuscular debe ser evitada. NOVOMIX® 30 no debe ser utilizado en bombas de infusión para insulina.
NOVOMIX® 30 es administrado por la vía subcutánea en el muslo o en la pared abdominal.
En caso de ser conveniente, es posible utilizar la región del glúteo o del deltoides. Los sitios de inyección deben ser alternados dentro de una misma región para reducir el riesgo de lipodistrofia. No se ha investigado la influencia de los diferentes sitios de inyección en la absorción de NOVOMIX® 30. Tal como sucede con todas las insulinas, la duración de la acción variará dependiendo de la dosis, del sitio de inyección, del flujo sanguíneo, de la temperatura y del nivel de actividad física.
NOVOMIX® 30 comienza a actuar más rápido que la insulina humana bifásica y, por lo general, debe ser administrado inmediatamente antes de los alimentos. Cuando sea necesario, NOVOMIX® 30 puede ser administrado poco tiempo después de los alimentos.
NOVOMIX® 30 pluma precargada FlexPen® es una pluma precargada diseñada para ser utilizada con agujas desechables NovoFine® con una longitud de hasta 8 mm.
FlexPen® suministra 1-60 unidades en incrementos de 1 unidad.
NOVOMIX® 30 pluma precargada FlexPen® cuenta con un código de color e incluye un instructivo en el empaque con las instrucciones detalladas para su uso.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: No es posible definir una sobredosis específica para la insulina; sin embargo, es posible que se desarrolle hipoglucemia en etapas secuenciales si se administran dosis demasiado elevadas en relación con la necesidad del paciente.
• Los episodios leves de hipoglucemia pueden ser tratados a través de la administración de glucosa o productos azucarados por la vía oral. Por lo tanto, se recomienda que los pacientes diabéticos siempre traigan consigo productos que contengan glucosa.
• Los episodios severos de hipoglucemia –en los cuales el paciente pierde la conciencia– pueden ser tratados a través de la administración de glucagón (0.5 a 1 mg) por la vía intramuscular o subcutánea por parte de una persona capacitada, o bien, mediante la administración de glucosa por la vía intravenosa por parte de un profesional médico.
• Si el paciente no responde al glucagón al cabo de 10 a 15 minutos, también se deberá administrar glucosa por la vía intravenosa. Una vez que el paciente haya recuperado la conciencia, se recomienda administrar carbohidratos por la vía oral con el fin de evitar una recaída.
PRESENTACIONES: NOVOMIX® 30 caja con 1 o 5 pluma(s) prellenada(s) FlexPen® de 3 ml e instructivo anexo.
*FlexPen®: Cartucho de suspensión con 3 ml (cristal tipo I) con un émbolo (bromobutil) y un cierre de goma (bromobutil/poliisopreno) contenida en una pluma de dosis múltiple, precargada y desechable hecha de polipropileno en una caja. El cartucho contiene un recipiente de cristal para facilitar la resuspensión.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Consérvese en refrigeración a una temperatura de 2°C a 8°C. Mantener lejos del congelador. No congelar. NOVOMIX® 30 pluma precargada FlexPen® que esté siendo utilizado o portado como repuesto puede ser conservado a temperatura ambiente (a menos de 30ºC) durante un máximo de 4 semanas; una vez cumplido este periodo, todo producto no utilizado deberá ser desechado. No volver a refrigerar. No almacenar el producto a una temperatura superior a 30°C. Mantener tapado el inyector tipo pluma NOVOMIX® 30 FlexPen® cuando el mismo no esté siendo utilizado, para protegerlo de la luz.
NOVOMIX® 30 pluma precargada FlexPen® debe protegerse del calor y luz excesivos.
Tras la primera apertura o al llevar como repuesto: No refrigerar.
Después de sacar NOVOMIX® 30 pluma precargada del refrigerador, se recomienda permitir que alcance la temperatura ambiente antes de resuspender la insulina según las instrucciones de uso por primera vez.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. No se deje al alcance y la vista de los niños. Literatura exclusiva para médicos. NOVOMIX® 30 no debe usarse si el líquido resuspendido no tiene aspecto uniformemente blanco y opaco. Debe recalcarse al paciente la necesidad de resuspender la suspensión de NOVOMIX® 30 pluma precargada FlexPen® inmediatamente antes de usarse. No se debe usar NOVOMIX® 30 que haya sido congelado. Se debe recomendar al paciente desechar la aguja después de cada inyección. Las agujas no deben compartirse. El cartucho no debe volverse a llenar.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx
Titular del Registro:
Novo Nordisk A/S
Novo Allé, Bagsvaerd,
2880, Dinamarca.
Representante legal:
NOVO NORDISK MÉXICO, S. A. de C. V.
Homero Núm. 1500, piso 3, Col. Polanco, C.P. 11560, Deleg. Miguel Hidalgo, Ciudad de México, México.
Reg. Núm. 054M2005, SSA
®Marca Registrada