
NOVIAL
DESOGESTREL, ETINILESTRADIOL
Tabletas
1 Caja, 1 Envase(s) de burbuja, 21 Tabletas,
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA contiene:
Tabletas Amarillas
Desogestrel 0.050 mg
Etinilestradiol 0.035 mg
Tabletas Rojas
Desogestrel 0.100 mg
Etinilestradiol 0.030 mg
Tabletas Blancas
Desogestrel 0.150 mg
Etinilestradiol 0.030 mg
Excipiente cbp 1 tableta
INDICACIONES TERAPÉUTICAS: Anticonceptivo oral trifásico.
Coadyuvante en el tratamiento de cutis graso y prevención del acné.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacocinéticas:
Desogestrel:
Absorción: El desogestrel administrado por vía oral se absorbe rápida y completamente y se convierte en etonogestrel. Las concentraciones séricas máximas se alcanzan aproximadamente a las 1.5 horas. La biodisponibilidad es del 62-81%.
Distribución: El etonogestrel se une a albúmina sérica y a la globulina fijadora de hormonas sexuales (SHBG). Sólo el 2-4% de las concentraciones séricas totales del fármaco están presentes como esteroide libre; el 40-70% se une específicamente a la SHBG. El aumento de la SHBG inducido por el etinil estradiol incide en la distribución de las proteínas séricas, lo cual causa un aumento de la fracción unida a SHBG y una disminución de la fracción unida a albúmina. El volumen aparente de distribución del desogestrel es de 1.5 L/kg.
Metabolismo: El etonogestrel se metaboliza por completo por las vías conocidas de metabolismo de los esteroides. La tasa de aclaramiento metabólico del suero es de aproximadamente de 2 mL/min/kg. No se halló interacción con el etinilestradiol coadministrado.
Eliminación: Los niveles séricos de etonogestrel disminuyen en dos fases. La fase de eliminación terminal se caracteriza por una vida media de aproximadamente 30 horas. El desogestrel y sus metabolitos se excretan con una relación urinaria biliar de alrededor de 6:4.
Condiciones de estado estable: La farmacocinética del etonogestrel es afectada por los niveles de SHBG, los cuales son incrementados al triple por el etinilestradiol. Luego de la ingesta diaria, los niveles séricos del fármaco aumentan alrededor de dos o tres veces y alcanzan condiciones de estado estable durante la segunda mitad del ciclo de tratamiento.
Etinilestradiol:
Absorción: El etinilestradiol administrado por vía oral se absorbe rápida y completamente. Las concentraciones séricas máximas se alcanzan en 1-2 horas. La biodisponibilidad absoluta como resulta de conjugación presistémica y metabolismo de primer paso es aproximadamente del 60%.
Distribución: El etinilestradiol se une en gran medida, pero no específicamente, a la albúmina sérica (aproximadamente el 98.5%) e induce un aumento de las concentraciones séricas de SHBG. Se determinó el volumen aparente de distribución aproximadamente de 5 L/kg.
Metabolismo: El etinilestradiol experimenta conjugación presistémica tanto en la mucosa del intestino delgado como en el hígado. El etinilestradiol es metabolizado principalmente por hidroxilación aromática, pero se forman gran variedad de metabolitos hidroxilados y metilados, los cuales están presentes como metabolitos libres y conjugados con glucurónidos y sulfato. La tasa de aclaramiento metabólico es de alrededor de 5 mL/min/kg.
Eliminación: Los niveles séricos de etinilestradiol disminuyen en dos fases, la fase de eliminación terminal se caracteriza por una vida media de aproximadamente 24 horas. No se excreta el fármaco sin cambios, los metabolitos del etinilestradiol se excretan con una relación urinaria-biliar de 4:6. La vida media de excreción de metabolitos es de aproximadamente 1 día.
Condiciones de estado estable: Se alcanzan concentraciones de estado estable después de 3-4 días, cuando los niveles séricos del fármaco son superiores al 30-40% en comparación con dosis únicas.
Propiedades farmacodinámicas:
Clasificación ATC G03A B05.
El efecto anticonceptivo de los AOCs (anticonceptivos orales combinados) se basa en la interacción de varios factores, de los cuales el más importante que se observa es la inhibición de la ovulación y los cambios en la secreción cervical. Además de brindar protección contra el embarazo, los AOCs tienen varias propiedades positivas que, junto con las propiedades negativas, pueden ser útiles para decidir el método anticonceptivo. El ciclo es más regular y con frecuencia la menstruación es menos dolorosa y el sangrado es menos abundante. Este último puede producir una disminución en la presentación de deficiencia de hierro. Independientemente de esto, con los AOCs de dosis más elevadas (50 μg de etinilestradiol) hay evidencia de la reducción de tumores fibroquísticos de la glándula mamaria, quistes de ovario, enfermedad pélvica inflamatoria, embarazo ectópico y cáncer de ovario y endometrial. Si esto también aplica a los AOCs de dosis baja, está por ser confirmado.
En los estudios clínicos se demostró que NOVIAL® reducía significativamente los parámetros androgénicos 3-α androstenediol-glucurónido, androstenediona, DHEA-S y testosterona libre.
CONTRAINDICACIONES: No se deberán utilizar anticonceptivos hormonales combinados (AHCs) en presencia de cualquiera de las condiciones enumeradas a continuación. En el caso de que cualquiera de las condiciones aparezca por primera vez durante el uso del AHC, el mismo deberá ser descontinuado inmediatamente.
• Presencia o antecedentes de trombosis venosas (trombosis venosa profunda, embolismo pulmonar).
• Presencia o antecedentes de trombosis arterial (infarto al miocardio, accidente cerebro-vascular) o condiciones prodrómicas (por ejemplo, isquemia transitoria, angina de pecho).
• Predisposición conocida para trombosis arterial o venosa, tal como resistencia de proteína C activada (APC), deficiencia de anti-trombina III, deficiencia de proteína C, deficiencia de proteína S, hiperhomocisteinemia y anticuerpos anti-fosfolípidos.
• Antecedentes de migraña con síntomas neurológicos focales.
• Diabetes mellitus con compromiso vascular.
• La presencia de uno o múltiples factores de riesgo para la trombosis venosa o arterial también puede constituir una contraindicación.
• Cirugía mayor con inmovilización prolongada.
• Pancreatitis o antecedentes de la misma si está asociada con hipertrigliceridemia severa.
• Presencia o antecedentes de enfermedad hepática severa en tanto los varones de la función hepática no hayan regresado a valores normales.
• Presencia o antecedentes de tumores hepáticos (benignos o malignos).
• Neoplasias malignas influenciadas por esteroides sexuales o sospecha de éstas (por ejemplo, de los órganos genitales o las glándulas mamarias).
• Sangrado vaginal sin diagnóstico.
• Embarazo o sospecha de éste.
• Hipersensibilidad a las sustancias activas o a cualquiera de los excipientes.
NOVIAL® está contraindicado para uso con el régimen farmacológico combinado con el virus de la Hepatitis C Ombitasvir/paritaprevir/ritonavir con o sin dasabuvir (ver Precauciones generales).
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: NOVIAL® no está indicado durante el embarazo. Si ocurre el embarazo durante el tratamiento con NOVIAL®, se debe detener la ingestión posterior. Sin embargo, extensos estudios epidemiológicos no han revelado un incremento en el riesgo de defectos al nacimiento en niños que nacen de mujeres que usaron AOCs antes del embarazo, ni efecto teratogénico cuando los AOCs se tomaron involuntariamente durante el primer trimestre del embarazo.
La lactancia puede verse influida por los AOCs ya que pueden reducir la cantidad y cambiar la composición de la leche materna. Por lo tanto, el uso de AOCs generalmente no debe recomendarse hasta que la madre en periodo de lactancia haya destetado completamente a su hijo. Pequeñas cantidades de esteroides anticonceptivos y/o sus metabolitos pueden excretarse en la leche, pero no hay evidencia de que esto afecte de forma adversa la salud del niño.
Efectos sobre la capacidad de conducir vehículos y operar maquinaria: No se han observado efectos en la habilidad para conducir vehículos y operar maquinaria.
REACCIONES SECUNDARIAS Y ADVERSAS: Los efectos indeseables posiblemente relacionados que se han reportado en ensayos clínicos o estudios observacionales en usuarias de NOVIAL® y en general en usuarias de AHCs, están listados en la siguiente tabla1.
|
Clase/Órgano Sistema |
Común (≥ 1/100) |
No común (≥ 1/1000 y < 100) |
Raro (< 1/1000) |
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
||
|
Trastornos del metabolismo y de la nutrición |
Retención de líquidos |
||
|
Desórdenes psiquiátricos |
Estado de ánimo depresivo, estado de ánimo alterado |
Disminución de la libido |
Aumento de la libido |
|
Trastornos del sistema nervioso |
Cefalea |
Migraña |
|
|
Trastornos oculares |
Intolerancia a los lentes de contacto |
||
|
Trastornos vasculares |
Tromboembolismo venoso2 Tromboembolismo arterial2 |
||
|
Trastornos gastrointestinales |
Náusea, dolor abdominal |
Vómito, diarrea |
|
|
Trastornos de la piel y del tejido subcutáneo |
Rash, urticaria |
Eritema nodoso, eritema multiforme |
|
|
Trastornos del sistema reproductivo y glándula mamaria |
Dolor y sensibilidad en las mamas |
Agrandamiento de las glándulas mamarias |
Secreción vaginal, secreción mamaria |
|
Investigaciones |
Aumento de peso |
Disminución de peso |
1 Se menciona el término MedDRA más adecuado (versión 11.0) para describir una cierta reacción adversa. Los sinónimos o condiciones relacionadas no se mencionan, pero deben tomarse en cuenta también.
2 lncidencia en estudios observacionales de cohorte de ≥ 1/10,000 a < 1/1,000 mujer-año.
Un número de reacciones adversas se han reportado en las mujeres que usan anticonceptivos orales combinados, los cuales se discuten con más detalle en la sección de Advertencias y Precauciones Especiales para Uso. Esto incluye: trastornos tromboembólicos venosos, tromboembólicos arteriales; hipertensión; tumores hormono-dependientes (por ejemplo: tumores de hígado; cáncer de mama); cloasma.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Los datos pre-clínicos no revelan un riesgo especial para los humanos cuando los AOCs se usan como se recomienda. Esto basado en los estudios convencionales de toxicidad, genotoxicidad, potencial carcinogénico y toxicidad reproductiva. Sin embargo, se deberá tener en mente que los esteroides sexuales pueden promover el crecimiento de ciertos tejidos y tumores dependientes de hormonas.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Nota: La información sobre la prescripción de medicamentos concomitantes debe consultarse para identificar interacciones potenciales.
Las interacciones entre anticonceptivos orales y otros medicamentos pueden llevar a un sangrado repentino y/o falla de los anticonceptivos orales. Las siguientes interacciones han sido reportadas en la literatura.
Metabolismo hepático: Pueden ocurrir interacciones con medicamentos o productos herbales que inducen a las enzimas microsomales, específicamente enzimas del citocromo P450 (CYP) lo cual pueden resultar en un incremento en el aclaramiento reduciendo las concentraciones plasmáticas de hormonas sexuales y puede disminuir la eficacia de los anticonceptivos orales combinados, incluyendo NOVIAL®.
Estos productos incluyen fenitoína, fenobarbital, primidona, bosentan, carbamazepina, rifampicina y posiblemente oxcarbamazepina, topiramato, felbamato, griseofulvina, algunos inhibidores de la proteasa del VIH (por ejemplo, ritonavir) y los inhibidores no nucleósidos de la transcriptasa inversa (por ejemplo, efavirenz) y productos que contienen el remedio herbal de la hierba de San Juan.
La inducción enzimática puede ocurrir después de unos días de tratamiento. La inducción enzimática máxima se observa generalmente en unas pocas semanas. Después de que la terapia con fármacos se ha suspendido, la inducción enzimática puede durar aproximadamente 28 días.
Cuando se coadministra con anticonceptivos hormonales, muchas combinaciones de inhibidores de la proteasa del VIH (por ejemplo, nelfinavir) e inhibidores no análogos de nucleósidos de la transcriptasa inversa (por ejemplo, nevirapina) y/o combinaciones con medicamentos contra el virus de la hepatitis C (VHC) (por ejemplo, boceprevir, telaprevir), puede incrementar o disminuir las concentraciones en plasma de progestinas, incluido el etonogestrel, el metabolito activo de desogestrel, o estrógenos. El efecto neto de estos cambios puede ser clínicamente relevante en algunos casos.
Debe asesorarse a las mujeres que reciben cualquiera de los medicamentos o productos herbales inductores de enzimas hepáticas mencionados anteriormente en el sentido de que la eficacia de NOVIAL® puede disminuir. Se debe utilizar un método anticonceptivo de barrera además de NOVIAL® durante la administración del medicamento inductor de enzimas hepáticas y por 28 días después a la descontinuación del medicamento inductor de enzimas hepáticas.
Si la administración concomitante de medicamentos se extiende más allá del final de las tabletas en el paquete de AOC actual, el siguiente paquete de AOC debe de iniciarse de inmediato sin el habitual intervalo libre de tabletas.
Para mujeres con terapia a largo plazo con medicamentos inductores de enzimas, debe de considerarse un método anticonceptivo alternativo que no se vea afectado por medicamentos inductores de enzimas.
La administración concomitante de inhibidores potentes del CYP3A4 (por ejemplo, ketoconazol, itraconazol, claritromicina) o moderados (por ejemplo, fluconazol, diltiazem, eritromicina) pueden incrementar las concentraciones séricas de estrógenos o progestinas, incluyendo el etonogestrel, el metabolito activo del desogestrel.
Los anticonceptivos orales pueden interferir con el metabolismo normal de otros fármacos. En consecuencia, las concentraciones plasmáticas y en los tejidos pueden incrementarse (por ejemplo, ciclosporina) o disminuir (por ejemplo, lamotrigina).
Durante los ensayos clínicos con el régimen de combinación de fármacos contra el VHC ombitasvir/paritaprevir/ritonavir con y sin dasabuvir, las elevaciones de ALT mayores a 5 veces el límite superior de lo normal (LSN) fueron significativamente más frecuentes en mujeres que usaban medicamentos que contienen etinilestradiol, tales como los AHCs. NOVIAL® debe suspenderse antes de iniciar el tratamiento con el régimen de combinación de fármacos contra el VHC ombitasvir/paritaprevir/ritonavir con o sin dasabuvir (ver Contraindicaciones y precauciones generales).
NOVIAL® puede reiniciarse aproximadamente 2 semanas después de la finalización del tratamiento con el régimen de combinación de fármacos.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: El uso de anticonceptivos esteroidales puede influir en los resultados de ciertas pruebas de laboratorio, incluso en los parámetros bioquímicos de la función hepática, tiroidea, adrenal y renal y los niveles plasmáticos de ciertas proteínas (trasportadoras), por ej., Globulinas, fijadores de corticosteroides y fracciones de lípido/lipoproteína, parámetros del metabolismo de carbohidratos y parámetros de coagulación y fibrinólisis. Los cambios generalmente permanentes dentro del parámetro normal de laboratorio.
PRECAUCIONES GENERALES: En presencia de cualquiera de las condiciones/factores de riesgo mencionados a continuación, los beneficios del uso de anticonceptivos hormonales combinados (AHCs) deberán ser evaluados frente a los posibles riesgos para cada mujer en particular y discutidos con la usuaria antes de que decida comenzar a utilizarlo. En el caso de agravamiento, exacerbación o aparición por primera vez de cualquiera de estas condiciones o factores de riesgo, la mujer deberá contactar a su médico. El médico deberá decidir si discontinuar o no el uso del AHC.
A lo largo de esta sección, el término general Anticonceptivo Hormonal Combinado (AHC) se utiliza cuando existen datos para los anticonceptivos orales y no orales. El término anticonceptivo oral combinado (AOC) se usa cuando existen datos sólo para anticonceptivos orales.
Trastornos circulatorios:
• Estudios epidemiológicos han mostrado una asociación entre el uso de AHCs y un incremento en el riesgo de enfermedades trombóticas arteriales, venosas y enfermedades tromboembólicas tales ncomo infarto de miocardio, accidente cerebrovascular, trombosis venosa profunda y embolismo pulmonar. Estos eventos ocurren rara vez.
• El uso de cualquier AHC está asociado con un riesgo de tromboembolismo venoso (TEV), que se manifiesta como trombosis venosa profunda y/o embolismo pulmonar. El riesgo es más alto durante el primer año en que una mujer utiliza por primera vez un AHC. El riesgo también aumenta después de iniciar por primera vez un AHC o al reiniciar el mismo o un AHC diferente después de una interrupción en su uso de 4 semanas o más.
• Algunos estudios epidemiológicos han sugerido que las mujeres que usan bajas dosis de AOCs de progestágenos de tercera generación, incluyendo desogestrel, tienen un incremento en el riesgo de TEV comparadas con las que usan AOCs de dosis bajas con el progestágeno levonorgestrel. Estos estudios indican un incremento del riesgo de aproximadamente 2 veces, lo cual corresponderá a 1-2 casos adicionales de TEV por cada 10,000 mujeres/año de uso. Sin embargo, los datos de otros estudios no han demostrado este aumento de 2 veces del riesgo.
• En general. la incidencia de TEV en usuarias de AHCs de dosis bajas de estrógeno (< 0.05 mg de etinilestradiol) varía de aproximadamente 3 a 12 casos por 10,000 mujeres/año en comparación con 1 a 5 casos por 10,000 mujeres/año en no usuarias de AHC. La incidencia de TEV que ocurre durante el uso de AHCs es menor que la incidencia asociada con el embarazo (es decir, 5 a 20 casos por cada 10,000 mujeres/año). El TEV es fatal en 1-2% de los casos.
• La siguiente figura muestra el riesgo de desarrollar un TEV para las mujeres que no están embarazadas y que no usan AHCs, para las mujeres que usan AHCs, para las mujeres embarazadas y para las mujeres en el periodo postparto. Para poner en perspectiva el riesgo de desarrollar un TEV: Si 10,000 mujeres que no están embarazadas y no usan AHCs se monitorean durante un año, entre 1 y 5 de estas mujeres desarrollarán TEV.
• Probabilidad de desarrollar un TEV.
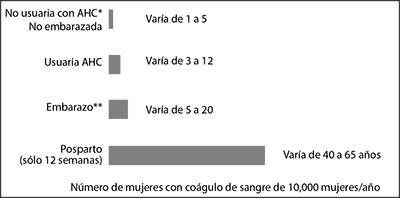
* AHC = Anticonceptivo Hormonal Combinado.
** Datos de embarazos basados en la duración real del embarazo en los estudios de referencia. Basado en un modelo que asume que la duración del embarazo es de 9 meses, la tasa es de 7 a 27 por 10,000 mujer/año.
• Muy rara vez, se ha reportado que la trombosis ocurra en otros vasos sanguíneos, por ejemplo, venas y arterias hepáticas, mesentéricas, renales, cerebrales o retinianas en usuarias de AHCs.
• Los síntomas de los eventos trombóticos/tromboembólicos venosos o arteriales o de un accidente cerebrovascular pueden incluir: dolor de piernas unilateral y/o hinchazón; dolor severo repentino en el tórax, ya sea que se irradie o no hacia el brazo izquierdo; dificultad respiratoria súbita; inicio repentino de tos; cualquier dolor de cabeza inusual, severo, prolongado; pérdida repentina de la vista parcial o completa; diplopía; dificultad para hablar o afasia; vértigo; colapso con o sin crisis consultiva focal; debilidad o adormecimiento muy marcado que afecta repentinamente un lado o una parte del cuerpo; trastornos motores; abdomen ‘agudo’.
• El riesgo de incremento de tromboembolismo venoso con:
– Incremento de edad.
– Una historia familiar positiva (es decir, tromboembolismo venoso incluso en un hermano o padre a una edad relativamente temprana). Si se sospecha de una predisposición hereditaria, la mujer debe remitirse a una especialista para que la asesore antes de decidirse por el uso de cualquier AOC.
– Obesidad (índice de masa corporal superior a 30 kg/m2).
– Inmovilización prolongada, cirugía mayor, cualquier cirugía de las piernas o trauma mayor. En estas situaciones es aconsejable descontinuar el uso de AOCs (en caso de cirugía programada por lo menos cuatro semanas previas a la misma) y no reanudar hasta dos semanas después de una re-movilización completa.
– Y también posiblemente con tromboflebitis superficial y venas varicosas. No hay consenso acerca del posible papel de las venas varicosas y la tromboflebitis superficial en la etiología del tromboembolismo venoso.
• El riesgo de complicaciones tromboembólicas arteriales se incrementa con:
– Incremento de edad.
– El habito de fumar (al fumar mayor cantidad de cigarrillos y aumentar la edad el riesgo aumenta adicionalmente, sobre todo en mujeres mayores de 35 años de edad).
– Dislipoproteinemia.
– Obesidad (índice de masa corporal mayor de 30 kg/m2).
– Hipertensión.
– Migraña.
– Enfermedad cardiaca vascular.
– Fibrilación arterial.
– Un antecedente familiar positivo (es decir, trombosis arterial incluso en un hermano o padre a una edad relativamente temprana). Si se sospecha de una predisposición hereditaria, la mujer de remitirse a un especialista para que la asesore antes de decidirse por el uso de cualquier AOC.
• El incremento en el riesgo de tromboembolismo en el puerperio debe ser considerado (para información de "embarazo y lactancia").
• Otras condiciones médicas que se han asociado con eventos adversos circulatorios, incluyen a la diabetes mellitus, lupus eritematoso sistémico, síndrome urémico hemolítico, enfermedad intestinal inflamatoria crónica (enfermedad de Crohn o colitis ulcerativa) y enfermedad de células falciformes.
• Un aumento en la frecuencia o la severidad de las migrañas durante el uso del AOC (que puede ser el pródromo de un evento cerebrovascular) puede ser una razón para la discontinuación inmediata del AOC.
• Los factores bioquímicos pueden ser indicativos de predisposición hereditaria o adquirida para la trombosis venosa o arterial incluyen la resistencia a la Proteína C activada (APC), hiperhomocisteinemia, deficiencia de antitrombina III, deficiencia de proteína C, deficiencia de proteína S, anticuerpos antifosfolipídicos (anticuerpos anticardiolipina, anticoagulante lúpico).
• Cuando considera el riesgo/beneficio, el médico debe tomar en cuenta que el tratamiento adecuado de una condición puede reducir el riesgo asociado de trombosis.
Tumores:
• El factor de riesgo más importante para cáncer de cérvix es una infección persistente por el virus del papiloma humano (VPH). Estudios epidemiológicos han indicado que el uso a largo plazo de los AOCs puede contribuir a elevar el riesgo, pero continúa existiendo controversia acerca del grado, al cual este hallazgo es atribuible a confundir como, exploración cervical y diferencias en la conducta sexual incluyendo el uso de anticonceptivos de barrera.
• Un metaanálisis de 54 estudios epidemiológicos reportó que hay un riesgo relativo ligeramente aumentado (RR=1.24) de tener diagnóstico de cáncer de mama en mujeres quienes están usando actualmente AOCs. El riesgo en exceso desaparece gradualmente durante el transcurso de los 10 años después de dejar de usar el AOC. Debido a que el cáncer de mama es raro en mujeres menores de 40 años de edad, el número en exceso de diagnósticos de cáncer de mama en las usuarias actuales o recientes de AOC es pequeño en relación con el riesgo global de cáncer de mama. Estos estudios no dan evidencia de las causas. El patrón observado del incremento del riesgo puede ser debido a un diagnóstico más temprano de cáncer de mama en usuarias de AOCs o una combinación de ambos. Los cánceres de mama diagnosticados en usuarias de siempre tienden a ser clínicamente menos avanzados que los cánceres diagnosticados en las que nunca los usaron.
• En casos raros, los tumores hepáticos benignos y aun más rara vez, los tumores hepáticos malignos han sido reportados en usuarias de AOCs. En casos aislados, estos tumores han conducido a hemorragias intraabdominales que ponen en riesgo la vida. Se debe considerar un tumor hepático en el diagnóstico diferencial cuando ocurre un dolor abdominal superior que sea severo, crecimiento hepático o signos de hemorragia intraabdominal.
Hepatitis C:
• Durante los ensayos clínicos con el régimen de combinación de fármacos contra el VHC ombitasvir/paritaprevir/ritonavir con y sin dasabuvir, las elevaciones de ALT mayores a 5 veces el límite superior de lo normal (LSN) fueron significativamente más frecuentes en las mujeres que utilizaron medicamentos que contenían etinilestradiol, como los AHCs. NOVIAL® debe interrumpirse antes de iniciar el tratamiento con el régimen de combinación de fármacos ombitasvir/paritaprevir/ritonavir con y sin dasabuvir (ver Contraindicaciones e interacciones medicamentosas y de otro género). NOVIAL® puede reiniciarse aproximadamente 2 semanas después de completar el tratamiento con el régimen de combinación de fármacos.
Otras condiciones:
• Las mujeres con hipertrigliceridemia, o historial familiar de la misma, pueden tener riesgo elevado de pancreatitis cuando usan AOCs.
• Aunque se han reportado aumentos pequeños en la presión arterial en muchas mujeres que toman AOCs, los aumentos clínicamente relevantes son raros. Sin embargo, si se desarrolla una hipertensión clínicamente significativa sostenida durante el uso de un AOC entonces es prudente que el médico retire el AOC y trate la hipertensión. Cuando se considere adecuado, el uso del AOC puede reanudarse si se pueden alcanzar valores normotensos con la terapia antihipertensiva.
• Se ha reportado que ocurren las siguientes condiciones o que se deterioran con el embarazo y uso de AOC, pero la evidencia de una asociación con el uso de AOC no es concluyente: ictericia y/o prurito relacionado con colestasis; formación de cálculos biliares; porfiria; lupus eritematoso sistémico; síndrome urémico hemolítico; corea de Sydenham; herpes gestacional; pérdida de la audición relacionada con otoesclerosis; angioedema (hereditario).
• Los trastornos agudos o crónicos de la función hepática pueden requerir la discontinuación del AOC hasta que los marcadores de la función hepática regresen a lo normal. La recurrencia de ictericia colestática que ocurra durante el embarazo o el uso previo de esteroides sexuales necesita la discontinuación del AOCs.
• La enfermedad de Crohn y la colitis ulcerativa se ha asociado con el uso de AOCs.
• El cloasma puede ocurrir ocasionalmente, sobre todo en mujeres con antecedentes de cloasma gravídico. Las mujeres con tendencia al cloasma deben evitar la exposición al sol o la radiación ultravioleta, mientras estén tomando AOCs.
• El NOVIAL® contiene < 65 mg de lactosa por tableta. Los pacientes con problemas hereditarios de intolerancia a la galactosa, la deficiencia de lactasa de Lapp o mala absorción de glucosa-galactosa que están con dieta de lactosa deben tomar esta cantidad en consideración.
Cuando se asesore sobre la elección del método anticonceptivo, toda la información anterior debe de tomarse en consideración.
Consulta médica o examen: Antes de iniciar o reinstituir el uso de NOVIAL® se debe tener un historial clínico completo (incluyendo historia familiar) y descartar un embarazo. Debe medirse la presión arterial y si está indicado clínicamente, debe realizarse un examen físico, guiado por las contraindicaciones y las precauciones especiales, la mujer debe también leer cuidadosamente el instructivo de uso y apegarse a las recomendaciones dadas. La frecuencia y la naturaleza de evaluaciones periódicas deben basarse en los lineamientos establecidos y adaptarse individualmente a cada mujer.
Las usuarias deben ser informadas de que los anticonceptivos orales no protegen contra infecciones por VIH (SIDA) y otras enfermedades de transmisión sexual.
Disminución de la eficacia: La eficacia de NOVIAL® puede disminuir en el caso de, por ejemplo, omisión de tabletas (ver Manejo de tabletas olvidadas), trastornos gastrointestinales (recomendaciones en enfermedades gastrointestinales) o medicaciones concomitantes que disminuyen la concentración plasmática del etonogestrel, el metabolito activo del desogestrel (ver Interacciones medicamentosas y de otro género).
Control del ciclo reducido: Con todos los AOCs puede ocurrir un sangrado irregular (manchado o sangrado repentino), sobre todo durante los primeros meses de uso. Por lo tanto, la evaluación de cualquier sangrado irregular sólo es significativa después de un periodo de adaptación de aproximadamente tres ciclos.
Si persisten las irregularidades en el sangrado después de ciclos previamente regulares, entonces se deben considerar las causas no hormonales y las medidas diagnósticas adecuadas indicadas para descartar malignidad neoplasia o embarazo. Éstas pueden incluir el legrado.
En algunas mujeres el sangrado por supresión puede que no ocurra durante el intervalo libre de tabletas. Si se ha tomado el AOC de acuerdo con las instrucciones descritas, (ver posología y vía de administración) es poco probable que la mujer esté embarazada. Sin embargo, si el AOC no se ha estado tomando de acuerdo con estas instrucciones antes del primer sangrado por supresión faltante o si no se presentan dos sangrados por supresión, el embarazo debe descartarse antes de que continúe con el uso del AOC.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Cómo se toma NOVIAL®: Las tabletas deben tomarse en el orden indicado que aparece en el empaque diariamente, aproximadamente a la misma hora con algo de líquido según sea necesario. Debe tomar una tableta diariamente por 21 días consecutivos, comenzando con las tabletas amarillas durante 7 días, seguidas por las rojas durante 7 días y finalmente las blancas durante 7 días. Cada paquete nuevo se inicia después de un intervalo de 7 días sin ingesta de tabletas, durante el cual usualmente se produce un sangrado por supresión. Éste generalmente comienza el día 2-3 después de la última tableta y puede haber finalizado antes de iniciar el próximo paquete.
Cómo empezar a tomar NOVIAL®:
Sin uso anterior de anticonceptivos hormonales (en el mes anterior): La toma de tabletas tiene que iniciar en el día 1 del ciclo natural de la mujer (es decir, el primer día de su sangrado menstrual). Se permite el inicio en los días 2-5, pero durante el primer ciclo se recomienda un método de barrera adicional durante los primeros 7 días de la toma de las tabletas.
Cambio de un anticonceptivo hormonal combinado (anticonceptivo oral combinado [AOC], anillo vaginal o parche transdérmico): Las mujeres deben iniciar con NOVIAL® de preferencia el día después de la última tableta activa (la última tableta que contiene las sustancias activas) de su AOC previo, pero a más tardar el día después del intervalo normal libre de tableta o después de la última tableta placebo de su AOC anterior. En caso de que se haya usado un anillo vaginal o parche transdérmico, la mujer debe empezar a tomar NOVIAL® de preferencia el día del retiro, pero a más tardar cuando sea la fecha de la siguiente aplicación.
Si la mujer ha estado usando su método previo de forma consistente, correcta y si se confirma la ausencia de embarazo, ella también puede cambiar su anticonceptivo hormonal combinado previo en cualquier día del ciclo.
El intervalo libre de hormonas del método previo nunca debe ser extendido más allá de la duración recomendada.
Cambio de un método de sólo progestágeno (mini-píldora, inyección, implante) o de un sistema intrauterino de liberación de progestágeno (DIU): La mujer puede cambiar en cualquier día de la mini-píldora (de un implante o el del DIU en el día de su remoción, de un inyectable cuando sea la fecha límite de la siguiente inyección), pero en todos los casos debe ser aconsejada sobre el uso adicional de un método de barrera durante los primeros 7 días de tomar las tabletas.
Después de un aborto durante el primer trimestre: La mujer debe iniciar inmediatamente. Cuando lo haga así, no necesita tomar medidas anticonceptivas adicionales. Después del parto o de un parto en el segundo trimestre: Para mujeres en un periodo de lactancia vea Restricciones de uso durante el embarazo y la lactancia.
Las mujeres deben ser aconsejadas de iniciar en el día 21 a 28 después del parto o de un aborto en el segundo trimestre. Cuando empiece después, la mujer debe ser aconsejada de usar adicionalmente un método de barrera durante los primeros 7 días de estar tomando las tabletas. Sin embargo, si ya han ocurrido las relaciones sexuales, el embarazo debe descartarse antes del inicio real de uso de AOC o la mujer tiene que esperar su primer periodo menstrual.
El incremento del riesgo de TEV durante el periodo postparto debe considerarse al reiniciar NOVIAL® (ver Precauciones generales).
Manejo de tabletas olvidadas: Si la usuaria ha dejado pasar menos de 12 horas de haber olvidado la toma de alguna tableta, la protección anticonceptiva no se reduce. La usuaria debe tomar la tableta tan pronto como lo recuerde y debe tomar las tabletas siguientes a la hora habitual.
Si la usuaria ha dejado pasar más de 12 horas de haber olvidado la toma de alguna tableta, la protección anticonceptiva puede ser reducida. El manejo de las tabletas olvidadas puede guiarse mediante las dos reglas básicas siguientes:
1. La toma de las tabletas nunca debe abandonarse por más de 7 días.
2. Se requiere 7 días de una toma de tabletas ininterrumpida para lograr una supresión adecuada del eje hipotálamo-hipófisis-ovario.
Por consiguiente, se puede dar el siguiente consejo en la práctica diaria:
Semana 1 (tabletas amarillas): La usuaria debe tomar la última tableta olvidada tan pronto como lo recuerde, aun si esto significa tomar dos tabletas al mismo tiempo. Entonces ella continúa tomando las tabletas en su horario habitual. Además, se debe usar un método de barrera tal como un condón por los siguientes 7 días. Si ocurrieron relaciones sexuales en los 7 días anteriores, la posibilidad de un embarazo debe considerarse. Entre más tabletas se olviden de tomar y entre más cerca estén del intervalo regular libre de tabletas, el riesgo de un embarazo es mayor.
Semana 2 (tabletas rojas): La usuaria debe tomar la última tableta olvidada tan pronto como lo recuerde, aun si esto significa tomar dos tabletas al mismo tiempo. Entonces ella continúa tomando las tabletas a su hora habitual. Siempre y cuando la mujer haya tomado sus tabletas correctamente en los 7 días anteriores a la primera tableta olvidada, no hay necesidad de usar precauciones anticonceptivas extra. Sin embargo, si este no es el caso, o si ella olvidó más de 1 tableta, la usuaria debe ser aconsejada de usar precauciones adicionales por 7 días. Semana 3 (tabletas blancas): El riesgo de una confiabilidad reducida es inminente debido al próximo intervalo libre de tabletas. Sin embargo, al ajustar el horario de la toma de las tabletas, todavía se puede evitar una protección anticonceptiva reducida. Al apegarse a cualquiera de las dos opciones siguientes, no hay necesidad de usar precauciones anticonceptivas adicionales, siempre y cuando en los 7 días anteriores a la primera tableta olvidada la mujer haya tomado todas las tabletas correctamente. Si este no es el caso, la mujer debe ser aconsejada de seguir la primera de estas dos opciones y usar precauciones adicionales durante los siguientes 7 días también.
1. La usuaria debe tomar la última tableta olvidada tan pronto como se acuerde, aun si esto significa tomar dos tabletas en su horario habitual. El siguiente envase debe iniciarse tan pronto como se termine el actual, es decir, no se debe dejar espacio entre paquetes. Es poco probable que la usuaria tenga el sangrado por supresión hasta el final del segundo paquete, pero puede que experimente manchado o sangrado repentino en los días que toma tabletas.
2. La mujer también debe ser aconsejada de dejar la toma de las tabletas del paquete actual. Entonces debe tener un intervalo libre de tabletas de hasta 7 días, incluyendo los días en que ella olvidó las tabletas, y subsiguientemente continuar con el paquete siguiente.
Si la mujer olvidó tomar tabletas y subsecuentemente no tiene sangrado por supresión en el primer intervalo normal libre de tabletas, la posibilidad de un embarazo debe considerarse.
Asesoría en caso de trastornos gastrointestinales: En caso de trastornos gastrointestinales severos, puede que la absorción no sea completa y se deban tomar medidas anticonceptivas adicionales.
Si ocurre el vómito dentro de 3-4 horas después de tomar las tabletas, se recomienda seguirlo mencionando en manejo de tabletas olvidadas, si la mujer no quiere cambiar su horario habitual de toma de tabletas, tiene que tomar la(s) tableta(s) adicional(es) necesarias de otro paquete. Cómo desplazar periodos menstruales o cómo retrasar un periodo menstrual: Para retrasar un periodo menstrual la mujer debe continuar con otro paquete de NOVIAL® sin un intervalo libre de tabletas. La prolongación puede realizarse en tanto se desee, hasta el final del segundo paquete. Durante la extensión la mujer puede experimentar un sangrado repentino o manchado. La ingestión regular de NOVIAL® se reanuda entonces después del intervalo normal de 7 días libre de tabletas. Para desplazar su periodo menstrual a otro día de la semana diferente de aquel al que la mujer está acostumbrada con su esquema actual, ella puede ser aconsejada de acortar su próximo intervalo libre de tabletas por tantos días como ella desee. Entre más corto sea el intervalo, es mayor el riesgo de que no tenga un sangrado por supresión y experimentará el sangrado repentino y manchado durante el segundo paquete (igual que cuando se retrasa un periodo menstrual).
Vía de administración: Oral.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: No se han reportado efectos nocivos serios debido a sobredosis. Los síntomas que pueden ocurrir en este caso son: náuseas, vómitos y en niñas jóvenes ligero sangrado vaginal. No hay antídotos y el tratamiento adicional deberá ser sintomático.
PRESENTACIÓN: Caja de cartón con 21 tabletas en envase de burbuja en sobre e instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a no más de 30 °C.
Consérvese la caja bien cerrada.
Protéjase de la luz.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Dosis: la que el médico señale. Su venta requiere receta médica. No se use durante el embarazo ni lactancia.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx y/o
farmacovigilancia@aspenlatam.com y al teléfono:
800 8496 530.
Hecho en España por:
Cyndea Pharma, S.L.
Polígono Industrial Emiliano Revilla Sanz,
Avda. de Ágreda, 31,
Ólvega, 42110 (Soria), España
Para:
Aspen Pharma Pty Ltd
286-302 Frankston-Dandenong Road,
Dandenong South VIC 3175, Australia
Representante Legal e importador en México:
ASPEN LABS, S.A. de C.V.
Carretera México-Querétaro km. 30,
Park III, Nave 1,
Col. San Martín Obispo,
C.P. 54769, Cuautitlán Izcalli,
México, México
Reg. Núm. 357M2002, SSA IV
®Marca Registrada