
MIRENA / KYLEENA
LEVONORGESTREL
Dispositivo intrauterino
1 Caja, 1 Dispositivo intrauterino,
FORMA FARMACÉUTICA Y FORMULACIÓN:
Polvo
El dispositivo con POLVO MIRENA contiene:
|
Levonorgestrel |
52.00 mg |
|
Dispositivo intrauterino 1 pieza. |
|
El dispositivo con POLVO KYLEENA contiene:
|
Levonorgestrel |
19.5 mg |
|
Dispositivo intrauterino 1 pieza. |
|
MIRENA 52 mg es un endoceptivo (Sistema intrauterino de liberación hormonal). El sistema intrauterino liberador de levonorgestrel (SIU-LNG) consiste de un núcleo de fármaco, cubierto con una membrana opaca, blanca o casi blanca, el cual está montado sobre el brazo vertical de un cuerpo en T. El cuerpo en T tiene un asa en el extremo del brazo vertical y dos brazos horizontales en el otro extremo. Los hilos de extracción se encuentran atados al asa. El brazo vertical del endoceptivo se carga en el tubo de inserción a la altura de la punta del insertor. El endoceptivo y el insertor se encuentran esencialmente libres de impurezas visibles.
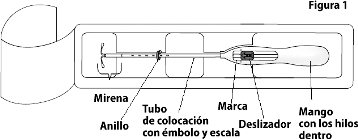
KYLEENA 19.5 mg es un endoceptivo (Sistema intrauterino de liberación hormonal) que consiste de un núcleo de fármaco blanquecino o amarillo pálido recubierto con una membrana semi-opaca, la cual está montado en el tallo vertical de un cuerpo en forma de T. Además, el tallo vertical contiene un anillo de plata ubicado cerca de los brazos horizontales. El cuerpo en forma de T tiene un asa en un extremo del tallo vertical y dos brazos horizontales en el otro extremo. Unidos al asa se encuentran hilos de extracción de color azul. El tallo vertical del SIU-LNG está cargado en el tubo de inserción a la altura de la punta del insertor . El dispositivo de inserción consta de un mango y un deslizador que están integrados a, un tubo de colocación pre-curvado y un émbolo. Los hilos de extracción están ubicados dentro del tubo de inserción y el mango.
INDICACIONES TERAPÉUTICAS:
MIRENA 52 mg: Anticoncepción intrauterina de acción prolongada; manejo del sangrado menstrual abundante; prevención de hiperplasia de endometrio durante la terapia de reemplazo estrogénica.
KYLEENA 19.5 mg: Anticoncepción en mujeres multíparas y nulíparas.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacodinámicas:
Código ATC: G02BA03.
Grupo fármaco-terapéutico: sistema intrauterino de plástico con progestágeno.
MIRENA 52 mg:
El Levonorgestrel es un progestágeno con actividad antiestrogénica ampliamente utilizado en ginecología: para anticoncepción como el componente progestágeno en los anticonceptivos orales y en la terapia de sustitución hormonal o para la anticoncepción en las píldoras con solo progestágeno e implantes subdérmicos. El Levonorgestrel también puede administrarse en la cavidad uterina con un sistema intrauterino de liberación. Esto permite una dosis diaria muy baja, ya que la hormona es liberada directamente en el órgano blanco.
MIRENA tiene efectos progestagénicos principalmente locales en la cavidad uterina. La alta concentración de levonorgestrel en el endometrio disminuye los receptores estrogénicos y progestagénicos endometriales, insensibilizando el endometrio al estradiol circulante ocasionando un potente efecto antiproliferativo. Durante el uso de MIRENA se observan cambios morfológicos en el endometrio y una débil reacción local a cuerpo extraño. El aumento de viscosidad del moco cervical impide el paso de los espermatozoides a través del canal cervical. La liberación hormonal local en útero y las trompas inhibe la motilidad y función de los espermatozoides, evitando la fertilización. En algunas mujeres se presenta inhibición de la ovulación.
La eficacia anticonceptiva de MIRENA ha sido estudiada en 5 importantes estudios clínicos con 3,330 mujeres usuarias de MIRENA. El índice de falla (índice Pearl) fue de aproximadamente 0.2% en un año y aproximadamente 0.7% en 5 años. El índice de falla incluye también embarazos debido a expulsión del dispositivo o perforaciones no detectadas. Se observó una eficacia anticonceptiva similar en un estudio de farmacovigilancia con más de 17 000 mujeres usuarias de MIRENA. Debido a que el uso de MIRENA no requiere un cumplimiento de toma diaria para las usuarias, la tasa de embarazos durante el "uso típico" es similar a aquéllas observadas en estudios clínicos controlados ("uso perfecto").
El uso de MIRENA no altera la fertilidad futura. Aproximadamente 80% de las mujeres que deseaban quedar embarazadas concibieron dentro de los 12 meses siguientes a la extracción del endoceptivo.
El patrón menstrual es el resultado de la acción directa del levonorgestrel sobre el endometrio y no refleja el ciclo ovárico. No hay diferencias claras entre las mujeres con diferentes patrones menstruales con respecto al desarrollo folicular, ovulación o producción de estradiol y progesterona. En el proceso de inactivación de la proliferación del endometrio puede producirse un aumento inicial del manchado durante los primeros meses de uso. Después de eso, la fuerte supresión del endometrio ocasiona la reducción de la duración y el volumen del sangrado menstrual durante el uso de MIRENA. El sangrado escaso se convierte frecuentemente en oligomenorrea o amenorrea. La función ovárica es normal y los niveles de estradiol se mantienen, incluso en el caso de usuarias de MIRENA con amenorrea.
MIRENA puede usarse satisfactoriamente en el tratamiento del sangrado menstrual abundante. En estas mujeres la pérdida de sangre menstrual disminuyó 62-94% al final de tres meses y 71-95% al final de seis meses de uso. Es posible que en el caso de hemorragia producida por miomas submucosos la respuesta clínica no sea tan favorable. La disminución del sangrado aumenta la concentración de hemoglobina en la sangre. MIRENA también alivia la dismenorrea.
MIRENA previene con igual eficacia la hiperplasia de endometrio durante tratamiento continuo con estrógeno oral o transdérmico. Durante el tratamiento con estrógeno solo, se observó una tasa de hiperplasia de 20%. En estudios clínicos con 634 usuarias perimenopáusicas y postmenopáusicas de MIRENA, no se reportaron casos de hiperplasia de endometrio durante un periodo de observación que varió de uno a 5 años.
KYLEENA 19.5 mg:
Mecanismo de acción: KYLEENA 19.5 mg tiene principalmente efectos progestágenos en la cavidad uterina. La elevada concentración de levonorgestrel en el endometrio inhibe el estrógeno del endometrio y los receptores de progesterona. El endometrio se vuelve relativamente insensible al estradiol circulante y se observa un fuerte efecto antiproliferativo. Se observaron cambios morfológicos del endometrio y una débil reacción local al cuerpo extraño durante su uso. El espesamiento del moco cervical impide el paso de los espermatozoides a través del canal cervical. El entorno local del útero y de las trompas de Falopio inhibe la movilidad y la función de los espermatozoides, lo que impide la fertilización.
En los ensayos clínicos con KYLEENA 19.5 mg, se observó ovulación en la mayoría del subgrupo de mujeres estudiadas. Se observó evidencia de ovulación en 23 de 26 mujeres en el primer año, en 19 de 20 mujeres en el segundo año y en las 16 mujeres en el tercer año. En el cuarto año, se observó evidencia de ovulación en la única mujer restante en el subgrupo y en el quinto año ninguna mujer permaneció en este subgrupo.
La eficacia anticonceptiva de KYLEENA 19.5 mg fue evaluada en un estudio clínico con 1452 mujeres de 18-35 años de edad que incluyó 574 mujeres nulíparas (39.5%) de las cuales el 84.0% (482) eran nuligrávidas.
El Índice de Pearl del año 1 fue de 0.16 y el Índice de Pearl después de 5 años fue de 0.29. La tasa de falla fue de aproximadamente el 0.2% en el año 1 y la tasa acumulada de falla fue de aproximadamente el 1.5% a los 5 años. La tasa de falla también incluye embarazos debidos a expulsiones y perforaciones no detectadas. Debido a que el uso de KYLEENA 19.5 mg no requiere de un apego de toma diaria por parte de las usuarias, las tasas de embarazo en "uso típico" son similares a las observadas en ensayos clínicos controlados ("uso perfecto"). El uso de KYLEENA 19.5 mg no altera el curso de la fertilidad futura.
En un estudio de 5 años con KYLEENA 19.5 mg, 116 de 163 (71.2%) mujeres quienes discontinuaron el sistema debido al deseo de embarazo y con información de seguimiento disponible, se embarazaron durante el seguimiento de 12 meses.
Con KYLEENA 19.5 mg, los cambios en el patrón menstrual son resultado de la acción directa de levonorgestrel en el endometrio y no reflejan el ciclo ovárico. No existe una diferencia clara en el desarrollo de folículos, la ovulación o la producción de estradiol y progesterona en mujeres con diferentes patrones de sangrado. En el proceso de inhibición de la proliferación del endometrio, puede haber un incremento inicial de goteo durante los primeros meses de uso. A partir de ese punto, la fuerte supresión del endometrio da como resultado la reducción de la duración y el volumen del sangrado menstrual durante el uso de KYLEENA 19.5 mg. Con frecuencia, el flujo escaso evoluciona a oligomenorrea o amenorrea. La función ovárica permanece normal y los niveles de estradiol se mantienen, incluso cuando las mujeres desarrollan amenorrea.
Propiedades farmacocinéticas: El principio activo de MIRENA es Levonorgestrel. El levonorgestrel es liberado localmente en la cavidad uterina.
MIRENA 52 mg:
La tasa de liberación inicial in vivo de levonorgestrel es de aproximadamente 20 mcg/24 h la cual disminuye a 10 mcg/24 h después de 5 años.
KYLEENA 19.5 mg:
Las tasas estimadas de liberación in vivo para diferentes puntos temporales se proporcionan en la siguiente tabla:
Tasas de liberación in vivo estimadas
|
Tiempo |
Tasa de liberación in vivo estimada [µg/24 horas] |
|
24 días después de la colocación |
17.5 |
|
60 días después de la colocación |
15.3 |
|
1 año después de la colocación |
9.8 |
|
3 años después de la colocación |
7.9 |
|
5 años después de la colocación |
7.4 |
|
Promedio de los 5 años |
9.0 |
Absorción:
MIRENA 52 mg:
Después de la inserción, el levonorgestrel es inmediatamente liberado en la cavidad uterina, en base a las determinaciones de su concentración en suero. La alta exposición local al fármaco en la cavidad uterina ocasiona un gran gradiente de concentración desde el endometrio al miometrio (gradiente endometrio a miometrio > 100 veces) y bajas concentraciones de levonorgestrel en suero (gradiente endometrio a suero > 1 000 veces).
KYLEENA 19.5 mg:
Después de la colocación, el levonorgestrel se libera inmediatamente del SIU-LNG a la cavidad uterina. Las concentraciones de levonorgestrel máximas en suero se alcanzan dentro de las primeras 2 semanas después de la colocación de KYLEENA 19.5 mg. Siete días después de la colocación, se determinó una concentración media de levonorgestrel de 162 pg/mL. A partir de ese punto, las concentraciones de levonorgestrel en suero disminuyen con el paso del tiempo para alcanzar concentraciones medias de 91.3 pg/mL después de 3 años y de 83.1 pg/mL después de 5 años. Con el uso de un SIU-LNG, la elevada concentración local del fármaco en la cavidad uterina lleva a un fuerte gradiente de concentración del endometrio al miometrio (gradiente del endometrio al miometrio > 100 veces mayor), y a bajas concentraciones de levonorgestrel en suero (gradiente de endometrio a suero > 1 000 veces mayor.
Distribución:
MIRENA 52 mg:
El Levonorgestrel se une de forma no específica a la albúmina del suero y de forma específica a la globulina fijadora de hormonas sexuales (SHBG, por sus siglas en inglés). Alrededor del 1-2% del levonorgestrel circulante se encuentra como esteroide libre y un 42-62% unido de forma específica a la SHBG. Durante el uso de MIRENA la concentración de SHBG disminuye. Por consiguiente, la fracción unida a SHBG disminuye durante el tratamiento y se incrementa la fracción libre. El volumen medio aparente de distribución es de 106 L.
Después de una hora de la inserción de MIRENA, el levonorgestrel es detectable en suero. La concentración máxima se alcanza dentro de las 2 semanas posteriores a la inserción. De acuerdo al decremento de la tasa de liberación, la concentración media en suero de levonorgestrel disminuye de 206 pg/mL (percentiles 25 a 75: 151 pg/mL a 264 pg/mL) a los 6 meses, a 194 pg/mL (146 pg/mL a 266 pg/mL) a los 12 meses y a 131 pg/mL (113 pg/mL a 161 pg/mL) a los 60 meses en mujeres en edad reproductiva con peso superior a 55 kg.
Se ha demostrado que el peso corporal y la concentración de SHBG afectan la concentración sistémica de levonorgestrel, es decir, el bajo peso corporal y/o altos niveles de SHBG incrementan la concentración de levonorgestrel. En mujeres en edad reproductiva con bajo peso corporal (37 a 55 kg) la concentración media en suero de Levonorgestrel es aproximadamente 1.5 veces mayor.
En mujeres postmenopáusicas usando MIRENA junto con tratamiento estrogénico no oral, la concentración media en suero de levonorgestrel disminuye de 257 pg/mL (percentiles 25 a 75: 186 pg/mL a 326 pg/mL) a los 12 meses a 149 pg/mL (122 pg/mL a 180 pg/mL) a los 60 meses. Cuando se usa MIRENA junto con tratamiento estrogénico oral, la concentración media en suero de levonorgestrel se incrementa a los 12 meses aproximadamente a 478 pg/mL (percentiles 25 a 75: 341 pg/mL a 655 pg/mL) debido a la inducción de SHBG por el tratamiento estrogénico oral.
KYLEENA 19.5 mg:
El levonorgestrel se une en forma no específica a la albúmina del suero y en forma específica a la SHBG (globulina fijadora de hormonas sexuales). Menos del 2% del levonorgestrel circulante está presente como esteroide libre. El levonorgestrel se une con alta afinidad a la SHBG. En consecuencia, los cambios en la concentración de SHBG en el suero dan como resultado un incremento (a mayores concentraciones de SHBG) o una disminución (a menores concentraciones de SHBG) de la concentración total de levonorgestrel en suero. La concentración de SHBG disminuyó en promedio en aproximadamente 30% durante los primeros 3 meses después de la colocación de KYLEENA 19.5 mg y permaneció relativamente estable durante el periodo de uso de 5 años. El volumen aparente medio de distribución de levonorgestrel es de aproximadamente 106 L.
Biotransformación:
MIRENA 52 mg:
Levonorgestrel es extensamente metabolizado. Los metabolitos más importantes en el plasma son las formas conjugada y no conjugada de 3α, 5ß-tetrahidrolevonorgestrel. Basado en estudios in vivo e in vitro, la enzima CYP3A4 es la principal involucrada en el metabolismo de levonorgestrel, las enzimas CYP2E1, CYP2C19 y CYP2C9 pueden también estar involucradas, pero en menor grado.
KYLEENA 19.5 mg:
Levonorgestrel (LNG) se metaboliza de forma extensa. Las vías metabólicas más importantes son la reducción del grupo ∆4-3-oxo y las hidroxilaciones en las posiciones 2α, 1ß y 16ß, seguidas por la conjugación. La CYP3A4 es la principal enzima involucrada en el metabolismo oxidativo del LNG. Los datos in vivo disponibles indican que las reacciones de biotransformación mediadas por la CYP pueden tener una menor relevancia para el LNG a comparación de la reducción y la conjugación.
Eliminación:
MIRENA 52 mg, y KYLEENA 19.5 mg:
La depuración total de levonorgestrel del plasma es de aproximadamente 1.0 mL/min/kg. Sólo cantidades mínimas de levonorgestrel se eliminan en forma inalterada. Los metabolitos son excretados en las heces y la orina con un cociente de excreción de aproximadamente 1. La vida media de excreción la cual es representada principalmente por los metabolitos es de aproximadamente 1 día.
Linealidad/no linealidad Farmacocinética:
MIRENA 52 mg:
La farmacocinética del levonorgestrel depende de la concentración de SHBG, que a su vez está influenciada por los estrógenos y andrógenos. Durante el primer mes de uso de MIRENA 52 mg, se observó una disminución media de SHBG de alrededor del 30%, lo que ocasiona una disminución del levonorgestrel en suero, indicando una farmacocinética no lineal del levonorgestrel con respecto al tiempo. En función de la acción principalmente local de MIRENA 52 mg, no se espera un efecto sobre la eficacia de MIRENA 52 mg.
KYLEENA 19.5 mg:
La farmacocinética de levonorgestrel depende de la concentración de SHBG, misma que está influenciada por estrógenos y andrógenos. Una disminución en la concentración de SHBG lleva a una disminución de la concentración total de levonorgestrel en suero, lo que indica una farmacocinética no lineal de levonorgestrel en relación con el tiempo. Con base en la acción principalmente local de KYLEENA 19.5 mg, no se espera ningún impacto en la eficacia de KYLEENA 19.5 mg.
CONTRAINDICACIONES:
MIRENA 52 mg:
Embarazo o sospecha del mismo; enfermedad pélvica inflamatoria actual o recurrente; infección del aparato genital inferior; endometritis postparto; aborto séptico en los últimos tres meses; cervicitis; displasia cervical; neoplasia uterina o cervical; tumores progestágeno dependientes; hemorragia uterina anormal no diagnosticada; anomalía uterina congénita o adquirida incluyendo miomas si deforman la cavidad del útero; estados asociados a un aumento de la susceptibilidad a las infecciones; enfermedad hepática aguda o tumor hepático; hipersensibilidad a los constituyentes del preparado.
KYLEENA 19.5 mg:
Embarazo; Enfermedad pélvica inflamatoria aguda o recurrente; o condiciones relacionadas con un riesgo elevado de infecciones pélvicas; Cervicitis o vaginitis aguda; endometritis postparto o aborto infectado durante los últimos tres meses; neoplasia del cuello uterino; malignidad uterina o del cuello uterino; tumores dependientes de progestágeno; sangrado uterino anormal de etiología desconocida; anomalía uterina congénita o adquirida incluidos los fibroides que interfieren con la colocación y/o la retención del sistema intrauterino (es decir si deforman la cavidad uterina); enfermedad hepática aguda o tumor hepático, hipersensibilidad a la sustancia activa o a alguno de los excipientes.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
• Embarazo: El uso de MIRENA 52 mg está contraindicado durante el embarazo o sospecha del mismo (Ver sección Contraindicaciones). En caso de embarazo durante el uso de MIRENA 52 mg se recomienda extraer el endoceptivo, puesto que cualquier anticonceptivo intrauterino que se deje in situ puede aumentar el riesgo de aborto y parto prematuro. La extracción de MIRENA 52 mg o la introducción de sondas en el útero también pueden provocar un aborto espontáneo. Si la mujer deseara continuar el embarazo y el sistema no puede extraerse, se le debe informar a la mujer sobre los riesgos y posibles consecuencias para el producto de un parto prematuro. El curso de estos embarazos debe ser estrechamente controlado. Se debe excluir un embarazo ectópico. Se debe instruir a la paciente para que comunique todos los síntomas que sugieran complicaciones en el embarazo, como por ejemplo, cólicos abdominales con fiebre.
Debido a la administración intrauterina y a la exposición local al levonorgestrel, se debe tener en cuenta la posibilidad de efectos de virilización en el feto de sexo femenino. La experiencia clínica de los resultados de embarazos con MIRENA 52 mg es limitada debido a la alta eficacia anticonceptiva, pero se le debe informar a la mujer que actualmente no hay evidencias de malformaciones congénitas causadas por el uso de MIRENA 52 mg, en caso de parto de término con MIRENA 52 mg in situ.
KYLEENA 19.5 mg:
La colocación de KYLEENA 19.5 mg en mujeres embarazadas está contraindicada (ver la sección "Contraindicaciones"). Si una mujer se embaraza mientras utiliza KYLEENA 19.5 mg, se recomienda el retiro del sistema debido a que cualquier anticonceptivo intrauterino dejado in situ puede incrementar el riesgo de aborto y parto prematuro. El retiro de KYLEENA 19.5 mg o explorar la cavidad del útero también pueden dar como resultado un aborto espontáneo. Debe excluirse un embarazo ectópico. Si la mujer desea continuar con el embarazo y el SIU-LNG no puede ser extraído, se le debe informar acerca de los riesgos y las posibles consecuencias de un parto prematuro para el bebé. El curso de un embarazo como éste debe monitorearse de forma cautelosa. Se debe instruir a la mujer que reporte todos los síntomas que indiquen complicaciones del embarazo, como dolor abdominal tipo cólico con fiebre. Debido a la administración intrauterina y a la exposición local al levonorgestrel, debe tomarse en cuenta la posible aparición de efectos de virilización en un feto femenino. La experiencia clínica de los resultados de embarazos bajo el tratamiento de KYLEENA 19.5 mg está limitada debido a la alta eficacia anticonceptiva. Se debe informar a las mujeres que, hasta la fecha, no existe evidencia de defectos de nacimiento ocasionados por el uso de un SIU-LNG en donde el embarazo continúa hasta el término con el SIU-LNG en su lugar.
• Lactancia:
MIRENA 52 mg:
Aproximadamente 0.1% de la dosis de levonorgestrel se ha detectado en la leche materna, pero no es probable que exista un riesgo para el niño con la dosis liberada por MIRENA cuando se encuentra insertado en la cavidad uterina.
Parece que no hay efectos adversos sobre el crecimiento o desarrollo del lactante cuando se usa MIRENA después de seis semanas posparto. Los métodos con sólo progestágeno no parecen afectar la cantidad ni la calidad de la leche materna.
KYLEENA 19.5 mg:
En general, no parece haber un efecto perjudicial en el crecimiento ni en el desarrollo de los lactantes durante el uso de cualquier método con solo progestágenos después de seis semanas del parto. Un SIU-LNG (Levonorgestrel) no afecta la cantidad ni la calidad de la leche maternal. Pequeñas cantidades de progestina (aproximadamente 0.1% de la dosis de levonorgestrel) pasan a la leche materna en mujeres lactantes.
• Fertilidad: El uso de un SIU-LNG no altera el curso de la fertilidad en el futuro. Después de la extracción de MIRENA, la mujer recupera su fertilidad normal (consulte la sección "Propiedades farmacodinámicas").
Efectos sobre la capacidad de conducir y usar maquinaria: Ninguno conocido.
REACCIONES SECUNDARIAS Y ADVERSAS:
MIRENA 52 mg:
Resumen del perfil de seguridad: La mayoría de las mujeres experimenta cambios en el patrón de sangrado menstrual después de la inserción de MIRENA. Durante los primeros 90 días, el 22% de las mujeres experimentó sangrado prolongado y el 67% sangrado irregular después de la inserción posmenstruación de MIRENA, disminuyendo al 3% y 19% al final del primer año de uso, respectivamente. Concomitantemente, ninguna mujer experimentó y se presentó sangrado poco frecuente en el 11% durante los primeros 90 días, aumentando al 16% y 57% al final del primer año de empleo, respectivamente.
Cuando MIRENA se usa en combinación con tratamiento continuo de sustitución de estrógenos, se desarrolla gradualmente un patrón de ausencia de hemorragia en la mayoría de las mujeres durante el primer año.
Lista tabulada de reacciones adversas: Las frecuencias de las reacciones adversas al medicamento (RAM), reportadas con MIRENA, se resumen en la tabla siguiente. Las frecuencias se definen como muy frecuentes (≥ 1/10), frecuentes (≥ 1/100 a < 1/10), poco frecuentes (≥ 1/1,000 a < 1 /1 00), raras (≥ 1/10,000 a < 1 /1,000) y no conocidas. En la siguiente tabla se presentan las reacciones adversas según la clasificación por órganos y sistemas de MedDRA (COS MedDRA). Las frecuencias son incidencias brutas de los eventos observados en estudios clínicos en las indicaciones anticoncepción y menorragia idiopática/sangrado menstrual abundante, incluyendo 5091 mujeres y 12,101 mujeres-año.
Las reacciones adversas en estudios clínicos en la indicación para la protección contra hiperplasia endometrial durante el tratamiento de sustitución de estrógenos (incluyendo 514 mujeres y 1218.9 mujeres-año) se observaron a una frecuencia similar, salvo que se especifique en pies de página.
|
Clase de órgano o sistema |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raros |
No conocida |
|
Trastornos del sistema inmunológico |
Hipersensibilidad, incluyendo erupción, urticaria y angioedema |
||||
|
Trastornos psiquiátricos |
Humor deprimido/depresión |
||||
|
Trastornos del Sistema nervioso |
Cefalea |
Migraña |
|||
|
Trastornos gastrointestinales |
Dolor pélvico/abdominal |
Náuseas |
|||
|
Trastornos de la piel y del tejido subcutáneo |
Acné Hirsutismo |
Alopecia |
|||
|
Trastornos musculoesqueléticos, óseos y del tejido conjuntivo |
Dolor de espalda** |
||||
|
Trastornos del aparato reproductor y de la mama |
Cambios en el sangrado, incluyendo aumento y disminución del sangrado menstrual, manchado, oligomenorrea y amenorrea Vulvovaginitis* Secreción genital* |
Infección del aparato genital superior Quiste ovárico Dismenorrea Mastalgia** Expulsión del sistema anticonceptivo intrauterino (completa y parcial) |
Perforación uterina*** |
||
|
Exploraciones complementarias |
Aumento de la presión arterial |
El término MedDRA más adecuado se utiliza para describir una determinada reacción y sus sinónimos y trastornos relacionados.
* Estudios de protección endometrial: "frecuentes".
** Estudios de protección endometrial: "muy frecuentes".
*** Esta frecuencia se basa en los estudios clínicos que excluyeron a las mujeres en periodo de lactancia. En un gran estudio de cohortes, prospectivo, comparativo, no intervencional, en usuarias de DIU, la frecuencia de perforación en mujeres que estaban amamantando o que tuvieron una colocación hasta 36 semanas después del parto fue "poco frecuente" (ver Precauciones Generales).
KYLEENA 19.5 mg:
Resumen del perfil de seguridad: La mayoría de las mujeres experimentan cambios en el patrón de sangrado menstrual después de la colocación de KYLEENA 19.5 mg. Con el paso del tiempo, la frecuencia de la amenorrea y el sangrado infrecuente aumenta, y la frecuencia de sangrado prolongado y frecuente disminuye.
Se observaron los siguientes patrones de sangrado en ensayos clínicos con KYLEENA 19.5 mg:
Patrones de sangrado por periodo de referencia de 90 días.
|
KYLEENA 19.5 mg |
Primeros 90 días |
Segundos 90 días |
Fin del año 3 |
Fin del año 5 |
|
Amenorrea |
< 1% |
5% |
20% |
23% |
|
Sangrado infrecuente |
10% |
20% |
26% |
26% |
|
Sangrado frecuente |
25% |
10% |
2% |
2% |
|
Sangrado prolongado* |
57% |
14% |
2% |
1% |
* Las mujeres con sangrado prolongado también pueden ser incluidas en una de las otras categorías (excl. amenorrea).
Lista en tabla de reacciones adversas: Las frecuencias de Reacciones Adversas del Fármaco (ADR) reportadas con KYLEENA 19.5 mg se resumen en la tabla a continuación. Dentro de cada agrupación de frecuencia, se presentan reacciones adversas en orden de severidad decreciente. La tabla a continuación reporta las reacciones adversas por clases de órganos y sistemas del MedDRA (COS MedDRA). Las frecuencias son incidencias brutas de los eventos observados en los ensayos clínicos en la indicación de anticoncepción, incluidas 1697 mujeres y 5225.52 mujeres-año con KYLEENA 19.5 mg.
Las frecuencias se definen como:
Muy frecuente (≥ 1/10).
Frecuente (≥ 1/100 a < 1/10).
Poco frecuente (≥ 1/1,000 a < 1/100).
Muy poco frecuente (≥ 1/10,000 a < 1/1,000).
Infrecuente (< 1/10,000).
Reacciones adversas del fármaco, ensayos clínicos de fase II y III, N = 1697 mujeres (5225.52 mujeres-año).
|
Clase de órganos del sistema (MedDRA) |
Muy frecuente |
Frecuente |
Poco frecuente |
Muy poco frecuente |
Infrecuente |
|
Trastornos psiquiátricos |
Estado de ánimo deprimido/depresión |
||||
|
Trastornos del sistema nervioso |
Cefalea |
Migraña |
|||
|
Trastornos gastrointestinales |
Dolor abdominal/pélvico |
Náusea |
|||
|
Trastornos de la piel y del tejido subcutáneo |
Acné/Seborrea |
Alopecia |
Hirsutismo |
||
|
Trastornos del aparato reproductor y de las mamas |
Cambios en el sangrado menstrual, incluido el aumento o la disminución del sangrado menstrual, goteo, oligomenorrea y amenorrea Quiste ovárico* Vulvovaginitis |
Infección del tracto genital superior Dismenorrea Dolor/molestia en las mamas Expulsión del dispositivo (completa y parcial) Secreción genital |
Perforación uterina** |
* Se debían reportar los quistes ováricos como EA si eran quistes anormales y no funcionales y/o si tenían un diámetro > 3 cm en evaluación por ultrasonido.
** Esta frecuencia se basa en ensayos clínicos que excluyeron a mujeres en período de lactancia. En un gran estudio de cohorte prospectivo, comparativo, no intervencional con mujeres que utilizaban otro SIU-LNG y DIU de cobre, la frecuencia de perforación en mujeres que estaban en periodo de lactancia o que tuvieron una colocación hasta 36 semanas después del parto fue "poco frecuente" (ver la sección "Advertencias y precauciones especiales de empleo").
Descripción de reacciones adversas seleccionadas:
MIRENA 52 mg:
Embarazo, puerperio y condiciones perinatales: Cuando una mujer queda embarazada con MIRENA in situ, el riesgo relativo de embarazo ectópico aumenta.
Trastornos del aparato reproductor: Los hilos para la extracción puede sentirlos la pareja durante la relación sexual.
Trastornos mamarios: Se desconoce el riesgo de cáncer de mama cuando MIRENA se utiliza en la indicación para la protección contra hiperplasia endometrial durante el tratamiento de sustitución de estrógenos. Se han comunicado casos de cáncer de mama (frecuencia desconocida, ver la sección "Precauciones generales").
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos:
Las siguientes RAM se han reportado en relación con la inserción o el procedimiento de extracción de MIRENA: Dolor durante el procedimiento, sangrado durante el procedimiento, reacción vasovagal relacionada con la inserción con mareos o síncope. El procedimiento puede precipitar una crisis en una paciente epiléptica.
Se han reportado casos de sepsis (incluida la sepsis por estreptococos de grupo A) después de la colocación de un DIU (ver "Precauciones generales").
KYLEENA 19.5 mg:
Descripción de determinadas reacciones adversas: Con el uso de otro SIU-LNG, se han reportado casos de hipersensibilidad incluidos prurito, urticaria y angioedema. Si una mujer se embaraza mientras utiliza KYLEENA 19.5 mg, incrementa el riesgo relativo de embarazo ectópico.
La pareja puede sentir los hilos de extracción durante las relaciones sexuales.
Se han reportado las siguientes ADR en relación con el procedimiento de colocación o de extracción de KYLEENA 19.5 mg:
Dolor por el procedimiento terapéutico, sangrado por el procedimiento terapéutico, reacción vasovagal relacionada con la colocación con mareo o síncope. El procedimiento puede precipitar una convulsión en una paciente con epilepsia. Para otros DIU, se han reportado casos de sepsis (incluida la sepsis estreptocócica del grupo A) después de la colocación (ver la sección "Precauciones generales").
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
MIRENA 52 mg:
Las evaluaciones sobre seguridad preclínica no revelaron riesgos especiales para los seres humanos, con base en estudios sobre seguridad farmacológica, toxicidad, genotoxicidad y potencial carcinogénico del levonorgestrel. En el conejo no se observó embriotoxicidad tras la administración intrauterina de levonorgestrel. La evaluación de la seguridad de los componentes elastoméricos del depósito de hormona, de los materiales polieitilénicos del producto y de la combinación de elastómero y levonorgestrel, teniendo como base los estudios sobre la toxicología genética en sistemas de ensayo in vitro e in vivo y análisis de biocompatibilidad en ratón, cobaya, conejos y sistemas de ensayo in Vitro no han revelado bioincompatibilidad.
KYLEENA 19.5:
La evaluación preclínica sobre seguridad no reveló ningún riesgo especial para seres humanos con base en estudios de seguridad farmacológica, farmacocinética y toxicidad, incluidos la genotoxicidad y el potencial carcinogénico de levonorgestrel. Levonorgestrel es un progestágeno bien conocido.
El perfil de seguridad después de la administración sistémica está bien documentado. Estudios en monos con liberación intrauterina de levonorgestrel durante 9 a 12 meses confirmaron una actividad farmacológica local con una buena tolerancia local y sin signos de toxicidad sistémica.
No se observó embriotoxicidad en conejos después de la administración intrauterina de levonorgestrel.
La evaluación de seguridad de los componentes de elastómero del depósito hormonal, de materiales de polietileno y polipropileno así como del anillo de plata del producto, y la combinación de elastómero y levonorgestrel, con base tanto en la evaluación de toxicidad genética en sistemas de prueba estándar in vitro e in vivo como en pruebas de biocompatibilidad en ratones, ratas, cobayas, conejos y sistemas de prueba in vitro no revelaron bioincompatibilidad.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
MIRENA 52 mg:
El metabolismo de los progestágenos puede verse aumentado por el uso concomitante de sustancias que se sabe inducen enzimas metabolizantes de fármacos, específicamente las enzimas del sistema citocromo P450, tales como los anticonvulsivantes (p. ej., fenobarbital, fenitoína, carbamazepina) y anti-infecciosos (p. ej., rifampicina, rifabutina, nevirapina, efavirenz). Se desconoce la influencia de estos fármacos sobre la eficacia anticonceptiva de MIRENA, pero no se cree que pueda tener mayor importancia puesto que los mecanismos de acción anticonceptiva son principalmente locales.
KYLEENA 19.5 mg:
Efectos de otros medicamentos en KYLEENA 19.5 mg: Pueden ocurrir interacciones con fármacos que inducen enzimas microsomales, lo que puede dar como resultado una depuración elevada de las hormonas sexuales.
Sustancias que incrementan la depuración del levonorgestrel, por ejemplo: Fenitoína, barbitúricos, primidona, carbamazepina, rifampicina, y posiblemente también oxcarbazepina, topiramato, felbamato, griseofulvina y productos que contienen la hierba de San Juan.
Se desconoce la influencia de estos fármacos en la eficacia anticonceptiva de KYLEENA 19.5 mg, pero no se cree que sea de gran importancia debido al mecanismo de acción local.
Sustancias con efectos variables en la depuración del levonorgestrel, por ejemplo: Cuando se administran de manera conjunta con hormonas sexuales, muchos inhibidores de la proteasa del VIH/VHC y los inhibidores de la transcriptasa inversa no nucleosídicos pueden incrementar o disminuir las concentraciones plasmáticas de la progestina.
Sustancias que disminuyen la depuración del levonorgestrel (inhibidores enzimáticos): Los inhibidores fuertes y moderados del CYP3A4 tales como los antimicóticos azoles (por ejemplo fluconazol, itraconazol, ketoconazol, voriconazol), verapamilo, macrólidos (por ejemplo claritromicina, eritromicina), diltiazem y el jugo de toronja pueden incrementar las concentraciones plasmáticas de la progestina.
KYLEENA 19.5 mg:
Imagen de resonancia magnética nuclear (RMN): Las pruebas no clínicas de otro SIU-LNG con el mismo tamaño de anillo de plata y cuerpo en forma de T demostraron que una paciente puede ser examinada de forma segura después de la colocación de KYLEENA 19.5 mg (RMN condicional) bajo las siguientes condiciones:
• Campo magnético estático de 3-Tesla o menos.
• Campo de gradiente espacial de 36000 Gauss/cm (360 T/m) o menos.
• Tasa de absorción específica (TAE) promediada del cuerpo total máximo de 4 W/kg en el modo de Primer Nivel Controlado durante 15 minutos de escaneo continuo.
En pruebas no clínicas, el SIU-LNG arriba mencionado produjo un aumento de temperatura de igual o más que 1.8°C a una tasa de absorción específica (TAE) promediada del cuerpo total máximo de 2.9 W/kg, durante 15 minutos de escaneo de RM a 3T utilizando un cuerpo en espiral transmisor/receptor.
Puede ocurrir una pequeña cantidad de artefactos en la imagen si el área de interés está en la misma área o relativamente cercana a la posición de KYLEENA 19.5 mg.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: No existe evidencia.
PRECAUCIONES GENERALES: En caso de que cualquiera de las siguientes condiciones exista o se presente por primera vez, MIRENA 52 mg y KYLEENA 19.5 mg puede ser usado con precaución después de la consulta con el especialista o debe considerarse la extracción del endoceptivo:
• Migraña, migraña focal con pérdida asimétrica de la visión u otros síntomas indicadores de isquemia cerebral transitoria.
• Cefalea excepcionalmente intensa.
• Ictericia.
• Aumento marcado de la presión arterial.
• Enfermedad arterial grave como por ej. accidente cerebrovascular o infarto de miocardio.
MIRENA 52 mg:
Puede usarse con precaución en mujeres con enfermedad cardiaca congénita o valvulopatía con riesgo de endocarditis infecciosa. A estas pacientes se les debe administrar profilácticamente un antibiótico al insertar o extraer el endoceptivo.
Dosis bajas de levonorgestrel pueden afectar la tolerancia a la glucosa y en las usuarias de MIRENA diabéticas se debe monitorear la concentración de glucosa en la sangre.
Las hemorragias irregulares pueden enmascarar algunos síntomas y signos de pólipos endometriales ó cáncer de endometrio, y en estos casos se deben considerar medidas diagnósticas.
MIRENA no es el método de primera elección para mujeres jóvenes nulíparas, ni tampoco para mujeres postmenopáusicas con atrofia uterina avanzada.
Los datos disponibles demuestran que MIRENA no aumenta el riesgo de cáncer de mama en mujeres premenopáusicas menores de 50 años. Debido a la exposición limitada en estudios con MIRENA en la indicación para la protección contra la hiperplasia endometrial durante el tratamiento de sustitución de estrógenos, los datos disponibles no son suficientes para confirmar o refutar un riesgo de cáncer de mama cuando MIRENA se utiliza en esta indicación.
KYLEENA 19.5 mg:
Puede utilizarse con precaución en mujeres que tienen enfermedad cardiaca congénita o enfermedad cardiaca valvular con riesgo de endocarditis infecciosa. El levonorgestrel a bajas dosis puede afectar la tolerancia a la glucosa, y la concentración de glucosa en sangre debe ser monitoreada en usuarias diabéticas de KYLEENA 19.5 mg.
• Consulta y examen médico: Antes de realizar la inserción, se debe informar a la paciente sobre la eficacia y riesgos de MIRENA. Se debe realizar un examen físico, incluyendo examen pélvico, de las mamas y citología cervical. Se debe realizar un frotis cervical según sea necesario, de acuerdo con la evaluación del profesional de la salud. Debe descartarse la existencia de embarazo e infecciones de transmisión sexual; las infecciones genitales deben ser previa y adecuadamente tratadas antes de la colocación. Además debe determinarse la posición del útero y el tamaño de la cavidad uterina. Es importante que el endoceptivo MIRENA quede colocado en el fondo uterino para así poder asegurar una exposición uniforme del endometrio al progestágeno, reducir el riesgo de expulsión y maximizar la eficacia. Por consiguiente, se deben observar estrictamente las instrucciones de colocación. Las instrucciones de colocación se deben seguir cuidadosamente. Se debe hacer énfasis en la capacitación sobre la técnica de colocación correcta. La inserción y la extracción pueden ir acompañadas de cierto dolor y hemorragia. El procedimiento puede producir desmayo como reacción vasovagal o una crisis en una paciente epiléptica.
La paciente debe ser reexaminada 4 a 12 semanas después de la inserción y posteriormente una vez al año a partir de ese momento o más a menudo si su condición clínica lo requiere.
MIRENA no es adecuado para ser usado como anticonceptivo postcoital ("anticonceptivo de emergencia").
Puesto que las hemorragias irregulares/manchado son comunes durante los primeros meses de tratamiento, antes de insertar MIRENA 52 mg debe excluirse la posibilidad de patología endometrial. Si la mujer continúa usando el endoceptivo MIRENA 52 mg, insertado previamente como método anticonceptivo, debe excluirse una patología endometrial en caso de que ocurran trastornos menstruales tras el inicio de la terapia de reemplazo estrogénica. Se deben tomar las medidas diagnósticas apropiadas en caso de que durante un tratamiento prolongado se presenten hemorragias irregulares.
El sangrado irregular y el manchado menstrual son frecuentes durante los primeros meses de tratamiento con todos los SIU-LNG, incluido KYLEENA 19.5 mg. Si el sangrado se vuelve más abundante y/o más irregular con el tiempo, se deben tomar las medidas de diagnóstico adecuadas, ya que el sangrado irregular puede ser un síntoma de enfermedad endometrial: pólipos, hiperplasia o cáncer.
• Oligomenorrea/amenorrea:
MIRENA 52 mg:
En mujeres en edad fértil se desarrolla gradualmente oligomenorrea y amenorrea en el 57% y 16% de las mujeres, respectivamente. Se debe considerar la posibilidad de un embarazo si no se presenta menstruación dentro de las 6 semanas siguientes al inicio de la menstruación anterior.
Cuando MIRENA se usa en combinación con terapia continua de sustitución estrogénica, en la mayoría de las mujeres se desarrolla gradualmente un patrón de ausencia de hemorragia durante el primer año.
Infección pélvica: Al igual que otros procedimientos ginecológicos o quirúrgicos, se puede producir infección severa o sepsis (incluida la sepsis por estreptococos del grupo A) después de la colocación de un DIU, aunque es extremadamente raro que esto suceda.
MIRENA 52 mg:
Uno de los factores conocidos de riesgo de enfermedad pélvica inflamatoria es la promiscuidad sexual (múltiples parejas sexuales). La infección pélvica puede tener serias consecuencias y puede afectar la fertilidad y aumentar el riesgo de embarazo ectópico.
MIRENA debe ser extraído si la usuaria padece de endometritis o infecciones pélvicas recurrentes, o si una infección aguda es severa o no responde al tratamiento en el curso de algunos días.
KYLEENA 19.5 mg:
El sangrado infrecuente y/o la amenorrea se desarrollan de manera gradual. Para el final del quinto año, aproximadamente el 26.4% y el 22.6% de las usuarias desarrollaron sangrado infrecuente y/o amenorrea, respectivamente. Se debe considerar el embarazo si no ocurre la menstruación dentro de 6 semanas a partir del inicio de la menstruación anterior.
Infección pélvica: Se debe evaluar por completo a las pacientes para factores de riesgo asociados con infección pélvica (por ejemplo varias parejas sexuales, infecciones de transmisión sexual, historia previa de EPI). Las infecciones pélvicas tales como la enfermedad pélvica inflamatoria pueden tener consecuencias serias y esto puede deteriorar la fertilidad e incrementar el riesgo de embarazo ectópico.
Al igual que con otros procedimientos ginecológicos o quirúrgicos, puede ocurrir infección severa o sepsis (incluida la sepsis estreptocócica del grupo A) después de la colocación del DIU, aunque esto ocurre con una frecuencia extremadamente baja. Si una mujer experimenta endometritis o enfermedad pélvica inflamatoria recurrente o si una infección aguda es seria o no responde al tratamiento, KYLEENA 19.5 mg debe ser extraído.
• Expulsión:
MIRENA 52 mg:
Los síntomas de expulsión completa o parcial de un DIU pueden incluir hemorragia o dolor. Sin embargo, es posible que el endoceptivo sea expulsado de la cavidad uterina sin que la mujer lo advierta, ocasionando la pérdida de la protección anticonceptiva. La expulsión parcial puede disminuir la eficacia de MIRENA. Dado que MIRENA disminuye el flujo menstrual, un aumento de éste puede ser un indicativo de una expulsión.
En caso de desplazamiento, MIRENA debe extraerse a la brevedad posible; al mismo tiempo puede insertarse un endoceptivo nuevo.
La paciente debe ser instruida sobre la forma como revisar los hilos del endoceptivo MIRENA.
KYLEENA 19.5 mg:
En estudios clínicos con KYLEENA 19.5 mg, la incidencia de expulsión fue baja y dentro del mismo rango que el informado para otros DIU y SIU. Dado que KYLEENA 19.5 mg normalmente disminuye el sangrado menstrual con el tiempo, un aumento del sangrado menstrual podría indicar una expulsión.
KYLEENA 19.5 mg parcialmente expulsado se debe extraer. Se puede colocar un sistema nuevo en ese momento, siempre y cuando se haya descartado un embarazo.
Se debe recomendar a la mujer que revise los hilos de KYLEENA 19.5 mg y que se comunique con su profesional de la salud si no los puede sentir.
• Perforación:
MIRENA 52 mg, KYLEENA 19.5 mg:
La perforación o penetración del cuerpo uterino o del cérvix por un anticonceptivo intrauterino puede ocurrir más frecuentemente durante la inserción y pueden disminuir la eficacia de MIRENA. En estos casos, el sistema intrauterino debe extraerse.
En un gran estudio de cohortes, prospectivo, comparativo, no intervencional, en usuarias de DIU (N = 61,448 mujeres), la incidencia de perforación fue 1.3 (IC del 95%: 1.1-1.6) por cada 1 000 colocaciones en el estudio de cohortes completo; 1.4 (IC del 95%: 1.1-1.8) por cada 1 000 colocaciones en la cohorte de MIRENA y 1.1 (IC del 95%: 0.7-1.6) por cada 1 000 colocaciones en la cohorte de DIU de cobre.
En el estudio se demostró que tanto la lactancia en el momento de la colocación como la colocación hasta 36 semanas después del parto estaban asociadas a un riesgo mayor de perforación (ver la Tabla 1). Estos factores de riesgo eran independientes del tipo de DIU colocado.
Tabla 1. incidencia de perforación por cada 1 000 colocaciones para el estudio de cohortes completo, estratificado por lactancia y tiempo desde el parto a la colocación (mujeres que parieron)
|
Lactancia al momento de la colocación |
Sin lactancia al momento de la colocación |
|
|
Colocación ≤ 36 semanas después del parto |
5.6 (IC del 95% 3.9-7.9; n = 6047 colocaciones) |
1.7 (IC del 95% 0.8-3.1; n = 5927 colocaciones) |
|
Colocación > 36 semanas después del parto |
1.6 (IC del 95% 0.0-9.1; n = 608 colocaciones) |
0.7 (IC del 95% 0.5-1.1; n = 41910 colocaciones) |
El riesgo de perforación puede aumentar en mujeres con el útero retrovertido fijo.
• Embarazo ectópico:
MIRENA 52 mg:
La mujer con historia previa de embarazo ectópico, cirugía tubárica ó infección pélvica tiene un riesgo mayor de embarazo ectópico. Se debe considerar la posibilidad de un embarazo ectópico en el caso de dolor abdominal inferior, especialmente en combinación con ausencia de menstruación, o si una mujer en amenorrea comienza a sangrar. En los estudios clínicos, la tasa de embarazo ectópico con MIRENA fue aproximadamente 0,1% al año. En un gran estudio de cohortes, prospectivo, comparativo, no intervencional, con un periodo de observación de 1 año, la tasa de embarazo ectópico con MIRENA fue 0.02%. El riesgo absoluto de embarazo ectópico en las usuarias de MIRENA es bajo. Sin embargo, cuando una mujer se queda embarazada con MIRENA in situ, aumenta la probabilidad relativa de embarazo ectópico.
KYLEENA 19.5 mg:
Las mujeres con una historia previa de embarazo ectópico, cirugía tubárica o infección pélvica tienen un riesgo elevado de embarazo ectópico. Debe considerarse la posibilidad de un embarazo ectópico en el caso de dolor abdominal bajo –especialmente en relación con periodos faltantes o si una mujer amenorreica comienza a sangrar. Las mujeres que se embarazan mientras utilizan KYLEENA 19.5 mg deben ser evaluadas para un embarazo ectópico. El riesgo absoluto de embarazo ectópico en usuarias de KYLEENA 19.5 mg es bajo. Sin embargo, cuando una mujer se embaraza con KYLEENA 19.5 mg in situ, aumenta la probabilidad relativa de que este embarazo sea ectópico. La incidencia global de embarazo ectópico con KYLEENA 19.5 mg es de aproximadamente 0.20 por cada 100 mujeres-año.
• Pérdida de los hilos de extracción: Si en las visitas de seguimiento no se pueden detectar en el cérvix los hilos de extracción, debe excluirse un embarazo. Es posible que los hilos se hayan desplazado al canal cervical o a la cavidad uterina y que reaparezcan durante la siguiente menstruación. Si se ha confirmado la ausencia de embarazo, los hilos pueden localizarse, por lo general, sondeando suavemente con un instrumento adecuado. Si no se pueden encontrar, debería considerarse la posibilidad de una expulsión o una perforación.
MIRENA 52 mg:
El endoceptivo MIRENA puede localizarse mediante ultrasonido para demostrar su correcta posición. En caso de que no se disponga de ultrasonido o éste no sea satisfactorio, MIRENA puede localizarse mediante una radiografía.
Quistes ováricos:
MIRENA 52 mg:
Puesto que el efecto anticonceptivo de MIRENA es principalmente local, generalmente se presentan ciclos ovulatorios con ruptura folicular en mujeres en edad fértil. Algunas veces la atresia folicular está retrasada y la foliculogénesis puede continuar. Se han notificado quistes ováricos como reacciones adversas al medicamento en aproximadamente el 7% de las usuarias de MIRENA. Por lo general, estos folículos son asintomáticos, aun cuando algunos pueden ir acompañados de dolor pélvico o dispareunia.
En la mayoría de los casos los quistes ováricos desaparecen espontáneamente durante 2 a 3 meses de observación. Si éste no fuese el caso, se recomienda continuar con la monitorización por ultrasonido y considerar otras medidas diagnósticas ó terapéuticas. Muy rara vez se requiere intervención quirúrgica.
• Hilos no visibles: Si los hilos de extracción no son visibles en el cérvix en exploraciones de seguimiento, se debe excluir un embarazo. Es posible que los hilos hayan ingresado al útero o al canal del cuello uterino y pueden volver a aparecer durante el siguiente periodo menstrual. Si se ha excluido un embarazo, los hilos pueden ubicarse, generalmente, explorando suavemente el canal del cuello uterino con un instrumento adecuado. Si no se pueden encontrar los hilos, se debe considerar la posibilidad de expulsión o perforación. Se puede utilizar una evaluación con ultrasonido para determinar la posición del SIU-LNG. Si no está disponible o no se tiene éxito con el ultrasonido, se pueden utilizar rayos X para localizar KYLEENA 19.5 mg.
• Quistes ováricos /folículos ováricos agrandados:
KYLEENA 19.5 mg:
Quistes ováricos/folículos ováricos funcionales. Debido a que el efecto anticonceptivo de KYLEENA 19.5 mg se debe principalmente a sus efectos locales dentro del útero, por lo general no hay cambios en la función ovulatoria, incluido el desarrollo folicular regular, la liberación de ovocitos y la atresia folicular en mujeres en edad fértil. Algunas veces la atresia del folículo se retrasa y puede continuar la foliculogénesis. Estos folículos agrandados no pueden distinguirse clínicamente de los quistes ováricos. Se han reportado quistes ováricos (incluidos los quistes ováricos hemorrágicos y rotos) durante el transcurso de los ensayos clínicos como un evento adverso por lo menos una vez en aproximadamente el 22.2% de las mujeres que utilizan KYLEENA 19.5 mg. La mayoría de estos folículos son asintomáticos, aunque algunos pueden estar acompañados por dolor pélvico o dispareunia. En la mayoría de los casos, los folículos agrandados vuelven a la normalidad de manera espontánea tras observación de dos a tres meses. Si un folículo agrandado no vuelve a la normalidad de manera espontánea, el monitoreo continuo por ultrasonido y otras medidas diagnósticas/terapéuticas pueden ser adecuados. Rara vez se puede requerir intervención quirúrgica.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Dispositivo intrauterino:
MIRENA 52 mg:
MIRENA 52 mg se inserta en la cavidad uterina y tiene una duración efectiva de 5 años.
La tasa de disolución in vivo de levonorgestrel es de aproximadamente 20 µg/24 horas inicialmente y se reduce a aproximadamente 10 µg/24 horas después de 5 años. La tasa de disolución promedio de levonorgestrel es de aproximadamente 14 µg/24 horas durante los primeros cinco años.
En mujeres bajo terapia de reemplazo hormonal, MIRENA 52 mg puede usarse en combinación con preparados estrogénicos orales o transdérmicos sin progestágeno.
MIRENA 52 mg cuando es insertado de acuerdo a las instrucciones de inserción, tiene un índice de falla de aproximadamente 0.2% a un año y un índice de falla acumulado de aproximadamente 0.7% en 5 años.
Inserción y extracción/sustitución: En mujeres en edad fértil, MIRENA 52 mg debe insertarse en la cavidad uterina en cualquiera de los siete días siguientes al inicio de la menstruación. MIRENA puede reemplazarse por un endoceptivo nuevo en cualquier momento del ciclo. También puede insertarse inmediatamente después de un aborto del primer trimestre.
Las inserciones postparto deberán posponerse hasta que el útero haya involucionado completamente, sin embargo, no antes de las 6 semanas posteriores al parto. Si la involución se retrasa notablemente, considerar esperar hasta 12 semanas post-parto. En caso de una difícil inserción, y/o dolor excepcional o sangrado durante o después de la inserción, debe realizarse inmediatamente un examen físico y un ultrasonido para excluir perforación.
Cuando se usa para proteger el endometrio durante la terapia de reemplazo estrogénica, MIRENA 52 mg puede insertarse en cualquier momento en una mujer con amenorrea, o durante los últimos días de la menstruación o hemorragia por deprivación.
Se recomienda que MIRENA 52 mg sea insertado por el médico tratante o el especialista con experiencia en inserciones de MIRENA y tenga entrenamiento suficiente para ello.
MIRENA 52 mg se extrae tirando suavemente de los hilos con unas pinzas. Si no pueden verse los hilos y el endoceptivo está en la cavidad uterina, se puede extraer utilizando una pinza angosta, lo que puede requerir de la dilatación del canal cervical u otra intervención quirúrgica.
El endoceptivo debe extraerse después de 5 años de uso. Si la usuaria desea continuar usando el mismo método, se le puede insertar inmediatamente un nuevo endoceptivo.
En las mujeres en edad fértil que no deseen quedar embarazadas, MIRENA 52 mg debe extraerse durante la menstruación, siempre y cuando exista un ciclo menstrual. Si el endoceptivo se extrae en la mitad del ciclo y la mujer ha tenido relaciones sexuales durante la semana anterior, corre riesgo de embarazo a menos que se inserte un nuevo endoceptivo inmediatamente después de la extracción.
Después del reemplazo de MIRENA 52 mg, es necesario revisar que el sistema extraído se encuentre intacto. Durante extracciones difíciles, se han reportado casos individuales relacionados con el desplazamiento del cilindro hormonal sobre los brazos horizontales, lo cual ocasiona que éstos se oculten dentro del cilindro. Esta situación no requiere de intervenciones adicionales una vez que se ha determinado que el SIU se encuentra completo. Las protuberancias de los brazos horizontales normalmente evitan que el cilindro se desprenda totalmente del cuerpo en forma de T.
Instrucciones para su manejo y su uso: MIRENA 52 mg se suministra en un envase estéril que sólo debe abrirse inmediatamente antes de la inserción. El producto expuesto debe manejarse bajo condiciones asépticas. Si está rota la junta del envase estéril, el producto debe desecharse.
KYLEENA 19.5 mg:
KYLEENA 19.5 mg se coloca en la cavidad uterina y es efectivo hasta por 5 años.
La tasa de liberación in vivo es de aproximadamente 17.5 µg/24 horas después de 24 días y se reduce a aproximadamente 15.3 µg/24 horas después de 60 días y a 9.8 µg/24 horas después de 1 año. Después disminuye progresivamente a 7.4 µg/24 horas al cabo de 5 años. La tasa de liberación in vivo promedio de levonorgestrel es de aproximadamente 9 µg/24 horas durante el periodo de 5 años.
KYLEENA 19.5 mg, cuando se coloca de acuerdo con las instrucciones de colocación, tiene una tasa de falla de aproximadamente 0.2% en 1 año y una tasa acumulada de falla de aproximadamente el 1.5% en 5 años. La tasa de falla también incluye embarazos debidos a expulsiones y perforaciones uterinas no detectadas.
Colocación y retiro/reemplazo: Se recomienda que KYLEENA 19.5 mg sólo sea colocado por médicos/profesionales de la salud que tengan experiencia en colocar el SIU-LNG y/o que hayan tenido capacitación sobre el procedimiento de colocación de KYLEENA 19.5 mg.
KYLEENA 19.5 mg debe colocarse en la cavidad uterina en cualquiera de los 7 días siguientes al inicio de la menstruación. KYLEENA 19.5 mg puede reemplazarse por un sistema nuevo en cualquier momento del ciclo. KYLEENA 19.5 mg también puede colocarse inmediatamente después de un aborto del primer trimestre.
Las colocaciones postparto deben posponerse hasta que el útero esté completamente involucionado, sin embargo no antes de 6 semanas después del parto. Si la involución se retrasa sustancialmente, considere esperar hasta 12 semanas después del parto.
En caso de una colocación difícil y/o de sangrado o dolor excepcional durante o después de la colocación, se deben tomar medidas adecuadas de forma inmediata para excluir la perforación, tales como evaluación física y ultrasonido.
KYLEENA 19.5 mg puede distinguirse de otros SIU-LNG mediante la combinación de la visibilidad del anillo de plata en ultrasonido y el color azul de los hilos de extracción. El marco en forma de T de KYLEENA 19.5 mg contiene sulfato de bario, lo que lo hace visible en un examen de rayos X.
KYLEENA 19.5 mg se extrae jalando suavemente los hilos con una pinza. Si los hilos no son visibles y se encuentra que el SIU-LNG está en la cavidad uterina en una evaluación con ultrasonido, puede retirarse utilizando una pinza delgada. Esto puede requerir dilatación del canal cervical o una intervención quirúrgica.
El sistema debe retirarse a más tardar al final del quinto año. Si la mujer desea continuar usando el mismo método, se puede colocar un sistema nuevo inmediatamente después de retirar el sistema original.
Si no se desea un embarazo, el retiro debe realizarse dentro de los 7 días siguientes al inicio de la menstruación, siempre y cuando la mujer continúe experimentando menstruaciones regulares. Si el sistema se retira en algún otro momento durante el ciclo o si la mujer no presenta menstruaciones regulares y la mujer ha tenido relaciones sexuales dentro de una semana, ella está en riesgo de embarazarse. Para asegurar una anticoncepción continua, debe colocarse inmediatamente un sistema nuevo o se debe iniciar el uso de un método anticonceptivo alternativo.
Después del retiro de KYLEENA 19.5 mg, el sistema debe ser examinado para asegurar que está intacto.
Instrucciones de uso y manejo: KYLEENA 19.5 mg es suministrado en un paquete estéril dentro de un dispositivo de inserción integrado que permite una carga única. El empaque no debe abrirse hasta que sea necesario para la colocación. Una vez abierto, el producto expuesto debe manejarse utilizando técnicas asépticas. Si el sello del paquete estéril se rompe, o si se ve comprometido, no se debe utilizar el producto.
KYLEENA 19.5 mg, sistema anticonceptivo con baja dosis de levonorgestrel.
Debe ser colocado por un profesional de la salud utilizando una técnica aséptica.
KYLEENA 19.5 mg se suministra en un envase estéril con un dispositivo de colocación integrado que permite una única carga. El envase no debe abrirse hasta que sea necesario para la colocación. No volver a esterilizar. Como está suministrado, KYLEENA 19.5 mg es de uso único. No utilizar si el envase interior está dañado o abierto. No colocar después del mes y el año de caducidad indicados en la etiqueta.
Favor de consultar la información de prescripción de KYLEENA 19.5 mg en el momento de su colocación.
Preparación para la colocación:
• Examine a la paciente para establecer el tamaño y la posición del útero, con el fin de detectar cualquier signo de infección genital aguda u otra contraindicación para la colocación de KYLEENA 19.5 mg así como para excluir el embarazo.
• Coloque un espéculo, visualice el cérvix, y después limpie muy bien el cérvix y la vagina con una solución antiséptica adecuada.
• Utilice la ayuda de un asistente en caso de ser necesario.
• Sujete el labio anterior del cérvix con un tenáculo u otra pinza para estabilizar el útero. Si el útero está en retroversión, puede ser más apropiado sujetar el labio posterior del cérvix. Se puede aplicar una tracción suave en el fórceps para alinear el canal cérvico-uterino. La pinza debe permanecer en su posición y se debe mantener tracción en el cérvix durante el procedimiento de colocación.
• Ingrese una sonda uterina (histerómetro) a través del canal cérvico-uterino hasta el fondo del útero para medir la profundidad y confirmar la dirección de la cavidad uterina y para excluir cualquier evidencia de anormalidades intrauterinas (por ejemplo, tabique, fibroides sub-mucosos) o un anticonceptivo intrauterino previamente colocado que no haya sido extraído. Si se encuentra alguna dificultad, considere dilatar el cérvix. Si se requiere dilatar el canal cérvico-uterino, considere utilizar analgésicos y/o un bloqueo paracervical.
Colocación:
1. Primero, abra el empaque estéril por completo (Figura 1). Después utilice una técnica aséptica y guantes estériles.
2. Empuje el deslizador hacia adelante en la dirección de la flecha hasta arriba para cargar KYLEENA 19.5 mg en el tubo de colocación (Figura 2).
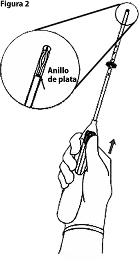
¡IMPORTANTE! No jale el deslizador hacia abajo ya que esto puede liberar KYLEENA 19.5 mg de forma prematura. Una vez liberado, KYLEENA 19.5 mg no puede volver a cargarse.
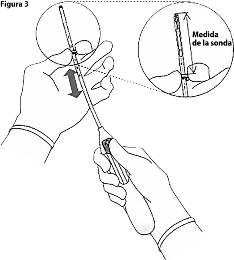
3. Manteniendo el deslizador hasta arriba, haga que el borde superior del anillo corresponda con la medida de la sonda (histerometría) de la profundidad de la cavidad uterina (Figura 3).
4. Mientras sujeta el deslizador hasta arriba, ingrese el dispositivo de colocación a través del cérvix hasta que el anillo esté a aproximadamente 1.5-2.0 cm del cérvix uterino (Figura 4).
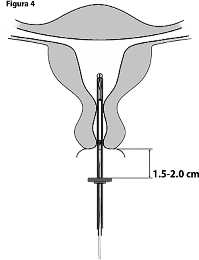
¡IMPORTANTE! No fuerce el dispositivo de colocación. Dilate el canal cérvico-uterino, en caso de ser necesario.
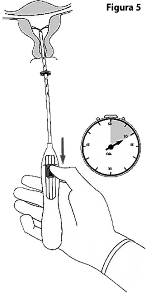
5. Mientras mantiene firme el dispositivo de colocación, jale el deslizador hacia la marca para abrir los brazos horizontales de KYLEENA 19.5 mg (Figura 5). Espere de 5 a 10 segundos para que los brazos horizontales se abran por completo.
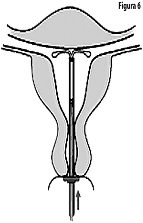
6. Ingrese suavemente el dispositivo de colocación hacia el fondo del útero hasta que el anillo toque el cérvix. KYLEENA 19.5 mg ahora está en el fondo del útero (Figura 6).
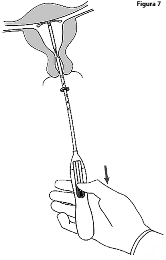
7. Manteniendo el dispositivo de colocación en su lugar, libere KYLEENA 19.5 mg jalando el deslizador hasta abajo (Figura 7). Mientras mantiene el deslizador hasta abajo, retire suavemente el dispositivo de colocación jalándolo. Corte los hilos para dejar aproximadamente de 2 a 3 cm visibles fuera del cérvix.
¡IMPORTANTE! Si sospecha que el sistema no está en la posición correcta, revise la colocación (por ejemplo, con un ultrasonido). Extraiga el sistema si no está colocado adecuadamente dentro de la cavidad uterina. No debe volver a colocarse un SIU-LNG que fue extraído.
Retiro/reemplazo:
Para el retiro/reemplazo, favor de consultar la información para prescribir de KYLEENA 19.5 mg.
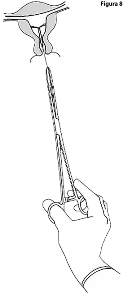
KYLEENA 19.5 mg se retira jalando los hilos con una pinza (Figura 8).
Puede colocar un nuevo KYLEENA 19.5 mg inmediatamente después de retirar el actual.
Información adicional sobre poblaciones especiales:
Niñas y adolescentes:
MIRENA 52 mg:
Se ha establecido la seguridad y eficacia de MIRENA 52 mg en mujeres en edad fértil. No existe indicación relevante para el uso de MIRENA 52 mg antes de la menarquia.
Pacientes geriátricas: MIRENA 52 mg no ha sido estudiado en mujeres mayores de 65 años.
Pacientes con insuficiencia hepática: MIRENA 52 mg, está contraindicado en mujeres con enfermedad hepática aguda o tumor hepático (ver Contraindicaciones).
Pacientes con insuficiencia renal: MIRENA 52 mg no se ha estudiado en mujeres con insuficiencia renal.
Pacientes pediátricas: La seguridad y la eficacia de KYLEENA 19.5 mg se han estudiado en mujeres de 18 años de edad o más. Se espera que la seguridad y la eficacia sean las mismas para adolescentes en etapa de post-pubertad menores de 18 años que para usuarias de 18 años de edad o más. El perfil de seguridad y de eficacia de otro SIU-LNG de menor dosis observado en un estudio de 304 adolescentes fue consistente con el de la población adulta (ver la sección "Farmacocinética y farmacodinamia). No existe indicación para el uso de KYLEENA 19.5 mg antes de la menarquia.
Pacientes geriátricas: KYLEENA 19.5 mg no está indicado para su uso en mujeres postmenopáusicas.
Pacientes con insuficiencia hepática: KYLEENA 19.5 mg no ha sido estudiado en mujeres con insuficiencia hepática. KYLEENA 19.5 mg está contraindicado en mujeres con enfermedad hepática aguda o con tumor hepático (ver la sección "Contraindicaciones").
Pacientes con insuficiencia renal: KYLEENA 19.5 mg no ha sido estudiado en mujeres con insuficiencia renal.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: No aplica.
PRESENTACIÓN: Caja con un dispositivo intrauterino.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Protéjase de la luz solar y de la humedad.
Consérvese o manténgase a no más de 30°C y en lugar seco.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. No se deje al alcance de los niños. Literatura exclusiva para médicos. No se use durante el embarazo.
Reporte las sospechas de reacciones adversas al correo:
farmacovigilancia@cofepris.gob.mx
Hecho en Finlandia por:
Bayer Oy
Pansiontie 47, 20210 Turku,
Finlandia
Distribuido por:
BAYER DE MÉXICO, S.A. de C.V.
Carr. México-Toluca Km 52.5
C.P. 52000, Lerma, México
Reg. Núm. 259M99, SSA IV
173300416T0039
Fecha de autorización: 19.Jun.2017