LEVEMIR
INSULINA DETEMIR
Solución inyectable
1 Caja, 5 Cartucho(s), 100 U/ml
1 Caja, 1 Pluma prellenada, 100 U/ml
1 Caja, 5 Pluma prellenada, 100 U/ml
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada mL contiene:
Insulina Detemir* 100 U (14.2 mg)
Vehículo cbp 1 mL
*Análogo de insulina de origen ADN recombinante expresado en Saccharomyces cerevisiae.
1 unidad (U) de insulina detemir corresponde a 1 UI de insulina humana.
1 mL de la solución contiene 100 U de insulina detemir (equivalente a 14.2 mg).
1 cartucho/pluma precargada contiene 3 mL, equivalente a 300 U.
INDICACIONES TERAPÉUTICAS: Tratamiento de la diabetes mellitus en adultos, adolescentes y niños de 2 años de edad en adelante.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades Farmacodinámicas:
Grupo farmacoterapéutico: Agente antidiabético. Insulinas y análogos inyectables de acción prolongada. Código ATC: A10AE05.
Levemir® es un análogo de insulina soluble, de acción y duración prolongada que se utiliza como insulina basal. El tiempo de acción de Levemir® es significativamente menos variable que el de insulina NPH e insulina glargina (ver abajo Tabla 1).
Tabla 1. Variabilidad intra-sujeto del perfil de acción de tiempo de la insulina detemir, insulina NPH e insulina glargina
|
Criterio de valoración farmacodinámica |
Levemir® Varianza |
Insulina NPH Varianza |
Insulina glargina Varianza |
|
AUCGIR,0-24h |
0.074 |
0.466 |
0.231 |
|
GIRmax |
0.053 |
0.209 |
0.130 |
Mecanismo de acción: La acción prolongada de Levemir® está mediada por la fuerte auto-asociación de las moléculas de insulina detemir en el sitio de la inyección y la unión a la albúmina por medio de la cadena lateral del ácido graso. La insulina detemir se distribuye más lentamente a los tejidos periféricos blanco, en comparación con la insulina NPH. Esta combinación de mecanismos de prolongación proporciona a Levemir® una absorción y un perfil de acción más reproducibles que la insulina NPH.
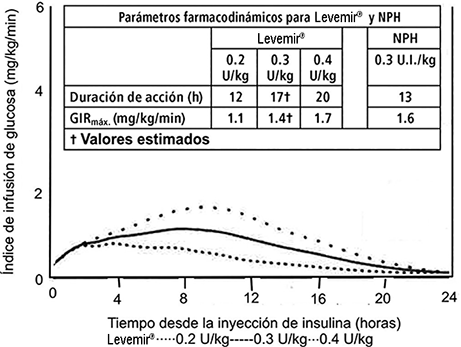
Figura 1. Perfiles de actividad para Levemir® en pacientes con diabetes tipo 1.
La duración de la acción es de hasta 24 horas, dependiendo de la dosis, lo cual permite la administración de una o dos dosis al día. Si Levemir® se administra dos veces al día, el estado estacionario ocurrirá después de la administración de 2-3 dosis. Para las dosis en el intervalo de 0.2-0.4 U/kg, Levemir® ejerce más del 50% de su efecto máximo entre 3-4 horas después de la administración de la dosis y hasta aproximadamente 14 horas después.
Después de la administración subcutánea se observa una proporcionalidad de la dosis en la respuesta farmacodinámica (efecto máximo, duración de la acción y efecto total).
Se demostró menor variabilidad diaria en FPG durante el tratamiento con Levemir® en comparación con NPH en los estudios clínicos a largo plazo.
Datos de eficacia y seguridad clínica: Los estudios en pacientes con diabetes tipo 2 tratados con insulina basal en combinación con antidiabéticos orales demostraron que el control glucémico (HbA1c) con Levemir® es comparable al obtenido con la insulina NPH y al obtenido con la insulina glargina, y está asociado con un menor aumento de peso. Vea la Tabla 2.
Tabla 2. Cambio en el peso corporal después del tratamiento con insulina
|
Duración del estudio |
Levemir® 1 vez al día |
Levemir® 2 veces al día |
Insulina NPH |
Insulina glargina |
|
20 semanas |
+ 0.7 kg |
+ 1.6 kg |
||
|
26 semanas |
+ 1.2 kg |
+ 2.8 kg |
||
|
52 semanas |
+ 2.3 kg |
+ 3.7 kg |
+ 4.0 kg |
Comparado con la insulina NPH (Neutral Protamine Hagedorn) y la insulina glargina, la terapia con Levemir® se asocia con menor ganancia de peso.
Comparado con otros productos de insulina, la terapia basal-bolo con Levemir® no está asociada con ganancia de peso.
En los estudios clínicos en que se investigó el uso de insulina una vez al día (OAD, Una vez al día), el tratamiento combinado con Levemir® resultó en un 61-65% menor riesgo de hipoglucemia nocturna, en comparación con la insulina NPH.
Se condujo un estudio clínico aleatorizado, abierto en pacientes con diabetes tipo 2 que no alcanzan los niveles con antidiabéticos orales. El estudio inició con un periodo de 12 semanas con liraglutida + metformina, en donde se alcanzó la meta de HbAlc <7% en el 61%. El 39% de los pacientes que no alcanzaron el objetivo fueron aleatorizados para recibir Levemir® una vez al día adicional o continuar con liraglutida + metformina por 52 semanas. La adición de Levemir® proporciona una reducción agregada de HbA1c de 7.6% a 7.1% después de 52 semanas. No se observaron episodios mayores de hipoglucemia. Cuando se adiciona Levemir® a liraglutida, el beneficio de peso de liraglutida se mantiene, ver tabla 3.
Tabla 3. Datos de estudio clínico, Levemir® con liraglutida + metformina
|
Semanas de estudio |
Aleatorio Levemir® + liraglutida + metformina N = 160 |
Aleatorio liraglutida + metformina N = 149 |
Valor de p |
|
|
Cambio de media en HbA1c desde la basal (%) |
0-26 |
-0.51 |
+ 0.02 |
< 0.0001 |
|
0-52 |
-0.50 |
0.01 |
< 0.0001 |
|
|
Proporción de pacientes alcanzando meta de HbA1c < 7% (%) |
0-26 |
43.1 |
16.8 |
< 0.0001 |
|
0-52 |
51.9 |
21.5 |
< 0.0001 |
|
|
Cambio en el peso corporal de la base (kg) |
0-26 |
-0.16 |
-0.95 |
0.0283 |
|
0-52 |
-0.05 |
-1.02 |
0.0416 |
|
|
Episodios menores de hipoglucemia (por pacientes al año) |
0-26 |
0.286 |
0.029 |
0.0037 |
|
0-52 |
0.228 |
0.034 |
0.0011 |
Se realizó un estudio clínico aleatorizado, doble ciego de 26 semanas para investigar la eficacia y seguridad de añadir liraglutida (1.8 mg) vs placebo en pacientes con diabetes tipo 2 controlados inadecuadamente con insulina basal con o sin metformina. La dosis de insulina fue reducida en 20% para los pacientes con HbA1c basal ≤8.0% para minimizar el riesgo de hipoglucemia. Subsecuentemente, se permitió a los pacientes aumentar su dosis de insulina hasta no más de la dosis pre-aleatorización. Levemir® fue el producto de insulina basal en 33% (N = 147) de los pacientes (97.3% usando metformina). En estos pacientes, la adición de liraglutida resultó en una mayor reducción de HbA1c en comparación con la adición de placebo (hasta 6.93% vs hasta 8.24%), una mayor reducción de la glucosa plasmática en ayuno (hasta 7.20 mmol/l vs hasta 8.13 mmol/l) y una mayor reducción del peso corporal (-3.47 kg vs -0.43 kg). Los valores basales para estos parámetros fueron similares en los dos grupos. Las tasas observadas de episodios menores de hipoglucemia fueron similares y no se observaron episodios severos de hipoglucemia en ningún grupo.
En estudios de tratamiento a largo plazo (≥ 6 meses) en pacientes con diabetes tipo 1, incluyendo niños y adolescentes de 2 a 17 años, el control de la glucosa plasmática en ayunas mejoró con Levemir®, en comparación con la insulina NPH cuando se administró como una terapia bolo/basal. El control glucémico (HbA1c) con Levemir® es comparable con el de la insulina NPH, con un menor riesgo de hipoglucemia nocturna y sin aumento de peso asociado.
Levemir® proporciona un mejor control glucémico, medido a través de los niveles de glucosa plasmática en ayuno (FGP), en comparación con el tratamiento con insulina NPH.
En un estudio clínico utilizando terapia de insulina bolo-basal, las tasas generales de hipoglucemia con Levemir® y con insulina NPH fueron similares. Los análisis de hipoglucemias nocturnas en pacientes con diabetes tipo 1 mostraron un riesgo significativamente menor de hipoglucemias nocturnas menores (capaz de auto-tratarse y confirmar por glucosa en sangre capilar menor de 50 mg/dL o 56 mg/dL si se expresa como glucosa en sangre) que con insulina NPH, sin embargo no se observó diferencia en diabetes tipo 2.
El perfil de glucosa nocturna es más regular y uniforme con Levemir® que con insulina NPH, resultando en un menor riesgo de hipoglucemia nocturna.
Se ha observado el desarrollo de anticuerpos con el uso de Levemir®. Sin embargo, esto no parece tener un impacto en el control glucémico.
Embarazo: En un estudio clínico aleatorizado controlado, mujeres embarazadas con diabetes tipo 1 (n = 310) fueron tratadas con un régimen basal-bolo en donde Levemir® (n = 152) fue comparado con insulina NPH (n = 158) con insulina asparta como insulina a la hora de comer.
Levemir® ha demostrado no ser inferior a la insulina NPH, calculado por HbA1c en la semana gestacional 36. La evolución de la media de HbA1c a través del embarazo fue similar para los sujetos en los grupos de Levemir® y de insulina NPH.
El objetivo de HbA1c ≤6.0%, en la semana gestacional 24 y 36, fue alcanzado por el 41% de los sujetos en el grupo de Levemir® y por el 32% en el grupo de la insulina NPH.
En la semana gestacional 24 y 36, la media de la glucosa plasmática en ayuno fue estadística y significativamente inferior en el grupo de Levemir® que en el grupo de insulina NPH.
No hubo diferencia estadística significativa entre Levemir® y el tratamiento de insulina NPH en las tasas de episodios de hipoglucemia durante el embarazo.
Las frecuencias generales de los eventos adversos durante el embarazo fueron similares para Levemir® y para el tratamiento de insulina NPH; sin embargo, se observó una frecuencia numérica elevada de eventos adversos serios durante el embarazo en las madres (61 [40%] vs. 49 [31%]) y en la descendencia durante el embarazo y después del nacimiento (36 [24%] vs. 32 [20%]) para Levemir® comparado con insulina NPH.
El número de niños recién nacidos vivos de madres que se embarazan después de una aleatorización fue de 50 (83%) para Levemir® y 55 (89%) para insulina NPH.
La frecuencia de niños con malformaciones congénitas fue de 4 (5%) en el grupo de Levemir® y de 11 (7%) en el grupo de insulina NPH, de ellos 3 (4%) niños en el grupo de Levemir® y 3 (2%) niños en el grupo de insulina NPH tuvieron malformaciones mayores.
Población pediátrica:
El estudio incluyendo niños mayores de 2 años fue ampliado por 12 meses adicionales (Datos de un total de 24 meses de tratamiento) para evaluar la formación de anticuerpos después del tratamiento a largo plazo con Levemir®. Después del aumento en los anticuerpos a insulina durante el primer año, los anticuerpos a insulina disminuyeron durante el segundo año hasta un nivel ligeramente más alto que el nivel previo al estudio. Los resultados indican que el desarrollo de anticuerpos no tuvo efecto negativo en el control glucémico y la dosis de insulina detemir.
Los datos de eficacia y seguridad para pacientes adolescentes con diabetes mellitus tipo 2 han sido extrapolados de datos de pacientes niños, adolescentes y adultos con diabetes mellitus tipo 1 y pacientes adultos con diabetes mellitus tipo 2. Los resultados apoyan el uso de Levemir® en pacientes adolescentes con diabetes mellitus tipo 2.
Propiedades farmacocinéticas:
Absorción: La concentración sérica máxima es alcanzada entre 6 y 8 horas después de la administración. Cuando se administra dos veces al día, las concentraciones séricas en el estado estacionario se alcanzan después de la administración de 2-3 dosis. La variación intra-sujeto en la absorción es menor para Levemir® que para otras preparaciones de insulina basal.
Distribución: El volumen de distribución aparente de Levemir® (aproximadamente 0.1 L/kg) indica que la fracción de insulina detemir en la sangre circulante es alta.
Los resultados de los estudios de unión a proteínas in vitro e in vivo demuestran que no existe una interacción clínicamente relevante entre la insulina detemir y los ácidos grasos u otros fármacos que se unen a las proteínas.
Metabolismo: La degradación de insulina detemir es similar a la de la insulina humana; todos los metabolitos formados son inactivos.
Eliminación: La vida media de la fase terminal después de la administración subcutánea está determinada por la magnitud de la absorción desde el tejido subcutáneo. La vida media terminal está entre 5 y 7 horas, dependiendo de la dosis.
Linealidad: Después de la administración subcutánea en el rango de la dosis terapéutica se observa una proporcionalidad de la dosis con las concentraciones séricas (concentración máxima y extensión de la absorción).
No hay diferencias clínicamente relevantes entre géneros en las propiedades farmacocinéticas de Levemir®.
No se observaron interacciones farmacocinéticas o farmacodinámicas entre liraglutida y Levemir® cuando se administra una dosis única de 0.5 U/kg de Levemir® con 1.8 mg de liraglutida en estado estacionario en pacientes con diabetes tipo 2.
Poblaciones especiales: Las propiedades farmacocinéticas de Levemir® fueron investigadas en niños pequeños (1-5 años), niños (6-12 años) y adolescentes (13-17 años) y comparadas con las de adultos con diabetes tipo 1. No hubo diferencias clínicas en las propiedades farmacocinéticas entre los niños pequeños, adolescentes y adultos.
No hubo una diferencia clínicamente relevante en la farmacocinética de Levemir® entre los sujetos de edad avanzada y los sujetos jóvenes, o entre los sujetos con disfunción renal o hepática y sujetos saludables.
CONTRAINDICACIONES:
Hipersensibilidad al principio activo a alguno de los excipientes (Glicerol, Fenol, Metacresol, Acetato de Zinc, Fosfato disódico dihidratado, Cloruro de sodio, Ácido clorhídrico (para ajuste del pH), Hidróxido de sodio (para ajuste del pH), Agua para inyecciones.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: Se puede considerar el tratamiento con Levemir® durante el embarazo, si el beneficio justifica los posibles riesgos.
Un estudio clínico aleatorio controlado en mujeres embarazadas con diabetes tipo 1 comparado con Levemir® (n = 152) y con insulina NPH (n = 158), ambos en combinación con insulina asparta. Los resultados mostraron eficacia similar de insulina detemir y de insulina NPH, y un perfil similar de seguridad global durante el embarazo, sobre los resultados de embarazo así como en el feto y en el recién nacido (ver sección de Farmacocinética y farmacodinamia).
Datos post comercialización de aproximadamente 300 resultados adicionales de mujeres embarazadas que se expusieron a Levemir®, no indicaron efectos adversos de insulina detemir en el embarazo ni toxicidad fetal/neonatal (Malformaciones).
Los datos en animales no indicaron toxicidad en la reproducción (ver sección de Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad).
En general, se recomienda un control glucémico intensivo y la monitorización de las pacientes diabéticas durante el embarazo y cuando se proyecta el mismo. Los requerimientos de insulina usualmente disminuyen durante el primer trimestre del embarazo y aumentan durante el segundo y tercer trimestres. Después del parto, normalmente los requerimientos de insulina vuelven rápidamente a los valores previos al embarazo.
Lactancia: Se desconoce si la insulina detemir es secretada en la leche materna. No se anticiparon efectos metabólicos de la ingesta de insulina detemir en la lactancia del recién nacido/infante, ya que la insulina detemir como péptido es digerida en amino ácidos en el tracto gastrointestinal humano.
Las mujeres en periodo de lactancia podrían necesitar un ajuste en la dosis de insulina.
REACCIONES SECUNDARIAS Y ADVERSAS:
a) Resumen del perfil de seguridad: Las reacciones adversas observadas en pacientes que usan Levemir® se deben al efecto farmacológico de la insulina. El porcentaje general de pacientes tratados que se espera que experimenten reacciones farmacológicas adversas se estima en 12%.
La reacción adversa reportada con mayor frecuencia durante el tratamiento es la hipoglucemia, por favor consulte la sección c a continuación.
Investigaciones clínicas han dado a conocer que la hipoglucemia mayor, definida como un requisito de la intervención de un tercero, ocurre en aproximadamente 6% de los pacientes tratados con Levemir®.
Las reacciones en el sitio de inyección se ven con mayor frecuencia durante el tratamiento con Levemir® que con la insulina humana. Estas reacciones incluyen dolor, enrojecimiento, urticaria, inflamación, moretones, hinchazón y comezón en el sitio de inyección. La mayoría de las reacciones en el sitio de inyección son menores y de naturaleza transitoria, es decir, éstas normalmente desaparecen durante la continuación del tratamiento, en pocos días o pocas semanas.
Al inicio del tratamiento con insulina pueden ocurrir alteraciones de la refracción y edema; usualmente estas reacciones son de naturaleza transitoria. La mejoría rápida del control de la glucosa puede asociarse con neuropatía aguda dolorosa, la cual es reversible eventualmente. La intensificación de la terapia con insulina con mejoría abrupta del control glucémico puede asociarse con un agravamiento temporal de la retinopatía diabética, mientras que la mejoría a largo plazo del control glucémico disminuye el riesgo de progresión a retinopatía diabética.
b) Lista de reacciones adversas: Las reacciones adversas enlistadas a continuación se basan en los datos obtenidos en los estudios clínicos y están clasificadas de acuerdo a la frecuencia en el MedDRA y en las Clases de Sistemas de Órganos. Las categorías de frecuencia se definen de acuerdo con la siguiente convención: muy comunes (≥ 1/10); comunes (≥ 1/100 a < 1/10); poco comunes (≥ 1/1,000 a < 1/100); raros (≥ 1/10,000 a < 1/1,000); muy raros (< 1/10,000), desconocidos (no se puede estimar con la información disponible).
|
Trastornos del sistema inmune |
Poco comunes - reacciones alérgicas, reacciones potencialmente alérgicas, urticaria, exantema, erupciones* |
|
Muy raras - Reacciones anafilácticas* |
|
|
Trastornos del Metabolismo y la nutrición |
Muy comunes - Hipoglucemia* |
|
Trastornos del Sistema Nervioso |
Raros - Neuropatía periférica (neuropatía dolorosa) |
|
Trastornos Oculares |
Poco comunes: trastornos de la refracción |
|
Poco comunes - Retinopatía diabética |
|
|
Trastornos de la piel y el tejido subcutáneo |
Poco comunes - Lipodistrofia* |
|
Trastornos generales y condiciones en el sitio de administración |
Comunes - Reacciones en el sitio de inyección |
|
Poco comunes - Edema |
* Ver sección c.
c) Descripción de reacciones adversas seleccionadas:
Reacciones alérgicas, reacciones potencialmente alérgicas, urticaria, exantema, erupciones: Las reacciones alérgicas, reacciones potencialmente alérgicas, urticaria, exantema y erupciones son poco comunes cuando Levemir® es usado dentro de un régimen basal-bolo. Sin embargo, tres estudios clínicos mostraron una frecuencia común (se observó un 2.2% de reacciones alérgicas y reacciones potencialmente alérgicas) al ser usado en combinación con medicamentos antidiabéticos orales.
Reacciones anafilácticas: La ocurrencia de reacciones de hipersensibilidad generalizadas (que incluyen exantema cutáneo generalizado, prurito, sudor, molestias gastrointestinales, edema angioneurótico, dificultad para respirar, palpitaciones y reducción de la presión sanguínea) es muy rara, sin embargo, éstas pueden poner en riesgo la vida.
Hipoglucemia: La reacción adversa reportada más frecuentemente es la hipoglucemia. Puede presentarse si la dosis de insulina es muy alta en relación al requerimiento de insulina. La hipoglucemia severa puede llevar a pérdida de la conciencia y/o convulsiones y puede resultar en deterioro temporal o permanente de la función cerebral o incluso la muerte. Los síntomas de hipoglucemia usualmente ocurren de forma súbita. Pueden incluir sudor frío, palidez y frialdad de la piel, fatiga, nerviosismo o temblor, ansiedad, cansancio o debilidad inusuales, confusión, dificultad para concentrarse, mareo, hambre excesiva, alteraciones de la visión, cefalea, náuseas y palpitaciones.
Lipodistrofia: Puede ocurrir lipodistrofia (incluyendo lipo-hipertrofia, lipo-atrofia) en el sitio de inyección. La rotación continua del sitio de inyección dentro del área particular de inyección puede ayudar a reducir el desarrollo de estas reacciones.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Las pruebas in vitro en líneas de células humanas que investigaron la unión a los sitios receptores de insulina e IGF-I han mostrado que insulina detemir tiene una afinidad reducida para ambos receptores, así como un efecto reducido en el crecimiento celular, en comparación con la insulina humana.
Los datos preclínicos no revelaron un riesgo especial para los humanos, con base en los estudios convencionales de farmacología de la seguridad, toxicidad de dosis repetidas, genotoxicidad, potencial carcinogénico y toxicidad para la reproducción.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: Se sabe que ciertos medicamentos interaccionan con el metabolismo de la glucosa.
Las siguientes sustancias pueden reducir los requerimientos de insulina del paciente: Antidiabéticos orales, receptores agonistas GLP-1, inhibidores de la monoaminooxidasa (IMAO), beta bloqueadores, inhibidores de la enzima convertidora de la angiotensina (ECA), salicilatos, esteroides anabólicos y sulfonamidas.
Las siguientes sustancias pueden aumentar los requerimientos de insulina: Anticonceptivos orales, tiazidas, glucocorticoides, hormonas tiroideas, simpaticomiméticos, hormona del crecimiento y danazol.
Los agentes beta-bloqueadores pueden enmascarar los síntomas de hipoglucemia.
La octreotida/lanreotida puede tanto aumentar o reducir los requerimientos de insulina.
El alcohol puede intensificar o reducir el efecto hipoglucémico de la insulina.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
No se han observado hallazgos en los resultados de pruebas de laboratorio, en estudios clínicos donde se administró sólo Levemir®.
Se observó un incremento en los niveles de amilasa, lipasa y calcitonina, en un estudio clínico donde Levemir® se administró con liraglutida.
PRECAUCIONES GENERALES: Antes de viajar entre diferentes horarios el paciente debe buscar consejo médico, ya que esto podría implicar que tendrá que aplicarse la insulina y su comida a horarios diferentes.
Hiperglucemia: La dosificación inadecuada o la interrupción del tratamiento, especialmente en la diabetes tipo 1, puede ocasionar hiperglucemia y cetoacidosis diabética. Los primeros síntomas de la hiperglucemia generalmente aparecen de forma gradual, durante un periodo de horas o días. Estos síntomas incluyen sed, aumento de la frecuencia urinaria, náusea, vómito, somnolencia, piel seca enrojecida, sequedad de boca, pérdida de apetito así como aliento con olor a acetona. En pacientes con diabetes tipo 1, los eventos hiperglucémicos no tratados producen con el tiempo, cetoacidosis diabética, la cual es potencialmente letal.
Hipoglucemia: La omisión de una comida y el ejercicio físico intenso no previsto pueden producir hipoglucemia. En niños, debe tenerse precaución al sincronizar las dosis de insulina (especialmente en los regímenes basal-bolo) con la ingesta de comida y las actividades físicas para minimizar el riesgo de hipoglucemia.
Puede ocurrir una hipoglucemia si la dosis de insulina es demasiado alta en comparación con la dosis requerida. (Ver secciones Reacciones secundarias y adversas y Manifestaciones y manejo de la sobredosificación o ingesta accidental).
Los pacientes cuyo control glucémico mejora en gran medida, por ejemplo, por medio de la terapia insulínica intensiva, pueden experimentar un cambio en sus síntomas usuales de aviso de hipoglucemia, y deben ser advertidos de esta posibilidad. Los síntomas de aviso habituales pueden desaparecer en los pacientes con diabetes de larga duración.
Las enfermedades concomitantes, especialmente las infecciones y condiciones febriles, por regla general aumentan el requerimiento de insulina del paciente. Enfermedades concomitantes a nivel renal, hepático o que afecten a las glándulas adrenales, hipófisis o tiroides pueden requerir de modificaciones de la dosis de insulina.
Cambio de otro producto insulínico: El cambio de un paciente a otro tipo o marca de insulina se debe realizar bajo una estricta supervisión médica. Los cambios en la concentración, marca (fabricante), tipo, origen (insulina humana o análogo de insulina) y/o el método de fabricación pueden requerir un cambio en la dosis. Los pacientes que han cambiado otra insulina por Levemir® pueden necesitar un cambio en la dosis en comparación con la dosis utilizadas con sus insulinas habituales. Si es necesario un ajuste de la dosis, esto puede ocurrir con la primera dosis o durante las primeras semanas o meses.
Reacciones en el sitio de inyección: Al igual que con cualquier terapia con insulina, pueden ocurrir reacciones en el sitio de la inyección, las cuales incluyen dolor, enrojecimiento, urticaria, inflamación, moretones, y comezón. La rotación continua del sitio de la inyección dentro de un área determinada puede ayudar a reducir o prevenir estas reacciones. Las reacciones normalmente desaparecen en unos pocos días a unas pocas semanas. En raras ocasiones, las reacciones en el sitio de la inyección pueden requerir la interrupción de Levemir®.
Combinación de tiazolidinedionas con productos insulínico: Se han reportado casos de insuficiencia cardiaca con el uso combinado de tiazolidinedionas e insulina, especialmente en pacientes con factores de riesgo para el desarrollo de insuficiencia cardiaca congestiva. Debe tenerse esto en cuenta si se considera iniciar tratamiento combinado con tiazolidinedionas y medicamentos insulínicos. Si se usa la combinación, los pacientes deben ser monitoreados en búsqueda de signos y síntomas de insuficiencia cardiaca congestiva, aumento de peso y edema. Las tiazolidinedionas deben ser descontinuadas si ocurre algún signo de deterioro cardiaco.
Evitar mezclas accidentales/errores médicos:
Se debe instruir a los pacientes para que comprueben siempre la etiqueta de insulina antes de cada inyección para evitar mezclas accidentales entre Levemir y otros productos de insulina.
Efectos en la capacidad para conducir y utilizar máquinas: La capacidad de concentración y de reacción de los pacientes diabéticos puede verse afectada por una hipoglucemia. Esto puede ser causa de riesgo en situaciones que precisen estas habilidades (por ej., conducir automóviles o manejar maquinaria).
Debe advertirse a los pacientes que tomen las precauciones necesarias para evitar una hipoglucemia mientras conducen. Esto es particularmente importante en aquellos pacientes con capacidad reducida o nula para percibir los signos de advertencia de hipoglucemia, o que padecen episodios frecuentes de hipoglucemia. Se considerará la conveniencia de conducir en estas circunstancias.
Incompatibilidades: Las sustancias añadidas a Levemir® pueden causar degradación de insulina detemir, p.ej. si el medicamento contiene tioles o sulfitos. Levemir® no debe añadirse a los líquidos para infusión. Este medicamento no debe mezclarse con otros medicamentos.
DOSIS Y VÍA DE ADMINISTRACIÓN: Levemir® es un análogo de insulina basal soluble, con un perfil de duración prolongada del efecto (hasta 24 horas).
El menor riesgo de hipoglucemia nocturna comparado con insulina NPH permite un ajuste de dosis más intensivo hacia los niveles de glucosa en la sangre deseados para el tratamiento de bolo-basal.
El menor riesgo de hipoglucemia nocturna leve comparado con insulina NPH permite un ajuste de dosis más intensivo hacia los niveles de glucosa en la sangre deseados para los sujetos con tratamiento combinado de insulina una vez al día (OAD).
Levemir® puede ser utilizado solo como insulina basal o en combinación con insulina de bolo. También puede ser utilizada en combinación con medicamentos antidiabéticos orales y adicionándolo al tratamiento con terapia de liraglutida.
Levemir® puede ser usado sólo como la insulina basal o en combinación con bolo de insulina. También puede ser utilizado con antidiabéticos órales y/o receptores agonistas GLP-1.
Dosis: Cuando Levemir se usa en combinación con productos antidiabéticos orales o cuando se añade a agonistas del receptor de GLP-1 se recomienda usar Levemir® una vez al día, inicialmente en una dosis de 0.1-0.2 U/kg o de 10 U en pacientes adultos.
La inyección puede aplicarse a cualquier hora del día, pero a la misma hora todos los días. La dosis de Levemir® debe ajustarse con base en las necesidades individuales del paciente.
Cuando se añade un agonista del receptor de GLP-1 a Levemir, se recomienda reducir la dosis de Levemir en 20% para minimizar el riesgo de hipoglucemia. Posteriormente, la dosificación debe ajustarse individualmente.
Para los ajustes individuales de la dosis, se recomiendan las siguientes dos guías para adultos.
Guía de ajuste en Diabetes tipo 2 en adulto:
|
Promedio de glucosa plasmática en ayuno* |
Ajuste de Dosis de Levemir® |
|
> 10.0 mmol/L (180 mg/dL) |
+ 8 U |
|
9.1-10.0 mmol/L (163-180 mg/dL) |
+ 6 U |
|
8.1-9.0 mmol/L (145-162 mg/dL) |
+ 4 U |
|
7.1-8.0 mmol/L (127-144 mg/dL) |
+ 2 U |
|
6.1-7.0 mmol/L (109-126 mg/dL) |
+ 2 U |
|
4.1-6.0 mmol/L |
Sin cambio (objetivo) |
|
3.1-4.0 mmol/L (56-72 mg/dL) |
- 2 U |
|
< 3.1 mmol/L (< 56 mg/dL) |
- 4 U |
* Automedición de glucosa plasmática.
Guía simple de auto-ajuste en diabetes tipo 2 en adulto:
|
Valor medio de los SMPG previos al desayuno* |
Ajuste de dosis de Levemir® |
|
> 6.1 mmol/L (> 110 mg/dL) |
+3 U |
|
4.4 - 6.1 mmol/L (80-110 mg/dL) |
sin cambios (objetivo) |
|
< 4.4 mmol/L (< 80 mg/dL) |
-3 U |
* Autocontroles de la glucosa plasmática.
Cuando Levemir® se utiliza como parte de un régimen de insulina basal-bolo, Levemir® se debe administrar una o dos veces al día, dependiendo de las necesidades del paciente. La dosis de Levemir® se debe ajustar individualmente.
Para los pacientes que requieren dosificación dos veces al día para optimizar el control de glucosa en sangre, la dosis de la noche puede administrarse a la hora de dormir. Podría necesitarse un ajuste de la dosificación si el paciente se somete a un aumento en la actividad física, cambia su dieta regular o durante enfermedades concomitantes.
Poblaciones especiales: Como con todos los productos de insulina, en pacientes de edad avanzada y pacientes con insuficiencia renal o hepática, debe intensificarse el monitoreo de la glucosa y ajustarse la dosis de Levemir® de manera individual.
Población pediátrica:
Levemir puede usarse en adolescentes y niños desde la edad de 2 años (ver sección Propiedades Farmacodinámicas). Al cambiar de insulina basal a Levemir® es necesario considerar la reducción de la dosis de insulina basal y bolo de manera individual, para minimizar el riesgo de hipoglucemia (ver sección Precauciones generales).
No se ha establecido la segurida y eficacia de Levemir en niños menores de 2 años.
No hay datos disponibles.
Cambio desde otras insulinas: El cambio a Levemir® desde otras insulinas de acción intermedia o prolongada puede requerir un ajuste de la dosis y/o de la hora de administración (ver sección Precauciones generales).
Al igual que con otras insulinas, se recomienda un estricto control glucémico durante el cambio y las primeras semanas después del cambio.
El tratamiento antidiabético concomitante podría necesitar un ajuste de dosis y/o horario de los medicamentos antidiabéticos orales o productos de insulina de acción corta concurrente.
Método de Administración: Levemir® se administra únicamente por vía subcutánea. Levemir® no se debe de administrar vía intravenosa, ya que podría resultar en una hipoglucemia grave. También debe evitarse la administración intramuscular. No debe utilizarse Levemir® en bombas de infusión de insulina.
Levemir® se administra por vía subcutánea mediante inyección en la pared abdominal, en el muslo, parte superior del brazo, la región del deltoides o la región glútea. Siempre deben cambiarse los sitios de inyección dentro de la misma área, a fin de reducir el riesgo de lipodistrofia. Como con todos los productos de insulina, la duración de la acción varía de acuerdo con la dosis, sitio de inyección, flujo sanguíneo, temperatura y nivel de actividad física.
Levemir® Penfill® está diseñado para ser utilizado con sistemas de administración de Novo Nordisk y con agujas NovoFine®. Levemir® Penfill® viene acompañado con un instructivo de uso que debe seguirse durante su uso. Levemir® FlexPen® son plumas pre-cargadas, diseñadas para utilizarse con agujas desechables NovoFine® de hasta 8 mm de longitud. FlexPen® suministra de 1-60 unidades con incrementos de 1 unidad. Levemir® FlexPen® tiene un código de color y está acompañado de un instructivo detallado dentro del empaque que debe seguirse durante su uso.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: No es posible definir una sobre dosificación específica para las insulinas; sin embargo, se puede desarrollar hipoglucemia en fases secuenciales si el paciente recibe una dosis superior a sus requerimientos:
• Los episodios hipoglucémicos leves pueden tratarse con administración oral de glucosa o productos azucarados. Por consiguiente, se recomienda que los pacientes diabéticos lleven siempre productos que contienen azúcar.
• Los episodios hipoglucémicos severos con pérdida de la consciencia, pueden tratarse con inyección intramuscular o subcutánea de glucagon (0.5 a 1 mg) administrada por una persona entrenada, o bien glucosa por vía intravenosa administrada por un profesional médico. Además, se debe administrar glucosa intravenosa si el paciente no responde al glucagon dentro de 10 a 15 minutos. Se recomienda la administración de carbohidratos orales al paciente una vez recuperada la consciencia, a fin de prevenir una recaída.
PRESENTACIONES:
Levemir® cartuchos Penfill® 100 U/ml, solución (inyectable) en un cartucho.
Caja de cartón con 5 cartuchos de vidrio tipo I, e instructivo anexo.
Levemir® pluma precargada FlexPen® 100 U/mL, solución (inyectable) en una pluma precargada.
Caja de cartón con 1 ó 5 plumas precargada e instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Caducidad:
Antes de abrir: 30 meses.
Antes de abrir: Consérvese a temperatura de 2°C a 8°C (en un refrigerador) no cerca del congelador. No congelar. Durante el uso: Levemir® [Pen fill® ó FlexPen®] en uso o cuando se llevan de repuesto: El producto puede almacenarse hasta por 6 semanas.
Cartucho [Penfill®] en uso o cuando se llevan de repuesto: Conservar por debajo de 30°C. No refrigerar. No congelar.
Para proteger de la luz, mantener los cartuchos dentro de la caja de cartón externa.
Pluma Precargada [FlexPen®] en uso o cuando se llevan de repuesto: Conservar por debajo de 30°C. Puede almacenarse en refrigeración (2°C-8°C). No congelar.
Para proteger de la luz, mantener el capuchón en su lugar cuando Levemir® no se esté usando.
Debe proteger a Levemir® del calor excesivo y de la luz.
Consérvese la caja bien cerrada.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. No se administre si la solución no es transparente, si contiene partículas en suspensión o si el cierre ha sido violado. No se use en bombas de infusión de insulina. Su venta requiere receta médica. No se deje al alcance de los niños. Léase instructivo anexo.
Levemir® es para usar por una sola persona. Si Levemir® se ha congelado no debe utilizarse.
Los cartuchos están diseñados para ser usados con los dispositivos de administración de Novo Nordisk (dispositivos duraderos para uso repetido) y con agujas NovoFine®. Deben seguirse las instrucciones detalladas que acompañan al dispositivo de administración.
El cartucho no debe rellenarse.
El paciente debe ser advertido de desechar la aguja después de cada inyección.
Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx
Titular del Registro:
Novo Nordisk A/S
Novo Allé
2880 Bagsvaerd, Dinamarca
Representante Legal:
NOVO NORDISK MÉXICO, S. A. de C. V.
Homero 1500 Piso 3
Col. Polanco, C.P. 11560
Miguel Hidalgo, Ciudad de México, México
Reg. Núm. 372M2005, SSA IV
®Marca Registrada