
KLARICID I.V.
CLARITROMICINA
Solución inyectable
1 Vial(es) , 30 ml
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada frasco ámpula de SOLUCIÓN INYECTABLE contiene:
Lactobionato de claritromicina
equivalente a 500 mg
de claritromicina
La ampolleta con diluyente contiene:
Agua estéril de uso inyectable 10 mL
INDICACIONES TERAPÉUTICAS: KLARICID® IV está indicado para el tratamiento parenteral de las infecciones debidas a microorganismos sensibles, en pacientes con:
• Infecciones del tracto respiratorio superior e inferior o ambos, de moderadas a graves.
• Infecciones localizadas o diseminadas por micobacterias como Mycobacterium avium y Mycobacterium intracellulare o infecciones localizadas por Mycobacterium chelonae, fortuitum o kansasii.
• Infecciones cutáneas y de tejidos blandos.
FARMACOCINÉTICA Y FARMACODINAMIA: Se absorbe rápido; luego de su administración I.V., la claritromicina aparece en el torrente sanguíneo y se distribuye por todo el organismo. Su acumulación es poca o es impredecible y la disposición metabólica no cambió en ninguna especie después de la administración de dosis múltiples. Sus niveles tisulares, excepto en el sistema nervioso central, son varias veces mayores que los niveles circulantes. Las concentraciones mayores se encuentran en hígado y pulmones, donde la relación tejido plasma llega a 10 y 20, respectivamente. Su unión a proteínas plasmáticas llega a 70%.
La claritromicina y su metabolito 14-OH claritromicina se distribuyen en todos los líquidos y tejidos corporales. La claritromicina se biotransforma en el hígado a 14-OH-claritromicina, la cual es igual o 1-2 veces más activa que el precursor (excepto contra H. influenzae, contra el que es dos veces más activo); sus vidas medias son de 5 a 6 horas y de 3 a 4 horas, respectivamente. Ambos se eliminan por el riñón, principalmente.
KLARICID® IV en dosis de 75 a 500 mg en 100 mL puede infundirse durante 30 minutos, y en 500 a 1,000 mg en 250 mL en 60 minutos, y sus concentraciones máximas fueron para el precursor, de 1.25 µg/mL, luego de 75 mg/30 minutos, hasta 9.40 µg/mL, luego de 1,000 mg/60 minutos; para el metabolito, 0.21 µg/mL, luego de 125 mg/30 minutos, hasta 1.06 µg/mL, luego de 1,000 mg/60 minutos. La vida media del precursor fue de 21.1 horas (75 mg/30 minutos) a 4.5 horas (1,000 mg/60 minutos) y la del metabolito de 5.3 horas (250 mg/30 minutos) a 9.3 horas (1,000 mg/60 minutos).
Al parecer, tanto sus concentraciones plasmáticas y tisulares como su vida media en fase terminal son, dentro de cierto límite, dependientes de la dosis.
La claritromicina ejerce su acción bacteriana al unirse a la subunidad ribosomal 50S, inhibiendo la síntesis proteica en las bacterias sensibles.
La claritromicina ha demostrado poseer una excelente actividad in vitro frente a cepas estándar de bacterias y de aislados clínicos. Es muy potente frente a una amplia variedad de organismos aerobios y anaerobios gram positivos y gram negativos.
Además, la claritromicina posee una actividad excelente frente a Legionella pneumophila, Mycoplasma pneumoniae y Helicobacter (Campylobacter) pylori. El espectro antibacteriano de la claritromicina in vitro, es el siguiente:
|
Bacterias susceptibles |
Bacterias no susceptibles |
|
Streptococcus agalactiae |
Enterobacteriaceae |
|
Streptococcus pyogenes |
Pseudomonas (especie) |
|
Streptococcus viridans |
|
|
Streptococcus pneumoniae |
|
|
Haemophilus influenzae |
|
|
Haemophilus parainfluenzae |
|
|
Neisseria gonorrhoeae |
|
|
Listeria monocytogenes |
|
|
Legionella pneumophila |
|
|
Mycoplasma pneumoniae |
|
|
Helicobacter (Campylobacter) pylori |
|
|
Borrelia burgoderferi |
|
|
Clostridium perfringens |
|
|
Bacteroides melaninogenicus |
|
|
Peptococcus niger |
|
|
Campylobacter jejuni |
|
|
Chlamydia pneumoniae |
|
|
Chlamydia trachomatis |
|
|
Moraxella (Branhamella) catarrhalis |
|
|
Bordetella pertussis |
|
|
Staphylococcus aureus |
|
|
Propionibacterium acnes |
|
|
Mycobacterium avium |
|
|
Mycobacterium leprae |
|
|
Pasteurella multocida |
|
|
Mycobacterium kansasii |
|
|
Mycobacterium chelonae |
|
|
Mycobacterium fortuitum |
|
|
Mycobacterium intracellulare |
|
|
Treponema pallidum |
|
CONTRAINDICACIONES: La claritromicina está contraindicada en pacientes con hipersensibilidad conocida a la claritromicina, eritromicina, cualquier otro de los antibióticos macrólidos o cualquiera de sus excipientes.
La administración concomitante de claritromicina y cualquiera de los siguientes medicamentos está contraindicada: astemizol, cisaprida, pimozida, terfenadina ya que pueden generar prolongación del QT y arritmias cardiacas incluyendo taquicardia ventricular, fibrilación ventricular y torsade de pointes (ver Interacciones medicamentosas y de otro género). La administración concomitante de claritromicina y ergotamina o dehidroergotamina está contraindicado ya que puede resultar en toxicidad por ergot. También está contraindicada la administración concomitante de claritromicina con lovastatina o simvastatina (ver Interacciones medicamentosas y de otro género).
Claritromicina no deberá de administrarse a pacientes con historia de prolongación del QT o arritmia cardiaca ventricular incluyendo torsade de pointes (ver Precauciones generales e Interacciones medicamentosas y de otro género).
Claritromicina no debe administrarse de manera concomitante con inhibidores de la HMG-CoA reductasa (estatinas) que son metabolizados de manera extensa por CYP3A4 (lovastatina o simvastatina), debido al mayor riesgo de miopatía, incluyendo rabdomiólisis (ver Precauciones generales).
La colchicina está contraindicada en pacientes con daño renal o hepático que estén tomando glucoproteína-P o un inhibidor potente de CYP3A4.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: La seguridad de claritromicina para su uso durante el embarazo no ha sido establecida. Por lo tanto, su uso durante el embarazo no es aconsejable sin haber confrontado los beneficios contra los riesgos.
Lactancia: La seguridad del uso de claritromicina en quien alimenta con leche materna a los niños no ha sido establecida. La claritromicina se excreta a través de la leche materna.
REACCIONES SECUNDARIAS Y ADVERSAS:
Efectos en la habilidad para manejo y uso de maquinaria: No hay datos sobre el efecto de claritromicina en la habilidad para el manejo o uso de máquinas. La posibilidad de mareo, vértigo, confusión y desorientación, los cuales pueden ocurrir con el medicamento, deberán considerarse antes de que los pacientes manejen o usen maquinaria.
Las reacciones adversas más frecuentes relacionadas con el tratamiento de claritromicina, tanto en población adulta como pediátrica, son dolor abdominal, diarrea, náusea, vómito y alteración del sabor. Estas reacciones adversas generalmente son de intensidad leve y son consistentes con el perfil de seguridad de los macrólidos.
La tabla 1 muestra los efectos adversos reportados en pacientes tomando claritromicina en estudios clínicos y posmarketing. Las reacciones consideradas al menos posiblemente relacionadas con claritromicina son mostradas por órganos y sistemas usando la siguiente definición: muy común (> 1/10), común (> 1/100 a < 1/10), poco común (> 1/1,000 a < 1/100) y desconocida (reacciones adversas posmarketing; no pueden ser estimadas con los datos disponibles). En cada grupo, las reacciones adversas son presentadas en orden decreciente en magnitud cuando ésta puede ser evaluada.
Tabla 1. Eventos adversos reportados con claritromicina
|
Órgano o sistema |
Muy común ³ 1/10 |
Común ³ 1/100 a < 1/10 |
Poco común ³ 1/1,000 a < 1/100 |
Se desconoce* (no se puede estimar con los datos disponibles) |
|
Infecciones e infestaciones |
Celulitis,1 candidiasis, gastroenteritis,2 infección,3 infección vaginal |
Colitis pseudomembranosa, erisipelas, eritrasma. |
||
|
Sistema linfático y sanguíneo |
Leucopenia, neutropenia,4 trombocitopenia,3 eosinofilia4 |
Agranulocitosis, trombocitopenia. |
||
|
Enfermedades del sistema inmune |
Reacción anafilactoide,1 hipersensibilidad |
Reacción anafiláctica. |
||
|
Enfermedades del metabolismo y nutrición |
Anorexia, apetito disminuido |
Hipoglucemia. |
||
|
Enfermedades psiquiátricas |
Insomnio |
Ansiedad, nerviosismo,3 gritar3 |
Enfermedad psicótica, estado confusional, despersonalización, depresión, desorientación, alucinaciones, sueños anormales. |
|
|
Enfermedades del sistema nervioso |
Disgeusia, cefalea, alteración del sabor |
Pérdida de conciencia,1 discinesia,1 mareo, somnolencia,7 tremor |
Convulsión, ageusia, parosmia, anosmia, parestesia. |
|
|
Enfermedades del oído y laberinto |
Vértigo, audición alterada, tinnitus |
Sordera. |
||
|
Enfermedades cardiacas |
Paro cardiaco,1 fibrilación atrial,1 prolongación del QT en el electrocardiograma, extrasístoles,1 palpitaciones |
Torsade de pointes, taquicardia ventricular. |
||
|
Enfermedades vasculares |
Vasodilatación |
Hemorragia. |
||
|
Enfemedades mediastínicas, torácicas y respiratorias |
Asma,1 epistaxis,2 embolismo pulmonar1 |
|||
|
Enfermedades gastrointestinales |
Diarrea, vómito, dispepsia, náusea, dolor abdominal |
Esofagitis,1 enfermedad por reflujo gastroesofágico,2 gastritis, proctalgia,2 estomatitis, glositis, distensión abdominal,4 estreñimiento, boca seca, eructos, flatulencia |
Pancreatitis aguda, decoloración de lengua, decoloración de dientes. |
|
|
Enfermedades hepatobilares |
Pruebas de función hepática alteradas |
Colestasis,4 hepatitis,4 incremento de alanino aminotransferasa, incremento de aspartato aminotransferasa, incremento de gama glutamil transferasa4 |
Insuficiencia hepática, ictericia hepatocelular. |
|
|
Enfermedades de la piel y tejido subcutáneo |
Rash, hiperhidrosis |
Dermatitis bullosa1, prurito, urticaria, rash maculopapular3 |
Síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, rash medicamentoso con eosinofilia y síntomas sistémicos (DRESS), acné, púrpura de Henoch-Schönlein. |
|
|
Enfermedades del tejido conjuntivo y músculo-esqueléticas |
Espasmos musculares,3 rigidez musculoesquelética,1 mialgia2 |
Rabdomiólisis2, miopatía. |
||
|
Enfermedades renales y urinarias |
Incremento en la creatinina sérica,1 incremento en la urea sanguínea1 |
Falla renal, nefritis intersticial. |
||
|
Enfermedades generales y trastornos en el sitio de administración |
Flebitis en el sitio de inyección1 |
Dolor en el sitio de inyección1, inflamación en el sitio de inyección1 |
Malestar,4 pirexia,3 astenia, dolor en el pecho,4 escalofríos,4 fatiga4 |
|
|
Laboratorio |
Relación anormal albúmina: globulina,1 incremento en la fosfatasa alcalina sanguínea,4 incremento en la deshidrogenasa láctica sanguínea4 |
Incremento en el rango normalizado internacional (INR), prolongación del tiempo de protrombina, color anormal de la orina. |
* Debido a que estas reacciones son reportadas voluntariamente y derivadas de una población de tamaño incierto, no siempre es posible estimar su frecuencia o establecer una relación causal a la exposición del medicamento. Los pacientes expuestos se estima que sea mayor a 1 billón de días/tratamiento/paciente para claritromicina.
** En algunos de los reportes de rabdomiólisis, claritromicina se administró de forma concomitante con otros medicamentos que se sabe que están asociados con rabdomiólisis (tales como estatinas, fibratos, colchicina o alopurinol).
1. Reportados sólo con el polvo para solución y aplicación inyectable.
2. Reportados sólo con las tabletas de liberación prolongada.
3. Reportados sólo con los gránulos para la formulación de suspensión oral.
4. Reportados sólo con las tabletas de liberación inmediata.
Pacientes inmunodeprimidos: En pacientes con SIDA o cualquier inmunodepresión que son tratados con dosis más altas de claritromicina durante periodos prolongados, es difícil distinguir entre efectos adversos posiblemente asociados a claritromicina y los signos derivados de la enfermedad por el VIH o presencia de enfermedades concomitantes.
En adultos tratados con dosis de claritromicina de 1,000 mg, los efectos adversos reportados con mayor frecuencia fueron: náusea, vómito, alteraciones del sabor, dolor abdominal, diarrea, rash, flatulencia, dolor de cabeza, constipación, trastornos de la audición y elevaciones en TGO y TGP. Eventos adicionales menos frecuentes fueron: disnea, insomnio y boca seca.
En esos pacientes inmunodeprimidos, la evaluación de los estudios de laboratorio fue hecha analizando aquellos niveles altamente anormales (ej., extremo alto o bajo) para determinada prueba. Con base en este criterio, cerca de 2 a 3% de los pacientes que recibieron 1,000 mg de claritromicina diaria tuvieron niveles altamente anormales de TGO y TGP con niveles bajos de plaquetas y glóbulos blancos. Un porcentaje menor de pacientes tuvieron también elevación de BUN.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Se han hecho diversas pruebas de mutagenicidad in vitro con claritromicina con resultados negativos; además, la prueba de Ames resultó negativa a concentraciones de 25 µg/caja de Petri o menos.
Los estudios de teratogenicidad en animales (ratas) mostraron sólo anomalías cardiovasculares y retardo en el crecimiento fetal que parecen deberse a cambios genéticos espontáneos de la colonia.
Los estudios de fertilidad y reproducción en ratas machos y ratas hembras no causaron efectos adversos sobre el ciclo estrogénico, la fertilidad o el parto, ni el número o viabilidad de las crías.
En dos de los estudios realizados en ratones se encontró una incidencia variable de paladar hendido (3-30%) después de dosis 70 veces mayor de la dosis máxima diaria usada en humanos, que parece una acción tóxica sobre las madres y fetos, pero no teratogenicidad.
Administrada a monos 10 veces la dosis máxima diaria en humanos durante el inicio de la gestación hasta el día 20, se produjo pérdida de los embriones. Este efecto se atribuye a toxicidad de la droga sobre las hembras preñadas. Se realizó otro estudio similar en monas preñadas con dosis de 2.5 a 5 veces la dosis máxima diaria y no se produjo efecto nocivo.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: El uso de los siguientes medicamentos está estrictamente contraindicado debido a la posibilidad de efectos severos por interacción farmacológica.
Se han reportado niveles elevados de cisaprida en pacientes que reciben concomitantemente claritromicina y cisaprida, lo que resulta en prolongación del intervalo QT, arritmias cardiacas incluyendo taquicardia y fibrilación ventricular, y torsade de pointes. Efectos similares se han observado con el uso concomitante de pimozida.
Se ha informado que los macrólidos alteran el metabolismo de terfenadina, resultando niveles elevados de terfenadina, lo que ocasionalmente ha sido asociado con arritmias cardiacas como prolongación del intervalo QT, taquicardia y fibrilación ventricular, y torsade de pointes. En un estudio en que se usó concomitantemente claritromicina y terfenadina en 14 voluntarios sanos, los niveles séricos del metabolito ácido de terfenadina aumentaron dos a tres veces y hubo prolongación del intervalo QT que no condujo a ningún efecto clínico detectable. Similares efectos se han observado con el uso concomitante de astemizol y otros macrólidos.
Ergotamina/dihidroergotamina: Reportes posmercadeo indican que la coadministración con ergotamina o dihidroergotamina se ha asociado con toxicidad aguda por ergot, caracterizada por vasoespasmo e isquemia de extremidades y del sistema nervioso central. El uso concomitante de claritromicina y estos medicamentos está contraindicado.
Efectos de otros productos medicinales en claritromicina: Medicamentos que son inductores de CYP3A (por ejemplo, rifampicina, fenitoína, carbamazepina, fenobarbital, hierba de San Juan) pueden inducir el metabolismo de la claritromicina. Esto puede generar niveles subterapéuticos de claritromicina produciendo una reducción en su eficacia. Por ello, es necesario monitorizar los niveles plasmáticos del inductor CYP3A, los cuales podrían incrementarse por la inhibición de CYP3A por la claritromicina (ver también la información relevante sobre el producto del inhibidor del CYP3A4 administrado). La administración concomitante de rifabutina y claritromicina resultó en un incremento en los niveles séricos de rifabutina, y una disminución en los de claritromicina junto con un incremento en el riesgo de uveítis.
Efecto de otros medicamentos en claritromicina: Se conoce o se sospecha que los siguientes medicamentos pueden afectar las concentraciones circulantes de claritromicina. Pueden requerirse ajustes de dosis o puede ser necesario considerar alternativas de tratamiento.
Efavirenz, nevirapina, rifampicina, rifabutina y rifapentina: Efavirenz, nevirapina, rifampicina, rifabutina y rifapentina son fuertes inductores del sistema de metabolismo del citocromo P450 y pueden acelerar el metabolismo de la claritromicina disminuyendo sus niveles plasmáticos, mientras que incrementa los de 14 (R)hidroxi-claritromicina (14-OH claritromicina), un metabolito que es microbiológicamente activo. Debido a que las actividades antimicrobianas de claritromicina y 14-OH claritromicina son distintas para diferentes bacterias, el efecto terapéutico deseado puede alterarse durante la coadministración de claritromicina e inductores enzimáticos.
Etravirina: La exposición a claritromicina disminuyó por etravirina; sin embargo, se incrementaron las concentraciones del metabolito activo, 14-OH-claritromicina. Debido a que 14-OH-claritromicina tiene una actividad reducida contra el complejo Mycobacterium avium (MAC), en general la actividad contra este patógeno puede alterarse; por lo tanto se deberán considerar alternativas a claritromicina para el tratamiento de MAC.
Fluconazol: La administración concomitante de 200 mg al día de fluconazol y 500 mg dos veces al día de claritromicina a 21 voluntarios sanos generó un aumento en la Cmin y el ABC (área bajo la curva) de 33 y 18% respectivamente. Las concentraciones en el estado estable del metabolito activo 14-OH-claritromicina no fueron afectadas significativamente por la administración concomitante con fluconazol. No se requiere ajuste en la dosis de claritromicina.
Ritonavir: Un estudio de farmacocinética demostró que el uso concomitante de ritonavir 200 mg cada 8 horas y claritromicina 500 mg cada 12 horas generan una marcada inhibición del metabolismo de claritromicina. La Cmax de claritromicina aumenta 31%, la Cmin aumentó 182% y el ABC aumentó en 77% con la administración concomitante de ritonavir. Se notó una inhibición completa de la formación de 14 OH-claritromicina.
Debido a una amplia ventana terapéutica de claritromicina, no será necesaria una reducción de la dosis en pacientes con función renal normal; sin embargo, en pacientes con falla renal, se deberán considerar los siguientes ajustes de dosis: para pacientes con depuración de creatinina de 30 a 60 mL/min, la dosis de claritromicina deberá reducirse en 50%. Para pacientes con falla renal severa (depuración de creatinina < 30 mL/min), la dosis de claritromicina deberá reducirse en 75%. Dosis de claritromicina mayores a 1 g/día no deberán coadministrarse con ritonavir. Ajustes similares de dosis se deberán considerar en pacientes con función renal reducida cuando ritonavir es utilizado como potenciador farmacocinético con otros inhibidores de proteasa del VIH, incluyendo atazanavir y saquinavir (ver Interacciones medicamentosas y de otro género).
Efecto de claritromicina en otros medicamentos:
Antiarrítmicos: Hay reportes posmercadeo de torsade de pointes que ocurrieron con el uso concomitante de claritromicina y quinidina o disopiramida. Durante la coadministración de claritromicina con estos medicamentos se debe realizar un monitoreo con electrocardiogramas para detectar una prolongación del QTc. Los niveles séricos de estos medicamentos se deberán monitorizar durante el tratamiento con claritromicina.
Interacciones basadas en CYP3A: La coadministración de claritromicina, que se conoce inhibe CYP3A, y de un medicamento que es metabolizado por CYP3A puede asociarse a una elevación en las concentraciones de este último, lo que podría incrementar o prolongar los efectos adversos y terapéuticos del medicamento concomitante. La claritromicina deberá usarse con precaución en pacientes que reciben tratamiento con otros medicamentos que se conozca que sean sustratos de la enzima CYP3A, en especial si el sustrato tiene un margen estrecho de seguridad (por ejemplo, carbamazepina) y/o si el sustrato es extensamente metabolizado por esta enzima. Deberán considerarse los ajustes de la dosis y, cuando sea posible, se deberán monitorizar las concentraciones séricas de los medicamentos que se metabolizan por CYP3A cuando el paciente recibe de forma concomitante claritromicina.
Como con otros antibióticos macrólidos, el uso de claritromicina está contraindicado en pacientes que toman fármacos que son biotransformados por la isoenzima CYP3A: anticoagulantes orales (por ejemplo, warfarina), alcaloides del ergot, alprazolam, aztemizol, carbamazepina, cilostazol, cisaprida, metilprednisolona, omeprazol, pimozida, quinidina, sildenafil, simvastatina, tacrolimus, vinblastina, triazolam, terfenadina, midazolam, lovastatina, disopiramida, ciclosporina y rifabutina. Medicamentos que interactúan con mecanismos similares a través de otras isoenzimas dentro del citocromo P450 incluyen a fenitoína, teofilina y valproato.
Omeprazol: La claritromicina (500 mg cada 8 horas) fue utilizada en combinación con omeprazol (40 mg diarios) en adultos sanos. Las concentraciones plasmáticas estables de omeprazol se incrementaron (Cmax, ABC0-24 y la vida media aumentaron en 30, 89 y 34%, respectivamente) por el uso concomitante de claritromicina. El promedio en 24 horas del pH gástrico fue de 5.2 cuando el omeprazol se administraba solo, y de 5.7 cuando se coadministraba claritromicina.
Sildenafil, tadalafil y vardenafil: Cada uno de estos inhibidores de fosfodiesterasa es metabolizado en parte por CYP3A, la cual puede ser inhibida con el uso concomitante de claritromicina; esto generaría un aumento en la exposición a los inhibidores de fosfodiesterasa por lo que se deberá considerar una reducción en la dosis de estos medicamentos cuando son coadministrados con claritromicina.
Teofilina, carbamazepina: Resultados de estudios clínicos indican que existe un incremento modesto pero significativo (p £ 0.05) de los niveles circulantes de teofilina o carbamazepina cuando cualquiera de estos medicamentos se administra de forma concomitante con claritromicina.
Tolterodina: La ruta principal de metabolismo de tolterodina es vía la isoforma 2D6 del citocromo P450 (CYP2D6). Sin embargo, en un subgrupo de población desprovista de CYP2D6, la vía identificada de metabolismo es CYP3A. En este subgrupo, la inhibición de CYP3A resulta en un incremento significativo en los niveles séricos de tolterodina. Una reducción en la dosis de tolterodina puede ser necesaria en la presencia de inhibidores de CYP3A como claritromicina en aquella población con pobre metabolismo por la vía CYP2D6.
Triazolbenzodiazepinas (por ejemplo, alprazolam, midazolam, triazolam): Cuando el midazolam se coadministró con tabletas de claritromicina (500 mg dos veces al día), el ABC de midazolam aumentó 2.7 veces después de la administración de midazolam I.V. y 7 veces después de la administración oral. La administración oral concomitante de midazolam y claritromicina deberá evitarse. Si el midazolam por vía intravenosa se coadministra con claritromicina, se debe monitorizar estrechamente al paciente para permitir un ajuste de dosis.
Las mismas precauciones se aplican para otras benzodiazepinas que son metabolizadas por CYP3A incluyendo triazolam y alprazolam. Para las benzodiazepinas que no dependen para su eliminación de CYP3A (temazepam, nitrazepam, lorazepam), es poco factible una interacción clínica importante con la coadministración de claritromicina.
Ha habido reportes posmercadeo de interacciones farmacológicas y efectos en el sistema nervioso central (por ejemplo, somnolencia y confusión) con el uso concomitante de claritromicina y triazolam. Por el incremento de los efectos farmacológicos a nivel de sistema nervioso central, se sugiere una vigilancia del paciente.
Otras interacciones medicamentosas:
Colchicina: La colchicina es un sustrato para CYP3A y para el transportador de eflujo glucoproteína P (P-gp). Se sabe que la claritromicina y otros macrólidos inhiben CYP3A y P-gp. Cuando la claritromicina y colchicina se administran juntas, la inhibición de P-gp y/o CYP3A por claritromicina puede generar un aumento en la exposición a colchicina. Los pacientes deberán monitorizarse por síntomas clínicos de toxicidad con colchicina (ver Precauciones generales).
Digoxina: Se piensa que la digoxina es un sustrato para el transportador de eflujo, glucoproteína-P (P-gp). Se sabe que la claritromicina inhibe la P-gp. Cuando se administran juntas la claritromicina y la digoxina, la inhibición puede originar un incremento de exposición a digoxina; esta elevación también ha sido reportada en vigilancia posregistro. Algunos pacientes han mostrado signos consistentes con toxicidad por digoxina, incluyendo arritmias potencialmente fatales. La concentración sérica de digoxina debe monitorizarse estrechamente mientras los pacientes reciban de forma simultánea claritromicina y digoxina.
Zidovudina: En pacientes infectados con el VIH, las tabletas de claritromicina interfieren con la administración simultánea de zidovudina oral, disminuyendo su concentración en el estado estable ya que claritromicina parece interferir con la absorción de zidovudina, esta interacción puede evitarse mayormente si la claritromicina se administra por vía intravenosa. Esta interacción no parece ocurrir en pacientes pediátricos que toman claritromicina suspensión con zidovudina o didanosina.
Fenitoína y valproato: Hay reportes publicados o espontáneos de interacciones de inhibidores de CYP3A4, incluyendo claritromicina con medicamentos que no se pensaba fueran metabolizados por CYP3A4 (por ejemplo, fenitoína y valproato). Se recomienda medir niveles séricos de estos medicamentos cuando se administran de forma concomitante con claritromicina. Se han reportado incremento en los niveles séricos.
Interacciones farmacológicas bidireccionales:
Atazanavir: Tanto la claritromicina como el atazanavir son sustratos e inhibidores de CYP3A y hay evidencia de una interacción farmacológica bidireccional. La coadministración de claritromicina (500 mg dos veces al día) con atazanavir (400 mg una vez al día) resulta en un incremento de dos veces en la exposición a claritromicina y una disminución de 70% de exposición a 14-OH claritromicina con un incremento de 28% en el ABC de atazanavir. Debido a la amplia ventana terapéutica de claritromicina, no es necesaria una reducción en la dosis cuando el paciente tiene una función renal normal. Para pacientes con una función renal moderada (depuración de creatinina de 30 a 60 mL/min), la dosis de claritromicina deberá disminuirse en 50%. Para los pacientes con depuración de creatinina < 30 mL/min, la dosis de claritromicina deberá disminuirse en 75%, usando una formulación apropiada. Dosis de claritromicina mayores a 1000 mg por día no deberán coadministrarse con inhibidores de proteasa.
Itraconazol: La claritromicina y el itraconazol son sustratos e inhibidores de CYP3A originando una interacción farmacológica bidireccional. La claritromicina puede aumentar los niveles en plasma de itraconazol, mientras que el itraconazol puede aumentar los niveles en plasma de claritromicina. Los pacientes que toman itraconazol y claritromicina de forma concomitante deberán ser monitorizados estrechamente por la presencia de signos y síntomas de aumento o prolongación de efecto farmacológico.
Saquinavir: La claritromicina y el saquinavir son sustratos e inhibidores de CYP3A originando una interacción farmacológica bidireccional. La coadministración de claritromicina (500 mg dos veces al día) y saquinavir (cápsulas de gelatina blanda, 1200 mg tres veces al día) a 12 voluntarios sanos resultaron en valores de Cmax y ABC estables de saquinavir de 177 y 187% más altos que los vistos con solamente saquinavir. Los valores de Cmax y ABC de claritromicina fueron aproximadamente 40% más altos que los vistos con claritromicina sola. No se requiere un ajuste de la dosis cuando los dos medicamentos son coadministrados por un tiempo limitado y en las presentaciones/dosis estudiadas. Las observaciones de interacciones farmacológicas usando la presentación de gelatina blanda de saquinavir pueden no ser representativas de los efectos vistos usando la presentación de saquinavir de cápsula de gelatina dura. Las observaciones de los estudios de interacciones farmacológicas llevados a cabo con saquinavir sólo pueden ser no representativas de los efectos vistos con la terapia combinada de saquinavir/ritonavir. Cuando el saquinavir es coadministrado con ritonavir, se deberán considerar los efectos potenciales de ritonavir con claritromicina (ver Precauciones generales, Interacciones medicamentosas y de otro género).
Verapamilo: Se ha observado hipotensión, bradiarritmias y acidosis láctica en pacientes que están tomando claritromicina y verapamilo de forma concomitante.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Se encontraron algunos cambios leves en los valores de algunas pruebas de laboratorio hepáticas (aumento de transaminasas y bilirrubina total), leucocitos y aumento de creatinina en plasma.
PRECAUCIONES GENERALES: Dado que la claritromicina se excreta principalmente por el hígado, se debe tener precaución al administrar este antibiótico en pacientes con insuficiencia renal moderada a severa o insuficiencia hepática.
Se han reportado disfunción hepática, incluyendo el incremento en las enzimas hepáticas, y hepatitis colestásica y/o hepatocelular, con o sin ictericia, con el uso de claritromicina. Esta disfunción hepática puede ser severa y usualmente es reversible.
En algunas ocasiones, se ha reportado falla hepática con resultados fatales y generalmente se ha asociado con enfermedades subyacentes serias y/o medicamentos concomitantes. Se debe suspender de inmediato la claritromicina si ocurren signos y síntomas de hepatitis como anorexia, ictericia, orina oscura o abdomen sensible.
El uso de cualquier terapia antimicrobiana, como claritromicina, para tratar la infección por H. pylori puede seleccionar organismos resistentes al medicamento.
El uso a largo plazo puede, como con otros antibióticos, generar colonización con un aumento en el número de bacterias y hongos no susceptibles. Si ocurre una superinfección, se deberá aplicar la terapia apropiada.
La colitis pseudomembranosa se ha reportado con casi todos los agentes antibacterianos, incluidos los macrólidos, y puede variar en severidad, desde leve hasta grave.
La diarrea asociada a Clostridium difficile (DACD) se ha reportado con el uso de casi todos los antibióticos, incluyendo claritromicina y el cuadro puede ser de moderado hasta la presentación de colitis fatal. El tratamiento con antibacterianos altera la flora normal del colon, lo cual origina el sobrecrecimiento de C. difficile.
La DACD se debe considerar en todos los pacientes que se presentan con diarrea posterior al uso de antibióticos. Una historia médica minuciosa es necesaria debido a que la DACD se ha reportado dos meses después del uso de antibacterianos.
Se han reportado exacerbaciones de los síntomas de miastenia gravis en pacientes que reciben terapia con claritromicina.
Claritromicina se excreta principalmente por el hígado. Por lo tanto, deberá tenerse precaución cuando se utiliza en pacientes con alteración en la función hepática. También deberá tenerse precaución cuando se administra a pacientes con alteración renal moderada a severa.
Colchicina: Existen reportes posmercadeo de toxicidad por colchicina, especialmente en edad avanzada, algunos de los cuales ocurrieron en pacientes con insuficiencia renal. En algunos casos se han reportado fallecimientos en dichos pacientes (ver Interacciones medicamentosas y de otro género). La colchicina está contraindicada en pacientes con insuficiencia renal o hepática que están tomando glucoproteína P o un inhibidor potente de CYP3A4.
Se recomienda tener precaución con el uso concomitante de claritromicina y triazolbenzodiazepinas, como triazolam y midazolam (ver Interacciones medicamentosas y de otro género).
Debido al riesgo de prolongación del QT, la claritromicina deberá usarse con precaución en pacientes con un cuadro médico asociado con una tendencia incrementada a tener prolongación del QT y torsade de pointes.
Neumonía: Debido a la emergencia de resistencia de Streptococcus pneumoniae a los macrólidos, es importante la realización de pruebas de sensibilidad cuando se prescriba claritromicina para la neumonía adquirida en la comunidad. En la neumonía adquirida en el hospital, la claritromicina deberá usarse en combinación con antibióticos adicionales apropiados.
Infecciones de la piel y tejidos blandos de moderadas a severas: Estas infecciones son con mayor frecuencia causadas por Staphylococcus aureus y Streptococcus pyogenes, ambos pueden ser resistentes a los macrólidos. Por lo tanto, es importante realizar pruebas de sensibilidad. En casos en los que los antibióticos beta-lactámicos no puedan usarse (por ejemplo, alergia), otros antibióticos, como la clindamicina, pueden ser los medicamentos de primera elección. Actualmente, los macrólidos son solamente considerados en algunas infecciones de la piel y tejidos blandos, como aquellas causadas por Corynebacterium minutissimum (eritrasma), acne vulgaris, y erisipelas, así como situaciones en donde no se puede usar tratamiento con penicilina.
En casos donde se presenten reacciones de hipersensibilidad aguda como anafilaxis, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, DRESS y púrpura de Henoch-Schönlein, la terapia con claritromicina deberá suspenderse de inmediato y el tratamiento específico deberá iniciarse de forma urgente.
Claritromicina deberá usarse con precaución cuando se administra de forma conjunta con medicamentos que inducen la enzima del citocromo CYP3A4 (ver Interacciones medicamentosas y de otro género).
Se debe prestar atención a la posibilidad de resistencia cruzada entre claritromicina y otros macrólidos como la lincomicina y la clindamicina.
Hipoglucemiantes orales/insulina: El uso concomitante de claritromicina y agentes hipoglucemiantes orales y/o insulina puede resultar en hipoglucemia significativa. Con ciertos medicamentos hipoglucemiantes como nateglinida, pioglitazona, repaglinida y rosiglitazona, puede estar involucrada la inhibición de la enzima CYP3A por la claritromicina y podría causar hipoglucemia cuando su uso es concomitante. Se recomienda un monitoreo cuidadoso de la glucosa.
Anticoagulantes orales: Hay un riesgo de hemorragia seria y elevación significativa en el INR y tiempo de protrombina cuando la claritromicina se coadministra con warfarina. El INR y tiempo de protrombina deberán de monitorizarse con frecuencia mientras los pacientes estén recibiendo de forma concomitante claritromicina y anticoagulantes orales.
Inhibidores de HMG-CoA reductasa: El uso concomitante de claritromicina con lovastatina o simvastatina está contraindicado (ver Contraindicaciones) ya que estas estatinas son metabolizadas extensamente por CYP3A4 y el tratamiento concomitante con claritromicina aumenta su concentración en plasma, lo que incrementa el riesgo de miopatía, incluyendo rabdomiólisis. Se han reportado casos de rabdomiólisis en pacientes que toman estos medicamentos de forma concomitante. Si el tratamiento con claritromicina no puede evitarse, la terapia con lovastatina o simvastatina debe ser suspendida durante el curso del tratamiento.
Se debe tener precaución cuando se prescriba claritromicina con estatinas. Cuando el uso concomitante de claritromicina con estatinas no se pueda evitar, se recomienda prescribir la dosis más baja registrada de la estatina.
El uso de una estatina cuyo metabolismo no dependa de CYP3A (ej., fluvastatina) puede considerarse.
DOSIS Y VÍA DE ADMINISTRACIÓN: La vía intravenosa puede emplearse durante un máximo de 2 a 5 días en pacientes graves y deberá cambiarse a la vía oral en cuanto se observe la recuperación clínica.
Claritromicina I.V. no deberá administrarse en bolo ni por vía intramuscular.
Adultos mayores de 18 años de edad: La dosis recomendada de claritromicina I.V. es de 1 g/día, dividida en dos dosis iguales e infundidas durante un periodo de 60 minutos después de diluirlas en forma apropiada.
Niños: Actualmente no hay datos que soporten el uso de claritromicina I.V. para recomendar un régimen de dosificación de rutina en pacientes menores de 18 años.
Ancianos: Igual que en adultos.
Alteración renal: Se debe tener cuidado en pacientes con insuficiencia renal y depuración de creatinina < 30 mL/min, la dosis debe ser reducida a la mitad de la recomendada normalmente.
Instrucciones para preparar la solución: Preparar todas las soluciones utilizando técnicas asépticas.
1. Preparar la solución inicial de KLARICID® IV añadiendo sólo 10 mL de agua estéril para inyección al frasco ámpula de 500 mg. Cada mL contiene 50 mg de claritromicina. No utilizar otros diluyentes que contengan conservadores o sales inorgánicas ya que pueden precipitar la solución. Además, la solución resultante contiene un eficaz conservador antimicrobiano. El producto reconstituido deberá utilizarse dentro de las 24 a 48 horas siguientes, si la temperatura es de 25ºC (ambiente) o 5ºC, respectivamente.
2. Antes de administrar el producto reconstituido, a los 10 mL del paso 1 deberá añadirse 250 mL de uno de los siguientes diluyentes:
Dextrosa a 5%.
Dextrosa a 5% en cloruro de sodio a 0.3%.
Dextrosa a 5% en cloruro de sodio a 0.45%.
Normosol M en dextrosa a 5%.
Normosol R en dextrosa a 5%.
Cloruro de sodio a 0.9%.
Dextrosa a 5% en solución de Ringer lactato.
Solución de Ringer lactato.
Esto proporciona una solución con una concentración aproximada de 1.9 mg/mL.
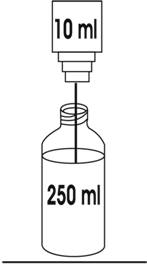
El producto final deberá utilizarse dentro de 6 horas, si se almacena a temperatura ambiente (25ºC), o en 48 horas si lo es a 5ºC.
No utilizar:
• Diluyentes que contengan conservadores.
• Diluyentes que contengan sales inorgánicas.
• Concentraciones de soluciones mayores de 2 mg/mL (0.2%).
• Velocidades elevadas de infusión.
• Si estas precauciones no se respetan, puede aparecer dolor a lo largo de la vena.
No deberán añadirse a la solución final otros fármacos o agentes químicos, a menos que se haya determinado, antes, su efecto sobre la estabilidad física y química de la solución.
A la fecha no se han realizado estudios clínicos relevantes respecto a la compatibilidad física de claritromicina con otras mezclas intravenosas.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
En caso de intoxicación con claritromicina I.V., lo primero es descontinuar su administración.
Puede esperarse que se intensifiquen los efectos adversos mencionados y que aparezcan alteraciones del estado mental, conducta paranoide, hipocaliemia e hipoxemia, como ocurrió en un paciente con trastorno bipolar que ingirió 8 g de claritromicina.
Si hay reacciones alérgicas, se debe promover la eliminación del medicamento no absorbido (si se usó la vía oral) y proporcionar medidas generales del tratamiento de las intoxicaciones. Además, no se promueve su eliminación de manera importante por la hemodiálisis ni por la diálisis peritoneal.
PRESENTACIÓN:
Claritromicina I.V.: Viales de cristal transparente de 30 mL, que contienen el polvo liofilizado, y una ampolleta con 10 mL de diluyente.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a temperatura ambiente, a no más de 30°C. Protéjase de la luz.
LEYENDAS DE PROTECCIÓN:
No se deje al alcance de los niños. No se use durante el embarazo y la lactancia. Su venta requiere receta médica. Literatura exclusiva para médicos.
ABBOTT LABORATORIES DE MÉXICO, S. A. de C. V.
Calz. De Tlalpan No. 3092
Col. Ex Hacienda Coapa, C.P. 04980
Deleg. Coyoacán, Ciudad de México
Reg. Núm. 239M94, SSA IV
123300415D0342