
IMPLANON NXT
ETONOGESTREL
Implante subdérmico
1 Caja, 1 Implante, 68 mg
III. FORMA FARMACÉUTICA Y FORMULACIÓN
Cada IMPLANTE contiene:
Etonogestrel 68 mg
Excipiente cbp 1 implante
Contiene Sulfato de Bario 3%.
XIX. NÚMERO DE REGISTRO DEL MEDICAMENTO ANTE LA SECRETARÍA
Reg. No. 321M2000 SSA IV
Versión: S-CCDS-OG8415-IPTx-022022, 042022
RCN: 000001081-MX, 000001405
IV. INDICACIONES TERAPÉUTICAS
Anticonceptivo hormonal
V. FARMACOCINÉTICA Y FARMACODINAMIA
IMPLANON NXT es un implante radiopaco, no biodegradable, solo de progestágeno, flexible, precargado en un aplicador estéril y desechable.
Cada implante radiopaco contiene 68 mg de etonogestrel; la tasa de liberación es de aproximadamente 60-70 μg/día en la semana 5-6, y ha disminuido a aproximadamente 35-45 μg/día para el final del primer año, a aproximadamente 30-40 μg/día para el final del segundo año, y a aproximadamente 25-30 μg/día para el final del tercer año. El aplicador está diseñado para operarse con una mano y ayudar a facilitar la correcta inserción subcutánea del implante.
Propiedades farmacocinéticas
Absorción:
Después de la inserción del implante, el etonogestrel es rápidamente absorbido hacia la circulación. Concentraciones inhibidoras de la ovulación se alcanzan dentro de 1 día. Las concentraciones séricas máximas (entre 472 a 1,270 pg/mL) se alcanzan dentro de 1 a 13 días. La tasa de liberación del implante disminuye con el tiempo. Como resultado, las concentraciones séricas declinan rápidamente durante los primeros meses. Para el final del primer año, se mide una concentración promedio de aproximadamente 200 pg/mL (rango 150-261 pg/mL), la cual disminuye lentamente a 156 pg/mL (rango 111-202 pg/mL) para el final el tercer año. Las variaciones observadas en las concentraciones séricas pueden atribuirse parcialmente a diferencias en el peso corporal.
Distribución:
Etonogestrel se une a proteínas séricas en un 95.5-99%, predominantemente a la albúmina y en menor grado a la globulina transportadora de hormonas sexuales. El volumen de distribución central y total es de 27 L y 220 L, respectivamente, y difícilmente cambia durante el uso de IMPLANON NXT.
Metabolismo:
El etonogestrel sufre hidroxilación y reducción. Los metabolitos se conjugan a sulfatos y glucurónidos. Los estudios en animales muestran que la circulación enterohepática probablemente no contribuye a la actividad progestagénica del etonogestrel.
Eliminación:
Después de la administración intravenosa de etonogestrel, la vida media de eliminación promedio es de aproximadamente 25 horas y la depuración sérica es de aproximadamente 7.5 L/hora. Tanto la depuración como la vida media de eliminación permanecen constantes durante el período de tratamiento. La excreción de etonogestrel y sus metabolitos, ya sea como esteroides libres o conjugados, es en la orina y en las heces (relación 1.5:1). Después de la inserción a mujeres lactantes, etonogestrel es excretado en la leche materna con una relación leche/suero de 0.44-0.50 durante los primeros cuatro meses. En mujeres lactantes, la transferencia promedio de etonogestrel al lactante es de aproximadamente 0.2% de la dosis materna diaria absoluta estimada de etonogestrel (2.2 % cuando los valores se normalizan por kg de peso corporal). Las concentraciones muestran una disminución gradual y estadísticamente significativa con el tiempo.
Propiedades farmacodinámicas
(Grupo farmacoterapéutico: progestágenos, clasificación ATC: G03AC08)
IMPLANON NXT es un implante no biodegradable, radiopaco, que contiene etonogestrel, para uso subcutáneo, precargado en un aplicador estéril y desechable. Etonogestrel es el metabolito biológicamente activo de desogestrel, un progestágeno ampliamente utilizado en los anticonceptivos orales (OCs, por las siglas en inglés para oral contraceptives). Se deriva Estructuralmente de la 19-nortestosterona y se une con una alta afinidad a los receptores de progesterona en los órganos blanco. El efecto anticonceptivo de etonogestrel se consigue principalmente mediante inhibición de la ovulación. No se observaron ovulaciones en los primeros dos años de uso del implante y solo rara vez durante el tercer año. Además de la inhibición de la ovulación, etonogestrel también causa cambios en el moco cervical, lo cual dificulta el paso de los espermatozoides. Se realizaron estudios clínicos en mujeres de 18 a 40 años de edad. Aunque no se realizó una comparación directa, la eficacia anticonceptiva pareció al menos comparable a la conocida para los OCs combinados (más de 99%). El alto grado de protección contra el embarazo se obtiene, entre otras razones, porque la acción anticonceptiva de IMPLANON NXT no es dependiente de la adherencia de la mujer a un régimen diario, semanal o mensual. La acción anticonceptiva de etonogestrel es reversible, lo que es aparente por el rápido retorno del ciclo menstrual normal después de la extracción del implante. Aunque el etonogestrel inhibe la ovulación, la actividad ovárica no se suprime completamente. Las concentraciones promedio de estradiol permanecen por arriba del nivel observado en la fase folicular temprana. En un estudio de dos años, en el cual se comparó la densidad mineral ósea en 44 usuarias con la de un grupo control de 29 usuarias de dispositivo intrauterino (DIU o IUD por las siglas en inglés para Intrauterine Device), no se observaron efectos adversos en la masa ósea. No se han observado efectos clínicos relevantes en el metabolismo de lípidos. El uso de anticonceptivos que contienen progestágenos puede tener un efecto sobre la resistencia a la insulina y la tolerancia a la glucosa. Estudios clínicos indican adicionalmente que las usuarias de IMPLANON NXT frecuentemente tienen un sangrado menstrual menos doloroso (dismenorrea).
VI. CONTRAINDICACIONES
Los anticonceptivos que contienen solo progestágenos no deben utilizarse en ninguna de las circunstancias mencionadas a continuación. La primera vez que se produzca alguna de estas situaciones durante el uso de IMPLANON NXT, deberá suspenderse el uso del producto de inmediato.
• Embarazo conocido o sospecha de embarazo.
• Trastorno tromboembólico venoso activo.
• Tumores malignos que se sabe o se sospecha que sean sensibles a los esteroides sexuales.
• Presencia o antecedentes de tumores hepáticos (benignos o malignos).
• Presencia o antecedentes de enfermedad hepática grave siempre y cuando los valores de la función hepática no hayan regresado al nivel normal.
• Sangrado vaginal no diagnosticado.
• Hipersensibilidad al fármaco o a cualquiera de los excipientes de la fórmula.
VII. PRECAUCIONES GENERALES
Si cualquiera de las condiciones/factores de riesgo mencionados a continuación está presente, deben evaluarse los beneficios del uso del progestágeno frente a los posibles riesgos para cada mujer individual y discutir con ella antes de que la mujer decida iniciar con IMPLANON NXT. En caso de agravamiento, exacerbación o primera aparición de cualquiera de estas condiciones, la mujer debe contactar a su médico. El médico debe entonces decidir si se descontinúa el uso de IMPLANON NXT.
Cáncer de Mama
• El riesgo de cáncer de mama incrementa con la edad. Durante el uso de anticonceptivos orales (OCs) combinados, el riesgo de un diagnóstico de cáncer de mama incrementa ligeramente. Este incremento en el riesgo desaparece gradualmente dentro de los 10 años después de la descontinuación del OC y no se relaciona con la duración del uso, sino con la edad de la mujer cuando utiliza el OC. Se ha calculado que el número esperado de casos diagnosticados por cada 10,000 mujeres que utilizan OCs combinados (hasta 10 años después de suspenderlos) con relación a las que nunca han sido usuarias durante el mismo período para los grupos de edad respectivos es: 4.5/4 (16-19 años), 17.5/16 (20-24 años), 48.7/44 (25-29 años), 110/100 (30-34 años), 180/160 (35-39 años) y 260/230 (40-44 años). El riesgo en usuarias de métodos anticonceptivos, que contienen solo progestágenos es posiblemente de una magnitud similar a la asociada con OCs combinados. Sin embargo, para estos métodos, la evidencia es menos concluyente. En comparación con el riesgo de tener cáncer de mama alguna vez en la vida, el incremento en el riesgo asociado a los OCs es bajo. Los casos de cáncer de mama diagnosticados en las usuarias de OCs tienden a ser menos avanzados que en aquellas que no han utilizado OCs. El aumento en el riesgo observado en usuarias de OC puede deberse a un diagnóstico más temprano, efectos biológicos del OCs o una combinación de ambos.
Hepatopatía
• Cuando ocurran trastornos agudos o crónicos de la función hepática, la mujer debe referirse a un especialista para examen y consejo médico.
Eventos Vasculares Trombóticos y Otros
• Investigaciones epidemiológicas han asociado el uso de OCs combinados con un incremento en la incidencia de tromboembolismo venoso (VTE [por las siglas en inglés para venous thromboemblosim], trombosis venosa profunda y embolia pulmonar). Aunque se desconoce la relevancia clínica de este hallazgo para etonogestrel (el metabolito biológicamente activo de desogestrel) utilizado como un anticonceptivo en ausencia de un componente estrogénico, debe extraerse el implante en caso de confirmarse una trombosis. También debe considerarse la extracción del implante en caso de inmovilización de largo plazo debida a cirugía o enfermedad. Aunque IMPLANON NXT es un anticonceptivo que contiene solo progestágeno, se recomienda evaluar los factores de riesgo que se sabe incrementan el riesgo de tromboembolismo venoso y arterial. Debe concientizarse a las mujeres con antecedentes de trastornos tromboembólicos de la posibilidad de una recurrencia.
• Ha habido reportes posteriores a la comercialización de eventos tromboembólicos venosos y arteriales graves, incluyendo casos de embolia pulmonar (algunas veces fatales), trombosis venosa profunda, infarto al miocardio y apoplejía, en mujeres que utilizaban implantes de etonogestrel. IMPLANON NXT debe extraerse en el caso de una trombosis.
Hipertensión Arterial
• Si se desarrolla hipertensión sostenida durante el uso de IMPLANON NXT , o si un incremento importante en la presión arterial no responde adecuadamente a tratamiento antihipertensivo, debe extraerse IMPLANON NXT.
Efectos Metabólicos en Lípidos y Carbohidratos
• Aunque los progestágenos pueden tener un efecto sobre la resistencia periférica a la insulina y la tolerancia a la glucosa, no hay evidencia de una necesidad de alterar el régimen terapéutico en mujeres diabéticas que utilizan anticonceptivos que contienen solo progestágeno. Sin embargo, la mujer diabética debe observarse cuidadosamente mientras esté utilizando anticonceptivos que contienen solo progestágeno.
• Las mujeres que estén siendo tratadas por hiperlipidemia deben vigilarse estrechamente si ellas eligen utilizar IMPLANON NXT. Algunos progestágenos pueden elevar los niveles de LDL y pueden hacer que el control de la hiperlipidemia sea más difícil.
Cloasma
• Puede ocurrir ocasionalmente cloasma, especialmente en mujeres con antecedentes de cloasma gravídico. Las mujeres con tendencia al cloasma deben evitar la exposición al sol o a la radiación ultravioleta mientras utilizan IMPLANON NXT.
Peso Corporal
• El efecto anticonceptivo de IMPLANON NXT se relaciona con los niveles plasmáticos de etonogestrel, los cuales están inversamente relacionados con el peso corporal y disminuye con el tiempo después de la inserción. La experiencia clínica en mujeres con mayor peso en el tercer año de uso es limitada. Por lo tanto, no puede excluirse que el efecto anticonceptivo en estas mujeres durante el tercer año de uso pueda ser menor que para las mujeres de peso normal. Por lo tanto, los médicos pueden considerar un reemplazo más temprano del implante en mujeres con mayor peso.
Complicaciones de la Inserción
• Puede ocurrir una expulsión, especialmente si el implante no es insertado de acuerdo con las instrucciones provistas (ver DOSIS Y VÍA DE ADMINISTRACIÓN, ¿Cómo insertar IMPLANON NXT?), o como consecuencia de una inflamación local.
• Ha habido reportes de migración del implante dentro del brazo desde el sitio de inserción, lo que puede estar relacionado ya sea a una inserción profunda (ver DOSIS Y VÍA DE ADMINISTRACIÓN, ¿Cómo insertar IMPLANON NXT?) o a fuerzas externas (p. ej., manipulación del implante o deportes de contacto). También ha habido reportes raros posteriores a la comercialización de implantes localizados dentro de los vasos del brazo y en la arteria pulmonar, lo que puede relacionarse a inserciones profundas o inserción intravascular. En casos donde el implante ha migrado dentro del brazo desde el sitio de inserción, la localización puede ser más difícil y la extracción puede requerir un procedimiento quirúrgico menor con una incisión más grande o un procedimiento quirúrgico en un quirófano. En casos en el que el implante ha migrado a la arteria pulmonar, pueden ser necesarios procedimientos endovasculares o quirúrgicos para extraerlo (ver DOSIS Y VÍA DE ADMINISTRACIÓN, ¿Cómo extraer IMPLANON NXT?). Si en cualquier momento el implante no puede palparse, debe localizarse y se recomienda extraerlo. Si el implante no es extraído, la anticoncepción y el riesgo de efectos indeseables relacionados con los progestágenos pueden continuar más allá del tiempo deseado por que la mujer desea.
Quistes Ováricos
• Con todos los anticonceptivos hormonales de dosis baja, puede ocurrir desarrollo folicular y ocasionalmente el folículo puede continuar creciendo más allá del tamaño que alcanzaría en un ciclo normal. Generalmente, estos folículos crecidos desaparecen espontáneamente. A menudo, son asintomáticos; en algunos casos se asocian a dolor abdominal leve. Rara vez requieren intervención quirúrgica.
Embarazos Ectópicos
• La protección con anticonceptivos tradicionales que contienen solo progestágeno contra embarazos ectópicos no es tan buena como con los OCs combinados, lo que se ha asociado con una ocurrencia frecuente de ovulaciones durante el uso de estos métodos. A pesar del hecho de que IMPLANON NXT inhibirá consistentemente la ovulación, debe tenerse en cuenta un embarazo ectópico en el diagnóstico diferencial si la mujer tiene amenorrea o dolor abdominal.
Otras Condiciones
• Se han reportado las siguientes condiciones tanto durante el embarazo, como durante el uso de esteroides sexuales, pero no se ha establecido una asociación con el uso de progestágenos: ictericia y/o prurito relacionado con colestasis; formación de cálculos biliares; porfiria; lupus eritematoso sistémico; síndrome urémico hemolítico; corea de Sydenham, herpes gestacional; hipoacusia relacionada con otosclerosis y angioedema (hereditario).
Examen/consulta médica
Antes del inicio o reinicio de IMPLANON NXT, debe hacerse una historia clínica completa (incluyendo antecedentes médicos familiares), y excluirse el embarazo. Debe medirse la presión arterial y realizarse un examen físico, guiado por las contraindicaciones (ver CONTRAINDICACIONES) y las precauciones (ver PRECAUCIONES GENERALES). Es recomendable que la mujer regrese para un chequeo médico tres meses después de la inserción de IMPLANON NXT. Durante este chequeo, debe medirse la presión arterial y debe indagarse después de cualquier pregunta, queja o la ocurrencia de efectos indeseables. La frecuencia y naturaleza de chequeos periódicos adicionales debe adaptarse a cada mujer individualmente, guiado por el criterio clínico.
Debe advertirse a las mujeres que IMPLANON NXT no protege contra el virus de inmunodeficiencia humana (VIH o HIV por las siglas en inglés para Human Immunodeficiency Virus) (SIDA o AIDS por las siglas en inglés para Acquired Immunodeficiency Syndrome) y otras enfermedades de transmisión sexual.
Reducción de la eficacia con medicamentos concomitantes
La eficacia de IMPLANON NXT puede verse reducida cuando se utilizan medicamentos concomitantes que disminuyen la concentración plasmática de etonogestrel (ver INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO).
Cambios en el patrón de sangrado menstrual
Durante el uso de IMPLANON NXT, es probable que las mujeres tengan cambios en su patrón de sangrado menstrual. Estos pueden incluir cambios en la frecuencia del sangrado (ausente, menos frecuente, más frecuente o continuo), intensidad (reducción o incremento) o duración. Se reportó amenorrea en alrededor de 1 de cada 5 mujeres, también se reportó sangrado frecuente y/o prolongado en 1 de cada 5 mujeres. La dismenorrea tendió a mejorar con el uso de IMPLANON NXT. El patrón de sangrado experimentado durante los primeros tres meses predice ampliamente los patrones de sangrado futuros para muchas mujeres. Información, asesoría y el uso de un diario de sangrado pueden mejorar la aceptación de la mujer de un patrón de sangrado. La evaluación del sangrado vaginal debe realizarse de acuerdo con las necesidades de cada caso y puede incluir un examen para excluir patología ginecológica o embarazo.
Implante roto o doblado
Ha habido reportes de implantes rotos o doblados, lo cual puede relacionarse a fuerzas externas (p. ej., manipulación del implante o deportes de contacto) mientras se encuentran en el brazo de la mujer. También ha habido reportes de migración de un fragmento de un implante roto dentro del brazo. Con base en información in vitro, cuando el implante esté roto o doblado, la tasa de liberación de etonogestrel puede incrementar ligeramente. No se espera que este cambio tenga efectos clínicamente significativos.
Cuando se extraiga un implante, es importante extraerlo en su totalidad (ver DOSIS Y VÍA DE ADMINISTRACIÓN, ¿Cómo extraer IMPLANON NXT?).
Efectos sobre la habilidad para conducir y utilizar maquinarias
No se han observado efectos adversos.
VIII. RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA
Embarazo
No se recomienda el uso de IMPLANON NXT durante la gestación. Si ocurre el embarazo durante el uso de IMPLANON NXT, el implante debe extraerse. Los estudios en animales han mostrado que dosis muy altas de sustancias progestágenicas pueden causar la masculinización de fetos hembra. Estudios epidemiológicos extensos no han revelado un incremento en el riesgo de defectos congénitos en niños nacidos de mujeres que utilizaron OCs antes del embarazo, ni efecto teratogénico cuando los OCs fueron utilizados inadvertidamente durante el embarazo. Aunque esto probablemente aplica para todos los OCs, no está claro si también es el caso para IMPLANON NXT.
La información de farmacovigilancia con varios productos que contienen etonogestrel y desogestrel (etonogestrel es un metabolito de desogestrel) no indica un aumento en el riesgo.
Lactancia
La información clínica indica que IMPLANON NXT no tiene influencia sobre la producción o la calidad (concentraciones de proteína, lactosa o grasa) de la leche materna. Sin embargo, pequeñas cantidades de etonogestrel son excretadas en la leche materna. Con base en una ingesta diaria promedio de leche de 150 mL/kg, la dosis promedio diaria de etonogestrel en el lactante, calculada después de un mes de liberación de etonogestrel, es de aproximadamente 27 ng/kg/día. Esto corresponde a aproximadamente 2.2% de la dosis diaria materna ajustada al peso y a aproximadamente 0.2% de la dosis diaria materna absoluta estimada. Subsecuentemente, la concentración de etonogestrel en la leche disminuye con el tiempo durante el período de lactancia.
Existe información de largo plazo disponible de 38 niños, cuyas madres comenzaron a utilizar un implante durante la 4ª a la 8ª semana postparto. Ellos fueron amamantados por una duración promedio de 14 meses y monitoreados hasta los 36 meses de edad. La evaluación del crecimiento y del desarrollo físico y psicomotriz no indicó diferencia alguna en comparación con los lactantes amamantados cuyas madres utilizaron un DIU (n=33). Sin embargo, debe seguirse cuidadosamente el desarrollo y crecimiento del niño. Con base en la información disponible, IMPLANON NXT puede utilizarse durante la lactancia y debe insertarse después de la 4ª semana postparto.
IX. REACCIONES SECUNDARIAS Y ADVERSAS
Durante el uso de IMPLANON NXT, es probable que las mujeres tengan cambios en su patrón de sangrado menstrual. Estos pueden incluir cambio en la frecuencia de sangrado (ausente, menos frecuente, más frecuente o continuo), intensidad (reducción o incremento) o duración. Se reportó amenorrea en alrededor de 1 de cada 5 mujeres, también se reportó sangrado frecuente y/o prolongado en 1 de cada 5 mujeres. Ocasionalmente, se ha reportado sangrado abundante. En estudios clínicos, los cambios en el sangrado fueron el motivo más común para suspender el tratamiento (alrededor de 11%). La dismenorrea tendió a mejorar durante el uso de IMPLANON NXT. El patrón de sangrado experimentado durante los primeros tres meses es ampliamente predictivo de patrones de sangrado futuros para muchas mujeres.
En la Tabla a continuación se han listado los efectos indeseables posiblemente relacionados reportados en estudios clínicos.
|
Clasificación por órganos y sistemas |
Reacción Adversa en Términos MedDRA1 |
||
|
Muy común > 1/10 |
Común < 1/10 ≥ 1/100 |
Poco común <1/100 ≥ 1/1,000 |
|
|
Infecciones e infestaciones |
Infección vaginal |
Faringitis; rinitis; infección de vías urinarias |
|
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
||
|
Trastornos metabólicos y nutricionales |
Incremento del apetito |
||
|
Trastornos psiquiátricos |
Labilidad emocional; estado de ánimo deprimido, nerviosismo, disminución de la libido |
Ansiedad; insomnio |
|
|
Trastornos del sistema nervioso |
Cefalea |
Mareo |
Migraña; somnolencia |
|
Trastornos vasculares |
Bochorno |
||
|
Trastornos gastrointestinales |
Dolor abdominal; náusea; flatulencia |
Vómito; estreñimiento; diarrea |
|
|
Trastornos de la piel y tejido subcutáneo |
Acné |
Alopecia |
Hipertricosis, erupción cutánea; prurito |
|
Trastornos Musculoesqueléticos y del tejido conectivo |
Lumbalgia; artralgia; mialgia; dolor musculoesquelético |
||
|
Trastornos renales y urinarios |
Disuria |
||
|
Trastornos del sistema reproductivo y mamarios |
Sensibilidad y dolor en las mamas; menstruación irregular |
Dismenorrea; quistes ováricos |
Secreción genital; malestar vulvovaginal; galactorrea; hipertrofia mamaria; prurito genital |
|
Trastornos generales y condiciones en el sitio de administración |
Dolor en el sitio del implante; reacción en el sitio del implante; fatiga; enfermedad influenza; dolor |
Pirexia; edema |
|
|
Exploraciones Complementarias |
Incremento de peso |
Disminución de peso |
|
1 Se lista el término MedDRA (versión 10.1) más apropiado para describir una reacción adversa determinada. En esta lista no hay sinónimos o condiciones relacionadas, pero también deben tenerse en cuenta.
En un estudio clínico de IMPLANON NXT, en el que se pidió a los investigadores examinar el sitio del implante después de la inserción, se reportaron reacciones en el sitio del implante en el 8.6% de las mujeres . El eritema cutáneo fue la complicación más frecuente en el sitio de implante, reportada durante y/o poco tiempo después de la inserción y ocurrió en 3.3% de las mujeres. Adicionalmente, se reportaron hematoma (3.0%), equimosis (2.0%), dolor (1.0%) y tumefacción (0.7%).
Durante la vigilancia posterior a la comercialización, se ha observado en casos raros un incremento clínicamente relevante en la presión arterial. También se ha reportado seborrea. Pueden ocurrir reacciones anafilácticas, urticaria, angioedema, agravamiento del angioedema y/o agravamiento del angioedema hereditario.
La inserción o extracción del implante puede ocasionar reacciones vasovagales (por ejemplo: hipotensión, mareos o síncope), equimosis, irritación, dolor o prurito locales leves. Puede ocurrir fibrosis en el sitio del implante, puede formarse una cicatriz, o se puede desarrollar un absceso. Pueden ocurrir parestesia o eventos tipo parestesia. Se ha reportado la expulsión o migración del implante, incluyendo raramente a la pared torácica. En casos raros, se han encontrado implantes dentro de la vasculatura, incluyendo la arteria pulmonar. Algunos casos de implantes encontrados dentro de la arteria pulmonar reportaron dolor torácico y/o trastornos respiratorios (como disnea, tos o hemoptisis); otros han sido reportados como asintomáticos (ver PRECAUCIONES GENERALES). Podría ser necesaria una intervención quirúrgica para extraer el implante.
En raras ocasiones, se han reportado embarazos ectópicos (ver PRECAUCIONES GENERALES).
En mujeres que utilizan anticonceptivos (combinados orales) se han reportado varios efectos indeseables (graves). Estos incluyen trastornos tromboembólicos venosos, trastornos tromboembólicos arteriales, tumores dependientes de hormonas (p. ej., tumores hepáticos, cáncer de mama) y cloasma, algunos de los cuales se discuten en más detalle en la sección de Precauciones Generales.
X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO
Nota: Debe consultarse la información para prescribir de medicamentos concomitantes para identificar posibles interacciones.
• Influencia de otros medicamentos sobre IMPLANON NXT
Las interacciones entre los anticonceptivos hormonales y otros medicamentos pueden llevar a sangrado menstrual y/o fallo en la anticoncepción.
Se han reportado las siguientes interacciones en la literatura (principalmente con anticonceptivos combinados, pero ocasionalmente también con anticonceptivos que contienen solo progestágeno).
Metabolismo hepático:
Pueden ocurrir interacciones con productos herbolarios o medicamentos que inducen enzimas microsomales, específicamente enzimas del citocromo P450 (CYP), lo que puede generar en un incremento en la depuración, reduciendo las concentraciones plasmáticas de hormonas sexuales y puede disminuir la efectividad de IMPLANON NXT. Estos productos incluyen fenitoína, fenobarbital, primidona, bosentan, carbamazepina, rifampicina y posiblemente, también oxcarbazepina, topiramato, felbamato, griseofulvina, algunos inhibidores de la proteasa del VIH (p. ej., ritonavir) e inhibidores no nucleósidos de transcriptasa reversa (p. ej., efavirenz) y el remedio herbolario hierba de San Juan.
Puede ocurrir inducción enzimática después de algunos días de tratamiento. La inducción enzimática máxima se observa generalmente dentro de unas pocas semanas. Después de que se descontinúa el tratamiento con el fármaco, la inducción enzimática puede durar alrededor de 28 días.
Cuando se administran concomitantemente con anticonceptivos hormonales, muchas combinaciones de inhibidores de proteasa del VIH (p. ej., nelfinavir) e inhibidores no nucleósidos de transcriptasa reversa (p. ej., nevirapina), y/o combinaciones con medicamentos para el virus de hepatitis C (HCV por las siglas en inglés para Hepatitis C Virus) (p. ej., boceprevir, telaprevir), pueden incrementar o disminuir las concentraciones plasmáticas de progestinas, incluyendo etonogestrel. El efecto neto de estos cambios puede ser clínicamente relevante en algunos casos.
Debe advertirse a las mujeres que reciben cualquiera de los medicamentos inductores de enzimas hepáticas o productos herbolarios antes mencionados arriba, que puede reducirse la eficacia de IMPLANON NXT. Si se decide continuar utilizando IMPLANON NXT, debe aconsejarse a la mujer que también utilice un método anticonceptivo no hormonal durante el tiempo de la administración concomitante y durante 28 días después de la descontinuación.
La administración concomitante de inhibidores potentes (p. ej., ketoconazol, itraconazol, claritromicina) o moderados (p. ej., fluconazol, diltiazem, eritromicina) de CYP3A4, puede incrementar las concentraciones séricas de progestinas, incluyendo etonogestrel.
• Influencia de IMPLANON NXT sobre otros medicamentos
Los anticonceptivos hormonales pueden interferir con el metabolismo de otros medicamentos. En consecuencia, las concentraciones plasmáticas y tisulares pueden ya sea incrementar (p. ej., ciclosporina) o disminuir (p. ej., lamotrigina).
XI. ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO
La información obtenida con OCs combinados ha mostrado que los anticonceptivos esteroideos pueden afectar algunos parámetros de laboratorio, incluyendo parámetros bioquímicos de la función hepática, tiroidea, suprarrenal y renal, niveles séricos de proteínas (transportadoras), p. ej., globulina transportadora de corticosteroides y fracciones de lípidos/lipoproteínas, parámetros del metabolismo de carbohidratos y parámetros de coagulación y fibrinólisis. Los cambios generalmente permanecen dentro del rango normal. Se desconoce hasta qué punto esto también aplica a los anticonceptivos que contienen solo progestágenos.
Información de seguridad para imágenes por resonancia magnética (IRM).
Implanon es seguro para RM.
XIII. DOSIS Y VÍA DE ADMINISTRACIÓN
Debe excluirse el embarazo antes de la inserción IMPLANON NXT.
Se recomienda firmemente la participación de los profesionales de la salud (HCPs, por las siglas en inglés para Healthcare Professionals) en una sesión de entrenamiento para familiarizarse con el uso del aplicador de IMPLANON NXT y las técnicas para la inserción y extracción del implante IMPLANON NXT, y cuando sea apropiado, solicitar supervisión antes de insertar o extraer el implante.
Antes de insertar el implante, lea y siga cuidadosamente las instrucciones para la inserción y extracción del implante en las secciones correspondientes más adelante “¿Cómo insertar IMPLANON NXT?”, y “¿Cómo extraer IMPLANON NXT?”.
Por favor contáctenos por email al correo dpoc.mexico@organon.com en caso de tener alguna pregunta.
Si usted no está seguro(a) de los pasos necesarios para insertar y/o extraer IMPLANON NXT de forma segura, no intente realizar el procedimiento.
¿Cómo usar IMPLANON NXT?
IMPLANON NXT es un anticonceptivo hormonal de acción prolongada. Se inserta por vía subcutánea un solo implante y puede dejarse en ese lugar durante tres años. Extraer el implante a más tres años después de la fecha de inserción. La usuaria debe informarse que ella puede solicitar la extracción del implante en cualquier momento. Los HCPs pueden considerar un reemplazo más temprano del implante en mujeres con mayor peso (ver PRECAUCIONES GENERALES). Después de la extracción del implante, la inserción inmediata de un nuevo implante resultará en protección anticonceptiva continua. Si la mujer no desea continuar utilizando IMPLANON NXT, pero quiere continuar evitando el embarazo, debe recomendarse otro método anticonceptivo.
La base para un uso y su subsecuente extracción exitosos del IMPLANON NXT es una inserción subcutánea del implante realizada correcta y cuidadosamente, de acuerdo con las instrucciones. Si el implante no se inserta de acuerdo con las instrucciones (ver más adelante “¿Cómo insertar IMPLANON NXT?”) y en el día correcto (ver más adelante “¿Cuándo insertar IMPLANON NXT?”), esto puede resultar en un embarazo no deseado. Un implante insertado más profundamente que subcutáneamente (inserción profunda) puede no ser palpable y su localización y/o extracción puede ser difícil (ver más adelante “¿Cómo extraer IMPLANON NXT?” y PRECAUCIONES GENERALES).
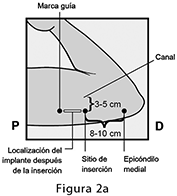
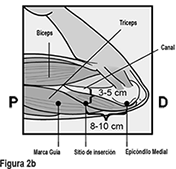
El implante de IMPLANON NXT debe insertarse subcutáneamente justo bajo de la piel en la cara interna superior del brazo no dominante. El sitio de inserción está superpuesto al músculo tríceps a alrededor de 8-10 cm (3-4 pulgadas) del epicóndilo medial del húmero y 3-5 cm (1.25-2 pulgadas) posterior al (bajo el) surco (hueco) entre los músculos bíceps y tríceps. Esta localización está destinada para evitar los grandes vasos sanguíneos y nervios que yacen dentro y rodean al surco. (ver Figuras 2a y 2b).
Inmediatamente después de la inserción, debe verificarse la presencia del implante por palpación. En caso de que el implante no pueda ser palpado o cuando la presencia del implante sea dudosa, vea más adelante “¿Cómo insertar IMPLANON NXT?”.
El empaque de IMPLANON NXT contiene una Tarjeta de la Usuaria destinada para la mujer, que registra el número de lote del implante. Se solicita a los HCPs que registren la fecha de inserción, el brazo de inserción y el día previsto de extracción en la Tarjeta de la Usuaria. El empaque también contiene etiquetas adhesivas, que muestran el número de lote, destinadas para los expedientes (registros) de los médicos.
¿Cuándo insertar IMPLANON NXT?
IMPORTANTE: Descartar el embarazo antes de insertar el implante.
El momento de la inserción depende de la historia anticonceptiva reciente de la mujer, como sigue:
Sin uso previo de anticonceptivos hormonales en el mes pasado
El implante debe insertarse entre el Día 1 (primer día del sangrado menstrual) y el Día 5 del ciclo menstrual, incluso si la mujer todavía presenta sangrado.
Si es insertado como se recomienda, no es necesaria anticoncepción de respaldo. Si hay una desviación del momento de inserción recomendado, debe aconsejarse a la mujer que utilice un método de barrera hasta 7 días después de la inserción. Si ya ha tenido relaciones sexuales, debe excluirse el embarazo.
Cambio de un método anticonceptivo a IMPLANON NXT
Cambio de un método anticonceptivo hormonal combinado (anticonceptivo oral combinado (COC, por las siglas en inglés para combined oral contraceptive), anillo vaginal o parche transdérmico)
El implante debe insertarse preferiblemente el día después de la última tableta con activo (la última tableta que contiene sustancias activas) del COC previo, pero a más tardar al día siguiente al intervalo usual libre de tabletas o después de la última tableta placebo del COC previo. En caso de que se haya utilizado un anillo vaginal o un parche transdérmico, el implante debe insertarse preferiblemente el día de la extracción, pero a más tardar en la fecha en que debía realizarse la siguiente aplicación.
Si se inserta como se recomienda, no es necesaria anticoncepción de respaldo. Si hay una desviación del momento de inserción recomendado, debe aconsejarse a la mujer que utilice un método de barrera hasta 7 días después de la inserción. Si ya ha tenido relaciones sexuales, debe excluirse el embarazo.
Cambio de un método anticonceptivo que contiene solo progestágeno (p. ej., una píldora, inyección, implante o dispositivo intrauterino [DIU] que contiene solo progestágeno)
Como hay varios tipos de métodos que contiene solo progestágenos, la inserción del implante debe realizarse de la siguiente manera:
• Anticonceptivos inyectables: Insertar el implante el día en que se debería aplicar la siguiente inyección.
• Píldora que contiene solo progestágeno: Una mujer puede cambiar de la píldora que contiene solo progestágeno a IMPLANON NXT en cualquier día del mes. El implante debe insertarse dentro de las 24 horas de haber tomado la última píldora.
• Implante/Dispositivo intrauterino (DIU): Insertar el implante el mismo día en que el implante previo o DIU sea extraído.
Si se inserta como se recomienda, no es necesaria anticoncepción de respaldo. Si hay una desviación del momento de inserción recomendado, debe aconsejarse a la mujer que utilice un método de barrera hasta 7 días después de la inserción. Si ya ha tenido relaciones sexuales, debe excluirse el embarazo.
Después de un aborto voluntario o espontáneo
• Primer trimestre: El implante debe insertarse dentro de 5 días después de un aborto voluntario o espontáneo durante el primer trimestre.
• Segundo trimestre: Insertar el implante entre los 21 a 28 días después de un aborto voluntario o espontáneo durante el segundo trimestre.
Si se inserta como se recomienda, no es necesaria anticoncepción de respaldo. Si hay una desviación del momento de inserción recomendado, debe aconsejarse a la mujer que utilice un método de barrera hasta 7 días después de la inserción. Si ya ha tenido relaciones sexuales, debe excluirse el embarazo.
Postparto
• Lactancia: El implante debe insertarse después de la cuarta semana postparto (ver RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA). Debe aconsejarse a la mujer que utilice un método de barrera hasta 7 días después de la inserción. Si ya ha tenido relaciones sexuales, debe excluirse el embarazo.
• Sin lactancia: El implante debe insertarse entre los 21 a 28 días postparto. Si se inserta como se recomienda, no es necesaria anticoncepción de respaldo. Si el implante es insertado después de los 28 días posparto, debe aconsejarse a la mujer que utilice un método de barrera hasta 7 días después de la inserción. Si ya ha tenido relaciones sexuales, debe excluirse el embarazo.
¿Cómo insertar IMPLANON NXT?
La base para el uso y su subsecuente extracción exitosos de IMPLANON NXT es una inserción subcutánea del implante realizada correcta y cuidadosamente en el brazo no dominante de acuerdo con las instrucciones. Tanto el HCP como la usuaria deben ser capaces de sentir el implante bajo la piel de la mujer después de su colocación.
El implante debe insertarse subcutáneamente justo bajo la piel en la cara interna superior del brazo no dominante.
• Un implante insertado más profundamente que subcutáneamente (inserción profunda) puede no palparse y ser difícil su localización y/o extracción (ver más adelante “¿Cómo extraer IMPLANON NXT?” y Precauciones Generales).
• Si el implante es insertado profundamente, puede ocurrir daño neural o vascular. Inserciones profundas o incorrectas se han asociado con parestesia (debido a daño neural) y la migración del implante (debido a inserción intramuscular o fascial), y en casos raros con inserción intravascular.
La inserción de IMPLANON NXT debe realizarse bajo condiciones asépticas y solamente por un HCP calificado que esté familiarizado con el procedimiento. La inserción del implante debe realizarse únicamente con el aplicador precargado.
Procedimiento de Inserción
Con el fin de asegurar que el implante se inserta justo bajo la piel, el HCP debe colocarse en una posición que le permita ver el avance de la aguja observando el aplicador por un lado y no por arriba del brazo. Desde esta vista lateral, tanto el sitio de inserción como el movimiento de la aguja bajo la piel pueden ser vistos claramente.
Con fines ilustrativos, las Figuras representan la cara interna del brazo izquierdo.
• Pida a la mujer que se recueste sobre su espalda en la mesa de exploración, con su brazo no dominante flexionado por el codo y rotado externamente de manera que su mano quede por debajo de su cabeza (o lo más cerca posible) (Figura 1).

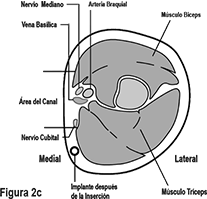
 Identifique el sitio de inserción, el cual se encuentra en la cara interna superior del brazo no dominante. El sitio de inserción está superpuesto al músculo tríceps a aproximadamente 8-10 cm (3-4 pulgadas) del epicóndilo medial del húmero y 3-5 cm (1.25-2 pulgadas) posterior al (debajo del) surco (hueco) entre los músculos bíceps y tríceps. (Figuras 2a, 2b, y 2c). Esta localización está destinada para evitar los grandes vasos sanguíneos y nervios que yacen dentro y rodeando el surco. Si no es posible insertar el implante en esta localización (p. ej., en mujeres con brazos delgados), debe insertarse lo más distal del surco como sea posible.
Identifique el sitio de inserción, el cual se encuentra en la cara interna superior del brazo no dominante. El sitio de inserción está superpuesto al músculo tríceps a aproximadamente 8-10 cm (3-4 pulgadas) del epicóndilo medial del húmero y 3-5 cm (1.25-2 pulgadas) posterior al (debajo del) surco (hueco) entre los músculos bíceps y tríceps. (Figuras 2a, 2b, y 2c). Esta localización está destinada para evitar los grandes vasos sanguíneos y nervios que yacen dentro y rodeando el surco. Si no es posible insertar el implante en esta localización (p. ej., en mujeres con brazos delgados), debe insertarse lo más distal del surco como sea posible.
• Haga dos marcas con un marcador quirúrgico: Primero, marque el punto en donde será insertado el implante, y segundo, marque un punto a 5 cm (2 pulgadas) proximal (hacia el hombro) a la primera marca (Figura 2a y 2b). Esta segunda marca (marca guía) le servirá después como una guía durante la inserción.
P, proximal (hacia el hombro);
D, distal (hacia el codo)
Corte transversal del brazo izquierdo, visto desde el codo
Medial (lado interno del brazo)
Lateral (lado externo del brazo)
• Después de marcar el brazo, confirme que el sitio está en la localización correcta en la cara interna del brazo.
• Limpie la piel del sitio de la inserción a la marca guía con una solución antiséptica.
• Anestesie el área de inserción (p. ej., con aerosol anestésico o inyectando 2 mL de lidocaína al 1% justo bajo la piel a lo largo del túnel de inserción planeado).
• Extraiga de su blíster el aplicador estéril precargado desechable de IMPLANON NXT que porta el implante. Inspeccione visualmente antes de su uso, para detectar alteraciones en la integridad del empaque, en busca de daños (por ejemplo, desgarres, perforaciones etc.) Si el envase tiene algún daño visual que pueda comprometer la esterilidad, no utilice el aplicador.
• Sostenga el aplicador justo por arriba de la aguja en el área de superficie texturizada. Extraiga la tapa protectora transparente deslizándola de forma horizontal en el sentido de la flecha, fuera de la aguja (Figura 3). Si la tapa no se desliza fácilmente, no debe utilizarse el aplicador. Usted debe ver el implante de color blanco mirando por la punta de la aguja. No toque el deslizador púrpura hasta que usted haya insertado completamente la aguja subcutáneamente, ya que hacerlo retraerá la aguja y liberará prematuramente el implante de su aplicador.
• Si el deslizador púrpura es liberado prematuramente, reinicie el procedimiento con un nuevo aplicador.

• Con su mano libre, estire la piel alrededor del sitio de inserción, hacia el codo (Figura 4).
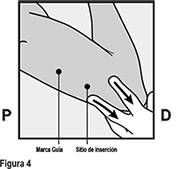
• El implante debe insertarse subcutáneamente justo bajo la piel (ver PRECAUCIONES GENERALES).
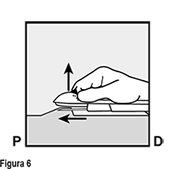
Para ayudar a asegurar que el implante sea insertado justo bajo la piel, usted debe colocarse de tal forma que pueda ver el avance de la aguja, viendo el aplicador desde un lado y no por arriba del brazo. Desde una vista lateral usted podrá ver claramente el sitio de inserción y el movimiento de la aguja justo bajo la piel (ver Figura 6).
• Puncione la piel con la punta de la aguja ligeramente angulada a menos de 30° (Figura 5a).
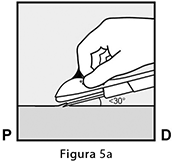
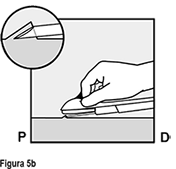
 Inserte la aguja hasta que el bisel (abertura sesgada de la punta) esté justo bajo de la piel (y no más allá) (Figura 5b). Si usted insertó la aguja más profundamente que el bisel, retire la aguja hasta que solamente el bisel esté bajo la piel.
Inserte la aguja hasta que el bisel (abertura sesgada de la punta) esté justo bajo de la piel (y no más allá) (Figura 5b). Si usted insertó la aguja más profundamente que el bisel, retire la aguja hasta que solamente el bisel esté bajo la piel.
• Baje el aplicador hasta una posición casi horizontal. Para facilitar la colocación subcutánea, levante la piel con la aguja, mientras desliza la aguja en toda su extensión (Figura 6). Usted puede sentir una ligera resistencia, pero no ejerza una fuerza excesiva. Si la aguja no es insertada en toda su longitud, el implante no será insertado adecuadamente.
Si la punta de la aguja sale por la piel antes de que la in serción de la aguja sea completa, debe retraerse la aguja y reajustar la posición subcutánea antes de completar el procedimiento de inserción.
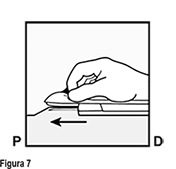
• Mantenga el aplicador en la misma posición con la aguja insertada en toda su longitud (Figura 7). Si es necesario, usted puede utilizar su mano libre para estabilizar el aplicador.
• Libere el deslizador púrpura empujándolo ligeramente hacia abajo (Figura 8a). Mueva el deslizador completamente hacia atrás hasta que se detenga. No mueva ( ) el aplicador mientras está moviendo el deslizador púrpura (Figura 8b). El implante está ahora en su posición subcutánea final y la aguja está asegurada dentro del cuerpo del aplicador. Ahora puede retirar el aplicador (Figura 8c).
) el aplicador mientras está moviendo el deslizador púrpura (Figura 8b). El implante está ahora en su posición subcutánea final y la aguja está asegurada dentro del cuerpo del aplicador. Ahora puede retirar el aplicador (Figura 8c).

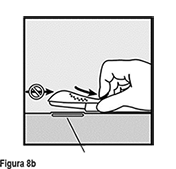

Si el aplicador no se mantiene en la misma posición durante este procedimiento o si el deslizador púrpura no se mueve completamente hacia atrás hasta que se detenga, el implante no será insertado adecuadamente y puede protruir por el sitio de inserción.
Si el implante protruye por el sitio de inserción, extraiga el implante y realice un nuevo procedimiento en el mismo sitio de inserción, utilizando un nuevo aplicador. No empuje el implante protruyente de regreso en la incisión.
• Aplique un pequeño vendaje adhesivo sobre el sitio de inserción.
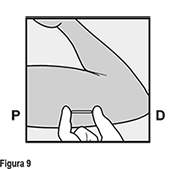
• Verifique siempre la presencia del implante en el brazo de la mujer inmediatamente después de la inserción, mediante palpación. Al palpar ambos extremos del implante, usted debe ser capaz de confirmar la presencia de la varilla de 4 cm (Figura 9). Ver más adelante “Si el implante no es palpable después de la inserción”.
• Pida a la mujer que palpe el implante.
• Aplique gasa estéril con un vendaje compresivo para minimizar la formación de equimosis. La mujer puede retirar el vendaje compresivo en 24 horas y el pequeño vendaje adhesivo sobre el sitio de inserción después de 3-5 días.
• Llene la Tarjeta de la Usuaria y désela a la mujer para que la guarde. También, llene las etiquetas adhesivas y péguelas en el expediente médico de la mujer.
• El aplicador debe utilizarse una sola vez y debe desecharse de forma adecuada, de acuerdo con la regulación local para el manejo de residuos biológicos peligrosos.
Si el implante no es palpable después de la inserción:
Si no puede palpar el implante o duda de su presencia, puede ser que el implante no haya sido insertado o que haya sido insertado profundamente.
• Verifique el aplicador. La aguja debe estar completamente retraída y debe ser visible solamente la punta púrpura del obturador.
• Utilice otros métodos para confirmar la presencia del implante. Dada la naturaleza radiopaca del implante, métodos adecuados para su localización son radiografía bidimensional y tomografía computarizada (CT scan, por las siglas en inglés para Computed Tomography scan) con rayos X. Puede utilizarse ultrasonido (US) con un transductor de arreglo lineal de alta frecuencia (10 MHz o mayor) o imagen de resonancia magnética (MRI, por las siglas en inglés para Magnetic Resonance Imaging). En caso de que estos métodos de imagen fallen, se aconseja verificar la presencia del implante midiendo el nivel de etonogestrel en una muestra sanguínea de la mujer. En este caso, el Titular del producto le brindará el protocolo apropiado (por favor contáctenos al correo dpoc.mexico@organon.com Hasta que usted haya verificado la presencia del implante, la mujer debe utilizar un método anticonceptivo no hormonal.
• Los implantes colocados profundamente deben localizarse y extraerse tan pronto como sea posible para evitar una potencial migración distante (ver PRECAUCIONES GENERALES).
¿Cómo extraer IMPLANON NXT?
 La extracción del implante debe realizarse solamente bajo condiciones asépticas por un(a) HCP que esté familiarizado(a) con la técnica de extracción. Si usted no está familiarizado(a) con la técnica de extracción, contáctenos al correo dpoc.mexico@organon.com para mayor información.
La extracción del implante debe realizarse solamente bajo condiciones asépticas por un(a) HCP que esté familiarizado(a) con la técnica de extracción. Si usted no está familiarizado(a) con la técnica de extracción, contáctenos al correo dpoc.mexico@organon.com para mayor información.
Antes de iniciar el procedimiento de extracción, el/la HCP debe evaluar la localización del implante. Verifique la localización exacta del implante en el brazo mediante palpación.
Si el implante no es palpable, consulte la Tarjeta de la Usuaria o el expediente médico para verificar el brazo que contiene el implante. Si el implante no puede palparse, puede estar localizado profundamente o haber migrado. Considere que puede yacer cerca de vasos y nervios. La extracción de implantes no palpables solamente debe realizarse por un(a) HCP experimentado(a) en la extracción de implantes colocados profundamente y familiarizado(a) con la localización de implantes y la anatomía del brazo. Contáctenos al correo dpoc.mexico@organon.com para mayor información.
Ver más adelante la sección sobre “Localización y extracción de un implante no palpable” si no puede palparse el implante.
Procedimiento para extraer un implante que es palpable
Con fines ilustrativos, las figuras representan la cara interna del brazo izquierdo
• Pida a la mujer que se recueste sobre su espalda en la mesa de exploración. El brazo debe estar en una posición con el codo flexionado y la mano por debajo de la cabeza (o tan cerca como sea posible). (ver Figura 1)
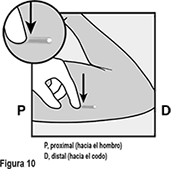
 Localice el implante por palpación. Empuje hacia abajo el extremo del implante más cercano al hombro (Figura 10) para estabilizarlo; debe aparecer una protuberancia, indicando la punta del implante que está más cerca del codo. Si la punta no aparece, la extracción del implante puede presentar un mayor reto y debe realizarse por profesionales experimentados con la extracción de implantes más profundos. Contáctenos al correo dpoc.mexico@organon.com para mayor información.
Localice el implante por palpación. Empuje hacia abajo el extremo del implante más cercano al hombro (Figura 10) para estabilizarlo; debe aparecer una protuberancia, indicando la punta del implante que está más cerca del codo. Si la punta no aparece, la extracción del implante puede presentar un mayor reto y debe realizarse por profesionales experimentados con la extracción de implantes más profundos. Contáctenos al correo dpoc.mexico@organon.com para mayor información.
• Marque el extremo distal (el extremo más cercano al codo), por ejemplo, con un marcador quirúrgico.
• Limpie el sitio con una solución antiséptica.
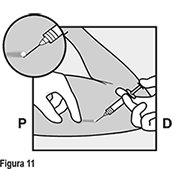
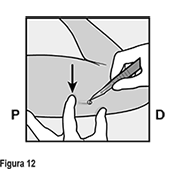
• Anestesie el sitio, por ejemplo, con 0.5 a 1 mL de lidocaína al 1% en donde se hará la incisión (Figura 11). Asegúrese de inyectar el anestésico local bajo el implante para mantener el implante cerca de la superficie de la piel. La inyección del anestésico local sobre el implante puede dificultar su extracción.
• Empuje hacia abajo el extremo del implante más cercano al hombro (Figura 12) para estabilizarlo a lo largo del procedimiento. Comenzando sobre la punta del implante más cercana al codo, haga una incisión longitudinal (paralela al implante) de 2 mm hacia el codo. Tenga cuidado de no cortar la punta del implante.
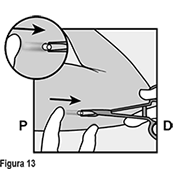
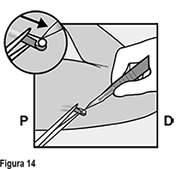
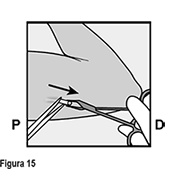
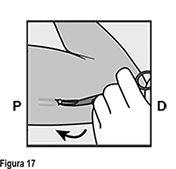
• La punta del implante debe salir por la incisión. Si no lo hace, empuje suavemente el implante hacia la incisión hasta que la punta sea visible. Sujete el implante con pinzas y, si es posible, extraiga el implante (Figura 13). Si es necesario, retire suavemente el tejido adherente de la punta del implante utilizando disección roma. Si la punta del implante no está expuesta después de la disección roma, haga una incisión en la vaina del tejido y después extraiga el implante con las pinzas (Figuras 14 y 15).
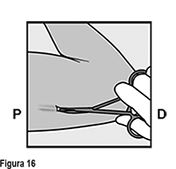
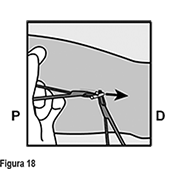
 Si la punta del implante no se vuelve visible en la incisión, inserte una pinza (preferiblemente pinzas de mosquito curvas, con las puntas apuntando hacia arriba) de forma superficial en la incisión (Figura 16). Sujete suavemente el implante y entonces voltee la pinza hacia a su otra mano (Figura 17). Con un segundo par de pinzas diseque cuidadosamente el tejido alrededor del implante y sujete el implante (Figura 18). El implante puede entonces extraerse. Si el implante no puede sujetarse, suspenda el procedimiento y refiera a la mujer a un(a) HCP experimentado(a) con extracciones complejas o contáctenos al correo dpoc.mexico@organon.com.
Si la punta del implante no se vuelve visible en la incisión, inserte una pinza (preferiblemente pinzas de mosquito curvas, con las puntas apuntando hacia arriba) de forma superficial en la incisión (Figura 16). Sujete suavemente el implante y entonces voltee la pinza hacia a su otra mano (Figura 17). Con un segundo par de pinzas diseque cuidadosamente el tejido alrededor del implante y sujete el implante (Figura 18). El implante puede entonces extraerse. Si el implante no puede sujetarse, suspenda el procedimiento y refiera a la mujer a un(a) HCP experimentado(a) con extracciones complejas o contáctenos al correo dpoc.mexico@organon.com.
• Confirme que el implante completo, el cual es de 4 cm de largo, ha sido extraído midiendo su longitud. Ha habido reportes de implantes rotos mientras están en el brazo de la mujer. En algunos casos, se ha reportado extracción difícil del implante roto. Si se extrae un implante parcial (menos de 4 cm), debe extraerse la parte restante siguiendo las instrucciones en la sección de “¿Cómo extraer IMPLANON NXT?”.
• Si la mujer desea continuar utilizando IMPLANON NXT, puede insertarse inmediatamente un nuevo implante después de que se ha extraído el implante viejo utilizando la misma incisión, siempre y cuando el sitio esté en la localización correcta (ver más adelante “¿Cómo reemplazar IMPLANON NXT?”).
• Después de extraer el implante, cierre la incisión con un vendaje de heridas adhesivo estéril.
• Aplique gasa estéril con un vendaje compresivo para minimizar la formación de equimosis. La mujer puede retirar el vendaje compresivo después de 24 horas y el cierre adhesivo de la herida de 3-5 días.
Localización y extracción de un implante no palpable
Ha habido reportes ocasionales de migración del implante, usualmente esto involucra un pequeño movimiento con relación a la posición original (ver PRECAUCIONES GENERALES), pero puede llevar a que el implante no sea palpable en la localización en la que fue colocado. Un implante que ha sido insertado profundamente o ha migrado puede no palparse y por lo tanto, pueden requerirse procedimientos de imagen, como se describe adelante, para localizarlo.
Un implante no palpable debe localizarse siempre antes de intentar su extracción. Dada la naturaleza radiopaca del implante, métodos adecuados para su localización incluyen radiografía bidimensional y la radiografía por tomografía computarizada (CT). Puede utilizarse ultrasonido (US) con un transductor de arreglo lineal de alta frecuencia (10 MHz o mayor) o imagen de resonancia magnética (MRI). Una vez el implante ha sido localizado en el brazo, debe extraerse por un(a) HCP experimentado(a) en la extracción de implantes colocados profundamente y familiarizado(a) con la anatomía del brazo. Debe considerarse el uso de guía con ultrasonido durante la extracción.
Si el implante no puede encontrarse en el brazo después de intentos de localización exhaustivos, considere utilizar técnicas de imagen en el tórax, ya que se han reportado eventos raros de migración a la vasculatura pulmonar. Si el implante se localiza en el tórax, pueden ser necesarios procedimientos quirúrgicos o endovasculares para la extracción, deben consultarse a HCP familiarizados con la anatomía del tórax.
Si en cualquier momento estos métodos de imagen fallan en localizar el implante, puede verificarse la presencia del implante mediante la determinación del nivel sanguíneo de etonogestrel. Por favor contáctenos al correo dpoc.mexico@organon.com para mayor guía.
Si el implante migra dentro del brazo, la extracción puede requerir un procedimiento quirúrgico menor con una incisión más grande o un procedimiento quirúrgico en un quirófano. La extracción de implantes insertados profundamente debe realizarse con precaución con la finalidad de ayudar a prevenir el daño a las estructuras neurales o vasculares más profundas en el brazo. Los implantes no palpables e insertados profundamente deben extraerse por HCPs familiarizados(as) con la anatomía del brazo y la extracción de implantes insertados profundamente.
Se desalienta estrictamente la cirugía exploratoria sin conocimiento de la localización exacta del implante.
Por favor contáctenos al correo dpoc.mexico@organon.com para mayor guía.
¿Cómo reemplazar IMPLANON NXT?
Puede realizarse un reemplazo inmediato después de la extracción del implante previo y es similar al procedimiento de inserción descrito en la sección “¿Cómo insertar IMPLANON NXT?".
El nuevo implante puede insertarse en el mismo brazo, y a través de la misma incisión desde la cual se extrajo el implante previo, siempre y cuando el sitio esté en la localización correcta, es decir, de 8-10 cm desde epicóndilo medial del húmero y 3-5 cm posterior al (debajo del) surco (ver “¿Cómo insertar IMPLANON NXT?”). Si se va a utilizar la misma incisión para insertar un nuevo implante, anestesie el sitio de la inserción (p. ej., 2 mL de lidocaína al 1%) aplicada justo bajo la piel, comenzando en la incisión de extracción a lo largo del “canal de inserción” y siga los pasos subsecuentes de las instrucciones de inserción.
XIV. MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL
Debe extraerse siempre un implante antes de insertar uno nuevo. No existe información disponible relacionada con sobredosis con etonogestrel. No ha habido reportes de efectos perjudiciales graves por una sobredosis de anticonceptivos en general.
XII. PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD
Los estudios toxicológicos no revelaron otros efectos además de los que pueden explicarse con base en las propiedades hormonales de etonogestrel, independientemente de la vía de administración.
XVIII. NOMBRE Y DOMICILIO DEL LABORATORIO
SCHERING - PLOUGH, S.A. de C.V.
Av. 16 de Septiembre No. 301,
Col. Xaltocan, C.P. 16090, Xochimilco,
Ciudad de México, México.
XV. PRESENTACIÓN:
Caja con un implante de 68 mg y aplicador en envase de burbuja con tarjeta e instructivo anexo.
XVI. RECOMENDACIONES SOBRE ALMACENAMIENTO
Consérvese a no más de 30 °C.
Protéjase de la luz.
Consérvese la caja bien cerrada.
IMPLANON NXT no debe ser insertado después de la fecha de vencimiento indicada en el envase primario.
XVII. LEYENDAS DE PROTECCIÓN
Literatura exclusiva para médicos.
Su venta requiere receta médica.
Este medicamento debe ser aplicado por un profesional de la salud capacitado.
Léase instructivo y tarjeta anexos.
No se deje al alcance de los niños.
No se use durante el embarazo.
En caso de lactancia, consulte a su médico.
Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx, dpoc.mexico@organon.com
Deséchese el aplicador inmediatamente después de su uso.