HYRIMOZ
ADALIMUMAB
Solución
1 Caja, 1 Jeringa(s) prellenada(s), 0.8 mL, 40/0.8 mg/ml
1 Caja, 2 Jeringa(s) prellenada(s), 0.8 mL, 40/0.8 mg/ml
1 Caja, 1 Pluma precargada, 0.2 mL, 20/0.2 mg/ml
1 Caja, 2 Pluma precargada, 0.2 mL, 20/0.2 mg/ml
1 Caja, 1 Jeringa(s) prellenada(s), 0.4 mL, 40/0.4 mg/ml
1 Caja, 2 Jeringa(s) prellenada(s), 0.4 mL, 40/0.4 mg/ml
1 Caja, 1 Jeringa(s) prellenada(s), 0.8 mL, 80/0.8 mg/ml
1 Caja, 2 Jeringa(s) prellenada(s), 0.8 mL, 80/0.8 mg/ml
1 Caja, 1 Pluma precargada, 0.8 mL, 40/0.8 mg/ml
1 Caja, 2 Pluma precargada, 0.8 mL, 40/0.8 mg/ml
1 Caja, 1 Pluma precargada, 0.4 mL, 40/0.4 mg/ml
1 Caja, 2 Pluma precargada, 0.4 mL, 40/0.4 mg/ml
1 Caja, 1 Pluma precargada, 0.8 mL, 80/0.8 mg/ml
1 Caja, 2 Pluma precargada, 0.8 mL, 80/0.8 mg/ml
FORMA FARMACÉUTICA Y FORMULACIÓN:
La jeringa prellenada contiene:
Adalimumab 40 mg
Vehículo cbp 0.8 mL
Adalimumab 20 mg
Vehículo 0.2 mL
Adalimumab 40 mg
Vehículo cbp 0.4 mL
Adalimumab 80 mg
Vehículo cbp 0.8 mL
La pluma precargada contiene:
Adalimumab 40 mg
Vehículo cbp 0.8 mL
Adalimumab 40 mg
Vehículo 0.4 mL
Adalimumab 80 mg
Vehículo cbp 0.8 mL
Anticuerpo monoclonal humano IgG1 de origen ADN recombinante expresado en células de ovario de hámster chino (CHO)
INDICACIONES TERAPÉUTICAS:
Adultos:
Artritis reumatoide:
HYRIMOZ® está indicado para reducir los signos y síntomas e inducir una respuesta clínica importante y remisión clínica de la enfermedad, inhibir la progresión del daño estructural y mejorar la función física en pacientes adultos con artritis reumatoide activa temprana y establecida, de moderada a severa intensidad.
HYRIMOZ® puede ser utilizado sólo o en combinación con metotrexato o bien en combinación con cualquier otro fármaco antirreumático modificador de la enfermedad.
Enfermedad de Crohn:
HYRIMOZ® está indicado para disminuir los signos y síntomas e inducir y mantener la remisión clínica en pacientes adultos con enfermedad de Crohn, de actividad moderada a severa, que han tenido una respuesta inadecuada al tratamiento convencional. HYRIMOZ® está indicado también para disminuir los signos y síntomas e inducir la remisión clínica en pacientes que ya no tienen respuesta o son intolerantes a lnfliximab.
Colitis ulcerativa:
HYRIMOZ® está indicado para la colitis ulcerativa activa de moderada a severa en pacientes adultos que han tenido una respuesta inadecuada al tratamiento convencional, incluyendo corticosteroides y/o 6-mercaptopurina o azatioprina, o que son intolerantes o tienen alguna contraindicación médica para recibir dichas terapias.
Uveítis:
HYRIMOZ® está indicado como tratamiento coadyuvante de pacientes adultos con uveítis crónica recurrente, intermedia, posterior y panuveítis no infecciosa. Previo a su administración deberá descartarse su origen infeccioso.
Hidradenitis supurativa (HS):
HYRIMOZ® está indicado para el tratamiento de la hidradenitis supurativa activa (acné inverso) de moderada a grave en pacientes adultos con una respuesta insuficiente al tratamiento sistémico convencional de hidradenitis supurativa.
Pediátricas:
Artritis idiopática juvenil:
HYRIMOZ® está indicado para disminuir los signos y síntomas de la artritis idiopática juvenil poliarticular activa de moderada a severa en niños de 2 años de edad en adelante. HYRIMOZ® puede utilizarse sólo o en combinación con metotrexato.
Artritis relacionada a entesitis:
HYRIMOZ® está indicado en el tratamiento de la artritis relacionada a entesitis en niños de 6 años de edad en adelante, quienes han tenido respuesta inadecuada o han sido intolerantes al tratamiento convencional.
Enfermedad de Crohn pediátrico:
HYRIMOZ® está indicado para reducir los signos y síntomas, así como inducir y mantener la remisión clínica en pacientes pediátricos a partir de los 6 años de edad con enfermedad de Crohn de moderada a severamente activa y que han tenido una respuesta inadecuada al tratamiento convencional.
Psoriasis pediátrica:
HYRIMOZ® está indicado para el tratamiento de la psoriasis en placas, severa, crónica, en niños y adolescentes a partir de los 4 años de edad que han tenido respuesta inadecuada al tratamiento o son candidatos inapropiados para el tratamiento tópico y fototerapia.
FARMACOCINÉTICA Y FARMACODINAMIA:
Grupo farmacoterapéutico: lnmunosupresores, inhibidores del factor de necrosis tumoral alfa (TNFα), Código ATC: L04AB04
Mecanismo de acción:
Adalimumab se une específicamente al TNF (factor de necrosis tumoral) y neutraliza su función biológica al bloquear su interacción con los receptores p55 y p75 del TNF en la superficie celular. Adalimumab también modula la respuesta biológica inducida o regulada por el TNF, incluyendo cambios en los niveles de las moléculas de adhesión responsables de la migración leucocitaria (ELAM-1, VCAM-1, e ICAM-1 con una CI50 de 0,1-0,2 nM).
Efectos farmacodinámicos:
Tras el tratamiento con Adalimumab, se observó una rápida disminución de los niveles de los componentes de fase aguda de inflamación (proteína C reactiva, PCR) y velocidad de sedimentación globular (VSG) y de las citoquinas plasmáticas (IL-6) en comparación con el inicial en pacientes con artritis reumatoide. Los niveles plasmáticos de metaloproteinasas de la matriz (MMP-1 y MMP-3) que participan en la remodelación tisular responsable de la destrucción del cartílago también disminuyeron tras la administración de Adalimumab. Los pacientes tratados con Adalimumab generalmente experimentaron mejorías en los signos hematológicos de inflamación crónica.
En pacientes con artritis idiopática juvenil poliarticular, enfermedad de Crohn, colitis ulcerosa e hidradenitis supurativa se ha observado un rápido descenso en los niveles de proteína C reactiva (PCR), después del tratamiento con Adalimumab. En pacientes con enfermedad de Crohn se observó una reducción en el número de células que expresan marcadores inflamatorios en el colon, incluyendo una reducción significativa en la expresión del TNFα. Los estudios endoscópicos de la mucosa intestinal han mostrado evidencias de cicatrización de mucosa en pacientes tratados con Adalimumab.
Eficacia clínica, seguridad e inmunogenicidad:
Artritis reumatoide en adultos:
Adalimumab se evaluó en más de 3,000 pacientes en el conjunto de los ensayos clínicos de artritis reumatoide. La eficacia y seguridad de Adalimumab en el tratamiento de la artritis reumatoide fue evaluada mediante cinco ensayos aleatorios, doble ciego y controlados. Algunos de estos pacientes fueron sometidos a tratamiento durante un máximo de 120 meses.
En el ensayo de artritis reumatoide I se evaluaron 271 pacientes con artritis reumatoide moderada a grave con edades ≥18 años, que no habían respondido a la terapia con al menos un fármaco antirreumático modificador de la enfermedad y mostraban una respuesta no suficientemente eficaz al metotrexato a dosis entre 12,5 y 25 mg (10 mg si no toleraban el metotrexato) semanales y cuyas dosis de metotrexato se mantuvieron fijas de 10 a 25 mg semanales. Se administraron dosis de 20, 40 y 80 mg de Adalimumab o de placebo en semanas alternas durante un periodo de 24 semanas.
En el ensayo de artritis reumatoide II se evaluaron 544 pacientes con artritis reumatoide activa moderada a grave con edades ≥ 18 años, que no habían respondido a la terapia con al menos un fármaco antirreumático modificador de la enfermedad. Se administraron dosis de 20 o de 40 mg de Adalimumab mediante inyección subcutánea en semanas alternas con placebo en las semanas intermedias, o cada semana durante un periodo de 26 semanas; el placebo se administró cada semana durante el mismo periodo. No se permitió la terapia con ningún otro fármaco antirreumático modificador de la enfermedad.
En el ensayo de artritis reumatoide III se evaluaron 619 pacientes con artritis reumatoide moderada a grave con edades ≥18 años, y que mostraban una respuesta ineficaz al metotrexato a dosis entre 12.5 y 25 mg o mostraron intolerancia a 10 mg de metotrexato semanales. Había tres grupos en este ensayo. Al primero se le administraron inyecciones de placebo durante 52 semanas. Al segundo se le administraron 20 mg de Adalimumab semanales durante 52 semanas. Al tercero se le administraron 40 mg de Adalimumab en semanas alternas, con inyecciones de placebo en las semanas intermedias. Una vez completadas las primeras 52 semanas, 457 pacientes fueron incluidos en una fase de extensión abierta en la cual se administraron 40 mg de Adalimumab/MTX en semanas alternas durante un máximo de 10 años.
En el ensayo de artritis reumatoide IV se evaluó fundamentalmente la seguridad en 636 pacientes con artritis reumatoide moderada a grave con edades ≥18 años. Los pacientes podían bien no haber sido tratados previamente con fármacos antirreumáticos modificadores de la enfermedad o bien seguir con su tratamiento reumatológico anterior, siempre y cuando hubiese sido un tratamiento continuado durante al menos 28 días. Estos tratamientos incluyen metotrexato; leflunomida, hidroxicloroquina, sulfasalazina y/o sales de oro. Los pacientes se aleatorizaron a los grupos de tratamiento con 40 mg de Adalimumab o placebo en semanas alternas durante un periodo de 24 semanas.
En el ensayo de artritis reumatoide V se evaluaron 799 pacientes adultos sin tratamiento previo con metotrexato con artritis reumatoide temprana moderada a grave (duración media de la enfermedad menor de 9 meses). Este ensayo evaluó la eficacia de Adalimumab 40 mg administrado en semanas alternas en terapia combinada con metotrexato, Adalimumab 40 mg administrado en semanas alternas en monoterapia y la monoterapia con metotrexato en la reducción de los signos, síntomas y velocidad de progresión del daño articular en la artritis reumatoide durante 104 semanas. Tras completar las primeras 104 semanas, se incluyeron 497 pacientes en una fase de extensión abierta en la que se administraron 40 mg de Adalimumab en semanas alternas hasta un periodo de 10 años.
La variable principal de los ensayos de artritis reumatoide I, II y III, y la secundaria del ensayo de artritis reumatoide IV era el porcentaje de pacientes que alcanzaron una respuesta ACR 20 en la Semana 24 o en la 26. La variable principal del ensayo de artritis reumatoide V era el porcentaje de pacientes que alcanzaron una respuesta ACR 50 en la Semana 52. Los ensayos de artritis reumatoide III y V tenían otro objetivo primario adicional a las 52 semanas, el retraso en la progresión de la enfermedad (detectado por medio de rayos-X). El ensayo de artritis reumatoide III tenía también el objetivo principal de cambios en la calidad de vida.
Respuesta ACR:
El porcentaje de pacientes tratados con Adalimumab que alcanzaron respuestas ACR 20, 50 y 70 fue constante durante los ensayos de artritis reumatoide I, II y III. Los resultados de los pacientes que recibieron dosis de 40 mg en semanas alternas se resumen en la Tabla 1.
Tabla 1. Respuestas ACR en ensayos controlados con placebo (porcentaje de pacientes)
|
Respuesta |
Ensayo de artritis reumatoide Iª** |
Ensayo de artritis reumatoide IIª** |
Ensayo de artritis reumatoide IIIª** |
|||
|
Placebo/MTXc n = 60 |
Adalimumabb/MTXc n = 63 |
Placebo n = 110 |
Adalimumabb n = 113 |
Placebo/MTXc n = 200 |
Adalimumab/MTXc n = 207 |
|
|
ACR 20 6 meses 12 meses |
13.3% NA |
65.1% NA |
19.1% NA |
46.0% NA |
29.5% 24.0% |
63.3% 58.9% |
|
ACR 50 6 meses 12 meses |
6.7% NA |
52.4% NA |
8.2% NA |
22.1% NA |
9.5% 9.5% |
39.1% 41.5% |
|
ACR 70 6 meses 12 meses |
3.3% NA |
23.8% NA |
1.8% NA |
12.4% NA |
2.5% 4.5% |
20.8% 23.2% |
ª Ensayo de artritis reumatoide I a las 24 semanas, ensayo de artritis reumatoide II a las 26 semanas, y ensayo de artritis reumatoide III a las 24 y 52 semanas.
b 40 mg Adalimumab administrados en semanas alternas.
c MTX = metotrexato.
**p <0.01, Adalimumab versus placebo.
En los ensayos de artritis reumatoide I-IV, todos los componentes individuales de los criterios de respuesta ACR (número de articulaciones doloridas e inflamadas, valoración por parte del médico y del paciente de la actividad de la enfermedad y dolor, resultados del índice de discapacidad (HAQ) y valores PCR (mg/dL)) mejoraron a las 24 o 26 semanas en comparación con placebo. En el ensayo de artritis reumatoide III, estas mejorías se mantuvieron durante 52 semanas.
En la fase de extensión abierta del ensayo III de AR, la mayoría de los pacientes con respuesta ACR mantuvieron esta respuesta a los 10 años. De 207 pacientes que fueron aleatorizados a Adalimumab 40 mg en semanas alternas, 114 pacientes continuaron con Adalimumab 40 mg en semanas alternas durante 5 años. De éstos, 86 pacientes (75.4%) tenían respuesta ACR 20; 72 pacientes (63.2%) tenían respuesta ACR 50; y 41 pacientes (36%) tenían respuesta ACR 70. De 207 pacientes, 81 continuaron con Adalimumab 40 mg en semanas alternas durante 10 años. De éstos, 64 pacientes (79.0%) tenían respuesta ACR 20; 56 pacientes (69.1%) tenían respuesta ACR 50; y 43 pacientes (53.1%) tenían respuesta ACR 70.
En el ensayo de artritis reumatoide IV, la respuesta ACR 20 en pacientes tratados con Adalimumab y cuidados estándar fue mejor de forma estadísticamente significativa que en pacientes tratados con placebo y cuidados estándar (p <0,001).
En los ensayos de artritis reumatoide I-IV, los pacientes tratados con Adalimumab alcanzaron respuestas ACR 20 y 50 estadísticamente significativas en comparación con placebo tan sólo una a dos semanas después de iniciar el tratamiento.
En el ensayo de artritis reumatoide V con pacientes con artritis reumatoide temprana sin tratamiento previo con metotrexato, la terapia combinada con Adalimumab y metotrexato resultó en una respuesta ACR significativamente mayor y más rápida que en la monoterapia con metotrexato y en la monoterapia con Adalimumab en la Semana 52 y dichas respuestas se mantuvieron en la Semana 104 (ver Tabla 2).
Tabla 2. Respuestas ACR en el Ensayo de artritis reumatoide V (porcentaje de pacientes)
|
Respuesta |
MTX n = 257 |
Adalimumab n = 274 |
Adalimumab/MTX n = 268 |
Valor pª |
Valor pb |
Valor pc |
|
ACR 20 |
||||||
|
Semana 52 |
62.6% |
54.4% |
72.8% |
0.013 |
<0.001 |
0.043 |
|
Semana 104 |
56.0% |
49.3% |
69.4% |
0.002 |
<0.001 |
0.140 |
|
ACR 50 |
||||||
|
Semana 52 |
45.9% |
41.2% |
61.6% |
<0.001 |
<0.001 |
0.317 |
|
Semana 104 |
42.8% |
36.9% |
59.0% |
<0.001 |
<0.001 |
0.162 |
|
ACR 70 |
||||||
|
Semana 52 |
27.2% |
25.9% |
45.5% |
<0.001 |
<0.001 |
0.656 |
|
Semana 104 |
28.4% |
28.1% |
46.6% |
<0.001 |
<0.001 |
0.864 |
ª Valor p se refiere a la comparación del par de valores correspondientes a la monoterapia con metotrexato y la terapia combinada con Adalimumab/metotrexato usando la prueba de Mann-Whitney U.
b Valor p se refiere a la comparación del par de valores correspondientes a la monoterapia con Adalimumab y la terapia combinada con Adalimumab/metotrexato usando la prueba de Mann-Whitney U.
c Valor p se refiere a la comparación del par de valores correspondientes a la monoterapia con Adalimumab y la monoterapia con metotrexato usando la prueba de Mann-Whitney U.
En la extensión abierta del ensayo de artritis reumatoide V, se mantuvieron las respuestas ACR tras un seguimiento de hasta un periodo de 10 años. De los 542 pacientes que fueron aleatorizados a recibir Adalimumab 40 mg en semanas alternas, 170 pacientes continuaron con Adalimumab 40 mg en semanas alternas hasta completar 10 años de tratamiento. Entre esos, 154 pacientes (90.6%) obtuvieron respuestas ACR 20; 127 pacientes (74.7%) obtuvieron respuestas ACR 50; y 102 pacientes (60.0%) obtuvieron respuestas ACR 70.
En la Semana 52, el 42.9% de los pacientes en tratamiento con la terapia combinada Adalimumab/metotrexato alcanzó la remisión clínica (DAS28 (PCR) <2.6) comparado con el 20.6% de los pacientes en monoterapia con metotrexato y el 23.4% de los pacientes en monoterapia con Adalimumab.
La combinación Adalimumab/metotrexato era clínica y estadísticamente superior a la monoterapia con metotrexato (p <0.001) y a la monoterapia con Adalimumab (p <0.001) a la hora de reducir la gravedad de la enfermedad en pacientes diagnosticados con artritis reumatoide reciente moderada a grave. La respuesta a las dos monoterapias fue similar (p = 0.447).
De los 342 sujetos inicialmente aleatorizados a recibir Adalimumab en monoterapia o la combinación Adalimumab/metotrexato que se incluyeron en la extensión abierta del estudio, 171 sujetos completaron 10 años de tratamiento con Adalimumab. Entre esos, se reportó que 109 sujetos (63.7%) estaban en remisión a los 10 años.
Respuesta radiográfica:
En el ensayo de artritis reumatoide III, en el que los pacientes tratados con Adalimumab habían tenido artritis reumatoide durante una media de 11 años, se valoró radiográficamente el daño estructural en las articulaciones y se expresó como el cambio en el índice Total de Sharp modificado (TSS) y sus componentes, el índice de erosión y el índice de estrechamiento del espacio articular. Los pacientes tratados con Adalimumab/metotrexato demostraron una progresión radiográfica significativamente menor que los pacientes tratados sólo con metotrexato a los 6 y 12 meses (ver Tabla 3).
Tabla 3. Cambios radiográficos medios durante 12 meses en el Ensayo de artritis reumatoide III
|
Placebo/MTXa |
Adalimumab/MTX 40 mg en semanas alternas |
Placebo/MTX-Adalimumab/MTX (ICb 95%) |
Valor p |
|
|
Índice Total de Sharp |
2.7 |
0.1 |
2.6 (1.4, 3.8) |
<0,001c |
|
Índice de erosión |
1.6 |
0.0 |
1,6 (0.9, 2,2) |
<0,001 |
|
Índice JSNd |
1.0 |
0.1 |
0,9 (0,3, 1,4) |
0,002 |
a Metotrexato.
b IC 95% para las diferencias en el cambio de los índices entre metotrexato y Adalimumab.
c Basado en análisis de rango.
d Estrechamiento del espacio articular.
En la extensión abierta del estudio de artritis reumatoide III, la reducción en la frecuencia de la progresión del daño estructural se mantuvo durante 8 y 10 años en un subgrupo de pacientes. A los 8 años se evaluaron radiográficamente 81 de los 207 pacientes tratados con Adalimumab 40 mg en semanas alternas. De los pacientes analizados, 48 no mostraron progresión del daño estructural, definido como un cambio desde el basal en el mTSS de 0.5 o menos. A los 10 años, 79 de 207 pacientes originalmente tratados con 40 mg de Adalimumab en semanas alternas se evaluaron radiográficamente. De éstos, 40 pacientes no mostraron progresión del daño estructural definido por un cambio desde el basal en el mTSS modificado de 0.5 o menos.
En el ensayo de artritis reumatoide V, el daño estructural en las articulaciones se valoró radiográficamente y se expresó como cambio en el Índice Total de Sharp modificado (ver Tabla 4).
Tabla 4. Principales cambios radiográficos en la Semana 52 en el Ensayo de artritis reumatoide V
|
MTX n = 257 (IC 95%) |
Adalimumab n = 274 (IC 95%) |
Adalimumab/MTX n = 268 (IC 95%) |
Valor pª |
Valor pb |
Valor pc |
|
|
Índice total de Sharp |
5.7 (4.2-7.3) |
3.0 (1.7-4.3) |
1.3 (0.5-2.1) |
<0.001 |
0.0020 |
<0.001 |
|
Índice de erosión |
3.7 (2.7-4.7) |
1.7 (1.0-2.4) |
0.8 (0.4-1.2) |
<0.001 |
0.0082 |
<0.001 |
|
Índice JSN |
2.0 (1.2-2.8) |
1.3 (0.5-2.1) |
0.5 (0-1.0) |
<0.001 |
0.0037 |
0.151 |
ª Valor p se refiere a la comparación del par de valores correspondientes a la monoterapia con metotrexato y la terapia combinada con Adalimumab/metotrexato usando la prueba de Mann-Whitney U.
b Valor p se refiere a la comparación del par de valores correspondientes a la monoterapia con Adalimumab y la terapia combinada con Adalimumab/metotrexato usando la prueba de Mann-Whitney U.
c Valor p se refiere a la comparación del par de valores correspondientes a la monoterapia con Adalimumab y la monoterapia con metotrexato usando la prueba de Mann-Whitney U.
En las siguientes 52 semanas y en las 104 semanas de tratamiento, el porcentaje de pacientes sin progresión (cambio de la línea base del Índice Total de Sharp ≤0.5) fue significativamente mayor con la terapia combinada Adalimumab/metotrexato (63.8% y 61.2% respectivamente) en comparación con la monoterapia con metotrexato (37.4% y 33.5% respectivamente, p <0.001) y con la monoterapia con Adalimumab (50.7%, p <0.002 y 44.5%, p <0.001 respectivamente).
En la extensión abierta del ensayo de artritis reumatoide V, el cambio medio desde la basal en el Índice Total de Sharp modificado a los 10 años fue de 10.8, 9.2 y 3.9 en los pacientes inicialmente aleatorizados a recibir metotrexato en monoterapia, Adalimumab en monoterapia y la combinación Adalimumab/metotrexato respectivamente. La proporción correspondiente de pacientes sin progresión radiográfica fue de 31.3%, 23.7% y 36.7 respectivamente.
Calidad de vida y rendimiento físico:
La calidad de vida relacionada con la salud y el rendimiento físico se evaluaron usando el índice de discapacidad del Cuestionario de Evaluación del Estado de Salud HAQ (Health Assessment Questionnaire) en los cuatro ensayos originales controlados, siendo éste uno de los objetivos fundamentales a la Semana 52 en el ensayo de artritis reumatoide III. En los cuatro ensayos, todas las dosis/pautas de Adalimumab mostraron de forma estadísticamente significativa superioridad en la mejoría en el índice de discapacidad del HAQ desde el nivel basal hasta el mes 6 comparado con placebo, y en el ensayo de artritis reumatoide III se observó lo mismo a la Semana 52. Los resultados del Cuestionario de Salud Abreviado SF 36 (Short Form Health Survey) para todas las dosis/pautas de Adalimumab en los cuatro ensayos respaldan estos hallazgos, con unos resultados del resumen del componente físico PCS (Physical Component Summary) estadísticamente significativos, así como unos resultados estadísticamente significativos en la escala de dolor y de la vitalidad para la dosis de 40 mg en semanas alternas. Se ha observado una disminución estadísticamente significativa de la fatiga, medida mediante la escala de valoración funcional del tratamiento de enfermedades crónicas FACIT (Functional Assessment of Chronic lllness Therapy) en los tres ensayos en los que se evaluó (ensayos de artritis reumatoide I, III, IV).
En el ensayo de artritis reumatoide III, la mayoría de los pacientes que consiguieron mejora en la función física y continuaron el tratamiento, mantuvieron la mejora durante las 520 semanas (120 meses) de tratamiento abierto. La mejora en la calidad de vida se midió hasta la Semana 156 (36 meses) manteniéndose a lo largo de este periodo de tiempo.
En el ensayo de artritis reumatoide V, la mejoría en el índice de discapacidad del Cuestionario HAQ y del componente físico del SF 36 mostró una mejora superior (p <0.001) para la combinación Adalimumab/metotrexato frente a la monoterapia con metotrexato y la monoterapia con Adalimumab en la Semana 52, que se mantuvo en la Semana 104. Entre los 250 sujetos que completaron la extensión abierta del estudio, las mejorías en la función física se mantuvieron durante los 10 años de tratamiento.
Enfermedad de Crohn en adultos:
Se valoró la seguridad y la eficacia de Adalimumab en más de 1,500 pacientes con enfermedad de Crohn moderada a grave (Índice de Actividad de la Enfermedad de Crohn (CDAl) ≥220 y ≤450) en ensayos aleatorizados doble-ciego controlados con placebo. Se permitieron tratamientos con dosis estables de aminosalicilatos, corticosteroides y/o agentes inmunomoduladores, y el 80% de los pacientes continuaron recibiendo como mínimo uno de estos medicamentos.
Se evaluó la inducción de la remisión clínica (definida como CDAI <150) en dos ensayos, ensayo de enfermedad de Crohn I (CLASSIC I) y ensayo de enfermedad de Crohn II (GAIN). En el ensayo de enfermedad de Crohn I, 299 pacientes que no habían recibido tratamiento previo con antagonistas del TNF, fueron aleatorizados a uno de los siguientes 4 grupos de tratamiento: placebo en las Semanas 0 y 2, 160 mg de Adalimumab en la Semana 0 y 80 mg en la Semana 2, 80 mg en la Semana 0 y 40 mg en la Semana 2, o bien 40 mg en la Semana 0 y 20 mg en la Semana 2. En el ensayo de enfermedad de Crohn II, 325 pacientes que habían dejado de responder o eran intolerantes a infliximab fueron aleatorizados para recibir 160 mg de Adalimumab en la Semana 0 y 80 mg en la Semana 2 o bien placebo en las Semanas 0 y 2. Los pacientes no-respondedores primarios fueron excluidos de los ensayos y, por tanto, no fueron evaluados.
En el ensayo de enfermedad de Crohn III (CHARM) se evaluó el mantenimiento de la remisión clínica. En el ensayo de enfermedad de Crohn III, 854 pacientes recibieron en el periodo abierto 80 mg en la Semana 0 y 40 mg en la Semana 2. En la Semana 4 los pacientes fueron aleatorizados a 40 mg en semanas alternas, 40 mg semanales o placebo, con una duración total del ensayo de 56 semanas. Los pacientes que respondieron clínicamente (disminución en CDAI ≥70) en la Semana 4 fueron estratificados y analizados por separado de aquellos que no habían respondido en la Semana 4. La reducción de la dosis de corticosteroides se permitió después de la Semana 8.
Las tasas de inducción de la remisión y respuesta de los ensayos de enfermedad de Crohn I y II se presentan en la Tabla 5.
Tabla 5. Inducción de remisión clínica y la respuesta (porcentaje de pacientes)
|
Ensayo de enfermedad de Crohn I: Pacientes sin tratamiento previo con lnfliximab |
Ensayo de enfermedad de Crohn II: Pacientes con tratamiento previo con Infliximab |
||||
|
Placebo N = 74 |
Adalimumab 80/40 mg N = 75 |
Adalimumab 160/80 mg N = 76 |
Placebo N = 166 |
Adalimumab 160/80 mg N = 159 |
|
|
Semana 4 |
|||||
|
Remisión clínica |
12% |
24% |
36%* |
7% |
21%* |
|
Respuesta clínica (CR-100) |
24% |
37% |
49%** |
25% |
38%** |
Todos los p-valores se refieren a la comparación del par de valores proporcionales para Adalimumab versus placebo.
* p <0.001.
** p <0.001.
Se observaron incidencias similares de remisión para los regímenes de inducción 160/80 mg y 80/40 mg en la Semana 8, siendo los efectos adversos más frecuentes en el grupo 160/80 mg. En el ensayo de enfermedad de Crohn III, en la Semana 4, el 58% (499/854) de los pacientes presentaban respuesta clínica, y fueron evaluados en el análisis primario. En aquellos pacientes que presentaban respuesta clínica en la Semana 4, el 48% habían recibido previamente tratamiento con otro anti-TNF. Las tasas de mantenimiento de la remisión y la respuesta se presentan en la Tabla 6.
Tabla 6. Mantenimiento de la remisión clínica y la respuesta (porcentaje de pacientes)
|
Placebo |
40 mg Adalimumab en semanas alternas |
40 mg Adalimumab semanales |
|
|---|---|---|---|
|
Semana 26 |
N = 170 |
N = 172 |
N = 157 |
|
Remisión clínica |
17% |
40%* |
47%* |
|
Respuesta clínica (CR-100) |
27% |
52%* |
52%* |
|
Pacientes con remisión libre de esteroides durante ≥90 díasª |
3% (2/66) |
19% (11/58)** |
15% (11/74)** |
|
Semana 56 |
N = 170 |
N = 172 |
N = 157 |
|
Remisión clínica |
12% |
36%* |
41%* |
|
Respuesta clínica (CR-100) |
17% |
41%* |
48%* |
|
Pacientes con remisión libre de esteroides durante ≥90 díasª |
5% (3/66) |
29% (17/58)* |
20% (15/74)** |
* p <0,001 comparación del par de valores proporcionales para Adalimumab versus placebo.
** p < 0,02 comparación del par de valores proporcionales para Adalimumab versus placebo.
ª De aquellos que recibían corticosteroides al inicio del ensayo.
Los resultados de remisión clínica permanecieron relativamente constantes, independientemente de si había un tratamiento previo con antagonistas del TNF o no.
Las hospitalizaciones y cirugías relacionadas con la enfermedad se redujeron de forma estadísticamente significativa con Adalimumab comparado con placebo en la Semana 56.
Entre los pacientes que no respondieron en la Semana 4, el 43% de los pacientes en tratamiento de mantenimiento con Adalimumab respondió hasta la Semana 12, comparado con el 30% de los pacientes con placebo. Estos resultados sugieren que algunos pacientes que no habían respondido en la Semana 4 se benefician del tratamiento continuado de mantenimiento hasta la Semana 12. El tratamiento continuado pasada la Semana 12 no dio lugar a una tasa de respuesta significativamente superior (ver sección Dosis y vía de administración).
Se realizó un seguimiento durante 3 años en tratamiento abierto con Adalimumab en 117/276 pacientes del ensayo I de enfermedad de Crohn y 272/777 pacientes de los ensayos II y III de enfermedad de Crohn. De éstos, 88 y 189 pacientes, respectivamente continuaron en remisión clínica. Se mantuvo la respuesta clínica (CR-100) en 102 y 233 pacientes respectivamente.
Calidad de vida:
En los ensayos de enfermedad de Crohn I y II, se consiguió una mejora estadísticamente significativa de la puntuación total en el Cuestionario de la Enfermedad Inflamatoria intestinal (IBDQ) específico de la patología, realizado en la Semana 4 en pacientes aleatorizados al tratamiento con Adalimumab 80/40 mg y 160/80 mg comparado con placebo. Estos resultados se pudieron reproducir en las Semanas 26 y 56 en los grupos de tratamiento con Adalimumab comparado con placebo durante el ensayo de enfermedad de Crohn III.
Colitis ulcerativa en adultos:
Se evaluó la seguridad y la eficacia de Adalimumab en pacientes adultos con colitis ulcerativa activa de moderada a grave (Índice de Mayo de 5 a 12 con un subíndice endoscópico de 2 a 3) en estudios aleatorizados, doble ciego, controlados con placebo (UC I y II).
En el estudio UC I, 390 pacientes sin tratamiento previo con antagonistas del TNF fueron aleatorizados para recibir placebo en las semanas 0 y 12, 160 mg de Adalimumab en la semana 0 seguido de 80 mg en la semana 2, o 80 mg de Adalimumab en la semana 0 seguido de 40 mg en la semana 2. Después de la semana 2, los pacientes de ambos grupos recibieron 40 mg seguidos. La remisión clínica (definida como un índice de Mayo ≤2 sin subíndice >1) fue evaluado en la semana 8.
En el estudio UC II, 248 pacientes recibieron 160 mg de Adalimumab en la semana 0, 80 mg en la semana 2 y 40 mg a partir de entonces, y 246 pacientes recibieron placebo. Los resultados clínicos se evaluaron para inducción a la remisión en la semana 8 y para el mantenimiento de remisión en la semana 52.
Los pacientes inducidos con 160/80 mg de Adalimumab lograron la remisión clínica frente a los que recibieron placebo en la semana 8, en un porcentaje mayor estadísticamente significativo en el estudio UC I (18% vs. 9% respectivamente, p = 0.031) y en el estudio UC II (17% vs. 9% respectivamente, p = 0.019). En el estudio UC II, entre los tratados con Adalimumab que estaban en remisión en la semana 8, 21/41 (51%) estaban en remisión en la semana 52.
De los pacientes que tuvieron una respuesta en la semana 8, 47% estaban en respuesta, 29% estaban en remisión, 41% tuvieron cicatrización de la mucosa y 21% estuvo en remisión sin uso de esteroides por ≥90 días en la semana 52.
Aproximadamente 40% de los pacientes en el estudio UC II habían fracasado en el estudio previo anti-TNF con infliximab. La eficacia de Adalimumab en esos pacientes se redujo en comparación con la de los pacientes sin experiencia previa con anti-TNF. Entre los pacientes que habían fracasado en el tratamiento anti-TNF previo, la remisión a la semana 52 se logró en un 3% con placebo y en un 10% con Adalimumab.
Los pacientes de los estudios UC I y UC tenían la opción de cambiar a un estudio abierto de extensión a largo plazo (UC III). Después de 3 años con terapia con Adalimumab, 75% (301/402) seguían en remisión clínica con un índice parcial de Mayo.
Índices de hospitalización:
Durante las 52 semanas de los estudios UC I y UC II, se observaron tasas más bajas de hospitalizaciones por cualquier causa y hospitalizaciones relacionadas con CU en el grupo tratado con Adalimumab en comparación con el grupo placebo.
El número de hospitalizaciones por todas las causas en el grupo de tratamiento con Adalimumab fue de 0.18 por paciente al año vs. 0.26 por paciente al año en el grupo placebo, el número correspondiente a las hospitalizaciones relacionadas a CU fue de 0.12 por paciente al año vs. 0.22 por paciente al año.
Calidad de vida:
En el estudio UC II (Tabla 7), el tratamiento con Adalimumab resultó en mejoras en la puntuación del cuestionario de Enfermedad Inflamatoria intestinal por sus siglas en inglés IBDQ (lnflammatory Bowel Disease Questionnaire).
Tabla 7. Remisión y respuesta clínica a la cicatrización de la mucosa en el estudio UC II (porcentaje de pacientes)
|
Placebo |
Adalimumab 40 mg |
|
|---|---|---|
|
Semana 52 |
N = 246 |
N = 248 |
|
Respuesta clínica |
18% |
30%* |
|
Remisión clínica |
9% |
17%* |
|
Cicatrización de la mucosa |
15% |
25%* |
|
Remisión por ≥90 días sin uso de esteroides |
6% |
13%* |
|
(N = 140) |
(N = 150) |
|
|
Semana 8 a 52 |
||
|
Respuesta sostenida |
12% |
24%** |
|
Remisión sostenida |
4% |
8%* |
|
Cicatrización sostenida de la mucosa |
11% |
19%* |
Remisión clínica = índice de Mayo ≤2 sin subíndice >1; la respuesta clínica es una disminución desde el inicio en el índice de mayo ≥3 y ≥30% más una disminución del índice de sangrado rectal (RBS) ≥1 o un absoluto RBS de 0 o 1; *p <0.5 de Adalimumab vs. placebo comparación de proporciones por grupos.
** p <0.001 de Adalimumab vs. placebo comparación de proporciones por grupos a de los que recibieron corticosteroides al inicio del estudio.
Uveítis en adultos:
Se evaluó la seguridad y la eficacia de Adalimumab en pacientes adultos con uveítis no infecciosa intermedia y posterior, y panuveítis, excluyendo pacientes con uveítis anterior aislada, en dos estudios aleatorizados, doble ciego, controlados con placebo (UV I y II). Los pacientes recibieron placebo o Adalimumab a una dosis inicial de 80 mg, seguido de 40 mg en semanas alternas comenzando una semana después de la dosis inicial. Se permitieron dosis estables concomitantes con un inmunosupresor no biológico.
En el estudio UV I se evaluaron 217 pacientes con uveítis activa a pesar del tratamiento con corticosteroides (prednisona oral a una dosis de entre 10 y 60 mg/día). Al comienzo del estudio, todos los pacientes recibieron una dosis estandarizada de 60 mg/día de prednisona durante 2 semanas, seguido de una pauta de reducción obligatoria, con una discontinuación completa de corticosteroides en la Semana 15.
En el estudio UV II se evaluaron 226 pacientes con uveítis inactiva que requerían tratamiento crónico basal con corticosteroides (de 10 a 35 mg/día de prednisona oral) para controlar su enfermedad.
Posteriormente, los pacientes se sometieron a una pauta de reducción obligatoria con una discontinuación completa de corticosteroides en la Semana 19.
La variable principal de eficacia en ambos estudios fue “tiempo hasta fallo del tratamiento”. Se definió el fallo a tratamiento mediante un resultado multi-componente basado en lesiones vasculares inflamatorias coriorretinianas y/o retinianas, grado de celularidad en la cámara anterior (CA), grado de turbidez vítrea (VH, por sus siglas en inglés) y mejor agudeza visual corregida (BCVA, por sus siglas en inglés).
Los pacientes que completaron los estudios UV I y UV II fueron elegibles para inscribirse en un estudio de extensión no controlado a largo plazo con una duración planificada originalmente de 78 semanas. Se permitió a los pacientes continuar con la medicación del estudio después de la Semana 78 hasta que tuvieran acceso a Adalimumab.
Respuesta clínica:
Los resultados de ambos estudios demostraron una reducción estadísticamente significativa del riesgo de fallo a tratamiento en pacientes tratados con Adalimumab versus aquellos pacientes que recibieron placebo (ver Tabla 8). Ambos estudios demostraron un efecto temprano y sostenido de Adalimumab en la tasa de fallo a tratamiento versus placebo (ver Figura 1).
Tabla 8. Tiempo hasta fallo del tratamiento en los Estudios UV I y UV II
|
Análisis Tratamiento |
N |
Fallo N (%) |
Tiempo medio hasta fallo (meses) |
HRª |
CI 95% para HRª |
Valor pb |
|
Tiempo hasta fallo del tratamiento hasta o después de la semana 6 en el Estudio UV I |
||||||
|
Análisis primario (ITT) |
||||||
|
Placebo |
107 |
84 (78.5) |
3.0 |
-- |
-- |
-- |
|
Adalimumab |
110 |
60 (54.5) |
5.6 |
0.50 |
0.36-0.70 |
<0.001 |
|
Tiempo hasta fallo del tratamiento hasta o después de la Semana 2 en el Estudio UV II |
||||||
|
Análisis primario (ITT) |
||||||
|
Placebo |
111 |
61 (55.0) |
8.3 |
-- |
-- |
-- |
|
Adalimumab |
115 |
45 (39.1) |
NEc |
0.57 |
0.39-0.84 |
0.004 |
Nota: El fallo a tratamiento hasta o después de la Semana 6 (Estudio UV I), o hasta o después de la Semana 2 (Estudio UV II), se contabilizó como evento. Las retiradas por razones diferentes al fallo a tratamiento fueron monitorizadas hasta el momento de la retirada.
a HR de Adalimumab vs placebo de regresión proporcional de riesgos con el tratamiento como factor.
b Valor p bilateral del test Log Rank.
c NE = no estimable. Menos de la mitad de que un sujeto en riesgo tuviera un evento.
Figura 1. Curvas de Kaplan-Meier que resume el Tiempo hasta Fallo del Tratamiento en o después de la Semana 6 (Estudio UV I) o de la Semana 2 (Estudio UV II)
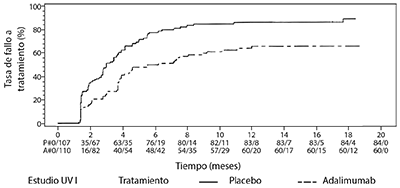
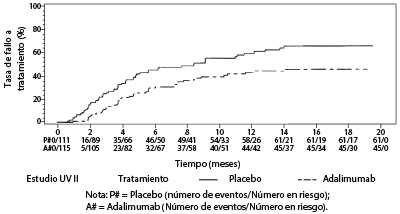
En el Estudio UV I se observaron diferencias estadísticamente significativas para cada componente del fallo a tratamiento en favor de Adalimumab versus. placebo. En el Estudio UV II, sólo se observaron diferencias estadísticamente significativas para la agudeza visual, pero los otros componentes fueron numéricamente favorables a Adalimumab. De los 424 sujetos incluidos en la extensión no controlada a largo plazo de los Estudios UV I y UV II, 60 de los sujetos se consideraron no elegibles (p. ej., por desviaciones o por complicaciones secundarias a retinopatía diabética, debido a la cirugía de cataratas o a una vitrectomía) y fueron excluidos del análisis primario de eficacia. De los 364 pacientes restantes, 269 pacientes evaluables (74%) alcanzaron las 78 semanas de tratamiento abierto con Adalimumab. Basándose en el enfoque de los datos observados, 216 (80.3%) fueron en inactividad (no lesiones inflamatorias activas, grado de celularidad en la cámara anterior ≤0.5+, grado VH ≤0.5+) con una dosis concomitante de esteroides ≤7.5 mg al día, y 178 (66.2%) estaban en inactividad sin esteroides. La BCVA fue mejorada o mantenida(<5 letras de deterioro) en el 88.6% de los ojos a la semana 78. Los datos más allá de la Semana 78 fueron generalmente consistentes con estos resultados, pero la cantidad de sujetos reclutados disminuyó después de este tiempo. Generalmente, entre los pacientes que discontinuaron el estudio, el 18% fue debido a efectos adversos, y el 8% fue debido a una respuesta insuficiente al tratamiento de Adalimumab.
Calidad de vida:
Se midieron los resultados notificados por los pacientes respecto a la funcionalidad relacionada con la visión usando el cuestionario NEI VFQ-25. Adalimumab fue numéricamente favorable para la mayoría de las subpuntuaciones con diferencias medias estadísticamente significativas para visión general, dolor ocular, visión cercana, salud mental, y puntuación total en el estudio UV I, y para visión general y salud mental en el estudio UV II. En los efectos relacionados con la visión, no hubo resultados numéricamente favorables a Adalimumab para visión de color en el estudio UV I y para visión de color, visión periférica y visión cercana en el estudio UV II.
lnmunogenicidad:
La formación de anticuerpos anti-Adalimumab se asocia con un incremento en el aclaramiento y una reducción de la eficacia de Adalimumab. No existe una correlación aparente entre la presencia de anticuerpos anti-Adalimumab y la incidencia de los efectos adversos.
En pacientes con artritis idiopática juvenil poliarticular de entre 4 y 17 años, se identificaron anticuerpos anti-Adalimumab en 15.8% (27/171) de los pacientes tratados con Adalimumab. En pacientes que no estaban recibiendo tratamiento concomitante con metotrexato, la incidencia fue de 25.6% (22/86), comparado con 5.9% (5/85) cuando Adalimumab se administraba como terapia adicional al metotrexato. En pacientes con artritis idiopática juvenil poliarticular que tenían entre 2 y <4 años de edad o de 4 años o más y un peso <15 kg, se identificaron anticuerpos anti-Adalimumab en un 7% (1/15) de los pacientes, y era el único paciente que estaba recibiendo un tratamiento concomitante con metotrexato.
En pacientes con artritis asociada a entesitis, se identificaron anticuerpos anti-Adalimumab en 10.9% (5/46) de los pacientes tratados con Adalimumab. En los pacientes que no recibieron metotrexato de forma concomitante, la incidencia fue de 13.6% (3/22), comparado con el 8.3% (2/24) cuando Adalimumab se utilizó como tratamiento adicional al metotrexato.
Se determinaron a varios tiempos los anticuerpos anti-Adalimumab en pacientes en ensayos de artritis reumatoide en fase I, II y III durante un periodo de 6 a 12 meses. En los ensayos pivotales, se identificaron anticuerpos anti-Adalimumab en 5.5% (58/1053) de los pacientes tratados con Adalimumab comparado con 0.5% (2/370) de los pacientes tratados con placebo. En los pacientes que no estaban recibiendo tratamiento concomitante con metotrexato, la incidencia fue del 12.4%, comparado con el 0.6% cuando se administraba Adalimumab como terapia adicional (add-on) al metotrexato.
En pacientes con psoriasis pediátrica, la presencia de anticuerpos anti-Adalimumab fue detectada en 5/38 sujetos (13%) tratados con 0.8 mg/kg con Adalimumab en monoterapia.
En pacientes con enfermedad de Crohn pediátrica activa de moderada a grave, la tasa de desarrollo de anticuerpos anti-Adalimumab fue de 3.3% en pacientes que recibieron Adalimumab.
En pacientes con enfermedad de Crohn, se identificaron anticuerpos anti-Adalimumab en 7 de 269 sujetos (2.6%).
En pacientes adultos con uveítis no infecciosa, se identificaron anticuerpos anti-Adalimumab en un 4.8% (12/249) de los pacientes tratados con Adalimumab.
Debido a que los análisis de inmunogenicidad son específicas de cada medicamento, no es apropiado comparar la incidencia de desarrollo de anticuerpos con la de otros medicamentos.
Hidradenitis supurativa en adultos:
Se evaluó la seguridad y la eficacia de Adalimumab en estudios aleatorizados, doble ciego, controlados con placebo y en un estudio de extensión abierto en pacientes adultos con hidradenitis supurativa (HS) de moderada a grave que eran intolerantes, tenían contraindicación o respuesta inadecuada al tratamiento con antibióticos sistémicos durante al menos tres meses. Los pacientes en HS-I y HS-II estaban en un estadio de la enfermedad Hurley II o Hurley III con al menos tres abscesos o nódulos inflamatorios.
En el estudio HS-I (PIONEER I) se evaluó a 307 pacientes en dos periodos de tratamiento. En el Periodo A, los pacientes recibieron placebo o Adalimumab a una dosis inicial de 160 mg en la Semana 0, 80 mg en la Semana 2, y 40 mg semanales comenzando en la Semana 4 hasta la Semana 11. No se permitió el uso concomitante de antibiótico durante el estudio. Después de 12 semanas de tratamiento, los pacientes que habían recibido Adalimumab en el Periodo A fueron re-aleatorizados en el Periodo B a 1 de 3 grupos de tratamiento (Adalimumab 40 mg semanal, Adalimumab 40 mg en semanas alternas o placebo de la Semana 12 a la Semana 35). Los pacientes aleatorizados a placebo en el Periodo A fueron asignados para recibir Adalimumab 40 mg semanal en el Periodo B.
En el estudio HS-II (PIONEER II) se evaluó a 326 pacientes en dos periodos de tratamiento. En el Periodo A, los pacientes recibieron placebo o Adalimumab a una dosis inicial de 160 mg en la Semana 0, 80 mg en la Semana 2, y 40 mg semanales, comenzando en la Semana 4 hasta la Semana 11. Un 19.3% de los pacientes tenían tratamiento inicial continuado con antibióticos orales durante el estudio. Después de 12 semanas de tratamiento, los pacientes que habían recibido Adalimumab en el Periodo A fueron realeatorizados en el Periodo B a 1 de 3 grupos de tratamiento (Adalimumab 40 mg semanal, Adalimumab 40 mg en semanas alternas, o placebo de la Semana 12 a la Semana 35). Los pacientes aleatorizados al grupo placebo en el Periodo A fueron asignados para recibir placebo en el Periodo B.
Los pacientes que participaron en los estudios HS-I y HS-II fueron reclutados en un estudio de extensión abierto en el que se administraba Adalimumab 40 mg semanal. La exposición media en toda la población tratada con Adalimumab fue de 762 días. Durante los tres estudios, los pacientes utilizaron líquido antiséptico tópico a diario.
Respuesta clínica:
Se evaluó la reducción de las lesiones inflamatorias y la prevención del empeoramiento de abscesos y fístulas drenantes utilizando la Respuesta Clínica de Hidradenitis Supurativa (HiSCR, reducción del recuento total de abscesos y nódulos inflamatorios de al menos un 50%, sin incremento en el recuento de abscesos ni incremento en el recuento de fístulas drenantes con respecto al inicio). La reducción del dolor cutáneo asociado a la HS se evaluó utilizando una Escala de Evaluación Numérica en los pacientes que entraron al estudio con una puntuación basal al inicio de 3 o más en una escala de 11 puntos.
Una proporción significativamente mayor de pacientes tratados con Adalimumab versus. placebo alcanzó el HiSCR en la Semana 12. Una proporción significativamente mayor de pacientes en el Estudio HS-II experimentó una disminución clínicamente relevante en el dolor cutáneo asociado a HS (ver Tabla 9), en la Semana 12. El riesgo de brote de la enfermedad se redujo significativamente en los pacientes tratados con Adalimumab durante las 12 semanas iniciales de tratamiento.
Tabla 9. Resultados de eficacia a la Semana 12, Estudios HS-I y II
|
Estudio HS I |
Estudio HS II |
|||
|
Placebo |
Adalimumab 40 mg semanal |
Placebo |
Adalimumab 40 mg semanal |
|
|
Respuesta clínica de la hidradenitis supurativa (HiSCR)a |
N = 154.40 (26.0%) |
N = 153.64 (41.8%)* |
N = 163.45 (27.6%) |
N = 163.96 (58.9%) |
|
≥30% reducción en el dolor cutáneob |
N = 109.27 (24.8%) |
N = 122.34 (27.9%) |
N = 111.23 (20.7%) |
N = 105.48 (45.7%)*** |
* p < 0.05, ***p < 0.001, Adalimumab vs. placebo.
a De todos los pacientes aleatorizados.
b De todos los pacientes con una evaluación inicial de dolor cutáneo asociado a HS ≥3, según una Escala de Evaluación Numérica de 0 - 10; 0 = sin dolor cutáneo, 10 = tanto dolor cutáneo como puedas imaginar.
El tratamiento con Adalimumab 40 mg semanal redujo significativamente el riesgo de empeoramiento de abscesos y fístulas drenantes. En las 12 primeras semanas de tratamiento en los Estudios HS-I y HS-II, de manera aproximada, dos veces la proporción de pacientes en el grupo de placebo comparado con aquellos en el grupo de Adalimumab experimentaron un empeoramiento de abscesos (23.0% vs. 11.4%, respectivamente) y fístulas drenantes (30.0% vs. 13.9%, respectivamente).
En la Semana 12 se demostraron mejorías superiores desde el inicio comparado con placebo en la calidad de vida relacionada con la salud específica para piel, medida por el Índice de Calidad de Vida en Dermatología (DLQI, Estudios HS-I y HS-II); la satisfacción global del paciente con el tratamiento farmacológico medida por el Cuestionario de Satisfacción con el Tratamiento - medicación (TSQM, Estudios HS-I y HS-II), y la salud física medida por la puntuación del componente físico del SF-36 (Estudio HS-I).
En la Semana 12, en los pacientes con al menos una respuesta parcial a Adalimumab 40 mg semanal, la tasa HiSCR en la Semana 36 fue superior entre aquellos pacientes que continuaron en tratamiento semanal 73 con Adalimumab que en aquellos pacientes en los que se redujo la frecuencia de la dosis a semanas alternas o en los que se retiró el tratamiento (ver Tabla 10).
Tabla 10. Proporción de pacientesª que alcanzaron respuesta HiSCRb en las Semanas 24 y 36 después de la reasignación de tratamiento de Adalimumab semanal en la Semana 12
|
Placebo (retirada de tratamiento) N = 73 |
Adalimumab 40 mg semanas alternas N = 70 |
Adalimumab 40 mg semanales N = 70 |
|
|
Semana 24 |
24 (32.9%) |
36 (51.4%) |
40 (57.1%) |
|
Semana 36 |
22 (30.1%) |
28 (40.0%) |
39 (55.7%) |
a Pacientes con al menos una respuesta parcial a Adalimumab 40 mg semanal después de 12 semanas de tratamiento.
b Pacientes que cumplieron el criterio especificado en protocolo para pérdida de respuesta o no mejoría y que requirieron abandonar los estudios y ser contabilizados como no-respondedores.
En aquellos pacientes que tuvieron al menos una respuesta parcial en la Semana 12, y que recibieron tratamiento semanal continuo con Adalimumab, el índice HiSCR en la Semana 48 fue del 68.3% y del 65.1% en la Semana 96. No se identificaron nuevos hallazgos de seguridad durante el tratamiento a largo plazo con Adalimumab 40 mg semanal durante 96 semanas.
En aquellos pacientes en los que el tratamiento con Adalimumab fue retirado en la Semana 12 en los Estudios HS-I y HS-II, el índice HiSCR alcanzó niveles similares a los observados antes de la retirada, 12 semanas después de la reintroducción de Adalimumab 40 mg semanal (56.0%).
Población pediátrica:
Artritis idiopática juvenil (AlJ):
Artritis idiopática juvenil poliarticular (AlJp):
Se han evaluado la seguridad y la eficacia de Adalimumab en dos ensayos (AlJp I y II) en niños con artritis idiopática juvenil poliarticular activa o de curso poliarticular, que tenían una variedad de tipos de AlJ (más frecuentemente factor reumatoide negativo o poliartritis positiva y oligoartritis extendida).
AlJp I:
Se ha evaluado la seguridad y eficacia de Adalimumab en un ensayo multicéntrico, aleatorizado, doble ciego, de grupo paralelo en 171 niños (de 4 a 17 años) con AlJ poliarticular. En una fase inicial abierta los pacientes fueron estratificados en dos grupos, tratados con metotrexato (MTX) o no tratados con metotrexato (no-MTX). Los pacientes del estrato no-MTX fueron tanto pacientes nave como pacientes a los que se les había retirado el metotrexato al menos dos semanas antes de la administración del fármaco. Los pacientes permanecieron en dosis estables de antiinflamatorios no esteroideos (AINE) o prednisona (≤0.2 mg/kg/día o 10 mg/día máximo). En la fase inicial abierta todos los pacientes recibieron 24 mg/m2 hasta un máximo de 40 mg de Adalimumab en semanas alternas durante 16 semanas. La distribución de pacientes por edad y dosis mínima, media y máxima recibida durante la fase inicial abierta se presenta en la Tabla 11.
Tabla 11. Distribución de pacientes por edad y dosis de Adalimumab recibida en la fase inicial abierta
|
Grupo de edad |
Número inicial de pacientes n (%) |
Dosis mínima, media y máxima |
|
4 a 7 años |
31 (18.1) |
10, 20 y 25 mg |
|
8 a 12 años |
71 (41.5) |
20, 25 y 40 mg |
|
13 a 17 años |
69 (40.4) |
25, 40 y 40 mg |
Los pacientes que demostraron respuesta ACR pediátrico-30 en la Semana 16 fueron candidatos para ser aleatorizados en una fase doble ciego, y recibir durante 32 semanas adicionales o hasta la exacerbación de la enfermedad Adalimumab 24 mg/m2 hasta un máximo de 40 mg, o placebo en semanas alternas. Los criterios de exacerbación se definieron como un empeoramiento ≥30% desde el nivel basal en ≥3 de 6 criterios ACR-pediátricos básicos, ≥2 articulaciones activas, y una mejora del 30% en no más de 1 de los 6 criterios. Después de 32 semanas de tratamiento o en la exacerbación de la enfermedad, los pacientes fueron candidatos para ser enrolados en la fase de extensión abierta (Tabla 12).
Tabla 12. Respuesta ACR-pediátrico 30 en el ensayo de AlJ
|
Estrato |
MTX |
No-MTX |
||
|
Fase |
||||
|
Inicial abierta tras 16 semanas |
||||
|
Respuesta ACR-pediátrico 30 (n/N) |
94.1% (80/85) |
74.4% (64/86) |
||
|
Resultados de eficacia |
||||
|
32 semanas doble ciego |
Adalimumab/MTX (N = 38) |
Placebo/MTX (N = 37) |
Adalimumab (N = 30) |
Placebo (N = 28) |
|
Recrudecimiento de la enfermedad después de 32 semanasª (n/N) |
36,8% (14/38) |
64,9% (24/37)b |
43,3% (13/30) |
71,4% (20/28)c |
|
Tiempo medio de exacerbación de la enfermedad |
>32 semanas |
20 semanas |
>32 semanas |
14 semanas |
a Respuestas ACR-pediátrico 30/50/70 en la Semana 48 significativamente mayores que aquellos pacientes tratados con placebo.
b p = 0.015
c p = 0.031
Entre aquellos pacientes respondedores a la Semana 16 (n = 144), las respuestas ACR-pediátrico 30/50/70/90 se mantuvieron durante seis años en la fase de extensión abierta en pacientes que recibieron Adalimumab a lo largo del ensayo. Un total de 19 sujetos, de los cuales 11 pertenecían inicialmente al grupo de edad de 4 a 12 y 8 al grupo de 13 a 17 años, fueron tratados durante 6 años o más.
La respuesta global fue generalmente mejor y, menos pacientes desarrollaron anticuerpos cuando fueron tratados con Adalimumab y Metotrexato en comparación con Adalimumab solo. Teniendo en cuenta estos resultados, se recomienda el uso de Adalimumab en combinación con Metotrexato y para uso en monoterapia en pacientes para los que el uso de Metotrexato no es apropiado (ver sección Dosis y vía de administración).
AlJp II:
Se ha evaluado la eficacia y la seguridad de Adalimumab en un estudio abierto, multicéntrico en 32 niños (entre 2 y <4 años de edad o de 4 años o más y un peso <15 kg) con AlJ poliarticular activa de moderada a grave. Los pacientes recibieron 24 mg/m2 de área de superficie corporal de Adalimumab hasta un máximo de 20 mg en semanas alternas como una dosis única vía inyección subcutánea durante al menos 24 semanas. Durante el estudio, la mayoría de los sujetos se trataron con metotrexato concomitante, con unas pocas notificaciones de tratamientos con corticosteroides o AINE.
En las Semanas 12 y 24, la respuesta PedACR30 fue del 93.5% y del 90.0%, respectivamente, usando la aproximación de observación de datos. La proporción de pacientes con PedACR50/70/90 en la Semana 12 y en la Semana 24 fue del 90.3%/61.3%/38.7% y del 83.3%/73.3%/36.7%, respectivamente. De aquellos pacientes que respondieron (ACR 30 pediátrico) en la Semana 24 (n = 27 de 30 pacientes), la respuesta ACR 30 pediátrica se mantuvo hasta 60 semanas en la fase de extensión abierta en los pacientes que recibieron Adalimumab a lo largo de este periodo de tiempo. En total, 20 sujetos fueron tratados durante 60 semanas o más.
Artritis asociada a entesitis:
Se evaluó la seguridad y eficacia de Adalimumab en un estudio multicéntrico, aleatorizado, doble-ciego en 46 pacientes pediátricos (de 6 a 17 años) con artritis asociada a entesitis moderada. Los pacientes se aleatorizaron para recibir 24 mg/m2 de área de superficie corporal (ASC) de Adalimumab hasta un máximo de 40 mg o placebo en semanas alternas durante 12 semanas. Tras el periodo doble ciego se continuó con un periodo abierto (PA) durante el que los pacientes recibieron 24 mg/m2 de ASC de Adalimumab hasta un máximo de 40 mg en semanas alternas por vía subcutánea durante 192 semanas adicionales. La variable principal del ensayo fue el porcentaje de cambio respecto al inicial de la Semana 12 en el número de articulaciones activas con artritis (inflamación no atribuida a la deformación o articulaciones con pérdida de movilidad más dolor y/o sensibilidad), que se alcanzó con una media de -62.6% (cambio porcentual medio de -88.9%) en pacientes en el grupo de Adalimumab comparado con el -11.6% (cambio porcentual medio -50%) en pacientes en el grupo placebo. Durante el PA se mantuvo la mejora en el número de articulaciones activas con artritis hasta la Semana 156 para los 26 de 31 pacientes (84%) del grupo de Adalimumab que permanecieron en el estudio. A pesar de que no sea estadísticamente significativo, la mayoría de los pacientes mostraron mejoras clínicas en variables secundarias como el número de zonas de entesitis, el recuento de articulaciones dolorosas (RAD), el recuento de articulaciones inflamadas (RAI), la repuesta ACR 50 pediátrica y la respuesta ACR 70 pediátrica.
Psoriasis pediátrica en placas:
La eficacia de Adalimumab fue evaluada en un ensayo aleatorizado, doble ciego y controlado de 114 pacientes pediátricos desde los 4 años de edad con psoriasis crónica en placas grave (definida por un PGA ≥4 o un BSA >20% o >10% con lesiones muy gruesas o con una respuesta PASI ≥20 o ≥10 con afectación clínica relevante en cara, genitales o manos/pies) con un control inadecuado con terapia tópica, helioterapia o fototerapia.
Se administró a los pacientes Adalimumab 0.8 mg/kg (hasta 40 mg) o 0.4 mg/kg (hasta 20 mg) en semanas alternas, o metotrexato (MTX) 0.1-0.4 mg/kg semanalmente (hasta 25 mg). En la Semana 16, el número de pacientes aleatorizados al tratamiento con Adalimumab 0.8 mg/kg con respuesta de eficacia positiva (por ejemplo, PASI 75) fue mayor que de los pacientes aleatorizados al tratamiento 0.4 mg/kg en semanas alternas o aquellos con MTX (ver Tabla 11).
Tabla 13. Resultados de eficacia de psoriasis pediátrica en placas a las 16 semanas
|
MTXa N = 37 |
Adalimumab 0.8 mg/kg en semanas alternas N = 38 |
|
|
PASI 75b |
12 (32.4%) |
22 (57.9%) |
|
PGA: Sin lesiones/mínimas lesionesc |
15 (40.5%) |
23 (60.5%) |
a MTX = metotrexato
b P=0.027, Adalimumab 0.8 mg/kg versus MTX
c P=0.083, Adalimumab 0.8 mg/kg versus MTX
A los pacientes que alcanzaron una respuesta PASI 75 y PGA de sin lesiones o mínimas lesiones se les retiró el tratamiento durante un máximo de 36 semanas y fueron monitorizados para evaluar la pérdida del control de la enfermedad (empeoramiento de PGA en al menos 2 grados). Tras este periodo de tiempo se reinició el tratamiento con Adalimumab 0.8 mg/kg en semanas alternas durante 16 semanas observándose un índice de respuesta muy similar al obtenido previamente en el ensayo doble ciego: respuesta PASI 75 de 78.9% (15 de 19 pacientes) y PGA de sin lesiones o mínimas lesiones de 52.6% (10 de 19 pacientes).
Durante la fase abierta del estudio, la respuesta a PASI 75 y el PGA de sin lesiones o mínimas lesiones se mantuvieron durante al menos 52 semanas adicionales sin nuevos hallazgos relevantes de seguridad.
Enfermedad de Crohn pediátrica:
Se valoró Adalimumab mediante un ensayo clínico multicéntrico, aleatorizado, doble ciego diseñado para evaluar la eficacia y seguridad del tratamiento de inducción y mantenimiento con dosis dependientes del peso corporal (<40 kg o ≥40 kg) en 192 pacientes pediátricos con edades comprendidas entre 6 y 17 (inclusive) años, con enfermedad de Crohn de moderada a grave definida como una puntuación en el Índice de actividad de la enfermedad de Crohn pediátrica (PCDAI) >30. Los sujetos tenían que haber fallado a terapia convencional (incluyendo un corticosteroide y/o un inmunomodulador) para EC. Además, previamente los sujetos podían haber perdido respuesta o sido intolerantes a infliximab.
Todos los sujetos recibieron un tratamiento de inducción abierto con dosis dependientes del peso corporal al inicio, 160 mg en la Semana 0 y 80 mg en la Semana 2 para pacientes ≥40 kg, y 80 mg y 40 mg, respectivamente, para pacientes con peso <40 kg.
En la Semana 4, los sujetos fueron aleatorizados 1:1 según su peso corporal en ese momento a los regímenes de mantenimiento a Dosis Bajas o a Dosis Estándar que se muestran en la Tabla 14.
Tabla 14. Régimen de mantenimiento
|
Peso del paciente |
Dosis Bajas |
Dosis estándar |
|
<40 kg |
10 mg semanas alternas |
20 mg semanas alternas |
|
40 kg |
20 mg semanas alternas |
40 mg semanas alternas |
Resultados de eficacia:
La variable principal del estudio fue la remisión clínica en la Semana 26, definida como una puntuación en el PCDAI ≤10.
Las tasas de remisión clínica y de respuesta clínica (definidas como una reducción en la puntuación del PCDAI de al menos 15 puntos desde el inicio) se presentan en la Tabla 15.
Tabla 15. Estudio de EC pediátrica PCDAI Remisión y respuesta clínica
|
Dosis estándar 40/20 mg Semanas alternas N = 93 |
Dosis bajas 20/10 mg Semanas alternas N = 95 |
Valor p* |
|
|---|---|---|---|
|
Semana 26 |
|||
|
Remisión clínica |
38.7% |
28.4% |
0.075 |
|
Respuesta clínica |
59.1% |
48.4% |
0.073 |
|
Semana 52 |
|||
|
Remisión clínica |
33.3% |
23.2% |
0.100 |
|
Respuesta clínica |
41.9% |
28.4% |
0.038 |
* Valor p para la comparación Dosis estándar versus Dosis baja.
Las tasas de interrupción de corticosteroides o inmunomoduladores se presentan en la Tabla 16.
Tabla 16. Estudio de EC pediátrica Interrupción de corticosteroides o inmunomoduladores y remisión de fístulas
|
Dosis estándar 40/20 mg semanas alternas |
Dosis bajas 20/10 mg semanas alternas |
Valor p1 |
|
|
Interrupción de corticosteroides |
N = 33 |
N = 38 |
|
|
Semana 26 |
84.8% |
65.8% |
0.066 |
|
Semana 52 |
69.7% |
60.5% |
0.420 |
|
Interrupción de inmunomo-duladores2 |
N = 60 |
N = 57 |
|
|
Semana 52 |
30.0% |
29.8% |
0.983 |
|
Remisión de fístulas3 |
N = 15 |
N = 21 |
|
|
Semana 26 |
46.7% |
38.1% |
0.608 |
|
Semana 52 |
40.0% |
23.8% |
0.303 |
1 Valor p para la comparación Dosis estándar versus. Dosis bajas.
2 El tratamiento con inmunosupresores sólo se puede interrumpir en o después de la semana 26 a criterio del investigador si el sujeto cumple los criterios de la respuesta clínica.
3 Definido como cierre de todas las fístulas que fueron drenando desde el inicio hasta al menos dos visitas consecutivas post-basal.
En ambos grupos de tratamiento se observaron aumentos estadísticamente significativos (mejoras) desde el inicio hasta las Semanas 26 y 52 en el índice de masa corporal y velocidad de crecimiento.
En ambos grupos de tratamiento se observaron también mejoras estadística y clínicamente significativas desde el inicio para parámetros de calidad de vida (incluyendo IMPACT III). 100 pacientes (n = 100) del Estudio de enfermedad de Crohn pediátrica continuaron en una extensión abierta del estudio a largo plazo. Tras 5 años de tratamiento con Adalimumab, el 74% de los 50 pacientes que siguieron en el estudio (37/50) continuaron en remisión clínica, y el 92% de los pacientes (46/50) continuaron en respuesta clínica, según PCDAI.
Comparabilidad farmacocinética de Adalimumab con el medicamento de referencia:
Adalimumab es un medicamento biosimilar al medicamento de referencia. Se ha demostrado la biosimilaridad con respecto a las características fisicoquímicas y los resultados de eficacia y seguridad.
Adalimumab ha demostrado ser biosimilar al medicamento de referencia en un estudio de brazos paralelos, aleatorio, doble ciego, de dosis única, de tres brazos en voluntarios sanos.
Estudios de PK en voluntarios sanos:
En los estudios de dosis única de PK en voluntarios sanos, el patrón y la naturaleza de los eventos adversos (EA) informados después de la administración de Adalimumab fueron comparabIes con el medicamento de referencia. Los eventos adversos más comúnmente observados fueron infecciones e infestaciones (principalmente nasofaringitis y rinitis), trastornos del sistema nervioso (principalmente dolor de cabeza), trastornos respiratorios y torácicos y mediastínicos (principalmente dolor orofaríngeo) y trastornos gastrointestinales (principalmente dolor abdominal, distensión abdominal, náuseas y diarrea). Los perfiles de seguridad fueron similares entre Adalimumab y el medicamento de referencia.
lnmunogenicidad:
Los números y las proporciones de pacientes con respuestas positivas de ADA fueron similares entre los grupos de medicamentos Adalimumab y de referencia durante TP1 y durante todo el estudio en los grupos de tratamiento continuo; los NAb se detectaron en proporciones similares entre los grupos.
En resumen, el programa clínico para Adalimumab confirma una eficacia terapéutica comparable y un perfil de seguridad e inmunogenicidad comparable de Adalimumab y el medicamento de referencia, por lo tanto, por lo tanto, sustenta la biosimilaridad.
Absorción y distribución:
Tras la administración subcutánea en semanas alternas de 24 mg/m2 (máximo de 40 mg) en pacientes con artritis idiopática juvenil poliarticular (AlJ) que tenían entre 4 y 17 años, la concentración plasmática media de Adalimumab en estado estacionario (valores medidos de la Semana 20 a la 48) fue 5.6 ± 5.6 μg/mL (102% CV) con Adalimumab sin metotrexato concomitante y 10.9 ± 5.2 μg/mL (47.7% CV) con metotrexato concomitante.
En pacientes con AlJ poliarticular que tenían de 2 a <4 años o de 4 años o más y un peso <15 kg dosificados con 24 mg/m2 de Adalimumab, la concentración plasmática media de Adalimumab en estado estacionario fue 6.0 ± 6.1 μg/mL (101% CV) para Adalimumab sin metotrexato concomitante y 7.9 ± 5.6 μg/mL (71.2% CV) con metotrexato concomitante.
Tras la administración de 24 mg/m2 (máximo de 40 mg) por vía subcutánea en semanas alternas en pacientes de 4 a 17 años con artritis asociada a entesitis, la concentración media de Adalimumab en estado estacionario (valores medidos en la Semana 24) fue de 8.8 ± 6.6 μg/mL para Adalimumab sin metotrexato concomitante y 11.8 ± 4.3 μg/mL con metotrexato concomitante.
Después de la administración de 0.8 mg/kg (máximo de 40 mg) subcutáneamente en semanas alternas a pacientes pediátricos con psoriasis en placas crónica, la media de concentración ± DS de Adalimumab en estado estacionario fue aproximadamente un 7.4 ± 5.8 μg/mL (79% CV).
En pacientes pediátricos con enfermedad de Crohn de moderada a grave, la dosis de inducción con Adalimumab fue de 160/80 mg u 80/40 mg en las Semanas 0 y 2, respectivamente, dependiendo de un corte de 40 kg de peso corporal. En la Semana 4, los pacientes fueron aleatorizados 1:1 en grupos de tratamiento de mantenimiento según su peso corporal a la Dosis Estándar (40/20 mg en semanas alternas) o Dosis Baja (20/10 mg en semanas alternas). La media (± DS) de la concentración sérica valle de Adalimumab alcanzada en la Semana 4 fue 15.7 ± 6.6 μg/mL para pacientes ≥40 kg (160/80 mg) y 10.6 ± 6.1 μg/mL para pacientes <40 kg (80/40 mg).
Para aquellos pacientes que permanecieron en el tratamiento aleatorizado, la media (± DS) de la concentración valle de Adalimumab en la Semana 52 fue de 9.5 ± 5.6 μg/mL para el grupo de la Dosis estándar y 3.5 ± 2.2 μg/mL para el grupo de Dosis bajas. Se mantuvo la media de las concentraciones valle en los sujetos que continuaron el tratamiento con Adalimumab en semanas alternas durante 52 semanas. Para aquellos pacientes en los que se produjo una escalada de dosis del régimen de semanas alternas a semanalmente, la media (± DS) de las concentraciones séricas de Adalimumab en la Semana 52 fueron 15.3 ± 11.4 μg/mL (40/20 mg semanalmente) y 6.7 ± 3.5 (20/10 mg semanalmente).
Relación exposición-respuesta en población pediátrica:
Basándose en los datos de ensayos clínicos en pacientes con AlJ (AlJp y ARE) se estableció una relación exposición-respuesta entre las concentraciones plasmáticas y la respuesta PedACR50. La concentración plasmática aparente de Adalimumab que produce la mitad del máximo de probabilidad de respuesta PedACR50 (EC50) fue 3 μg/mL (95% IC: 1-6 μg/mL).
Las relaciones exposición-respuesta entre la concentración de Adalimumab y la eficacia en pacientes pediátricos con placas psoriásicas crónicas graves se establecieron por PASI 75 y PGA de sin lesiones o mínimas, respectivamente. PASI 75 y PGA de sin lesiones o mínimas aumentó con el aumento de las concentraciones de Adalimumab ambas con un EC50 aparente de aproximadamente 4.5 μg/mL (95% IC 0.4-47.6 y 1.9-10.5, respectivamente).
Adultos:
La absorción y distribución de Adalimumab tras la administración subcutánea de una dosis única de 40 mg, fue lenta, alcanzándose las concentraciones plasmáticas máximas a los 5 días después de la administración. La media de la biodisponibilidad absoluta de Adalimumab fue del 64%, estimada a partir de tres ensayos con una dosis subcutánea única de 40 mg. Tras la administración intravenosa de dosis únicas en un rango de 0.25 a 10 mg/kg, las concentraciones fueron proporcionales a la dosis.
Tras la administración de dosis de 0.5 mg/kg (~40 mg), el aclaramiento osciló en un el rango de 11 a 15 mL/hora, el volumen de distribución (Vss) entre 5 y 6 litros, y la semivida media de eliminación terminal fue aproximadamente dos semanas. Las concentraciones de Adalimumab en el líquido sinovial, determinadas en varios pacientes con artritis reumatoide, oscilaron entre el 31 y el 96% de las plasmáticas.
Tras la administración subcutánea de 40 mg de Adalimumab en semanas alternas en pacientes adultos con artritis reumatoide (AR), la media de las concentraciones en el estado estacionario fue aproximadamente 5 μg/mL (sin tratamiento concomitante con metotrexato) y 8 a 9 μg/mL (con metotrexato concomitante), respectivamente. Los niveles plasmáticos de Adalimumab en estado estacionario aumentaron más o menos proporcionalmente con la dosis tras la administración subcutánea de 20, 40 y 80 mg en semanas alternas y cada semana.
En pacientes adultos con hidradenitis supurativa, una dosis de 160 mg de Adalimumab en la Semana 0 seguida de 80 mg en la Semana 2 alcanzan concentraciones séricas de Adalimumab de aproximadamente de 7 a 8 μg/mL en la Semana 2 y en la Semana 4. La media de las concentraciones del estado estacionario en la Semana 12 hasta la Semana 36 fueron aproximadamente de 8 a 10 μg/mL durante el tratamiento con Adalimumad 40 mg cada semana de tratamiento.
En pacientes con enfermedad de Crohn, la dosis de carga de 80 mg de Adalimumab en la Semana 0 seguida de 40 mg de Adalimumab en la Semana 2 alcanzan concentraciones séricas de Adalimumab de aproximadamente 5.5 μg/mL durante el periodo de inducción. Una dosis de carga de 160 mg de Adalimumab en la Semana 0 seguido de 80 mg de Adalimumab en la Semana 2 alcanza concentraciones séricas de Adalimumab de aproximadamente 12 μg/mL durante el periodo de inducción. La media de los niveles en estado estacionario de aproximadamente 7 μg/mL se observaron en pacientes con enfermedad de Crohn que recibieron una dosis de mantenimiento de 40 mg de Adalimumab en semanas alternas.
En pacientes adultos con uveítis, la dosis de carga de 80 mg de Adalimumab en la Semana 0 seguida de 40 mg de Adalimumab en semanas alternas, empezando en la Semana 1, derivó en concentraciones medias del estado estacionario de aproximadamente de 8 a 10 μg/mL.
La modelización y simulación de la farmacocinética/farmacodinámica y la farmacocinética de la población predijo una exposición a Adalimumab y eficacia similar en pacientes tratados con 80 mg cada dos semanas comparado con 40 mg semanal (incluyendo pacientes adultos con AR, HS, CU, EC o Ps, pacientes con HS adolescente, y pacientes pediátricos ≥40 kg con EC).
Eliminación:
Los análisis farmacocinéticos poblacionales con datos de aproximadamente 1,300 pacientes con AR revelaron una tendencia a una correlación directa entre el incremento aparente del aclaramiento de Adalimumab y el peso corporal. Después de un ajuste según las diferencias de peso corporal, se observó que el efecto del sexo y la edad sobre el aclaramiento de Adalimumab era mínimo. Los niveles plasmáticos de Adalimumab libre (no unido a anticuerpos anti-Adalimumab, AAA) eran inferiores en pacientes con AAA cuantificables.
Insuficiencia hepática o renal:
Adalimumab no se ha estudiado en pacientes con insuficiencia hepática o renal.
Género:
No se observaron diferencias farmacocinéticas relacionadas con el género después de la corrección del peso corporal del paciente.
Raza:
No se esperarían diferencias en el aclaramiento de inmunoglobulina entre las razas. A partir de datos limitados en no caucásicos, no se observaron diferencias cinéticas importantes para Adalimumab.
Insuficiencia renal y hepática:
No hay datos farmacocinéticos disponibles en pacientes con insuficiencia renal o hepática.
Estados de enfermedad:
Los voluntarios sanos y los pacientes con AR mostraron una farmacocinética de Adalimumab similar.
CONTRAINDICACIONES:
HYRIMOZ® no debe ser administrado a pacientes con hipersensibilidad conocida a Adalimumab o a cualquiera de sus excipientes.
HYRIMOZ® no se debe administrar si se diagnostica tuberculosis activa u otras infecciones graves tales como sepsis, e infecciones oportunistas (ver sección de Precauciones generales), ni en pacientes con insuficiencia cardiaca moderada a grave (NYHA clases III/IV) (ver sección de Precauciones generales).
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Uso durante el embarazo:
Un gran número de embarazos (aproximadamente 2,100) seguidos de forma prospectiva y expuestos a Adalimumab, resultando en nacimientos con vida conocidos, incluyendo más de 1,500 expuestos durante el primer trimestre, no indican un aumento en la tasa de malformación en el recién nacido.
En un registro de cohortes prospectivo, fueron reclutadas 257 mujeres con artritis reumatoide (AR) o enfermedad de Crohn (EC) tratadas con Adalimumab al menos durante el primer trimestre, y 120 mujeres con AR o EC no tratadas con Adalimumab. La variable principal fue la prevalencia de las principales anomalías congénitas que se dan al nacer. La tasa de embarazos que terminan con, al menos, un recién nacido vivo con un defecto congénito grave fue de 6/69 (8.7%) en mujeres con AR tratadas con Adalimumab y 5/74 (6.8%) en mujeres con AR sin tratamiento (OR no ajustado 1.31, 95% IC 0.38-4.52) y 16/152 (10.5%) en mujeres con EC tratadas con Adalimumab y 3/32 (9.4%) en mujeres con EC no tratadas (OR no ajustado 1.14, IC 95% 0.31-4.16). El OR ajustado (teniendo en cuenta las diferencias basales) fue de 1.10 (IC del 95% 0.45 a 2.73) para AR y EC combinadas. No hubo diferencias claras entre las mujeres tratadas con Adalimumab y las no tratadas para las variables secundarias de abortos espontáneos, defectos congénitos menores, parto prematuro, tamaño al nacer e infecciones graves u oportunistas, y no se notificaron nacimientos de niños muertos o neoplasias malignas. La interpretación de los datos puede verse afectada debido a las limitaciones metodológicas del estudio, incluyendo el pequeño tamaño de la muestra y el diseño no aleatorizado.
Debido a la inhibición del TNFα, la administración de Adalimumab durante el embarazo podría afectar a la respuesta inmune normal en el recién nacido. El uso durante el embarazo deberá ser realizado bajo supervisión médica y sólo en caso de ser claramente necesario.
Adalimumab puede atravesar la placenta al suero de niños nacidos de madres tratadas con Adalimumab durante el embarazo. Como consecuencia, estos niños pueden tener un riesgo incrementado de infecciones. No se recomienda la administración de vacunas vivas (p. ej., vacuna BCG) a niños expuestos a Adalimumab en el útero hasta 5 meses después de la última inyección de Adalimumab de la madre durante el embarazo.
Uso durante la lactancia:
La información limitada extraída de la literatura publicada indica que Adalimumab se excreta a través de la leche materna en concentraciones muy bajas, con una presencia de Adalimumab en leche humana en concentraciones del 0.1% al 1% del nivel sérico materno. Administrada por vía oral, la inmunoglobulina G se somete a proteólisis intestinal y tiene una biodisponibilidad escasa. No se prevén efectos en neonatos/lactantes alimentados con leche materna. En consecuencia, Adalimumab puede usarse durante la lactancia.
REACCIONES SECUNDARIAS Y ADVERSAS:
Resumen del perfil de seguridad:
Adalimumab se ha estudiado en 9,506 pacientes en ensayos pivotales controlados y abiertos durante un máximo de 60 meses o más. Estos ensayos clínicos incluyeron pacientes con artritis reumatoide reciente o de larga duración, artritis idiopática juvenil (artritis idiopática juvenil poliarticular y artritis asociada a entesitis, enfermedad de Crohn, colitis ulcerosa, hidradenitis supurativa y uveítis. Los datos están basados en ensayos pivotales controlados que abarcaron 6,089 pacientes tratados con Adalimumab y 3,801 pacientes con placebo o comparador activo durante el periodo controlado.
La proporción de pacientes que interrumpió el tratamiento debido a reacciones adversas durante la fase doble ciego y controlada de los ensayos pivotales fue 5.9% para los pacientes tratados con Adalimumab y 5.4% para el grupo control.
Las reacciones adversas notificadas más frecuentemente fueron infecciones (como nasofaringitis, infección del tracto respiratorio superior y sinusitis), reacciones en el lugar de inyección (eritema, picores, hemorragia, dolor o hinchazón), cefalea y dolor músculo esquelético. Se han notificado reacciones adversas graves con Adalimumab. Los antagonistas del TNF, como Adalimumab, afectan al sistema inmune, su uso puede afectar a la defensa del cuerpo contra infecciones y cáncer.
Se han notificado también en asociación con el uso de Adalimumab infecciones mortales o que amenazan la vida del paciente (incluyendo sepsis, infecciones oportunistas y tuberculosis), reactivación del VHB y varios tipos de tumores (incluyendo leucemia, linfoma y linfoma hepatoesplénico de células T).
También se han notificado reacciones hematológicas, neurológicas y autoinmunes graves. Éstas incluyen notificaciones raras de pancitopenia, anemia aplásica, acontecimientos desmielinizantes centrales y periféricos y notificaciones de lupus, enfermedades relacionadas con lupus y síndrome de Stevens-Johnson.
Población pediátrica:
En general, las reacciones adversas en pacientes pediátricos fueron similares en frecuencia y tipo a las observadas en pacientes adultos.
Tabla de reacciones adversas
La siguiente lista de reacciones adversas se basa en la experiencia de ensayos clínicos y en la experiencia postcomercialización y se enumeran según el sistema MedDRA de clasificación por órganos y frecuencia (SOC) en la Tabla 17: muy frecuentes (≥1/10); frecuentes (≥1/100 a <1/10); poco frecuentes (≥1/1,000 a <1/100); raras (≥1/10,000 a <1/1,000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Las frecuencias incluidas son las más altas observadas en las diferentes indicaciones.
En los casos en los que se incluye información adicional en las secciones de Contraindicaciones, Precauciones generales y Reacciones secundarias y adversas, aparece un asterisco(*) en la columna Sistema de clasificación de órganos.
Tabla 17. Reacciones adversas
|
Sistema de clasificación de órganos |
Frecuencia |
Reacciones adversas |
|---|---|---|
|
Infecciones e infestaciones* |
Muy frecuentes |
Infecciones del tracto respiratorio (incluyendo infecciones respiratorias del tracto inferior y superior, neumonía, sinusitis, faringitis, nasofaringitis y neumonía por herpes virus) |
|
Frecuentes |
Infecciones sistémicas (incluyendo sepsis, candidiasis y gripe infecciones intestinales (incluyendo gastroenteritis viral), infecciones de la piel y tejidos blandos (incluyendo paroniquia, celulitis, impétigo, fascitis necrotizante y herpes zóster), infección de oídos, infecciones orales (incluyendo herpes simple, herpes oral e infecciones dentales), infecciones del tracto reproductor (incluyendo infección micótica vulvovaginal), infecciones del tracto urinario (incluyendo pielonefritis), infecciones fúngicas, infecciones de las articulaciones |
|
|
Poco frecuentes |
Infecciones neurológicas (incluyendo meningitis viral), infecciones oportunistas y tuberculosis (incluyendo coccidiomicosis, histoplasmosis, infecciones por el complejo Mycobacterium avium), infecciones bacterianas, infecciones oculares, diverticulitis1 |
|
|
Neoplasias benignas, malignas y no especificadas (incluyendo quistes y pólipos)* |
Frecuentes |
Cáncer de piel excluido el melanoma (incluyendo carcinoma de células basales y carcinoma de células escamosas), neoplasia benigna |
|
Poco frecuentes |
Linfoma**, neoplasia de órganos sólidos (incluyendo cáncer de mama, neoplasia pulmonar y neoplasia tiroidea), melanoma** |
|
|
Raras |
Leucemia1 |
|
|
No conocida |
Linfoma hepatoesplénico de células T1, carcinoma de células de Merkel (carcinoma neuroendocrino de la piel)1 |
|
|
Trastornos de la sangre y del sistema linfático* |
Muy frecuentes |
Leucopenia (incluyendo neutropenia y agranulocitosis), anemia |
|
Frecuentes |
Leucocitosis, trombocitopenia |
|
|
Poco frecuentes |
Púrpura trombocitopénica idiopática |
|
|
Raras |
Pancitopenia |
|
|
Trastornos del sistema inmunológico* |
Frecuentes |
Hipersensibilidad, alergias (incluyendo alergia estacional) |
|
Poco frecuentes |
Sarcoidosis1, vasculitis |
|
|
Raras |
Anafilaxia1 |
|
|
Trastornos del metabolismo y de la nutrición |
Muy frecuentes |
Lípidos elevados |
|
Frecuentes |
Hipocaliemia, incremento de ácido úrico, sodio plasmático anormal, hipocalcemia, hiperglucemia, hipofosfatemia, deshidratación |
|
|
Trastornos psiquiátricos |
Frecuentes |
Cambios de humor (incluyendo depresión) ansiedad, insomnio |
|
Trastornos del sistema nervioso* |
Muy frecuentes |
Cefalea |
|
Frecuentes |
Parestesias, (incluyendo hipoestesia), migraña, compresión de la raíz nerviosa |
|
|
Poco frecuentes |
Accidente cerebrovascular1, temblor, neuropatía |
|
|
Raras |
Esclerosis múltiple, trastornos desmielinizantes (por ejemplo, neuritis óptica, síndrome de Guillain-Barré)1 |
|
|
Trastornos oculares |
Frecuentes |
Alteración visual, conjuntivitis, blefaritis, hinchazón de ojos |
|
Poco frecuentes |
Diplopía |
|
|
Trastornos del oído y del laberinto |
Frecuentes |
Vértigo |
|
Poco frecuentes |
Sordera, tinnitus |
|
|
Trastornos cardiacos* |
Frecuentes |
Taquicardia |
|
Poco frecuentes |
Infarto de miocardio1, arritmia, insuficiencia cardiaca congestiva |
|
|
Raras |
Paro cardiaco |
|
|
Trastornos vasculares |
Frecuentes |
Hipertensión, rubor, hematomas |
|
Poco Frecuentes |
Aneurisma aórtico, oclusión vascular arterial, tromboflebitis |
|
|
Trastornos respiratorios, torácicos y mediastínicos* |
Frecuentes |
Asma, disnea, tos |
|
Poco frecuentes |
Embolia pulmonar1, enfermedad pulmonar intersticial, enfermedad pulmonar obstructiva crónica, neumonitis, derrame pleural1 |
|
|
Raras |
Fibrosis pulmonar1 |
|
|
Trastornos gastrointestinales |
Muy frecuentes |
Dolor abdominal, náuseas y vómitos |
|
Frecuentes |
Hemorragia gastrointestinal, dispepsia, enfermedad de reflujo gastroesofágico, síndrome del ojo seco |
|
|
Poco frecuentes |
Pancreatitis, disfagia, edema facial |
|
|
Raras |
Perforación intestinal1 |
|
|
Trastornos hepatobiliares* |
Muy frecuentes |
Enzimas hepáticas aumentadas |
|
Poco frecuentes |
Colecistitis y colelitiasis, esteatosis hepática, incremento de la bilirrubina |
|
|
Raras |
Hepatitis, reactivación de la hepatitis B1, hepatitis autoinmune1 |
|
|
No conocida |
Insuficiencia hepática1 |
|
|
Trastornos de la piel y del tejido subcutáneo |
Muy frecuentes |
Erupción (incluyendo erupción exfoliativa) |
|
Frecuentes |
Empeoramiento de la psoriasis existente o psoriasis de nueva aparición (incluyendo psoriasis pustulosa palmoplantar)1, urticaria, aumento de moretones (incluyendo púrpura), dermatitis (incluyendo eccema), onicoclasis, hiperhidrosis, alopecia1, prurito |
|
|
Poco frecuentes |
Sudores nocturnos, cicatrices |
|
|
Raras |
Eritema multiforme1, síndrome de Stevens-Johnson1, angioedema1, vasculitis cutánea1, reacción liquenoide en la piel1 |
|
|
No conocida |
Empeoramiento de los síntomas de la dermatomiositis1 |
|
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Muy frecuentes |
Dolor musculoesquelético |
|
Frecuentes |
Espasmos musculares (incluyendo incrementos plasmáticos de la creatina fosfoquinasa) |
|
|
Poco frecuentes |
Rabdomiolisis, lupus eritematoso sistémico |
|
|
Raros |
Síndrome tipo lupus1 |
|
|
Trastornos renales y urinarios |
Frecuentes |
Insuficiencia renal, hematuria |
|
Poco frecuentes |
Nicturia |
|
|
Trastornos del aparato reproductor y de la mama |
Poco frecuentes |
Disfunción eréctil |
|
Trastornos generales y alteraciones en el lugar de administración* |
Muy frecuentes |
Reacción en el lugar de inyección (incluyendo eritema en el lugar de inyección) |
|
Frecuentes |
Dolor torácico, edema, pirexia1 |
|
|
Poco frecuentes |
Inflamación |
|
|
Exploraciones complementarias* |
Frecuentes |
Alteraciones en la coagulación y el sangrado (incluyendo prolongación del tiempo de tromboplastina parcial activada), presencia de autoanticuerpos (incluyendo anticuerpos de ADN bicatenario), incremento de la lactato deshidrogenasa plasmática |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Frecuentes |
Alteración de la cicatrización |
* Se incluye información adicional en las secciones Contraindicaciones, Precauciones generales y Reacciones secundarias y adversas.
** Incluyendo los estudios de extensión abierta.
1 Incluyendo los datos de notificaciones espontáneas.
Hidradenitis supurativa:
El perfil de seguridad de los pacientes con hidradenitis supurativa en tratamiento semanal con Adalimumab fue consistente con el perfil de seguridad conocido de Adalimumab.
Uveítis:
El perfil de seguridad de los pacientes con uveítis en tratamiento con Adalimumab en semanas alternas fue consistente con el perfil de seguridad conocido de Adalimumab.
Descripción de reacciones adversas seleccionadas:
Reacciones en el lugar de inyección:
En los ensayos controlados pivotales en adultos y niños, el 12.9% de los pacientes tratados con Adalimumab desarrollaron reacciones en el sitio de inyección (eritema y/o picores, hemorragia, dolor o hinchazón), comparado con el 7.2% de los pacientes tratados con placebo o control activo. No se consideró necesario interrumpir el medicamento debido a las reacciones en el lugar de administración.
Infecciones:
En los ensayos controlados pivotales en adultos y niños, la incidencia de infecciones fue de 1.51 por paciente/año en los pacientes tratados con Adalimumab y 1.46 por paciente/año en los pacientes tratados con placebo y control activo. Las infecciones consistieron fundamentalmente en nasofaringitis, infecciones del tracto respiratorio superior y sinusitis. La mayoría de los pacientes continuaron con Adalimumab tras resolverse la infección.
La incidencia de infecciones graves fue de 0.04 por paciente/año en los pacientes tratados con Adalimumab y 0.03 por paciente/año en los pacientes tratados con placebo y control activo.
En ensayos controlados abiertos en adultos y pediátricos con Adalimumab, se han notificado infecciones graves (incluyendo las mortales, que han ocurrido en casos raros), entre las que se incluyen notificaciones de tuberculosis (incluida la miliar y la localización extrapulmonar) e infecciones oportunistas invasivas (por ejemplo: histoplasmosis diseminada o extrapulmonar, blastomicosis, coccidioidomicosis, pneumocystis, candidiasis, aspergilosis y listeriosis). La mayoría de los casos de tuberculosis tuvieron lugar durante los primeros ocho meses del tratamiento y reflejan la exacerbación de una enfermedad latente.
Enfermedades neoplásicas malignas y trastornos linfoproliferativos:
No se han observado enfermedades neoplásicas malignas durante los ensayos con Adalimumab en 249 pacientes pediátricos de artritis idiopática juvenil (artritis idiopática juvenil poliarticular y artritis asociada a entesitis) con una exposición de 655.6 pacientes/año. Adicionalmente, no se observaron enfermedades neoplásicas malignas en 192 pacientes pediátricos con una exposición de 498.1 pacientes/año durante ensayos de Adalimumab en pacientes pediátricos con enfermedad de Crohn. No se han observado enfermedades neoplásicas malignas en 77 pacientes pediátricos con una exposición de 80.0 pacientes/año durante un ensayo de Adalimumab en pacientes pediátricos con psoriasis en placas crónica. No se observaron enfermedades neoplásicas malignas en 60 pacientes pediátricos con una exposición de 58.4 pacientes/año durante un ensayo de Adalimumab en pacientes pediátricos con uveítis.
Durante las fases controladas de los ensayos clínicos pivotales con Adalimumab en adultos que duraron un mínimo de 12 semanas en pacientes con artritis reumatoide activa de moderada a grave, hidradenitis supurativa, enfermedad de Crohn, colitis ulcerosa y uveítis, se observaron enfermedades neoplásicas malignas, diferentes a linfoma y cáncer de piel (tipo no melanoma), con una incidencia de 6.8 (4.4-10.5) por 1.000 pacientes/año (IC 95%) en los 5,291 pacientes tratados con Adalimumab, frente a una incidencia de 6.3 (3.4-11.8) por 1,000 pacientes/año en los 3,444 pacientes del grupo control (la duración media del tratamiento fue de 4 meses para los pacientes tratados con Adalimumab y de 3.8 meses para los pacientes tratados del grupo control). La incidencia de cáncer de piel (tipo no melanoma) fue de 8.8 (6.0-13.0) por 1,000 pacientes/año (IC 95%) en los pacientes tratados con Adalimumab y 3.2 (1.3-7.6) por 1,000 pacientes/año en los pacientes control. De estos casos de cáncer de piel, el carcinoma de células escamosas se produjo con una incidencia de 2.7 (1.4-5.4) por 1,000 pacientes/año (IC 95%) en los pacientes tratados con Adalimumab y de un 0.6 (0.1-4.5) por 1,000 pacientes/año en los pacientes del grupo control. La incidencia de linfomas fue de 0.7 (0.2-2.7) por 1,000 pacientes/año (IC 95%) entre los pacientes tratados con Adalimumab y de 0.6 (0.1-4.5) por 1,000 pacientes/año en los pacientes del grupo control.
Cuando se combinan los datos obtenidos en las fases controladas de estos ensayos clínicos y los ensayos de extensión abiertos en curso y completados, con una duración media aproximada de 3.3 años que incluyen 6,427 pacientes y más de 26,439 pacientes/año de tratamiento, la incidencia observada de enfermedades neoplásicas malignas, excluyendo linternas y cáncer de piel (tipo no melanoma), es de aproximadamente 8.5 por 1,000 pacientes/año. La incidencia observada de cáncer de piel (tipo no melanoma) es de aproximadamente un 9.6 por 1,000 pacientes/año. La incidencia observada de linfomas es de aproximadamente 1.3 por 1,000 pacientes/año.
En la experiencia postcomercialización desde enero de 2003 a diciembre de 2010, principalmente en pacientes con artritis reumatoide, la incidencia registrada de enfermedades neoplásicas malignas es aproximadamente de 2.7 por 1,000 pacientes tratados/año. La frecuencia registrada para cáncer de piel (tipo no melanoma) y linfomas es de aproximadamente 0.2 y 0.3 por 1,000 pacientes tratados/año, respectivamente (ver sección de Precauciones generales).
Durante la comercialización se han notificado casos raros de linfoma hepatoesplénico de células T en pacientes tratados con Adalimumab (ver sección de Precauciones generales).
Autoanticuerpos:
Se analizaron muestras séricas a distintos tiempos de los pacientes para la detección de autoanticuerpos en los ensayos I-V de artritis reumatoide. En dichos ensayos, el 11.9% de los pacientes tratados con Adalimumab y el 8.1% de los pacientes tratados con placebo y control activo que tuvieron títulos de anticuerpos antinucleares basales negativos dieron títulos positivos en la semana 24. Ningún paciente desarrolló lupus, nefritis o síntomas a nivel del sistema nervioso central.
Efectos hepatobiliares:
En los ensayos clínicos controlados fase 3 de Adalimumab en pacientes con artritis reumatoide con un rango de duración del periodo de control de 4 a 104 semanas, se produjo un aumento de ALT ≥3 SLN en un 3.7% de los pacientes tratados con Adalimumab y en un 1.6% de los pacientes del grupo control.
En los ensayos clínicos controlados fase 3 de Adalimumab en pacientes de 4 a 17 años con artritis idiopática juvenil poliarticular y en pacientes de 6 a 17 años con artritis asociada a entesitis, se produjo un aumento de ALT ≥3 SLN en un 6.1% de los pacientes tratados con Adalimumab y en un 1.3% de los pacientes del grupo control. La mayoría de los aumentos de ALT se produjeron con el uso en combinación con metotrexato. No se produjeron aumentos de la ALT ≥3 SLN en los ensayos de fase 3 de Adalimumab en pacientes con artritis idiopática juvenil poliarticular de 2 a <4 años de edad.
En los ensayos clínicos controlados fase 3 de Adalimumab en pacientes con enfermedad de Crohn y colitis ulcerosa con un rango de duración del periodo de control de 4 a 52 semanas, se produjo un aumento de ALT ≥3 SLN en un 0.9% de los pacientes tratados con Adalimumab y en un 0.9% de los pacientes del grupo control.
En los ensayos Fase 3 de Adalimumab en pacientes con enfermedad de Crohn pediátrica en los que se evaluó la eficacia y la seguridad de dos regímenes de dosificación ajustados por peso corporal en mantenimiento tras un tratamiento de inducción ajustado por peso corporal hasta 52 semanas de tratamiento, se observaron aumentos de la ALT ≥ 3 sobre el límite normal en el 2.6% (5/192) de los pacientes, 4 de los cuales recibieron inmunosupresores concomitantes inicialmente.
En los ensayos clínicos controlados fase 3 de Adalimumab en pacientes con psoriasis en placas con un rango de duración del periodo de control de 12 a 24 semanas, se produjo un aumento de ALT ≥ 3 SLN en un 1.8% de los pacientes tratados con Adalimumab y en un 1.8% de los pacientes del grupo control.
No se produjeron aumentos de ALT ≥ 3 SLN en los ensayos clínicos fase 3 de Adalimumab en pacientes pediátricos con psoriasis en placas.
En ensayos controlados con Adalimumab (dosis inicial de 160 mg en la semana 0 y 80 mg en la semana 2, seguido de 40 mg semanales a partir de la semana 4), se produjeron aumentos de ALT ≥3 SLN en un 0.3% de los pacientes tratados con Adalimumab y un 0.6% de los pacientes del grupo control, en pacientes con hidradenitis supurativa con una duración del periodo control de 12 a 16 semanas.
En los ensayos clínicos controlados con Adalimumab (dosis inicial de 80 mg en la semana 0 seguido de 40 mg en semanas alternas comenzando en la semana 1) en pacientes adultos con uveítis hasta 80 semanas con una exposición media de 166.5 días y 105 días para pacientes en tratamiento con Adalimumab y pacientes control respectivamente, se produjeron aumentos de ALT ≥3 SLN en un 2.4% de los pacientes en tratamiento con Adalimumab y en un 2.4% en los pacientes control.
En los ensayos clínicos de todas las indicaciones, los pacientes con ALT elevada fueron asintomáticos y en la mayoría de los casos estos aumentos fueron transitorios y se resolvieron en el curso del tratamiento. Sin embargo, en pacientes que han recibido Adalimumab, se han notificado además casos de fallo hepático, así como afecciones hepáticas menos graves que pueden preceder a la insuficiencia hepática, tales como hepatitis, incluida la hepatitis autoinmune, en el periodo de postcomercialización.
Tratamiento concomitante con azatioprina/6-mercaptopurina:
En estudios de enfermedad de Crohn con pacientes adultos, se vieron mayores incidencias de neoplasias malignas y efectos adversos relacionados con infecciones graves con la combinación de Adalimumab y azatioprina/6-mercaptopurina comparado con Adalimumab solo.
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas.
Eventos adversos con Adalimumab:
Durante el periodo de tratamiento 1 (PT1), 239 pacientes (51.4%) informaron un total de 541 Eventos Adversos (EA). No hubo diferencias relevantes con respecto a las proporciones que informaron EA (generales y relacionados con el tratamiento), EA graves, EA de interés especial, EA que requieren la interrupción o interrupción del fármaco del estudio debido a EA.
Las infecciones e infestaciones fueron la clase de órgano del sistema más comúnmente afectada (23.9%), con la nasofaringitis notificada con mayor frecuencia (6.0%).
Excepto para el carcinoma de células basales, los términos preferidos para los EA de interés especial fueron informados por no más de dos pacientes en cualquiera de los grupos de tratamiento.
No hubo diferencias relevantes entre los grupos de tratamiento cambiado y continuado con respecto a las proporciones que informaron EA y EA graves durante las semanas 17-51.
Las tasas de EA informados fueron similares para la mayoría de las clases de órganos del sistema y los términos preferidos. Se observaron diferencias de >10% en los trastornos gastrointestinales, que fueron reportados por el 3.2% de los pacientes en el grupo Adalimumab de referencia (ref-ADMB) a Adalimumab en comparación con el 14.2% de los pacientes en el grupo continuo ref-ADMB.
Los términos preferidos fueron generalmente informados por <5% de los pacientes en cualquier grupo de tratamiento, excepto por nasofaringitis, infección del tracto respiratorio superior, hipertensión y dolor de cabeza. Un paciente en el grupo Adalimumab continuo (con antecedentes de depresión) murió el día 178 (PT2) debido a suicidio; esto no se consideró relacionado con el tratamiento del estudio.
Las diferencias en las proporciones de pacientes con EA de interés especial fueron < 5% entre los grupos de tratamiento conmutado o continuado (Tabla 18). No se observó agrupamiento de ninguna AE de interés especial; a excepción de la trombocitopenia, herpes zóster y anemia, se informaron eventos de cada término preferido para no más de un paciente por grupo. No se informó hipersensibilidad al Adalimumab al intercambiar.
Tolerabilidad:
Durante PT1, la proporción de pacientes que informaron ISR fue de 6.5% con Adalimumab y 3.4% con ref-ADMB. Durante las semanas 17 a 51, la proporción de pacientes que informaron ISR se mantuvo en <4.8% por grupo de tratamiento y fue similar en los grupos de tratamiento intercambiado y continuo.
La mayoría de los ISR fueron de gravedad leve o moderada; un paciente que cambió de Adalimumab a ref-ADMB informó un dolor intenso en el lugar de la inyección.
Ninguno de los ISR informados durante el estudio se consideró grave, y no se informaron reacciones alérgicas o anafilácticas.
Tabla 18. Incidencia de eventos adversos por grupo de tratamiento (grupo de análisis de datos)
|
Periodo de tratamiento 1 (aleatorización a la semana 17) |
Periodo de tratamiento 2 + fase de extensión (semanas 17-51) |
|||||
|---|---|---|---|---|---|---|
|
Ref-ADMB (n = 234) |
HYRIMOZ® (n = 231) |
Ref-ADMB continuo (n = 127) |
Ref- ADMB a HYRIMOZ® (n = 63) |
HYRIMOZ® continuo (n = 126) |
Intercambio HYRIMOZ® a Ref-ADMB (n = 63) |
|
|
≥1 EA |
123 (52.6) |
116 (50.2) |
71 (55.9) |
29 (46) |
66 (52.4) |
36 (57) |
|
Leve |
68 (29.1) |
72 (31.2) |
33 (26.0) |
11 (17) |
26 (20.6) |
23 (37) |
|
Moderado |
45 (19.2) |
41 (17.7) |
31 (24.4) |
14 (22) |
37 (29.4) |
12 (19) |
|
Severo |
10 (4.3) |
3 (1.3) |
7 (5.5) |
4 (6) |
3 (2.4) |
1 (2) |
|
≥1 EA |
10 (4.3) |
3 (1.3) |
8 (6.3) |
4 (6) |
3 (2.4) |
2 (3) |
|
≥1 EA relacionado con el tratamiento |
28 (12.0) |
33 (14.3) |
16 (12.6) |
10 (16) |
16 (12.7) |
9 (14) |
|
≥1 EA relacionado con el tratamientoª |
3 (1.3) |
1 (0.4) |
3 (2.4) |
2 (3) |
1 (0.8) |
0 |
|
≥1 EA de especial interésb |
17 (7.3) |
13 (5.6) |
12 (9.4) |
3 (5) |
7 (5.6) |
5 (10) |
|
≥1 reacción relacionada con el sitio de inyección |
8 (3.4) |
15 (5.6) |
5 (3.9) |
2 (3) |
4 (3.2) |
3 (5) |
|
Interrupción de tratamiento |
4 (1.7) |
5 (2.2) |
8 (6.3) |
6 (10) |
14 (11.1) |
5 (8) |
|
Discontinuación del tratamiento |
7 (3.0) |
4 (1.7) |
5 (3.9) |
2 (3) |
4 (3.2) |
1 (2) |
|
Muertes |
0 |
0 |
0 |
0 |
1 (0.8) |
0 |
Valores n (%), EA, Eventos adversos, FE, Fase de Extensión; ref-ADMB, referencia HYRIMOZ®; SAE, AE grave; PT, periodo de tratamiento
a Diez pacientes tenían un EAS que se consideraba relacionado con el tratamiento, que incluía erupción cutánea tóxica grave, neumonía moderada, celulitis grave (PT2, ref-ADMB); infección estafilocócica severa e hipersensibilidad severa (ambas en un paciente; PT1, Adalimumab), neumonía severa y pirexia moderada (PT2 + EP, ref-ADMB al grupo HYRIMOZ®), tuberculosis pulmonar severa, neumonía necrotizante severa y neumonía moderada (PT2 + FE, grupo ref-ADMB continuo) y pielonefritis moderada (PT2 + FE, grupo GP2017 continuo).
b Abarca todas las advertencias y precauciones dadas en la etiqueta para ref-ADMB, incluidas infecciones, neoplasias, reacciones alérgicas o anafilácticas, trastornos del sistema inmunitario o eventos autoinmunes, eventos neurológicos, eventos hematológicos, insuficiencia cardiaca congestiva y enfermedad pulmonar intersticial.
lnmunogenicidad:
Durante el periodo de tratamiento 1, las proporciones de pacientes que informaron al menos una respuesta de anticuerpos anti-medicamento (AA) positiva hasta la semana 17 fueron 36.8% y 34.1% en los grupos Adalimumab y ref-ADMB, respectivamente. De éstos, el 80% en cada grupo eran anticuerpos neutralizantes. Las proporciones de pacientes con al menos una respuesta AA positiva fueron similares en el grupo ref-ADMB a Adalimumab (39%) y el grupo Adalimumab continuo (35.8%). La tasa fue del 45,1% en el grupo continuo de ref-ADMB y del 47% en el grupo que cambió de Adalimumab a ref-ADMB. En los grupos de tratamiento cambiado y continuo, la mayoría de los pacientes con AA-positivo (75-100%) también dieron positivo para anticuerpos neutralizantes. Las proporciones de pacientes que desarrollaron AA después del primer cambio de tratamiento fueron similares (ver Tabla 19).
Tabla 19. Incidencia de respuesta de anticuerpos antimedicamento por grupo de tratamiento
|
Periodo de tratamiento 1 (aleatorización a la semana 17) |
Periodo de tratamiento 2 + fase de extensión (semanas 17-51) |
|||||
|
Ref-ADMB (n = 234) |
HYRIMOZ® (n = 231) |
Ref-ADMB continuo (n = 127) |
Ref-ADMB (n = 63) |
HYRIMOZ® continuo (n = 126) |
HYRIMOZ® (n = 63) |
|
|
Negativo |
145/220 (65.9) |
139/220 (54.9) |
67/122 (54.9) |
37/61 (61) |
79/123 (64.2) |
32/60 (53) |
|
Positivo |
75/220 (34.1) |
81/220 (36.8) |
55/122 (45.1) |
24/61 (39) |
44/123 (35.8) |
28/60 (47) |
|
Anticuerpos neutralizantes |
60/75 (80) |
65/81 (80) |
47/55 (85) |
24/24 (100) |
38/44 (86) |
21/28 (75) |
Los valores son la tasa de detección de anticuerpos antidrogas, n/N (%). Ref-ADMB, Adalimumab producto de referencia.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
No se han realizado estudios en animales a largo plazo con Adalimumab para evaluar su potencial carcinogénico ni sus efectos sobre la fertilidad. No se han observado efectos clastogénicos en la prueba de micronúcleos de ratón in vivo, ni efectos mutagénicos en la prueba de Ames (con Salmonella-Escherichia coli).
En un estudio de toxicidad para el desarrollo realizado en monos, no hubo indicios de toxicidad maternal, embriotoxicidad o teratogenicidad. No se dispone de datos preclínicos sobre toxicidad postnatal de Adalimumab.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Adalimumab ha sido estudiado en pacientes con artritis reumatoide y artritis idiopática juvenil poliarticular tratados con Adalimumab tanto en monoterapia como con metotrexato de forma concomitante. Cuando se administró Adalimumab junto con metotrexato, la formación de anticuerpos fue inferior en comparación con el uso como monoterapia. La administración de Adalimumab sin metotrexato resultó en un incremento de la formación de anticuerpos, del aclaramiento y redujo la eficacia de Adalimumab (ver sección de Farmacodinamia).
La administración conjunta de Adalimumab y Anakinra no está recomendada.
Interacciones farmacológicas, metotrexato:
Cuando se administró Adalimumab a 21 pacientes con AR en tratamiento estable con metotrexato, no hubo cambios estadísticamente significativos en los perfiles de concentración de metotrexato en suero. En contraste, después de una dosis única y múltiple, el metotrexato redujo los aclaramientos aparentes de Adalimumab en un 29% y 44% respectivamente. Esto es consistente con las concentraciones mínimas más altas de Adalimumab encontradas en pacientes tratados con metotrexato concomitante (ver Farmacocinética).
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Hasta el momento no se han reportado.
PRECAUCIONES GENERALES:
Trazabilidad:
Con el objetivo de mejorar la trazabilidad de los medicamentos biológicos, debe anotarse claramente el nombre comercial y el número de lote del medicamento administrado.
Infecciones:
Los pacientes que están en tratamiento con antagonistas del TNF son más susceptibles de padecer infecciones graves. La función pulmonar alterada puede incrementar el riesgo de desarrollar infecciones. Los pacientes deben ser, por lo tanto, estrechamente monitorizados para la detección de infecciones (incluyendo tuberculosis), antes, durante y después del tratamiento con Adalimumab. Dado que la eliminación de Adalimumab puede tardar hasta cuatro meses, la monitorización se debe continuar durante este periodo.
El tratamiento con Adalimumab no se debe iniciar en pacientes con infecciones activas, incluyendo infecciones crónicas o localizadas, hasta que las infecciones estén controladas. Se debe considerar el riesgo y el beneficio antes de iniciar el tratamiento con Adalimumab en pacientes que han estado expuestos a tuberculosis y en pacientes que han viajado a áreas de alto riesgo de tuberculosis o áreas endémicas de micosis, como histoplasmosis, coccidioidomicosis o blastomicosis (ver Otras infecciones oportunistas).
Los pacientes que desarrollen una nueva infección mientras estén bajo tratamiento con Adalimumab deben ser estrechamente monitorizados y sometidos a una evaluación diagnóstica completa. La administración de Adalimumab debe interrumpirse si un paciente desarrolla una infección grave nueva o sepsis, y se debe iniciar el tratamiento antimicrobiano o antimicótico apropiado hasta que la infección esté controlada. Los profesionales de la salud deben tener precaución cuando consideren el uso de Adalimumab en pacientes con antecedentes de infección recurrente o con condiciones subyacentes que puedan predisponer a los pacientes a infecciones, incluido el uso concomitante de medicamentos inmunosupresores.
Infecciones graves:
Se han notificado infecciones graves, incluyendo sepsis, de origen bacteriano, micobacteriano, fúngicas invasivas, parasitarias, virales u otras infecciones oportunistas como listeriosis, legionelosis y Pneumocystis en pacientes en tratamiento con Adalimumab.
Otras infecciones graves observadas en los ensayos clínicos incluyen neumonía, pielonefritis, artritis séptica y septicemia. Se han notificado casos de hospitalizaciones o desenlaces mortales asociados a estas infecciones.
Tuberculosis:
Se han notificado casos de tuberculosis, incluyendo reactivación y tuberculosis de nueva aparición en pacientes en tratamiento con Adalimumab. Las notificaciones incluyeron casos de tuberculosis pulmonar y extrapulmonar, es decir, diseminada.
Antes de iniciar el tratamiento con Adalimumab, se debe evaluar en todos los pacientes la existencia de tuberculosis activa e inactiva (latente). Esta evaluación debe incluir una valoración médica detallada del paciente con antecedentes de tuberculosis o posible exposición previa a personas con tuberculosis activa y tratamiento inmunosupresor previo y/o actual. Se deberán realizar pruebas de detección adecuadas (es decir, prueba cutánea de la tuberculina y radiografía de tórax) en todos los pacientes (aplicando recomendaciones locales). Se recomienda anotar en la tarjeta de información para el paciente la realización y resultados de estas pruebas. Es importante tener en cuenta como profesionales de la salud el riesgo de falsos negativos en la prueba cutánea de la tuberculina, especialmente en pacientes que están gravemente enfermos o inmunodeprimidos.
Si se diagnostica tuberculosis activa, no se debe iniciar el tratamiento con Adalimumab (ver sección Contraindicaciones).
En todas las situaciones descritas a continuación, el balance beneficio/riesgo del tratamiento con Adalimumab debe ser cuidadosamente considerado.
Si se tienen sospechas de tuberculosis latente, se debe consultar con un profesional de la salud con experiencia en el tratamiento de la tuberculosis.
Si se diagnostica tuberculosis latente, se debe iniciar el tratamiento con una profilaxis antituberculosa antes de comenzar el tratamiento con Adalimumab y de acuerdo con las recomendaciones locales. Se debe considerar también el uso de profilaxis antituberculosa antes del inicio del tratamiento con Adalimumab en pacientes con factores de riesgo múltiples o significativos a pesar de un resultado negativo en la prueba para la tuberculosis y en pacientes con antecedentes de tuberculosis latente o activa en los que no se haya podido confirmar el curso adecuado del tratamiento.
A pesar de la profilaxis para la tuberculosis, se han producido casos de reactivación de ésta en pacientes tratados con Adalimumab. Algunos pacientes que habían recibido tratamiento satisfactorio para tuberculosis activa han vuelto a desarrollar tuberculosis mientras estaban en tratamiento con Adalimumab.
Se deben dar instrucciones a los pacientes para que consulten con su profesional de la salud si apareciesen signos/síntomas que sugieran tuberculosis (p. ej., tos persistente, debilidad/pérdida de peso, febrícula, apatía) durante o después del tratamiento con Adalimumab.
Otras infecciones oportunistas:
Se han observado infecciones oportunistas, incluyendo infecciones fúngicas invasivas, en pacientes en tratamiento con Adalimumab. Estas infecciones no se han identificado de forma sistemática en pacientes en tratamiento con antagonistas del TNF, lo que ha originado retrasos en el tratamiento apropiado, en ocasiones con consecuencias mortales.
Se tendrá en cuenta la posibilidad de una infección fúngica invasiva en aquellos pacientes que desarrollen signos y síntomas como fiebre, malestar, pérdida de peso, sudoración, tos, disnea y/o infiltraciones pulmonares u otros síntomas de enfermedad sistémica grave con o sin shock concomitante. En estos pacientes se debe suspender inmediatamente la administráción de Adalimumab. El diagnóstico y la administración de tratamiento antimicótico empírico en estos pacientes se debe realizar de acuerdo con un profesional de la salud con experiencia previa en el cuidado de pacientes con infecciones fúngicas invasivas.
Reactivación de hepatitis B:
Se han producido casos de reactivación de la hepatitis B en pacientes que estaban recibiendo antagonistas del TNF (factor de necrosis tumoral), incluyendo Adalimumab, los cuales son portadores crónicos del virus (por ejemplo, antígeno de superficie positivo), en algunos casos con desenlace mortal. Se debe analizar una posible infección previa con VHB en los pacientes antes de iniciar el tratamiento con Adalimumab. Para aquellos pacientes con análisis positivo para infección de hepatitis B, se recomienda consultar con un profesional de la salud especialista en el tratamiento de la hepatitis B.
Se monitorizarán estrechamente los signos y síntomas de infección activa por VHB durante todo el tratamiento y hasta varios meses después de la finalización del tratamiento en aquellos portadores de VHB que requieran tratamiento con Adalimumab. No existen datos adecuados acerca de la prevención de la reactivación del VHB en pacientes portadores del VHB que reciban de forma conjunta tratamiento antiviral y un antagonista del TNF. En pacientes que sufran ya una reactivación del VHB, se debe interrumpir el tratamiento con Adalimumab e iniciar un tratamiento antiviral efectivo con el tratamiento de soporte apropiado.
Efectos neurológicos:
Los antagonistas del TNF incluyendo Adalimumab se han asociado en casos raros con la nueva aparición o exacerbación de los síntomas clínicos y/o evidencia radiográfica de enfermedad desmielinizante del sistema nervioso central, incluyendo esclerosis múltiple, neuritis óptica y enfermedad desmielinizante del sistema nervioso periférico, incluyendo síndrome de Guillain-Barré. Los profesionales de la salud deberán considerar con precaución el uso de Adalimumab en pacientes con trastornos desmielinizantes del sistema nervioso central o periférico preexistentes o de reciente aparición; si se desarrolla cualquiera de estos trastornos se debe considerar la interrupción del tratamiento con Adalimumab. Existe una asociación conocida entre la uveítis intermedia y los trastornos desmielinizantes centrales. Antes del inicio del tratamiento con Adalimumab y de forma regular durante el tratamiento, se debe realizar una evaluación neurológica en pacientes con uveítis intermedia no infecciosa para valorar trastornos desmielinizantes centrales preexistentes o en desarrollo.
Reacciones alérgicas:
Las reacciones alérgicas graves asociadas a Adalimumab fueron raras durante los ensayos clínicos. Las reacciones alérgicas no-graves asociadas con Adalimumab fueron poco frecuentes durante los ensayos clínicos. Se han recibido notificaciones de reacciones alérgicas graves que incluyeron anafilaxia tras la administración de Adalimumab. Si aparece una reacción anafiláctica u otra reacción alérgica grave, se debe interrumpir inmediatamente la administración de Adalimumab e iniciar el tratamiento apropiado.
lnmunosupresión:
En un estudio de 64 pacientes con artritis reumatoide que fueron tratados con Adalimumab, no se observó evidencia de descenso de hipersensibilidad retardada, descenso de los niveles de inmunoglobulinas, o cambio en el recuento de células efectoras T, B y células NK, monocitos/macrófagos, y neutrófilos.
Enfermedades neoplásicas malignas y trastornos linfoproliferativos:
En las partes controladas de los ensayos clínicos de los antagonistas del TNF, se han observado más casos de enfermedades neoplásicas malignas, incluido el linfoma, entre los pacientes que recibieron un antagonista del TNF en comparación con el grupo control, sin embargo, la incidencia fue rara. En el entorno postautorización se han notificado casos de leucemia en pacientes tratados con antagonistas del TNF. Existe un mayor riesgo basal de linfomas y leucemia en pacientes con artritis reumatoide con enfermedad inflamatoria de alta actividad, que complica la estimación del riesgo. Con el conocimiento actual, no se puede excluir un posible riesgo de desarrollo de linfomas, leucemia, y otras enfermedades neoplásicas malignas en pacientes tratados con antagonistas del TNF.
Se ha notificado la aparición de enfermedades neoplásicas malignas, algunas mortales, entre niños, adolescentes y jóvenes adultos (hasta 22 años de edad) tratados con agentes antagonistas del TNF (inicio del tratamiento ≤18 años), incluyendo Adalimumab en el entorno postautorización.
Aproximadamente la mitad de los casos fueron linfomas. Los demás casos representan una variedad de enfermedades neoplásicas malignas e incluyen cánceres raros normalmente asociados con inmunosupresión. No se puede excluir el riesgo de desarrollar enfermedades neoplásicas malignas en niños y adolescentes tratados con antagonistas del TNF.
Durante la comercialización, se han identificado casos raros de linfoma hepatoesplénico de células T en pacientes tratados con Adalimumab. Estos casos raros de linfoma de células T cursan con una progresión muy agresiva y por lo general mortal de la enfermedad. Algunos de estos linfomas hepatoesplénicos de células T con Adalimumab se han presentado en pacientes adultos jóvenes en tratamiento concomitante con azatioprina o 6-mercaptopurina utilizada para la enfermedad inflamatoria intestinal. El riesgo potencial de la combinación de azatiopina o 6-mercaptopurina y Adalimumab debe ser cuidadosamente considerado. No se puede descartar el riesgo de desarrollar linfoma hepatoesplénico de células T en pacientes tratados con Adalimumab (ver sección de Reacciones secundarias y adversas).
No se han realizado estudios que incluyan pacientes con historial de enfermedades neoplásicas malignas o en los que el tratamiento con Adalimumab continúe tras desarrollar una enfermedad neoplásica maligna. Por tanto, se deben tomar precauciones adicionales al considerar el tratamiento de estos pacientes con Adalimumab (ver sección de Reacciones secundarias y adversas).
En todos los pacientes, y en particular en aquellos que hayan recibido un tratamiento inmunosupresor extensivo o pacientes con psoriasis y tratamiento previo con PUVA, se debe examinar la presencia de cáncer de piel de tipo no-melanoma antes y durante el tratamiento con Adalimumab. Se han notificado también casos de melanoma y carcinoma de células de Merkel en pacientes en tratamiento con antagonistas del TNF, incluyendo Adalimumab (ver sección de Reacciones secundarias y adversas).
En un ensayo clínico exploratorio que evaluaba el uso de otro antagonista del TNF, infliximab, en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) de moderada a grave, se registraron más casos de enfermedades neoplásicas malignas, la mayoría del pulmón o cabeza y cuello, en pacientes en tratamiento con infliximab en comparación con el grupo control. Todos los pacientes presentaban antecedentes de tabaquismo importante. Por tanto, se debe tener especial cuidado cuando se utilice cualquier antagonista de TNF en pacientes con EPOC, así como en pacientes con un elevado riesgo de sufrir enfermedades neoplásicas malignas por fumar en exceso.
Con los datos disponibles, actualmente se desconoce si el tratamiento con Adalimumab influye en el riesgo de desarrollar displasia o cáncer de colon. Se debe cribar para displasia a intervalos regulares antes del tratamiento y durante el curso de la enfermedad a todos los pacientes con colitis ulcerosa que presenten un riesgo incrementado de displasia o carcinoma de colon (por ejemplo, pacientes con colitis ulcerosa de larga duración o con colangitis esclerosante primaria), o que tengan antecedentes de displasia o carcinoma de colon. Esta evaluación deberá incluir colonoscopia y biopsias según recomendaciones locales.
Reacciones hematológicas:
En raras ocasiones se han descrito casos de pancitopenia, incluyendo anemia aplásica, con antagonistas del TNF. Se han descrito con Adalimumab reacciones adversas del sistema hematológico, incluyendo citopenias significativas desde el punto de vista del profesional de la salud (p. ej., trombocitopenia, leucopenia). Se debe aconsejar a todos los pacientes que consulten inmediatamente con su profesional de la salud en caso de presentar signos y síntomas de discrasias sanguíneas (p. ej., fiebre persistente, moretones, sangrado, palidez) cuando estén siendo tratados con Adalimumab. En pacientes con anomalías hematológicas significativas confirmadas debe considerarse la interrupción del tratamiento con Adalimumab.
Vacunas:
En un ensayo con 226 sujetos adultos con artritis reumatoide que fueron tratados con Adalimumab o placebo se observó una respuesta de anticuerpos similar frente a la vacuna estándar neumocócica 23-valente y la vacuna trivalente para el virus de la gripe. No se dispone de datos sobre la transmisión secundaria de infecciones por vacunas vivas en pacientes tratados con Adalimumab.
En pacientes pediátricos se recomienda, si es posible, una actualización del calendario de vacunaciones de acuerdo con las guías actuales de vacunación antes de iniciar el tratamiento con Adalimumab.
Los pacientes en tratamiento con Adalimumab pueden ser vacunados, excepto con vacunas de microorganismos vivos. No se recomienda la administración de vacunas de microorganismos vivos (p. ej., vacuna BCG) a lactantes expuestos a Adalimumab en el útero durante los 5 meses siguientes a la última inyección de Adalimumab de la madre durante el embarazo.
Insuficiencia cardiaca congestiva:
En un ensayo clínico con otro antagonista del TNF se ha observado empeoramiento de la insuficiencia cardiaca congestiva y aumento de la mortalidad debida a esta patología. También se han notificado casos de empeoramiento de la insuficiencia cardiaca congestiva en pacientes tratados con Adalimumab. Adalimumab debe utilizarse con precaución en pacientes con insuficiencia cardiaca leve (NYHA clases I/II). Adalimumab está contraindicado en insuficiencia cardiaca moderada o grave (ver sección de Contraindicaciones). El tratamiento con Adalimumab debe interrumpirse en pacientes que desarrollen insuficiencia cardiaca congestiva nueva o presenten un empeoramiento de los síntomas.
Procesos autoinmunes:
El tratamiento con Adalimumab puede dar lugar a la formación de autoanticuerpos. Se desconoce el impacto del tratamiento a largo plazo con Adalimumab sobre el desarrollo de enfermedades autoinmunes. Si un paciente desarrolla síntomas parecidos a los de un síndrome tipo lupus después del tratamiento con Adalimumab y da positivo a los anticuerpos frente al ADN bicatenario, se debe interrumpir el tratamiento con Adalimumab (ver sección de Reacciones secundarias y adversas).
Administración concomitante de FAME biológicos o antagonistas del TNF:
En ensayos clínicos se han observado infecciones graves con el uso concurrente de Anakinra y otro antagonista del TNF, Etanercept, sin beneficio clínico añadido en comparación con el uso de Etanercept solo. Por la naturaleza de los efectos adversos observados en el tratamiento combinado de Etanercept y Anakinra, la combinación de Anakinra y otros antagonistas del TNF puede producir una toxicidad similar. Por lo tanto, no se recomienda la combinación Adalimumab y Anakinra.
Basándose en el posible incremento del riesgo de infecciones, incluyendo infecciones graves, y otras interacciones farmacológicas potenciales, no se recomienda la administración concomitante de Adalimumab con otros FAME biológicos (por ejemplo, Anakinra y Abatacept) u otros antagonistas del TNF.
Cirugía:
La experiencia de seguridad de intervenciones quirúrgicas en pacientes tratados con Adalimumab es limitada. Si se planifica una intervención quirúrgica debe considerarse la larga semivida de eliminación de Adalimumab. Los pacientes tratados con Adalimumab que requieran cirugía, deben controlarse muy de cerca por la aparición de infecciones y tomar las medidas apropiadas. La experiencia de seguridad en los pacientes a los que se les ha practicado una artroplastia, mientras estaban en tratamiento con Adalimumab, es limitada.
Obstrucción del intestino delgado:
Un fallo en la respuesta al tratamiento para la enfermedad de Crohn puede indicar la presencia de estenosis fibróticas establecidas que pueden requerir tratamiento quirúrgico. Los datos disponibles sugieren que Adalimumab no empeora ni causa las estenosis.
Pacientes de edad avanzada:
La frecuencia de infecciones graves en sujetos mayores de 65 años (3,7%) tratados con Adalimumab fue mayor que para aquellos menores de 65 años (1,5%). Algunas de dichas infecciones tuvieron un resultado mortal. Se debe prestar una atención particular en relación con el riesgo de infecciones cuando se trate a pacientes de edad avanzada.
Población pediátrica: Ver Vacunas arriba.
Contenido de sodio:
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis de 0.8 mL, esto es, esencialmente “exento de sodio”.
La influencia de Adalimumab sobre la capacidad para conducir y utilizar máquinas es pequeña. Se pueden producir vértigo y alteraciones de la visión tras la administración de Adalimumab (ver sección de Reacciones secundarias y adversas).
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Subcutánea.
El tratamiento con Adalimumab debe ser iniciado y supervisado por profesionales de la salud, especialistas con experiencia en el diagnóstico y el tratamiento de aquellas indicaciones autorizadas para Adalimumab. Se aconseja a los oftalmólogos consultar con un especialista apropiado antes de iniciar el tratamiento con Adalimumab (ver sección de Precauciones generales). A los pacientes tratados con Adalimumab se les debe entregar la información para el paciente.
Tras un adecuado aprendizaje de la técnica de inyección, los pacientes pueden autoinyectarse Adalimumab si el profesional de la salud lo considera apropiado y les hace el seguimiento necesario.
Durante el tratamiento con Adalimumab, se deben optimizar otros tratamientos concomitantes (por ejemplo, corticosteroides y/o agentes inmunomoduladores).
Posología:
Artritis reumatoide:
La dosis recomendada de Adalimumab para pacientes adultos con artritis reumatoide es 40 mg de Adalimumab administrados en semanas alternas como dosis única en inyección por vía subcutánea. El metotrexato debe mantenerse durante el tratamiento con Adalimumab.
Glucocorticoides, salicilatos, fármacos antiinflamatorios no esteroideos, o analgésicos pueden mantenerse durante el tratamiento con Adalimumab. Para la combinación con fármacos antirreumáticos modificadores de la enfermedad distintos del metotrexato ver secciones de Precauciones generales y de Farmacodinamia.
En monoterapia, los pacientes que experimenten una disminución en su respuesta con Adalimumab 40 mg en semanas alternas pueden beneficiarse de un aumento de la dosis a 40 mg de Adalimumab cada semana u 80 mg cada dos semanas.
Los datos disponibles sugieren que la respuesta clínica normalmente se alcanza dentro de las 12 semanas de tratamiento. La continuación del tratamiento se debe reconsiderar en pacientes que no hayan respondido en este periodo de tiempo.
Adalimumab solo está disponible en jeringa prellenada de 40 mg y pluma precargada de 40 mg por lo tanto, no es posible administrar Adalimumab a pacientes que necesiten menos de una dosis completa de 40 mg.
Interrupción del tratamiento:
Puede ser necesaria la interrupción del tratamiento, por ejemplo, antes de una cirugía o si se produce una infección grave.
Los datos disponibles sugieren que cuando se vuelve a iniciar el tratamiento con Adalimumab tras una interrupción de 70 días de duración o superior, se obtiene una respuesta clínica y un perfil de seguridad similar al observado antes de la interrupción del tratamiento.
Hidradenitis supurativa:
La pauta posológica recomendada de Adalimumab para pacientes adultos con hidradenitis supurativa (HS) es de una dosis inicial de 160 mg en el día 1 (administrada como 4 inyecciones de 40 mg en un día o 2 inyecciones diarias de 40 mg en dos días consecutivos), seguida de 80 mg dos semanas después, en el día 15 (administrada como 2 inyecciones de 40 mg en un día). Dos semanas después (día 29), continuar con una dosis de 40 mg semanal u 80 mg cada dos semanas (administrada como dos inyecciones de 40 mg en un día). Si es necesario, se puede continuar el tratamiento con antibióticos durante el tratamiento con Adalimumab. Durante el tratamiento con Adalimumab se recomienda que el paciente utilice a diario un líquido antiséptico tópico en las lesiones de hidradenitis supurativa.
La continuación del tratamiento más allá de 12 semanas se debe reconsiderar, de forma cuidadosa en pacientes que no hayan mejorado en este periodo de tiempo.
Si se necesita interrumpir el tratamiento, se puede reintroducir Adalimumab 40 mg semanalmente u 80 mg cada dos semanas (ver sección de Farmacodinamia).
Se debe evaluar periódicamente el balance beneficio/riesgo del tratamiento continuado a largo plazo (ver sección de Farmacodinamia).
Enfermedad de Crohn:
La pauta de dosificación inicial recomendado de Adalimumab para pacientes adultos con enfermedad de Crohn activa de moderada a grave es de 80 mg en la Semana 0 seguido de 40 mg en la Semana 2.
En caso de que sea necesaria una respuesta más rápida al tratamiento, se puede cambiar la posología a 160 mg en la Semana 0 (administrada mediante 4 inyecciones de 40 mg en un día o con 2 inyecciones de 40 mg por día durante dos días consecutivos), seguido de 80 mg en la Semana 2 (administrada mediante dos inyecciones de 40 mg en un día), siendo consciente del mayor riesgo de reacciones adversas durante el inicio del tratamiento.
Después de iniciar el tratamiento, la dosis recomendada es de 40 mg administrados en semanas alternas vía inyección subcutánea. De forma alternativa, si un paciente interrumpe el tratamiento con Adalimumab y los signos y síntomas de la enfermedad recurren, se puede readministrar Adalimumab. Hay poca experiencia en la readministración transcurridas más de 8 semanas desde la dosis previa.
Los corticosteroides se pueden reducir durante el tratamiento de mantenimiento, de acuerdo con las guías de práctica clínica.
Para algunos pacientes que han experimentado una disminución de su respuesta con Adalimumab 40 mg en semanas alternas puede ser beneficioso un aumento de la dosis a 40 mg semanales u 80 mg cada dos semanas.
Para algunos pacientes que no han respondido al tratamiento en la Semana 4, puede ser beneficioso continuar con un tratamiento de mantenimiento hasta la Semana 12. El tratamiento continuado se debe reconsiderar, de forma cuidadosa, en pacientes que no hayan respondido dentro de este periodo·de tiempo.
Adalimumab sólo está disponible en jeringa prellenada de 40 mg y pluma precargada de 40 mg por lo tanto, no es posible administrar Adalimumab a pacientes que necesiten menos de una dosis completa de 40 mg.
Colitis ulcerosa:
La dosis de inducción recomendada de Adalimumab para pacientes adultos con colitis ulcerosa de moderada a grave es de 160 mg en la Semana 0 (administrada mediante 4 inyecciones de 40 mg en un día o con 2 inyecciones de 40 mg por día durante dos días consecutivos) y 80 mg en la Semana 2 (administrada mediante dos inyecciones de 40 mg en un día). Después del tratamiento de inducción, la dosis recomendada es de 40 mg cada dos semanas mediante inyección por vía subcutánea.
Los corticosteroides se pueden reducir durante el tratamiento de mantenimiento, de acuerdo con las guías de práctica clínica.
Para algunos pacientes que han experimentado una disminución de su respuesta con Adalimumab 40 mg en semanas alternas, puede ser beneficioso un aumento de la dosis a 40 mg semanales u 80 mg cada dos semanas.
Los datos disponibles sugieren que la respuesta clínica se alcanza generalmente dentro de 2-8 semanas de tratamiento. El tratamiento con Adalimumab no debería continuarse en pacientes que no respondan dentro de este periodo de tiempo.
Adalimumab solo está disponible en jeringa prellenada de 40 mg y pluma precargada de 40 mg, por lo tanto, no es posible administrar Adalimumab a pacientes que necesiten menos de una dosis completa de 40 mg.
Uveítis:
La dosis recomendada de Adalimumab para pacientes adultos con uveítis es de una dosis inicial de 80 mg, seguida de 40 mg administrado en semanas alternas, comenzando una semana después de la dosis inicial. Hay experiencia limitada en el inicio del tratamiento con Adalimumab en monoterapia. El tratamiento con Adalimumab se puede iniciar en combinación con corticosteroides y/o con otro agente inmunomodulador no biológico. El tratamiento concomitante con corticosteroides puede ser ajustado de acuerdo con la práctica clínica, comenzando dos semanas tras el inicio del tratamiento con Adalimumab.
Se recomienda una evaluación anual del beneficio y riesgo del tratamiento continuado a largo plazo (ver sección de Farmacodinamia).
Adalimumab sólo está disponible en jeringa prellenada de 40 mg y pluma precargada de 40 mg por lo tanto, no es posible administrar Adalimumab a pacientes que necesiten menos de una dosis completa de 40 mg.
Poblaciones especiales:
Pacientes de edad avanzada:
No se requiere ajuste de dosis.
Insuficiencia renal y/o hepática:
Adalimumab no se ha estudiado en estas poblaciones de pacientes, por lo que no hay recomendaciones de dosis.
Población pediátrica:
Adalimumab solo está disponible en jeringa prellenada de 40 mg y pluma precargada de 40 mg por lo tanto, no es posible administrar Adalimumab a pacientes pediátricos que necesiten menos de una dosis completa de 40 mg. Si se necesita una dosis alternativa, se deben utilizar otros productos que ofrezcan esa opción.
Artritis idiopática juvenil:
Artritis idiopática juvenil poliarticular desde los 2 años de edad.
La dosis recomendada de Adalimumab para pacientes con artritis idiopática juvenil poliarticular a partir de los 2 años de edad se basa en el peso corporal (Tabla 20). Adalimumab se administra en semanas alternas en inyección por vía subcutánea.
Tabla 20. Dosis de Adalimumab para pacientes con artritis idiopática juvenil poliarticular
|
Peso del paciente |
Pauta posológica |
|
10 kg hasta <30 kg |
-- |
|
≥30 kg |
40 mg en semanas alternas |
Los datos disponibles sugieren que la respuesta clínica se consigue, por lo general, dentro de las primeras 12 semanas de tratamiento. La continuación con el tratamiento se debe ser reconsiderar cuidadosamente en los pacientes que no hayan respondido en este periodo de tiempo.
No hay un uso relevante de Adalimumab en pacientes menores de 2 años para esta indicación.
Adalimumab solo está disponible en jeringa prellenada de 40 mg y pluma precargada de 40, por lo tanto, no es posible administrar Adalimumab a pacientes que necesiten menos de una dosis completa de 40 mg.
Artritis asociada a entesitis:
La dosis recomendada de Adalimumab para pacientes con artritis asociada a entesitis en pacientes a partir de 6 años se basa en el peso corporal (Tabla 21). Adalimumab se administra en semanas alternas en inyección por vía subcutánea.
Tabla 21. Dosis de Adalimumab para pacientes con artritis asociada a entesitis
|
Peso del paciente |
Pauta posológica |
|
15 kg hasta <30 kg |
-- |
|
≥30 kg |
40 mg en semanas alternas |
No se ha estudiado el uso de Adalimumab en pacientes con artritis asociada a entesitis menores de 6 años. Adalimumab solo está disponible en jeringa prellenada de 40 mg y pluma precargada de 40 mg, por lo tanto, no es posible administrar Adalimumab a pacientes que necesiten menos de una dosis completa de 40 mg.
Psoriasis pediátrica en placas:
La dosis recomendada de Adalimumab para pacientes con psoriasis en placas desde los 4 a los 17 años de edad se basa en el peso corporal (Tabla 22). Adalimumab se administra mediante inyección por vía subcutánea.
Tabla 22. Dosis de Adalimumab para pacientes pediátricos con psoriasis en placas
|
Peso del paciente |
Pauta posológica |
|
10 kg hasta <30 kg |
-- |
|
≥30 kg |
Dosis inicial de 40 mg, seguida de 40 mg administrados en semanas alternas, empezando una semana después de la dosis inicial |
La continuación del tratamiento más allá de 16 semanas se debe reconsiderar de forma cuidadosa en pacientes que no hayan respondido en este periodo de tiempo.
En el caso de que esté indicado el retratamiento con Adalimumab, se deben seguir las indicaciones anteriores en cuanto a la dosis y la duración del tratamiento.
La seguridad de Adalimumab en pacientes pediátricos con psoriasis en placas ha sido evaluada durante una media de 13 meses.
No existe una recomendación de uso específica para Adalimumab en niños menores de 4 años para esta indicación.
Adalimumab solo está disponible en jeringa prellenada de 40 mg y pluma precargada de 40 mg, por lo tanto, no es posible administrar Adalimumab a pacientes que necesiten menos de una dosis completa de 40 mg.
Enfermedad de Crohn pediátrica:
La dosis recomendada de Adalimumab para pacientes con enfermedad de Crohn desde los 6 hasta los 17 años de edad se basa en el peso corporal (Tabla 23). Adalimumab se administra en inyección por vía subcutánea.
Tabla 23. Dosis de Adalimumab para pacientes pediátricos con enfermedad de Crohn
|
Peso del paciente |
Dosis de inducción |
Dosis de mantenimiento a partir de la Semana 4 |
|
< 40 kg |
40 mg en la Semana 0 y 20 mg en la Semana 2: |
– |
|
≥ 40 kg |
80 mg en la Semana 0 y 40 mg en la Semana 2: |
40 mg en semanas alternas |
* Nota: Adalimumab solo está disponible en jeringa prellenada de 40 mg y pluma precargada de 40 mg.
Los pacientes que tengan una respuesta insuficiente pueden beneficiarse de un aumento en la frecuencia de dosificación: ≥ 40 kg: 40 mg cada semana u 80 mg cada dos semanas.
El tratamiento continuado se debe reconsiderar, de forma cuidadosa, en pacientes que no hayan respondido en la Semana 12.
El uso de Adalimumab en niños menores de 6 años para la indicación de enfermedad de Crohn no es relevante.
Adalimumab solo está disponible en jeringa prellenada de 40 mg y pluma precargada de 40 mg, por lo tanto, no es posible administrar Adalimumab a pacientes que necesiten menos de una dosis completa de 40 mg.
Colitis ulcerosa pediátrica:
No se ha establecido la seguridad y eficacia de Adalimumab en niños de 4 a 17 años. No se dispone de datos.
El uso de Adalimumab en niños menores de 4 años para la indicación de colitis ulcerosa no es relevante.
Forma de administración:
Adalimumab se administra mediante inyección subcutánea.
Las instrucciones completas para su uso se describen en el instructivo Adalimumab.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
No se observó toxicidad limitante de la dosis durante los ensayos clínicos en pacientes. El nivel de dosis más alto evaluado ha sido la administración intravenosa repetida de dosis de 10 mg/kg, que supone aproximadamente 15 veces la dosis recomendada.
PRESENTACIONES:
Caja de cartón con un blíster con 1 o 2 jeringa(s) prellenada(s) con 0.8 mL (40 mg/0.8 mL) y protector de seguridad para la aguja.
Caja de cartón que contiene 2 cajas de cartón, cada una contiene un blíster con 1 jeringa prellenada con 0.2 mL (20 mg/0.2 mL) y protector de seguridad para la aguja.
Caja de cartón con un blíster con 1 o 2 jeringa(s) prellenada(s) con 0.4 mL (40 mg/0.4 mL) y protector de seguridad para la aguja.
Caja de cartón con un blíster con 1 o 2 jeringa(s) prellenada(s) con 0.8 mL (80 mg/0.8 mL) y protector de seguridad para la aguja.
Caja de cartón con 1 o 2 pluma(s) precargada(s) con 0.8 mL (40 mg/0.8 mL) y protector de seguridad para la aguja.
Caja de cartón con 1 o 2 pluma(s) precargada(s) con 0.4 mL (40 mg/0.4 mL) y protector de seguridad para la aguja.
Caja de cartón con 1 o 2 pluma(s) precargada(s) con 0.8 mL (80 mg/0.8 mL) y protector de seguridad para la aguja.
Todas las presentaciones con instructivo anexo para uso del paciente.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Consérvese en refrigeración entre 2 y 8 ºC. No se congele.
Conservar la jeringa prellenada en la caja para protegerla de la luz. Consérvese la caja bien cerrada.
Conservar la pluma precargada en la caja para protegerlo de la luz. Consérvese la caja bien cerrada.
Una vez fuera del refrigerador, el producto se conserva y puede ser utilizado durante 21 días a 25 °C, protegido de la luz, posterior a este tiempo, debe ser desechado (aplica únicamente para la concentración de 50 mg/mL).
Una vez fuera del refrigerador, el producto se conserva y puede ser utilizado durante 42 días a 25 °C, protegido de la luz, posterior a este tiempo, debe ser desechado (aplica únicamente para la concentración de 100 mg/mL).
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para el médico. No se administre si la solución no es transparente, si contiene partículas en suspensión o sedimentos. No se administre si el cierre ha sido violado. Deséchese inmediatamente después de su uso. No se deje al alcance de los niños. Su venta requiere receta médica. No se use en niños menores de 2 años. No se use en el embarazo y la lactancia. Solo debe usarse bajo la supervisión adecuada de médicos especialistas.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx
Titular del Registro:
Sandoz GmbH
Biochemiestraße 10, Kundl, Tirol, 6250, Austria
Representante Legal:
SANDOZ, S.A. de C.V.
La Candelaria No. 186
Col. Atlántida, C.P. 04370
Coyoacán, Ciudad de México, México
Reg. Núm. 021M2023 SSA IV
®Marca Registrada
Clave de IPP:
23330022131485/07May2024/IPPA_DRA-Sandoz