EXELON
RIVASTIGMINA
Parche
1 Caja,30 Parche,10 cm
1 Caja,30 Parche,15 cm
1 Caja,30 Parche,20 cm
1 Caja,30 Parche,5 cm
1 Caja,7 Parche,5 cm
1 Caja,30 Parche,10 cm
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada PARCHE contiene:
Rivastigmina base equivalente a 9 mg, 18 mg, 27 mg, 36 mg
de rivastigmina
Excipiente cs 1 parche
|
Parche |
Dosis de |
Tasa de liberación de rivastigmina en 24 horas in vivo |
|
Cada parche de 5 cm2 |
9 mg |
4.6 mg |
|
Cada parche de 10 cm2 |
18 mg |
9.5 mg |
|
Cada parche de 15 cm2 |
27 mg |
13.3 mg |
|
Cada parche de 20 cm2 |
36 mg |
17.4 mg |
INDICACIONES TERAPÉUTICAS: Tratamiento de pacientes con demencia de leve a moderadamente severa de tipo Alzheimer, también denominada como probable enfermedad de Alzheimer o enfermedad de Alzheimer.
Tratamiento de pacientes con demencia de leve a moderadamente severa asociada con la enfermedad de Parkinson.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacocinéticas:
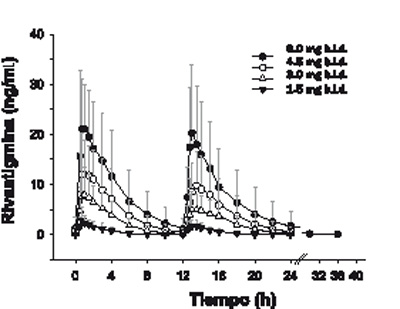
Absorción: La rivastigmina de los parches de EXELON® se absorbe lentamente. Después de administrar la primera dosis, las concentraciones del principio activo en el plasma se detectan con un retraso de entre media hora y una hora. Luego, las concentraciones plasmáticas aumentan paulatinamente hasta alcanzar valores cercanos a los máximos normalmente después de 8 horas, y el valor máximo (Cmáx) es alcanzado entre 10 y 16 horas. A partir de ese momento, las concentraciones plasmáticas descienden suavemente a lo largo del periodo de aplicación de 24 horas. Con la administración repetida (en el estado estable), justo después de reemplazar el parche anterior por uno nuevo, las concentraciones plasmáticas descienden de forma lenta durante unos 40 minutos en promedio, hasta que la velocidad de absorción del principio activo liberado por el nuevo parche supera a la de eliminación, momento en que dichas concentraciones aumentan nuevamente hasta alcanzar un nuevo máximo en torno a las 8 horas. En el estado estable, el descenso en los niveles es de aproximadamente la mitad (el 50%) de las cifras máximas, contrariamente a lo que sucede en la administración oral, en que las concentraciones decaen hasta ser prácticamente indetectables en el intervalo entre dos tomas (ver la figura 1). Se observa el mismo curso de concentraciones plasmáticas con todos los parches (tamaños) investigados de EXELON® (parches de 5 cm2 a 20 cm2). La exposición a rivastigmina (Cmáx y ABC), si bien es menos pronunciada que con la formulación oral, aumenta de forma más que proporcional a la dosis conforme se utilizan parches de mayor tamaño. Al ir escalando del parche de EXELON® de 5 cm al de 20 cm, el incremento del ABC de rivastigmina relativa con la menor dosis del parche de EXELON® 5 es 2.6, 4.9 y 7.8 veces para el parche de EXELON® 10, parche de EXELON® 15 y parche de EXELON® 20 respectivamente. El índice de fluctuación (FI), que es una medida de la diferencia relativa entre las concentraciones máximas y las concentraciones mínimas ([Cmáx-Cmín]/Cavg), variaba entre 0.57 y 0.77 con un parche, de modo que la fluctuación entre las concentraciones máxima y mínima es mucho menor que la que se observa con la formulación oral (FI = de 3.96 a 6.24). A juzgar por el modelo de compartimentos, el parche de 20 cm2 de EXELON® suministra una exposición (ABC24h) al paciente típico equivalente a la de una dosis oral de 9 a 10 mg dos veces al día (es decir, 18 a 20 mg/día), mientras que el parche de 10 cm2 proporciona una exposición equivalente a la de una dosis oral de alrededor de 6 mg dos veces al día (es decir, 12 mg/día).
Figura 1. Concentraciones plasmáticas de rivastigmina después de la aplicación dérmica del parche durante 24 horas
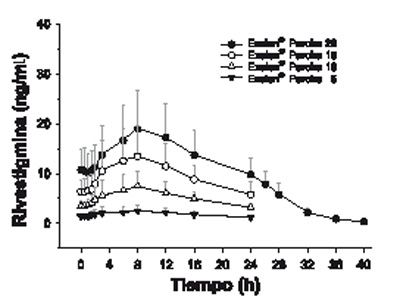
Figura 2. Concentraciones plasmáticas de rivastigmina después de la administración oral durante 24 horas
En un estudio de administración de dosis únicas en que el parche se comparó directamente con la cápsula, la variabilidad interindividual de las magnitudes farmacocinéticas de rivastigmina (normalizada en: dosis/kg de peso corporal) fue del 43% (Cmáx) y del 49% (ABC0-24h) con el parche, frente a 74% y 103%, respectivamente, con la cápsula oral. En un estudio de administración repetida en pacientes con demencia tipo Alzheimer en estado estable se observó asimismo una menor variabilidad interindividual de las magnitudes farmacocinéticas de rivastigmina con el parche que con la cápsula oral. La variabilidad interindividual fue como máximo del 45% (Cmáx) y el 43% (ABC0-24h) con el parche, y del 71% y 73%, respectivamente, con la formulación oral.
En los pacientes con enfermedad de Alzheimer, la exposición farmacológica (a la rivastigmina y al metabolito NAP226-90) en el estado estable se correlaciona con el peso corporal. Tomando como referencia un paciente de 65 kg de peso, las concentraciones de rivastigmina en el estado estable de un paciente de 35 kg serán aproximadamente del doble y las de un paciente de 100 kg aproximadamente iguales a la mitad. El efecto del peso corporal sobre la exposición farmacológica exige prestar una atención especial a la hora de aumentar la dosis en pacientes de bajo peso (ver Dosis y vía de administración).
La rivastigmina se libera adecuadamente del parche transdérmico en el plazo de 24 horas de aplicación dérmica; se libera del sistema aproximadamente el 50% de la carga de fármaco.
La exposición (ABC8) a la rivastigmina (y al metabolito NAP266-90) es máxima cuando se aplica el parche en la parte superior de la espalda, el pecho o el brazo. Llegado el caso de que no fuera posible aplicar el parche en alguno de esos tres sitios, todavía se puede aplicar sobre el abdomen o el muslo, aunque el médico debe tener presente que la exposición plasmática a la rivastigmina asociada con dichos sitios es entre un 20 y un 30% menor.
No se apreció ninguna acumulación importante de rivastigmina o del metabolito NAP226-90 en el plasma de los pacientes con enfermedad de Alzheimer, salvo que las concentraciones plasmáticas del segundo día eran mayores que las del primero con los parches.
El perfil farmacocinético de los parches transdérmicos de rivastigmina es comparable en pacientes con la enfermedad de Alzheimer y en pacientes con demencia asociada a la enfermedad de Parkinson.
Distribución: La rivastigmina se une moderadamente a proteínas plasmáticas (en aproximadamente un 40%). Atraviesa fácilmente la barrera hematoencefálica y tiene un volumen aparente de distribución de entre 1.8 y 2.7 L/kg
Metabolismo: La rivastigmina se metaboliza de forma rápida y extensa, con una vida media de eliminación aparente en el plasma aproximada a 3.4 horas del retiro de un parche. La eliminación se ve limitada por la velocidad de absorción (cinética flip-flop), lo cual explica la mayor vida media que se logra con la aplicación del parche (t½ de 3.4 h) que con la administración oral o intravenosa (t½ de 1.4 a 1.7 h). El fármaco se transforma principalmente en el metabolito descarbamilado mediante una reacción de hidrólisis catalizada por la colinesterasa. Dicho metabolito produce una inhibición mínima de la acetilcolinesterasa in vitro (< 10%). Los estudios realizados in vitro y con animales indican que las principales isoformas del citocromo P450 desempeñan un papel mínimo en la biotransformación de la rivastigmina. La depuración (clearance) total plasmática de rivastigmina fue de unos 130 L/h tras una dosis intravenosa de 0.2 mg y de 70 L/h tras una dosis intravenosa de 2.7 mg, lo cual es coherente con una farmacocinética de rivastigmina no lineal y sobre proporcional debido a la saturación de su eliminación.
La razón de ABC8 entre el metabolito y el compuesto original fue de 0.7 con el parche y de 3.5 con la administración oral, lo cual revela que la transformación metabólica es mucho menor con el tratamiento dérmico. Se forma una cantidad menor de NAP226-90 tras la aplicación de un parche, presuntamente debida a la falta de metabolismo pre-sistémico (primer paso por el hígado).
Eliminación: Se detectan cantidades ínfimas de rivastigmina inalterada en la orina; la excreción renal de metabolitos es la vía de eliminación principal. Tras la administración de 14C-rivastigmina, la eliminación renal durante 24 horas es rápida y prácticamente completa (> 90%). Menos del 1% de la dosis administrada se excreta en las heces.
Pacientes geriátricos: La edad no afectó la exposición a la rivastigmina en los pacientes con enfermedad de Alzheimer tratados con parches de EXELON®.
Pacientes con insuficiencia hepática: No se realizó ningún estudio con los parches de EXELON® en individuos con insuficiencia hepática. Tras la administración oral, la Cmáx de la rivastigmina fue un 60% superior, así como el ABC fue dos veces mayor en los individuos con insuficiencia hepática leve o moderada en comparación con los individuos sanos.
Pacientes con insuficiencia renal: No se realizó ningún estudio con los parches de EXELON® en individuos con insuficiencia renal. Tras la administración oral, la Cmáx y el ABC de rivastigmina se elevaron más del doble en los pacientes con Alzheimer e insuficiencia renal moderada en comparación con los individuos sanos; no obstante, no se apreciaron cambios en la Cmáx ni en el ABC de rivastigmina en los pacientes con Alzheimer e insuficiencia renal grave.
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: Inhibidor selectivo de la colinesterasa a nivel cerebral, código ATC: N06DA03.
Los cambios patológicos asociados a las demencias, como la enfermedad de Alzheimer, afectan las vías neuronales colinérgicas que se extienden desde el prosencéfalo hasta la corteza cerebral y el hipocampo. Estas vías guardan relación con la atención, el aprendizaje y la memoria, y con otros procesos cognitivos. La rivastigmina, un inhibidor cerebro selectivo de la acetilcolinesterasa y la butirilcolinesterasa de la clase del carbamato, facilita la neurotransmisión colinérgica mediante la desaceleración de la degradación de la acetilcolina liberada por las neuronas colinérgicas funcionalmente activas. Los estudios en animales indican que la rivastigmina aumenta selectivamente la disponibilidad de acetilcolina en la corteza y el hipocampo. Por consiguiente, EXELON® puede mejorar los déficits cognitivos que se asocian con la enfermedad de Alzheimer y con la enfermedad de Parkinson por vía colinérgica. Además, existen indicios de que la inhibición de la colinesterasa podría desacelerar la formación de fragmentos amiloidógenos de la proteína precursora del amiloide ß y, por ende, de las placas de amiloide, que son una de las principales características patológicas de la enfermedad de Alzheimer.
La rivastigmina interactúa con sus enzimas diana y forma un complejo unido covalentemente que las inactiva de forma pasajera. En los varones jóvenes sanos, una dosis oral de 3.0 mg disminuye la actividad de la acetilcolinesterasa en el líquido cefalorraquídeo en aproximadamente un 40% en la hora y media que sigue a la administración. La actividad de la enzima regresa a su nivel inicial cerca de 9 horas después de producido el efecto inhibitorio máximo. En los voluntarios jóvenes sanos, la actividad butirilcolinesterásica en el líquido cefalorraquídeo se inhibía temporalmente y al cabo de unas 3.6 horas, ya no se diferenciaba de la inicial. En los pacientes con enfermedad de Alzheimer, la inhibición de la acetilcolinesterasa por parte de la rivastigmina en el líquido cefalorraquídeo resultó proporcional a la dosis hasta los 6 mg dos veces al día, que fue la mayor dosis estudiada. La inhibición de la actividad butirilcolinesterásica por parte de la rivastigmina en el líquido cefalorraquídeo de los pacientes con enfermedad de Alzheimer era equiparable a la de la acetilcolinesterasa, observándose una variación de más del 60% con respecto al inicio tras la administración de 6 mg dos veces al día. El efecto de la rivastigmina sobre la actividad de la acetilcolinesterasa y la butirilcolinesterasa se mantenía después de 12 meses de administración, que fue el mayor tiempo estudiado. Se encontraron correlaciones estadísticamente significativas entre el grado de inhibición de la acetilcolinesterasa y la butirilcolinesterasa por parte de la rivastigmina en el líquido cefalorraquídeo y las variaciones en una variable compuesta de actividad cognitiva en los pacientes con enfermedad de Alzheimer; no obstante, únicamente la inhibición de la butirilcolinesterasa en el líquido cefalorraquídeo se correlacionaba de manera significativa y sistemática con mejorías en las pruebas secundarias de rapidez, atención y memoria.
CONTRAINDICACIONES:
El uso de EXELON® está contraindicado en pacientes con:
• Hipersensibilidad conocida a la rivastigmina, a otros derivados del carbamato o a los excipientes de la formulación (vitamina E, poli-butilmetacrilato, metil-metacrilato, copolímero de acrílico, aceite de silicona).
• Antecedentes de reacciones en el lugar de la aplicación de un parche transdérmico de rivastigmina indicativas de una dermatitis alérgica de contacto (ver Precauciones generales, Reacciones cutáneas).
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: La rivastigmina no fue teratogénica en estudios con animales. No obstante, aún no se ha confirmado la inocuidad de EXELON® en el embarazo humano y la rivastigmina debe administrarse a las mujeres embarazadas únicamente si el beneficio previsto justifica el posible riesgo para el feto.
Lactancia: Se ignora si EXELON® pasa a la leche humana; las pacientes que reciben EXELON® no deben amamantar.
REACCIONES SECUNDARIAS Y ADVERSAS: La incidencia global de eventos adversos en los pacientes tratados con el parche de 10 cm2 de EXELON® fue inferior a la tasa de episodios que se registraron entre los que recibieron las cápsulas de EXELON®. Las náuseas y los vómitos fueron los acontecimientos adversos observados con mayor frecuencia entre los pacientes tratados con el principio activo y sobrevenían con una frecuencia similar en los grupos que recibieron las cápsulas o los parches de 20 cm2 de EXELON®. No obstante, los porcentajes de ambos acontecimientos eran sustancialmente inferiores en el grupo del parche de 10 cm2 de EXELON®.
Las reacciones adversas referidas con mayor frecuencia son las gastrointestinales, como las náuseas (38%) y el vómito (23%), especialmente durante el reajuste posológico.
Las reacciones adversas (tablas 5 y 6) se han ordenado por orden de frecuencia, encabezadas por las más frecuentes, de acuerdo con la siguiente convención:
Muy frecuentes (³ 1/10); frecuentes (³ 1/100, < 1/10); ocasionales (³ 1/1,000, < 1/100); raras (³ 1/10,000, < 1/1,000); muy raras (< 1/10,000), incluidas las notificaciones aisladas.
Tabla 5. Reacciones adversas notificadas en 1,157 pacientes con demencia de Alzheimer tratados entre 24 y 48 semanas en estudios clínicos aleatorizados comparativos con parches de EXELON® en todas sus dosis (desde EXELON® de 5 cm2 hasta EXELON® de 20 cm2)
|
Trastornos del metabolismo y de la nutrición |
|
|
Frecuentes |
Anorexia, disminución del apetito. |
|
Infrecuentes |
Deshidratación. |
|
Trastornos psiquiátricos |
|
|
Frecuentes |
Ansiedad, depresión, insomnio. |
|
Infrecuentes |
Agitación, síndrome confusional, alucinaciones, agresividad. |
|
Trastornos del sistema nervioso |
|
|
Frecuentes |
Mareo, cefalea. |
|
Infrecuentes |
Accidente cerebrovascular, síncope, somnolencia, hiperactividad psicomotora. |
|
Trastornos cardiacos |
|
|
Infrecuentes |
Arritmia cardiaca (p. ej.: bradicardia, extrasístole supraventricular). |
|
Trastornos gastrointestinales |
|
|
Muy frecuentes |
Náuseas. |
|
Frecuentes |
Vómitos, diarrea, dispepsia, dolor abdominal. |
|
Infrecuentes |
Úlcera gástrica, hemorragia gastrointestinal (por ejemplo, duodenitis hemorrágica). |
|
Trastornos renales y urinarios |
|
|
Frecuentes |
Incontinencia urinaria. |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Infrecuentes |
Hiperhidrosis. |
|
Trastornos generales y afecciones en el sitio de la administración |
|
|
Frecuentes |
Reacciones en el sitio de aplicación, eritema en el sitio de aplicación, prurito en el sitio de aplicación, edema, cansancio, astenia. |
|
Infrecuentes |
Dermatitis de contacto, malestar general. |
|
Raros |
Caídas. |
|
Pruebas complementarias |
|
|
Frecuentes |
Pérdida de peso. |
|
Infecciones e infestaciones |
|
|
Frecuentes |
Infección de las vías urinaria. |
Tabla 6. Reacciones adversas notificadas durante un periodo de 24 semanas en el estudio clínico sin enmascaramiento realizado con EXELON® en parches transdérmicos en pacientes con demencia asociada a la enfermedad de Parkinson
|
Reacciones adversas |
EXELON® Parches n (%) |
|
|
Número total de pacientes estudiados |
288 (100) |
|
|
Trastornos psiquiátricos |
||
|
Frecuentes |
Insomnio |
18 (6.3) |
|
Frecuentes |
Depresión |
16 (5.6) |
|
Frecuentes |
Ansiedad |
15 (5.2) |
|
Frecuentes |
Agitación |
8 (2.8) |
|
Trastornos del sistema nervioso |
||
|
Frecuentes |
Temblor |
21 (7.3) |
|
Frecuentes |
Mareo |
16 (5.6) |
|
Frecuentes |
Somnolencia |
12 (4.2) |
|
Frecuentes |
Hipocinesia |
11 (3.8) |
|
Frecuentes |
Bradicinesia |
10 (3.5) |
|
Frecuentes |
Rigidez en rueda dentada |
8 (2.8) |
|
Frecuentes |
Discinesia |
7 (2.4) |
|
Trastornos gastrointestinales |
||
|
Frecuentes |
Dolor abdominal |
6 (2.1) |
|
Trastornos vasculares |
||
|
Frecuentes |
Hipertensión |
9 (3.1) |
|
Trastornos generales y afecciones en el sitio de administración |
||
|
Muy frecuentes |
Caídas |
34 (11.8) |
|
Muy frecuentes |
Eritema en el sitio de aplicación |
31 (10.8) |
|
Frecuentes |
Irritación en el sitio de aplicación, prurito, exantema |
9 (3.1); 13 (4.5); 7 (2.4) |
|
Frecuentes |
Fatiga |
10 (3.5) |
|
Frecuentes |
Astenia |
6 (2.1) |
|
Frecuentes |
Trastornos de la marcha |
11 (3.8) |
Durante un estudio prospectivo, abierto de 76 semanas en pacientes con demencia asociada a la enfermedad de Parkinson tratados con los parches transdérmicos de EXELON® se observaron las siguientes reacciones adversas adicionales: deshidratación, disminución de peso, agresividad, alucinaciones visuales (frecuente).
Las siguientes reacciones adversas fueron notificadas al ser observadas únicamente en los estudios clínicos de pacientes con demencia asociada a la enfermedad de Parkinson tratados con EXELON® cápsulas: náuseas, vómito (muy frecuentes), disminución del apetito, inquietud, empeoramiento de la enfermedad de Parkinson, bradicardia, diarrea, dispepsia, aumento de la salivación, aumento de la sudoración (frecuente), distonía, fibrilación auricular, bloqueo auriculoventricular (infrecuentes).
Reacciones adversas procedentes de comunicaciones espontáneas realizadas desde la comercialización del producto: Las comunicaciones espontáneas realizadas desde la comercialización del producto han permitido identificar las reacciones adversas adicionales que se indican a continuación. Debido al tamaño incierto de la población afectada, no siempre es posible estimar con fiabilidad la frecuencia de dichas reacciones.
Raras: hipertensión, hipersensibilidad en el sitio de la aplicación, prurito, exantema, eritema, urticaria, ampollas, dermatitis alérgica.
Muy raras: taquicardia, bloqueo auriculoventricular, fibrilación auricular, pancreatitis, convulsiones. Se ha observado un agravamiento de la enfermedad de Parkinson en enfermos de Parkinson que usaron los parches de EXELON®.
De frecuencia desconocida: hepatitis, agitación, síndrome de disfunción sinusal, anomalías en las pruebas de la función hepática, reacciones de hipersensibilidad cutánea diseminadas.
Reacciones adversas adicionales comunicadas con las cápsulas de EXELON®:
Muy raras: vómitos intensos asociados con ruptura del esófago.
Raras: angina de pecho, infarto de miocardio, úlceras duodenales.
Infrecuentes: anomalías en las pruebas de la función hepática.
Frecuentes: temblores, confusión.
Información obtenida de los pacientes con demencia tipo Alzheimer en los estudios clínicos: Las siguientes reacciones adversas se han identificado en pacientes con demencia asociada a la enfermedad de Alzheimer que fueron tratados con EXELON® Parches.
Tabla 7: Acontecimientos adversos (³ 2% en todos los grupos tratados con parches de EXELON®) procedentes del estudio clínico específico de 24 semanas, comparativo con placebo y con doble enmascaramiento, realizado en pacientes con demencia de Alzheimer que recibieron parches de EXELON®
|
Grupo tratado con el parche de 10 cm2 |
Grupo tratado con el parche de 20 cm2 |
EXELON® en cápsulas 12 mg/día |
Placebo |
Todos los grupos tratados con parches de EXELON® |
|
|
Total de pacientes estudiados |
291 |
303 |
294 |
302 |
594 |
|
Total de pacientes que presentaron EA |
147 (50.5) |
200 (66.0) |
186 (63.3) |
139 (46.0) |
347 (58.4) |
|
Náuseas |
21 (7.2) |
64 (21.1) |
68 (23.1) |
15 (5.0) |
85 (14.3) |
|
Vómitos |
18 (6.2) |
57 (18.8) |
50 (17.0) |
10 (3.3) |
75 (12.6) |
|
Diarrea |
18 (6.2) |
31 (10.2) |
16 (5.4) |
10 (3.3) |
49 (8.2) |
|
Disminución de peso |
8 (2.7) |
23 (7.6) |
16 (5.4) |
4 (1.3) |
31 (5.2) |
|
Mareos |
7 (2.4) |
21 (6.9) |
22 (7.5) |
7 (2.3) |
28 (4.7) |
|
Disminución del apetito |
2 (0.7) |
15 (5.0) |
12 (4.1) |
3 (1.0) |
17 (2.9) |
|
Cefalea |
10 (3.4) |
13 (4.3) |
18 (6.1) |
5 (1.7) |
23 (3.9) |
|
Anorexia |
7 (2.4) |
12 (4.0) |
14 (4.8) |
3 (1.0) |
19 (3.2) |
|
Depresión |
11 (3.8) |
12 (4.0) |
13 (4.4) |
4 (1.3) |
23 (3.9) |
|
Insomnio |
4 (1.4) |
12 (4.0) |
6 (2.0) |
6 (2.0) |
16 (2.7) |
|
Dolor abdominal |
7 (2.4) |
11 (3.6) |
4 (1.4) |
2 (0.7) |
18 (3.0) |
|
Astenia |
5 (1.7) |
9 (3.0) |
17 (5.8) |
3 (1.0) |
14 (2.4) |
|
Ansiedad |
9 (3.1) |
8 (2.6) |
5 (1.7) |
4 (1.3) |
17 (2.9) |
|
Fatiga |
5 (1.7) |
7 (2.3) |
2 (0.7) |
4 (1.3) |
12 (2.0) |
Irritación en la piel: En el estudio clínico de 24 semanas, comparativo con placebo, los casos de irritación cutánea se catalogaron por separado según una escala de irritación que el investigador evaluaba, pero no como acontecimientos adversos, a menos que cumpliesen con los criterios establecidos para los acontecimientos adversos graves. Cuando se observó, en la irritación cutánea fue casi siempre mínima o de intensidad leve y se la calificó de grave en £ 2.2% de los pacientes tratados con parches de EXELON®, frente a £ 1.0% de los pacientes a los que se les aplicaron parches de placebo.
En el estudio clínico de 48 semanas, comparativo con fármaco activo de referencia, los casos de irritación cutánea se catalogaron como acontecimientos adversos notificados bien por el paciente o bien por la persona que lo cuidaba. Los acontecimientos de irritación cutánea que se notificaron con mayor frecuencia durante las primeras 24 semanas del periodo con doble enmascaramiento en los grupos a los que se les aplicaba, respectivamente, EXELON® parche de 15 cm2 y EXELON® parche de 10 cm2, fueron el eritema en el sitio de aplicación (el 5.7% frente al 4.6%) y el prurito en el sitio de aplicación (el 3.6% frente al 2.8%). Los porcentajes disminuyeron con el tiempo (> 24 semanas) en ambos grupos, a saber, el de EXELON® parche de 15 cm2 y el de EXELON® parche de 10 cm2: el eritema en el sitio de la aplicación (el 0.8% frente al 1.6%) y el prurito en el sitio de la aplicación (el 0.4% frente al 1.2%), respectivamente. El prurito en el sitio de la aplicación dio lugar a la suspensión definitiva del tratamiento en el 1.1% de los pacientes de cada uno de los grupos terapéuticos durante toda la fase de 48 semanas con doble enmascaramiento. Casi todas las reacciones en el sitio de aplicación fueron de intensidad leve o moderada y únicamente se las calificó de graves en menos del 2% de los pacientes (ver Precauciones generales, Reacciones cutáneas).
En ninguno de estos estudios ha sido posible realizar una comparación directa de los porcentajes de acontecimientos de irritación cutánea, y ello a causa de los diferentes métodos utilizados para la recogida de datos.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Toxicidad tras dosis única: Los valores estimados de dosis letal media (LD50) en los ratones fueron de 5.6 mg de base/kg en los machos y de 13.8 mg de base/kg en las hembras. Los valores estimados de dosis letal media (LD50) en las ratas fueron de 8.1 mg de base/kg en los machos y de 13.8 mg de base/kg en las hembras.
Toxicidad tras dosis repetidas: Los estudios de toxicidad tras dosis repetidas por vía oral o tópica efectuados en ratones, ratas, conejos, perros y cerdos Minipig® revelaron solamente los efectos asociados con una actividad farmacológica exagerada. No se observó toxicidad en órganos afectados. En los estudios con animales, la administración oral y tópica fue limitada debido a la sensibilidad de los modelos animales utilizados.
Mutagénesis: La rivastigmina careció de poder mutágeno en los estudios in vitro de mutación génica y daño primario del ADN. En los estudios de aberraciones cromosómicas in vitro se observó un ligero aumento del número de células portadoras de aberraciones cromosómicas cuando se utilizaron concentraciones muy altas. Sin embargo, como no se observaron indicios de actividad clastógena en la prueba más importante de daño cromosómico in vivo por evaluación de micronúcleos, es bastante probable que los resultados observados in vitro fuesen falsos positivos.
Carcinogénesis: No se hallaron signos de carcinogenia en los estudios de administración oral y tópica efectuados en ratones, ni en un estudio de administración oral con la máxima dosis tolerada en ratas. La exposición a la rivastigmina y sus metabolitos fue aproximadamente equivalente a la que se observa en los seres humanos que reciben las dosis más elevadas de rivastigmina en cápsulas o parches.
Toxicidad en el sistema reproductor: Los estudios por vía oral en ratas y conejas grávidas con dosis de hasta 2.3 mg de base/kg/día no arrojaron indicios de que la rivastigmina sea teratógena. Tampoco hubo indicios de que la rivastigmina ejerza efectos tóxicos en la fertilidad, la función reproductora o el crecimiento y el desarrollo, tanto en el útero como en el periodo posnatal, en dosis de hasta 1.1 mg de base/kg/día. No se han llevado a cabo estudios dérmicos específicos en hembras grávidas de animales.
Toxicidad dérmica: Los parches de rivastigmina no fueron fototóxicos. En otros estudios de toxicidad dérmica, se apreció un leve efecto irritante en la piel de los animales de laboratorio, también en los testigos. Ello podría indicar que los parches de EXELON® tienen la capacidad de inducir un eritema leve en los pacientes.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: No se han realizado estudios de interacción específica con los parches de EXELON®.
La hidrólisis por medio de esterasas es la principal vía de transformación metabólica de la rivastigmina. Las principales isoformas del citocromo P450 apenas metabolizan el principio activo; por consiguiente, no cabe esperar que ocurran interacciones farmacocinéticas con otros sustratos farmacológicos de dichas enzimas.
En los estudios con voluntarios sanos no se han detectado interacciones farmacocinéticas entre la rivastigmina y la digoxina, la warfarina, el diazepam o la fluoxetina. El incremento en el tiempo de protrombina como resultado de la administración de warfarina, no se ve afectado por el uso de rivastigmina. Tras la administración simultánea de digoxina y rivastigmina no se han observado efectos adversos en la conducción cardiaca.
La administración simultánea de rivastigmina con medicamentos comúnmente prescritos como antiácidos, antieméticos, antihipoglucemiantes, antihipertensivos de acción central, betabloqueadores, antagonistas del calcio, fármacos inotrópicos, antianginosos, antiinflamatorios no esteroideos, estrógenos, analgésicos, benzodiacepínicos y antihistamínicos, no se asoció a una alteración en la cinética de rivastigmina, ni a un incremento del riesgo de aparición de efectos adversos clínicamente importantes.
En vista de sus efectos farmacodinámicos, la rivastigmina no debe administrarse simultáneamente con otros parasimpaticomiméticos y puede interferir con la actividad de los fármacos anticolinérgicos.
Como inhibidor de la colinesterasa, la rivastigmina puede potenciar los efectos de los miorelajantes de tipo succinilcolínico durante la anestesia.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Se han reportado raramente anomalías en las pruebas de la función hepática (ver Reacciones secundarias y adversas).
PRECAUCIONES GENERALES: La incidencia y la intensidad de los eventos adversos normalmente aumentan cuando se incrementa la dosis, especialmente cuando se modifica la posología. Si el tratamiento se interrumpe por varios días, debe reanudarse con el parche de 5 cm2 de EXELON®.
Al iniciar un tratamiento o aumentar la dosis, es posible que surjan trastornos gastrointestinales, como náuseas, vómito y diarrea. Dichos trastornos probablemente remitirán al reducir la dosis. En otros casos, tal vez deba interrumpirse el tratamiento con EXELON®. Los pacientes que presenten signos o síntomas de deshidratación generada por vómito o diarrea prolongada, pueden tratarse con electrólitos intravenosos y disminución o retiro de la dosis si se les identifica y corrige rápidamente. La deshidratación puede estar asociada a resultados graves (ver Reacciones adversas).
Los pacientes con enfermedad de Alzheimer pueden perder peso si reciben inhibidores de la colinesterasa, como la rivastigmina. Se debe controlar el peso de los pacientes durante el tratamiento con parches de EXELON®.
Como en el caso de otras sustancias colinérgicas, se ha de tener cuidado al momento de prescribir los parches de EXELON® a:
• Pacientes con síndrome del seno enfermo o trastornos de la conducción cardiaca (p. ej.: bloqueo sinoauricular o auriculoventricular) (ver Reacciones adversas).
• Pacientes que padecen úlceras duodenales o gástricas activas o que son susceptibles de padecerlas debido a un posible aumento de las secreciones de ácido gástrico.
• Pacientes susceptibles de padecer convulsiones u obstrucción urinaria debido a que los colinomiméticos pueden inducir o agravar dichos trastornos.
• Pacientes con antecedentes de asma o enfermedad pulmonar obstructiva.
Como otros colinomiméticos, la rivastigmina puede agudizar los síntomas extrapiramidales. En pacientes con demencia asociada a la enfermedad de Parkinson que recibían tratamiento con cápsulas de EXELON®, se ha observado un recrudecimiento de los síntomas parkinsonianos, especialmente de los temblores. Tales acontecimientos adversos también pueden sobrevenir con los parches de EXELON®, sobre todo con los parches de EXELON® de 15 cm2 y 20 cm2, que proporcionan una mayor exposición (ABC) que las cápsulas de 6 mg de EXELON® administradas dos veces al día.
Reacciones cutáneas: Es posible que ocurran reacciones cutáneas en el lugar de la aplicación del parche de EXELON®, las que suelen ser de intensidad leve o moderada. Estas reacciones no son necesariamente una indicación de sensibilización, pero el uso del parche de rivastigmina puede dar lugar a una dermatitis alérgica de contacto.
Se debe sospechar la existencia de una dermatitis alérgica de contacto si las reacciones en el lugar de la aplicación del parche trascienden el tamaño de éste, si existen signos de una reacción local más intensa (por ejemplo, eritema, edema, pápulas o vesículas en aumento) y si los síntomas no se alivian significativamente en un plazo de 48 horas después de retirar el parche. En esos casos, es necesario suspender el tratamiento (ver Contraindicaciones).
En pacientes que presentan reacciones en el lugar de la aplicación de un parche de EXELON® indicativas de una dermatitis alérgica de contacto y que todavía necesitan tratamiento con rivastigmina, el tratamiento sólo debe sustituirse por la rivastigmina oral después de practicar una prueba de alergia con resultados negativos y bajo estrecha supervisión médica. Es posible que algunos pacientes sensibilizados a la rivastigmina por exposición a un parche de esta sustancia no puedan recibir rivastigmina en ninguna otra formulación.
Desde la comercialización del producto ha habido notificaciones aisladas de pacientes que padecieron reacciones de hipersensibilidad cutánea diseminadas cuando se les administró rivastigmina, con independencia de la vía de administración (oral o transdérmica). En esos casos, es necesario suspender el tratamiento (ver Contraindicaciones). Se deben dar las correspondientes instrucciones a los pacientes y las personas que los cuidan.
Poblaciones especiales:
• Los pacientes con peso corporal inferior a 50 kg pueden experimentar más eventos adversos y, por este motivo, pueden ser más propensos a abandonar el tratamiento. Se ha de ejercer una especial cautela a la hora de aumentar la dosis por arriba de la dosis de mantenimiento recomendada del parche de 10 cm2 de EXELON® en dichos pacientes.
• Insuficiencia hepática: los pacientes con insuficiencia hepática clínicamente significativa pueden presentar más eventos adversos. Se ha de tener cuidado especial al momento de aumentar la dosis por arriba de la dosis de mantenimiento recomendada del parche de 10 cm2 de EXELON® en dichos pacientes (ver Farmacocinética).
Efectos sobre la capacidad para conducir y utilizar maquinaria: La demencia provocada por la enfermedad de Alzheimer o la enfermedad de Parkinson puede provocar deterioro gradual de la habilidad para conducir o comprometer la capacidad de utilizar maquinaria. La rivastigmina puede inducir mareos y somnolencia, principalmente cuando se inicia el tratamiento o se incrementa la dosis. Por lo tanto, en pacientes con demencia tratados con EXELON® que conduzcan o bien operen maquinaria compleja deben de tener una evaluación periódica por su médico tratante.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Cutánea.
Dosis:
Dosis inicial: El tratamiento se inicia con un parche de 5 cm2 de EXELON® una vez al día.
Al cabo de cuatro semanas de tratamiento como mínimo y si la dosis se tolera bien, se puede administrar el parche de 10 cm2 de EXELON®, que contiene la dosis eficaz recomendada.
Dosis de mantenimiento: El parche de 10 cm2 de EXELON® contiene la dosis de mantenimiento diaria recomendada que se administra el tiempo que sea necesario mientras proporcione un beneficio terapéutico al paciente.
• La reacción a la rivastigmina varía según el individuo; es posible que algunos pacientes obtengan mayores beneficios con dosis superiores. La administración posterior del parche de 15 cm2 y luego del parche de 20 cm2 de EXELON® dependerá siempre de la adecuada tolerabilidad de la dosis del parche anterior y se hará únicamente tras un periodo terapéutico mínimo de cuatro semanas con cada dosis farmacéutica.
• Si se observan reacciones adversas gastrointestinales o un empeoramiento de los síntomas extrapiramidales existentes (p. ej.: temblores) se debe suspender momentáneamente el tratamiento hasta la desaparición de dichos efectos. Si el tratamiento con un parche se ha interrumpido unos pocos días se puede reanudar a la misma dosis. En caso contrario, se debe reanudar con el parche de 5 cm2 de EXELON®.
• Si los efectos adversos persisten al reinstaurar el tratamiento, debe reducirse momentáneamente la dosis hasta la dosis anterior tolerada por el paciente.
Reemplazo de las cápsulas: Las cápsulas de EXELON® pueden reemplazarse por los parches de EXELON® como se indica a continuación:
• El paciente que recibe una dosis de rivastigmina oral inferior a 6 mg al día puede recibir el parche de 5 cm2 de EXELON®.
• El paciente que recibe una dosis de rivastigmina oral de entre 6 mg y 12 mg al día puede recibir directamente el parche de 10 cm2 de EXELON®.
Se recomienda aplicar el primer parche de EXELON® al día siguiente de haber tomado la última dosis oral.
Forma de administración: Los parches transdérmicos de rivastigmina se deben aplicar una vez al día sobre la piel sana, sin vello, seca y limpia, en la parte superior o inferior de la espalda, en el brazo o en el pecho, en una zona que no roce la ropa ajustada. El parche no debe aplicarse sobre la piel enrojecida, irritada ni herida. Se recomienda cambiar el sitio de aplicación cada día para evitar problemas de irritación, aunque dos parches consecutivos se pueden aplicar sobre la misma parte anatómica. Se debe presionar firmemente el parche hasta que sus bordes se hayan adherido bien. Los parches se pueden utilizar en cualquier situación de la vida diaria, incluso al bañarse o cuando hace calor.
Después de 24 horas hay que sustituir el parche por uno nuevo. Se colocará únicamente un solo parche a la vez (ver Manifestaciones y manejo de la sobredosificación o ingesta accidental). El parche no deberá ser cortado. Los pacientes y cuidadores deben ser instruidos al respecto.
Poblaciones especiales (ver Precauciones generales).
Insuficiencia renal: No se requiere ajustar la dosis en los pacientes con insuficiencia renal (ver Farmacocinética).
Pacientes pediátricos: Niños y adolescentes (menores de 18 años): no se recomienda el uso pediátrico de la rivastigmina.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Síntomas: La mayoría de los casos de sobredosis fortuita no se acompañaron de manifestaciones clínicas y casi todos los pacientes concernidos continuaron con el tratamiento de rivastigmina. Los síntomas, cuando llegaban a manifestarse, podían ser náuseas, vómitos, diarrea, hipertensión y alucinaciones. Debido al conocido efecto vagotónico de los inhibidores de la colinesterasa sobre la frecuencia cardiaca, también puede sobrevenir bradicardia o síncope.
Hubo un caso de ingestión de 46 mg, pero el paciente se recuperó por completo en un plazo de 24 horas con tratamiento conservador.
Se han registrado casos de sobredosis con los parches de EXELON® como resultado de errores de uso o de medicación (aplicación de varios parches al mismo tiempo) tras la aprobación del producto. Los síntomas comunicados en dichos casos suelen ser semejantes a los que se observan cuando se ingiere una sobredosis de rivastigmina (EXELON®) en formulación oral.
Tratamiento: En caso de sobredosis asintomática, como la rivastigmina tiene una vida media plasmática de unas 3.4 horas aproximadamente y dado que la inhibición de la acetilcolinesterasa dura unas 9 horas, se aconseja retirar de inmediato los parches de EXELON® y abstenerse de aplicar uno nuevo en las 24 horas siguientes. Si la sobredosis se acompaña de náuseas y vómitos intensos, se debe considerar la posibilidad de administrar antieméticos. Se administrará tratamiento sintomático si ocurren otros acontecimientos adversos, según proceda.
En caso de sobredosis masiva se puede usar atropina. Se recomienda una dosis inicial de 0.03 mg/kg de sulfato de atropina intravenoso, que luego se puede modificar en función de la respuesta clínica. No se recomienda el uso de escopolamina como antídoto.
PRESENTACIONES:
Caja con 7 o 30 parches de 5 cm2.
Caja con 30 parches de 10 cm2, 15 cm2 o 20 cm2.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a temperatura ambiente a no más de 25°C.
LEYENDAS DE PROTECCIÓN:
No se administre a menores de 18 años. No se administre durante el embarazo y la lactancia. No se deje al alcance de los niños. Su venta requiere receta médica. Literatura exclusiva para médicos.
NOVARTIS FARMACÉUTICA S.A. de C.V.
La Candelaria No. 186, Local A
Col. Atlántida, C.P. 04370
Deleg. Coyoacán, D.F., México
Reg. Núm. 293M2007, SSA IV
CDS: 01 Nov. 2010, 05.Abr.2011, 15.Dic.2011 y 12.Jun.2012
NPI: 22-Jun-2012
Tracking Number: 2010-PSB/GLC-0321-s, 2011-PSB/GLC-0379-s, 2011-PSB/GLC-0484-s y 2012-PSB/GLC-0545-s
® Marca registrada