
ELECSYS PROGRP
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
VALORES TEÓRICOS:
Un estudio del test ELECSYS PROGRP realizado en Europa y China con 1085 muestras de adultos aparentemente sanos (607 mujeres y 478 hombres) de entre 20 y 79 años de edad arrojó los resultados siguientes (estudios de Roche No. RD001525 y RD000788).
Ya que es conocido que la insuficiencia renal provoca un aumento de los valores de ProGRP20, el estudio incluyó solo a pacientes con una tasa de filtración glomerular estimada ≥ 30 calculada según una fórmula desarrollada por CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration).21
Valores de ProGRP en suero y plasma (de muestras provenientes de Europa y China):
|
ProGRP (pg/mL) |
||||
|
Percentil 5 |
Mediana |
Percentil 95 (IC del 95%b)) |
Percentil 97.5 (IC del 95%) |
|
|
Suero n = 1010 |
22.1 |
40.1 |
68.3 (64.2-74.4) |
77.7 (74.4-86.5) |
|
Plasma con heparina de litio n = 698 |
25.7 |
41.4 |
68.0 (63.7-74.5) |
77.0 (73.0-101.1) |
|
Plasma EDTA n = 844 |
22.8 |
36.4 |
59.5 (55.8-63.4) |
67.5 (63.4-76.9) |
b) IC = Intervalo de confianza.
Valores de ProGRP (suero y plasma combinados) según la región:
|
ProGRP (pg/mL) |
||||
|
Percentil 5 |
Mediana |
Percentil 95 (IC del 95%) |
Percentil 97.5 (IC del 95%) |
|
|
China n = 146 |
28.3 |
42.7 |
65.7 (59.9-86.5) |
74.4 (65.2-107.1) |
|
Europa n = 939 |
21.5 |
39.5 |
66.3 (62.8-72.6) |
77.7 (74.5-92.1) |
Cada laboratorio debería comprobar si los intervalos de referencia pueden aplicarse a su grupo de pacientes y, en caso necesario, establecer sus propios valores.
Valores de ProGRP en individuos aparentemente sanos con diferentes tipos de enfermedades benignas y malignas: En la tabla siguiente se indica la distribución porcentual (%) de los valores del test ProGRP determinados en 4 centros clínicos europeos y 2 centros clínicos chinos con el test ELECSYS PROGRP a partir de 2767 muestras séricas.
|
Valores de ELECSYS PROGRP en pg/mL |
||||||
|---|---|---|---|---|---|---|
|
Total |
< 3.0 |
3.0-50 |
50.1-100 |
100.1-200 |
> 200 |
|
|
N (%) |
N (%) |
N (%) |
N (%) |
N (%) |
||
|
Fumadores |
||||||
|
Aparentemente sanos |
192 |
0 (0) |
153 (79.7) |
39 (20.3) |
0 (0) |
0 (0) |
|
Ex fumadores |
74 |
0 (0) |
57 (77.0) |
16 (21.6) |
1 (1.4) |
0 (0) |
|
No fumadores |
618 |
0 (0) |
474 (76.7) |
136 (22.0) |
8 (1.3) |
0 (0) |
|
Enfermedades benignasc) |
||||||
|
Enfermedades pulmonares benignas |
100 |
0 (0) |
76 (76.0) |
23 (23.0) |
1 (1.0) |
0 (0) |
|
Nefropatías |
9 |
0 (0) |
5 (55.6) |
3 (33.3) |
1 (11.1) |
0 (0) |
|
Otras enfermedades benignas |
143 |
0 (0) |
113 (79.0) |
28 (19.6) |
2 (1.4) |
0 (0) |
|
Cáncer |
||||||
|
CPCP |
206 |
0 (0) |
31 (15.0) |
20 (9.7) |
19 (9.2) |
136 (66.0) |
|
NSCLC |
853 |
0 (0) |
619 (72.6) |
209 (24.5) |
12 (1.4) |
13 (1.5) |
|
Mezcla de NSCLC/SCLC |
8 |
0 (0) |
2 (25.0) |
2 (25.0) |
0 (0) |
4 (50.0) |
|
Mesotelioma |
28 |
0 (0) |
25 (89.3) |
3 (10.7) |
0 (0) |
0 (0) |
|
Carcinoma medular de tiroides |
15 |
0 (0) |
2 (13.3) |
1 (6.7) |
0 (0) |
12 (80.0) |
|
Carcinoma neuroendocrino |
22 |
0 (0) |
9 (40.9) |
5 (22.7) |
3 (13.6) |
5 (22.7) |
|
Cáncer de mama |
52 |
0 (0) |
40 (76.9) |
12 (23.1) |
0 (0) |
0 (0) |
|
Carcinoma ovárico |
36 |
0 (0) |
25 (69.4) |
9 (25.0) |
1 (2.8) |
1 (2.8) |
|
Cáncer de próstata |
31 |
0 (0) |
18 (58.1) |
9 (29.0) |
4 (12.9) |
0 (0) |
|
Cáncer colorrectal |
64 |
0 (0) |
46 (71.9) |
15 (23.4) |
3 (4.7) |
0 (0) |
|
Otras neoplasias malignasd) |
115 |
0 (0) |
86 (74.8) |
25 (21.7) |
4 (3.5) |
0 (0) |
c) Las otras afecciones benignas incluyen enfermedades hepáticas, metabólicas, autoinmunes e inflamatorias. Las enfermedades pulmonares benignas incluyen neumonía, asma, EPOC y tuberculosis.
d) Las otras neoplasias malignas incluyen tumores renales, hepáticos, pancreáticos, gastrointestinales, estomacales, cervicales y linfomas.
Utilización del test ProGRP para el diagnóstico diferencial primario del cáncer de pulmón: La idoneidad de ProGRP para diferenciar entre SCLC y NSCLC se investigó en el marco de un estudio efectuado con 1059 pacientes de 5 centros europeos y chinos (206 pacientes con SCLC y 853 pacientes con NSCLC). Los niveles de ProGRP se correlacionaron con hallazgos histológicos de biopsias. La distribución de los valores se ilustra en el diagrama de caja y en la tabla 2 x 2 indicados a continuación:

x = 1: NSCLC, China (n = 105)
2: NSCLC, Europa (n = 748)
3: SCLC, China (n = 37)
4: SCLC, Europa (n = 169)
y = ProGRP sérico (pg/mL)
|
NSCLC |
CPCP |
N |
|
|
ProGRP ≤ 80.1 pg/mL |
811 |
45 |
856 (80.8%) |
|
ProGRP > 80.1 pg/mL |
42 |
161 |
203 (19.2%) |
|
N |
853 (80.5%) |
206 (19.5%) |
1059 (100%) |
El valor de corte para una especificidad del 95% (basado en una cohorte de pacientes con NSCLC) fue de 80.1 pg/mL. En la tabla siguiente se presenta la correlación entre los valores del test ELECSYS PROGRP y la fase de la enfermedad para 189 pacientes con SCLC, 853 pacientes con NSCLC y 100 pacientes con enfermedad pulmonar benigna:
|
Condición clínica |
N |
Percentil 5 pg/mL |
Mediana de ProGRP pg/mL |
Percentil 95 pg/mL |
|
SCLC Fases I-II |
11 |
17.9 |
75.9 |
1215 |
|
SCLC Fase III |
66 |
32.9 |
545 |
3277 |
|
SCLC Fase IV |
112 |
35.3 |
748 |
21410 |
|
NSCLC Fases I-IV |
853 |
16.7 |
38.7 |
80.1 |
|
Enfermedad pulmonar benigna |
100 |
14.8 |
36.0 |
80.8 |
En la tabla siguiente se indica la sensibilidad del test ProGRP en pacientes en las fases I-IV de SCLC frente a NSCLC y frente a enfermedades pulmonares benignas a la especificidad predefinida del 95% así como los valores del área bajo la curva (ABC).
|
Punto de corte pg/mL |
Sensibilidad % |
ABC (IC del 95%) |
|
|
SCLC frente a NSCLC |
80.1 |
78.2 |
0.898 (0.868-0.928) |
|
SCLC frente a enfermedades pulmonares benignas |
80.8 |
78.2 |
0.913 (0.882-0.943) |
|
SCLC frente a otras neoplasias malignas |
191 |
66.0 |
0.864 (0.830-0.898) |
Seguimiento de la respuesta al tratamiento de pacientes con SCLC diagnosticado: Se determinó la utilidad del test ELECSYS PROGRP en el seguimiento de la respuesta al tratamiento de pacientes con SCLC en un estudio clínico llevado a cabo en 6 centros europeos y chinos a partir de un total de 1209 muestras de sangre de 314 pacientes en terapias de primera y segunda línea (en su mayoría regímenes con dobletes de platino o topotecán). El diagnóstico por imagen (tomografía computarizada, TC) se realizó según los estándares locales. Los niveles de ProGRP se registraron en cada toma de imagen. Los niveles de ProGRP antes del tratamiento se correlacionaron con los niveles de ProGRP en el momento de mayor respuesta tumoral visualizada durante el diagnóstico por imagen ("mejor respuesta"; n = 215 pacientes).
En la tabla siguiente se indican las variables demográficas del análisis:
|
Variables |
Europa |
China |
Todos los lugares |
|
|---|---|---|---|---|
|
N |
145 |
70 |
215 |
|
|
Edad |
Media |
62.7 |
61.0 |
62.1 |
|
Mín/máx |
36/83 |
27/83 |
27/38 |
|
|
Sexo |
Femenino |
67 |
18 |
85 |
|
Masculino |
78 |
52 |
130 |
|
|
Etnia |
Caucásica |
128 |
0 |
128 |
|
China |
0 |
70 |
70 |
|
|
Hábitos de fumar |
Fumadores habituales |
63 |
40 |
103 |
|
Ex fumadores |
39 |
13 |
52 |
|
|
No fumadores |
3 |
17 |
20 |
|
|
Ninguna indicación |
40 |
0 |
40 |
|
|
Línea de tratamiento con la mejor respuesta |
Tratamiento de 1.ra línea |
88 |
57 |
145 |
|
Tratamiento de 2.a línea |
36 |
7 |
43 |
|
|
Tratamiento de 3.ra línea u otro tratamiento |
21 |
6 |
27 |
Una modificación negativa del valor de ProGRP se definió como disminución porcentual en el momento de la mejor respuesta en relación con los niveles durante el pretratamiento. En la tabla siguiente se indican las sensibilidades y las especificidades de diferentes concentraciones de corte para la disminución porcentual de ProGRP. Los pacientes no respondedores al tratamiento se definen como pacientes con progresión tumoral visualizada por imágenes contrariamente a los pacientes que controlan el tumor (pacientes respondedores).
|
Punto de corte e) ProGRP en % |
Sensibilidadf ) % |
Especificidad g) % |
VPP h) % |
VPN i) % |
|
-50 |
82.8 |
65.6 |
27.3 |
96.1 |
|
-60 |
89.7 |
61.8 |
26.8 |
97.5 |
|
-70 |
89.7 |
55.4 |
23.9 |
97.2 |
|
-80 |
93.1 |
48.9 |
22.1 |
97.8 |
|
-90 |
96.6 |
39.8 |
20.0 |
98.7 |
e) Modificación desde los valores basales hasta la mejor respuesta
f) No respondedores, correctamente detectados
g) TC potencialmente ahorradas en pacientes respondedores
h) VPP = valor predictivo positivo
i) VPN = valor predictivo negativo
Los VPP y VPN están basados en las prevalencias de respondedores y no respondedores observadas en este estudio clínico.
La siguiente gráfica ilustra los cambios de las concentraciones de ProGRP antes del tratamiento hasta el momento de mayor respuesta. La línea gris representa la modificación media del total de los pacientes incluidos en el estudio.
Respondedores (n = 186):
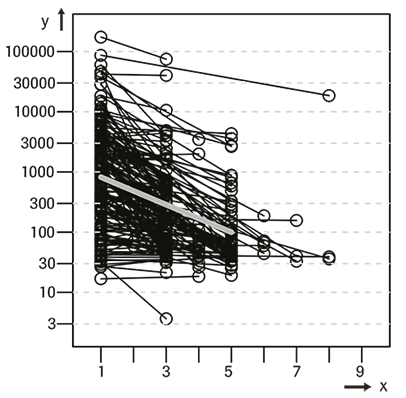
x = visitas, y = ProGRP (pg/mL)
No respondedores (n = 29)
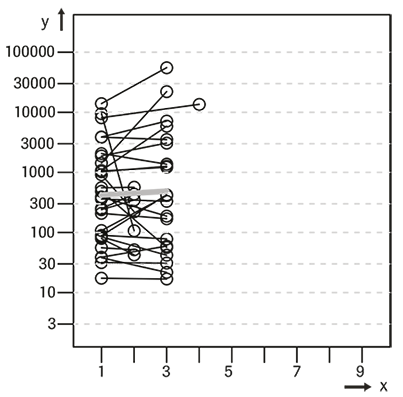
x = visitas, y = ProGRP (pg/mL)
El seguimiento del tratamiento primario de pacientes con SCLC: La utilidad del test ELECSYS PROGRP para el seguimiento de pacientes tras quimioterapia se ilustra en el ejemplo siguiente. La gráfica muestra los valores de ProGRP en una paciente a lo largo del tratamiento de primera línea (régimen de carboplatino/etopósido) y después del tratamiento.
Paciente femenina de 72 años:
Estadio de la UICC (Union Internationale Contre le Cancer): IV, TNM (clasificación de tumores malignos) estadio: T4_N3_M1b

x = días, y = PROGRP (pg/mL)
V = visita, PR = remisión parcial, SD = enfermedad estable, PD = enfermedad progresiva
• = tratamiento de primera línea, o = de seguimiento
Consideraciones importantes:
• Si los resultados del test ProGRP no coinciden con las evidencias clínicas, se recomienda efectuar pruebas adicionales para confirmar el resultado.
• Para el diagnóstico, los resultados deberían considerarse teniendo en cuenta diferentes aspectos como los síntomas, los resultados de otras pruebas, las impresiones clínicas, etc.
• Indicar los resultados conjuntamente con el tipo de muestra utilizado.
• En pacientes con una disfunción renal se han observado concentraciones elevadas de PROGRP. En esta enfermedad existe una correlación significativa entre las concentraciones séricas de PROGRP y las concentraciones séricas de creatinina.20 En el caso de altos valores de ProGRP que no concuerdan con el diagnóstico ni con las características clínicas del paciente debería considerarse la evaluación de las niveles séricas de creatinina.
• Independientemente de los valores obtenidos, los niveles de ProGRP no deben interpretarse como una evidencia absoluta de la presencia o ausencia de enfermedades malignas. En los pacientes con evidencia o sospecha de cáncer, también deben considerarse otros test y procedimientos apropiados que permitan establecer un diagnóstico y un tratamiento adecuado.
• Las concentraciones de ProGRP, determinadas para una misma muestra con pruebas de diferentes fabricantes, pueden diferir debido a diferentes métodos de análisis y calibración, y la especificidad de los reactivos.
MEDIDAS DE PRECAUCIÓN Y ADVERTENCIAS:
Para el uso diagnóstico in vitro por los profesionales de la salud. Observe las medidas de precaución usuales para la manipulación de reactivos de laboratorio.
Residuos infecciosos o microbiológicos:
Advertencia: manipule los residuos como material biológico potencialmente peligroso. Deseche los residuos de acuerdo con las instrucciones y procedimientos de laboratorio aceptados.
Peligros ambientales:
Aplique todas las normas locales de eliminación pertinentes para asegurar una eliminación segura.
Existe una ficha de datos de seguridad a disposición del usuario profesional que la solicite.
El presente estuche contiene componentes que han sido clasificados por la directiva CE No. 1272/2008 de la siguiente manera:
|
|
|
|
Advertencia: |
|
|
H317 |
Puede provocar una reacción alérgica en la piel. |
|
Prevención: |
|
|
P261 |
Evitar respirar el polvo/el humo/el gas/la niebla/los vapores/el aerosol. |
|
P272 |
Las prendas de trabajo contaminadas no podrán sacarse del lugar de trabajo. |
|
P280 |
Llevar guantes de protección. |
|
Respuesta: |
|
|
P333 + P313 |
En caso de irritación o erupción cutánea: consultar a un médico. |
|
P362 + P364 |
Quitar las prendas contaminadas y lavarlas antes de volver a usarlas. |
|
Eliminación: |
|
|
P501 |
Eliminar el contenido/el recipiente en una planta de eliminación de residuos aprobada. |
Las indicaciones de seguridad del producto corresponden a los criterios del sistema globalmente armonizado de clasificación y etiquetado de productos químicos (GHS por sus siglas en inglés) válidas en la UE.
Contacto telefónico internacional: +49-621-7590
Evite la formación de espuma en reactivos y muestras de todo tipo (especímenes, calibradores y controles).
CONSERVACIÓN Y ESTABILIDAD:
Conservar a 2-8°C.
No congelar.
Conservar el cobas e pack en posición vertical para garantizar la disponibilidad total de las micropartículas durante la mezcla automática antes del uso.
|
Estabilidad: |
|
|
Sin abrir, a 2-8°C |
Hasta la fecha de caducidad indicada |
|
En los analizadores |
16 semanas |
DILUCIÓN:
Las muestras con concentraciones de ProGRP superiores al intervalo de medición pueden diluirse con Diluent MultiAssay. Se recomienda una dilución a 1:10 (automáticamente por los analizadores o bien de forma manual). La concentración de la muestra diluida debe superar los 500 pg/mL.
Multiplicar los resultados obtenidos tras dilución manual por el factor de dilución.
El software de los analizadores tiene en cuenta la dilución automática al calcular la concentración de las muestras.
MATERIAL REQUERIDO ADICIONALMENTE (NO SUMINISTRADO):
• ![]() 06505970190, ProGRP CalSet para 4 x 1.0 mL
06505970190, ProGRP CalSet para 4 x 1.0 mL
• ![]() 06505988190, PreciControl ProGRP para 4 x 1.0 mL
06505988190, PreciControl ProGRP para 4 x 1.0 mL
• ![]() 07360070190, PreciControl Lung Cancer para 4 x 3.0 mL
07360070190, PreciControl Lung Cancer para 4 x 3.0 mL
• ![]() 07299010190, Diluent MultiAssay, 45.2 mL de diluyente para muestras
07299010190, Diluent MultiAssay, 45.2 mL de diluyente para muestras
• Equipo usual de laboratorio
• Analizador cobas e
Materiales adicionales para los analizadores cobas e 402 y cobas e 801:
• ![]() 06908799190, ProCell II M, 2 x 2 L de solución del sistema
06908799190, ProCell II M, 2 x 2 L de solución del sistema
• ![]() 04880293190, CleanCell M, 2 x 2 L de solución de limpieza para la célula de medida
04880293190, CleanCell M, 2 x 2 L de solución de limpieza para la célula de medida
• ![]() 07485409001, Reservoir Cup, 8 recipientes para ProCell II M y CleanCell M
07485409001, Reservoir Cup, 8 recipientes para ProCell II M y CleanCell M
• ![]() 06908853190, PreClean II M, 2 x 2 L de solución de lavado
06908853190, PreClean II M, 2 x 2 L de solución de lavado
• ![]() 05694302001, Bandeja de Assay Tip/Assay Cup, 6 x 6 bandejas, cada una con 105 cubetas y 105 puntas de pipeta (3780 determinaciones), 3 cartones de residuos sólidos
05694302001, Bandeja de Assay Tip/Assay Cup, 6 x 6 bandejas, cada una con 105 cubetas y 105 puntas de pipeta (3780 determinaciones), 3 cartones de residuos sólidos
• ![]() 07485425001, Liquid Flow Cleaning Cup, 2 recipientes para la solución de limpieza ISE Cleaning Solution/Elecsys SysClean para la unidad de detección Liquid Flow Cleaning Detection Unit
07485425001, Liquid Flow Cleaning Cup, 2 recipientes para la solución de limpieza ISE Cleaning Solution/Elecsys SysClean para la unidad de detección Liquid Flow Cleaning Detection Unit
• ![]() 07485433001, PreWash Liquid Flow Cleaning Cup, 1 recipiente para la solución de limpieza ISE Cleaning Solution/Elecsys SysClean para la unidad de prelavado Liquid Flow Cleaning PreWash Unit
07485433001, PreWash Liquid Flow Cleaning Cup, 1 recipiente para la solución de limpieza ISE Cleaning Solution/Elecsys SysClean para la unidad de prelavado Liquid Flow Cleaning PreWash Unit
• ![]() 11298500316, ISE Cleaning Solution/Elecsys SysClean, 5 x 100 mL de solución de limpieza para el sistema
11298500316, ISE Cleaning Solution/Elecsys SysClean, 5 x 100 mL de solución de limpieza para el sistema
MATERIAL SUMINISTRADO:
Consultar la sección "Reactivos - Soluciones de trabajo" en cuanto a los reactivos suministrados.
CALIBRACIÓN:
Trazabilidad: El presente método ha sido estandarizado frente al test ARCHITECT ProGRP de Abbott Diagnostics.
La curva máster predefinida es adaptada al analizador a través del CalSet correspondiente.
Intervalo de calibraciones: Efectuar la calibración una vez por lote de reactivos con reactivos frescos de un cobas e pack registrado como máximo 24 horas antes en el analizador.
El intervalo de calibración puede ampliarse si el laboratorio asegura una verificación aceptable de la calibración.
Se recomienda repetir la calibración:
• Después de 12 semanas si se trata del mismo lote de reactivos.
• Después de 28 días (si se emplea el mismo cobas e pack en el analizador).
• En caso necesario: por ejemplo, si los valores del control de calidad están fuera del intervalo definido
CONTROL DE CALIDAD:
Efectuar el control de calidad con PreciControl Lung Cancer o PreciControl PROGRP.
Adicionalmente pueden emplearse otros controles apropiados.
Los controles de los diferentes intervalos de concentración deberían efectuarse junto con el test en determinaciones simples por lo menos 1 vez cada 24 horas, con cada cobas e pack y después de cada calibración.
Adaptar los intervalos y límites de control a los requisitos individuales del laboratorio. Los resultados obtenidos deben hallarse dentro de los límites definidos. Cada laboratorio debería establecer medidas correctivas a seguir en caso de obtener valores fuera del intervalo definido.
Si fuera necesario, repetir la medición de las muestras en cuestión.
Cumplir con las regulaciones gubernamentales y las normas locales de control de calidad pertinentes.
CÁLCULO:
El analizador calcula automáticamente la concentración de analito de cada muestra en pg/mL.
ESPECIFICIDAD ANALÍTICA:
La especificidad del test ELECSYS PROGRP ha sido concebida para tener una reactividad cruzada ≤ 1% si se lo analiza con el péptido liberador de gastrina (GRP) en una concentración de 100 ng/mL. Se realizó un estudio con el test ELECSYS PROGRP con base en el protocolo EP7-A2 del CLSI. El ProGRP se analizó en alícuotas de plasma humano con ProGRP en el intervalo entre 34 pg/mL y 107 pg/mL junto con 400 ng/mL de GRP. La reactividad cruzada de GRP ha sido calculada para ser inferior al 0.01%.k)
k) Datos representativos; los resultados de los laboratorios individuales pueden diferir de estos datos.
INFORMACIÓN DEL SISTEMA:
Nombre abreviado: PROGRP
ACN (código de aplicación): 10108
Nota: El valor medido de ProGRP de una muestra de paciente puede variar según el método de ensayo aplicado. Por lo tanto, el laboratorio siempre debe indicar el método de determinación de ProGRP empleado. Los valores de ProGRP de un paciente, obtenidos mediante diferentes procedimientos de test, no pueden compararse entre sí de forma directa pudiendo dar lugar a interpretaciones erróneas por parte del médico. En caso de cambiar el método de determinación de ProGRP durante el control del tratamiento, los valores del mismo deben confirmarse en el periodo de transición mediante mediciones paralelas de ambos métodos.
LÍMITES E INTERVALOS:
Intervalo de medición: 3-5000 pg/mL (definido por el límite de detección y el máximo de la curva máster). Los valores inferiores al límite de detección se indican como < 3 pg/mL. Los valores superiores al intervalo de medición se indican como > 5000 pg/mL o, en las muestras diluidas al 1:10, hasta 50000 pg/mL.
Límites inferiores de medición:
Límite de Blanco, Límite de Detección y Límite de Cuantificación:
• Límite de Blanco = 2 pg/mL
• Límite de Detección = 3 pg/mL
• Límite de Cuantificación = 9 pg/mL
El Límite de Blanco, el Límite de Detección y el Límite de Cuantificación fueron determinados cumpliendo con los requerimientos EP17-A2 del Instituto de Estándares Clínicos y de Laboratorio (CLSI - Clinical and Laboratory Standards Institute).
El Límite de Blanco es el valor del percentil 95 obtenido a partir de n ≥ 60 mediciones de muestras libres de analito en varias series independientes. El Límite de Blanco corresponde a la concentración por debajo de la cual se encuentran, con una probabilidad del 95%, las muestras sin analito.
El Límite de Detección se determina basándose en el Límite de Blanco y en la desviación estándar de muestras de baja concentración. El Límite de Detección corresponde a la menor concentración de analito detectable (valor superior al Límite de Blanco con una probabilidad del 95%).
El Límite de Cuantificación es la menor concentración de analito cuya medición puede reproducirse con un coeficiente de variación para la precisión intermedia de ≤ 20%.
PRECISIÓN:
La precisión ha sido determinada mediante reactivos Elecsys, muestras y controles según un protocolo (EP05-A3) del CLSI (Clinical and Laboratory Standards Institute): 2 ciclos diarios por duplicado, cada uno durante 21 días (n = 84). Se obtuvieron los siguientes resultados:
|
Analizadores cobas e 402 y cobas e 801 |
|||||
|
Repetibilidad |
Precisión intermedia |
||||
|
Muestra |
Media pg/mL |
DE pg/mL |
CV % |
DE pg/mL |
CV % |
|
Plasma humano 1 |
6.74 |
0.292 |
4.3 |
0.334 |
5.0 |
|
Plasma humano 2 |
9.35 |
0.417 |
4.5 |
0.447 |
4.8 |
|
Plasma humano 3 |
72.1 |
1.12 |
1.6 |
1.40 |
1.9 |
|
Plasma humano 4 |
2504 |
38.8 |
1.6 |
47.6 |
1.9 |
|
Plasma humano 5 |
4834 |
51.0 |
1.1 |
88.2 |
1.8 |
|
PC j) ProGRP1 |
46.3 |
0.447 |
1.0 |
0.634 |
1.4 |
|
PC ProGRP2 |
796 |
8.18 |
1.0 |
10.2 |
1.3 |
|
PC Lung Cancer1 |
64.3 |
0.662 |
1.0 |
1.10 |
1.7 |
|
PC Lung Cancer2 |
862 |
9.07 |
1.1 |
10.6 |
1.2 |
j) PC = PreciControl.
CARACTERÍSTICAS:
El péptido liberador de gastrina (GRP) es una molécula reguladora importante implicada en diferentes procesos fisiológicos y fisiopatológicos humanos. Es una hormona intestinal que constituye el homólogo mamífero de la bombesina obtenida de anfibios. Aislado originalmente a partir del estómago porcino,2 el GRP está ampliamente distribuido en el sistema nervioso y el tracto gastrointestinal y pulmonar de mamíferos.3 Después de liberarse un péptido de señal, la preproproteína de 148 aminoácidos es proteolizada generándose el GRP de 27 aminoácidos y el precursor del GRP (ProGRP) de 68 aminoácidos. Debido a que el GRP tiene una vida media de sólo 2 minutos, no es posible medirlo en sangre.4 En su lugar se desarrolló un ensayo para medir la concentración de ProGRP (31-98), una región carboxiterminal común a tres variantes de empalme (splicing) humanas. Se averiguó que las concentraciones séricas de ProGRP (31-98) indican de forma fiable un carcinoma microcítico de pulmón (SCLC, por su sigla inglesa de Small Cell Lung Cancer).2,5,6,7 El test ELECSYS PROGRP mide el ProGRP (31-98) en plasma y suero.
El ProGRP como también la enolasa neuroespecífica (NSE) son moléculas que se expresan en tumores y tejidos de origen neuroendocrino. Los valores aumentados de ProGRP han sido comunicados en diferentes tipos de tumores neuroendocrinos, incluido el cáncer pulmonar de células pequeñas, el tumor carcinoide, el carcinoma de células grandes no diferenciado del pulmón con características neuroendocrinas, el carcinoma medular tiroideo,8 otras neoplasias malignas neuroendocrinas8 así como en un subgrupo de cánceres de próstata andrógeno-independientes con características neuroendocrinas.9
ProGRP en enfermedades benignas: En la literatura se consideran normales concentraciones séricas de ProGRP entre 2 y 50 pg/mL.10 Sin embargo, en el marco de un estudio sobre pacientes con enfermedades benignas (excluyendo las enfermedades con insuficiencia renal) inclusive las hepatopatías, se encontraron en un 2.5% de los pacientes valores séricos anormales de ProGRP superiores a 50 pg/mL. Todas las concentraciones fueron inferiores a 80 pg/mL. La insuficiencia renal constituyó la única causa de aumentos importantes de este marcador biológico.11 Ya que sus concentraciones aumentan específicamente en el carcinoma microcítico de pulmón, el ProGRP se considera el biomarcador más sensible para el diagnóstico diferencial entre el SCLC y enfermedades pulmonares benignas.12 Un estudio clínico llevado a cabo con el test ELECSYS PROGRP (descrito detalladamente en la sección "valores teóricos") confirmó la alta especificidad para SCLC en el diagnóstico diferencial.
ProGRP en el cáncer de pulmón: Aunque el ProGRP se considera como un marcador biológico específico del SCLC, pueden encontrarse niveles anormales en un pequeño subgrupo de pacientes con carcinomas pulmonares de células no pequeñas (NSCLC). Sin embargo, las concentraciones de ProGRP de estos pacientes son significativamente inferiores a las concentraciones séricas de pacientes con SCLC.7 Las concentraciones séricas de ProGRP están correlacionadas con el estadio del tumor.10
ProGRP en el diagnóstico diferencial del cáncer de pulmón: Si los niveles de ProGRP en pacientes con cáncer de pulmón (sin insuficiencia renal) superan los 120 pg/mL, se trata probablemente de un SCLC.13
ProGRP en cánceres extrapulmonares: Los valores de ProGRP se encuentran aumentados sobre todo en pacientes con SCLC o tumores neuroendocrinos.14 Un nivel elevado de ProGRP en pacientes con tumores neuroendocrinos bien diferenciados indica un tumor primario en el pulmón y está asociado a un pronóstico desfavorable.15 En pacientes con otras neoplasias malignas sin insuficiencia renal se encontraron valores ligeramente elevados de ProGRP aunque en el 99.7% de los casos eran inferiores a 100 pg/mL. Usando como criterio un valor de corte de 150 pg/mL, la determinación de ProGRP permite diagnosticar el SCLC con una sensibilidad del 72.5%.11
ProGRP en el seguimiento de pacientes con SCLC: Diferentes investigadores mostraron la utilidad del ProGRP en el seguimiento del tratamiento de pacientes con SCLC y en la detección de recidivas.16,17 Un estudio clínico llevado a cabo con el test ELECSYS PROGRP (descrito detalladamente en la sección "valores teóricos") confirmó la eficacia de este biomarcador en el seguimiento de diferentes regímenes de tratamiento.
El ProGRP se considera como biomarcador idóneo para el SCLC porque ha demostrado:
• Ser sensible al SCLC y específico en cuanto a otras neoplasias malignas.
• Presentar valores normales en la mayoría de las enfermedades benignas salvo la insuficiencia renal.
• No tener resultados falsos positivos por hemólisis además de presentar una alta capacidad discriminatoria entre el intervalo normal y los niveles encontrados en pacientes con SCLC.
El NSE constituye un marcador biológico complementario en el diagnóstico del SCLC de modo que la determinación combinada de NSE y ProGRP mejora la precisión del diagnóstico histológico, el pronóstico y el seguimiento de dicha enfermedad.18
Los valores de ProGRP son elevados en el estadio precoz del SCLC. Sin embargo, debido a que su incidencia en la población general es baja, el test ELECSYS PROGRP no se recomienda para el cribado de la población general.
USO PREVISTO:
Inmunoensayo para la determinación cuantitativa de ProGRP en suero y plasma humanos. El test está previsto como ayuda en el diagnóstico diferencial del carcinoma pulmonar1 y en el manejo de los pacientes con carcinoma microcítico de pulmón conjuntamente con otros métodos clínicos. Los resultados obtenidos deben interpretarse teniendo en cuenta los resultados de otros métodos de acuerdo con los estándares vigentes para el manejo clínico.
Este inmunoensayo de electroquimioluminiscencia (electrochemiluminescence immunoassay) "ECLIA" está previsto para el uso en inmunoanalizadores cobas e.
LIMITACIONES DEL ANÁLISIS - INTERFERENCIAS:
Se analizaron los efectos de las siguientes sustancias endógenas y los siguientes compuestos farmacéuticos sobre el funcionamiento del test sin que se hayan observado interferencias.
Sustancias endógenas:
|
Compuesto |
Concentración analizada |
|
Albúmina |
≤ 200 g/L |
|
Bilirrubina |
≤ 1129 μmol/L o ≤ 66 mg/dL |
|
Hemoglobina |
≤ 0.621 mmol/L o ≤ 1000 mg/dL |
|
Intralipid |
≤ 2000 mg/dL |
|
Biotina |
≤ 4912 nmol/L o ≤ 1200 ng/mL |
|
Factores reumatoides |
≤ 540 UI/mL |
|
IgG |
≤ 17 g/L |
|
IgA |
≤ 10 g/L |
|
IgM |
≤ 2.9 g/L |
Criterio: para las concentraciones de entre 3-60 pg/mL se obtuvo una desviación de ≤ 6 pg/mL. Para las concentraciones > 60 pg/mL se obtuvo una desviación de ≤ 10%.
No se ha registrado el efecto prozona (high-dose hook) con concentraciones de ProGRP de hasta 100000 pg/mL.
Compuestos farmacéuticos: Se analizaron in vitro 16 fármacos de uso extendido sin encontrar interferencias con el presente ensayo.
Se analizaron adicionalmente los siguientes fármacos especiales sin encontrar interferencias con el presente ensayo.
Fármacos especiales:
|
Fármaco |
Concentración analizada |
|
Avastin |
750 μg/mL |
|
Carboplatino |
600 μg/mL |
|
Cisplatino |
180 μg/mL |
|
Ciclofosfamida |
500 μg/mL |
|
Dexametasona |
20 μg/mL |
|
Docetaxel |
112.5 μg/mL |
|
Doxorrubicina |
72 μg/mL |
|
Epoetina |
25 mU/L |
|
Erlotinib |
150 μg/mL |
|
Etopósido |
300 μg/mL |
|
Gefitinib |
250 μg/mL |
|
Clorhidrato de gemcitabina |
1500 μg/mL |
|
Ifosfamida |
2400 μg/mL |
|
Lomustina |
172.5 μg/mL |
|
Metotrexato |
1000 μg/mL |
|
Metoclopramida |
7.5 μg/mL |
|
Neupogen |
0.9 μg/mL |
|
Paclitaxel |
330 μg/mL |
|
Hidrocloruro de topotecán |
2.25 μg/mL |
|
Sulfato de vincristina |
3.0 μg/mL |
|
Tartrato de vinorelbina |
53.1 μg/mL |
En casos aislados pueden presentarse interferencias por títulos extremadamente altos de anticuerpos dirigidos contra anticuerpos específicos del analito, la estreptavidina o el rutenio. Estos efectos se han minimizado gracias a un adecuado diseño del test.
Para el diagnóstico, los resultados del test siempre deben interpretarse teniendo en cuenta la anamnesis del paciente, la exploración clínica así como los resultados de otros exámenes.
SÍMBOLOS:
Roche Diagnostics utiliza los siguientes símbolos y signos adicionalmente a los indicados en la norma ISO 15223-1 (para los EE.UU.: consulte dialog.roche.com para la definición de los símbolos usados):
|
CONTENT |
Contenido del kit |
|
SYSTEM |
Analizadores/instrumentos adecuados para los reactivos |
|
REAGENT |
Reactivo |
|
CALIBRATOR |
Calibrador |
|
|
Volumen para reconstitución |
|
GTN |
Número Global de Artículo Comercial |
La barra del margen indica suplementos, eliminaciones o cambios.
© 2021 Roche Diagnostics
ROCHE DIAGNOSTICS GMBH
Sandhofer Strasse 116
D-68305 Mannheim
+800 5505 6606
OBTENCIÓN Y PREPARACIÓN DE LAS MUESTRAS:
Ya que el ProGRP puede degradarse en suero por proteasas endógenas generadas durante el proceso de coagulación, se considera que el ProGRP es más estable en plasma. Según la literatura, el tipo de muestra más apropiado es el plasma.19 Sin embargo, dado que los anticuerpos del test se fijan a una región menos susceptible a la escisión por la proteasa, el test ELECSYS PROGRP también puede efectuarse en muestras de suero.1 Sólo se ha analizado y considerado apto el tipo de muestras aquí indicado.
Suero recogido en tubos estándar de muestra o en tubos que contienen gel de separación.
Plasma tratado con heparina de litio o con EDTA di o tripotásico.
Pueden emplearse tubos para plasma con heparina de litio que contengan gel de separación.
Criterio: pendiente 0.9-1.1 + coeficiente de correlación ≥ 0.95. Estable durante 9 horas a 20-25°C, 72 horas a 2-8°C, 12 semanas a -20°C (± 5°C). Las muestras pueden congelarse 2 veces.
(Criterio de aceptación para suero y plasma: < 60 pg/mL ± 6 pg/mL, > 60 pg/mL ± 10%. Adicionalmente, para suero para hasta el 10% de las muestras: < 60 pg/mL ± 18 pg/mL > 60 pg/mL ± 30%.)
Los tipos de muestra aquí indicados fueron analizados con tubos de recogida de muestras seleccionados, comercializados en el momento de efectuar el análisis, lo cual significa que no fueron analizados todos los tubos de todos los fabricantes. Los sistemas de recogida de muestras de diversos fabricantes pueden contener diferentes materiales que, en ciertos casos, pueden llegar a afectar los resultados de los análisis. Si las muestras se procesan en tubos primarios (sistemas de recogida de muestras), seguir las instrucciones del fabricante de tubos.
Centrifugar las muestras que contienen precipitado antes de realizar el ensayo.
No emplear muestras inactivadas por calor.
No utilizar muestras ni controles estabilizados con azida.
Se debe garantizar una temperatura de 20-25°C para la medición de muestras y calibradores.
Para evitar posibles efectos de evaporación, determinar las muestras y los calibradores que se sitúan en los analizadores dentro de un lapso de 2 horas.
PREPARACIÓN DE LOS REACTIVOS:
Los reactivos incluidos en el kit están listos para el uso y forman una unidad inseparable.
La información necesaria para el correcto funcionamiento está disponible a través de cobas link.
COMPARACIÓN DE MÉTODOS:
a) Una comparación entre el test ELECSYS PROGRP, ![]() 07027702190 (analizador cobas e 801; y) y el test ELECSYS PROGRP,
07027702190 (analizador cobas e 801; y) y el test ELECSYS PROGRP, ![]() 06505961190 (analizador cobas e 601; x) generó las siguientes correlaciones (en pg/mL):
06505961190 (analizador cobas e 601; x) generó las siguientes correlaciones (en pg/mL):
Número de muestras medidas: 135
|
Passing/Bablok22 |
Regresión lineal |
|
y = 0.977x + 0.170 |
y = 0.955x +10.5 |
|
τ = 0.987 |
r = 1.000 |
Las concentraciones de las muestras se situaron entre 4.58 y 4992 pg/mL.
b) Una comparación entre el test ELECSYS PROGRP, ![]() 09007695190 (analizador cobas e 801; y) y el test ELECSYS PROGRP,
09007695190 (analizador cobas e 801; y) y el test ELECSYS PROGRP, ![]() 07027702190 (analizador cobas e 801; x) generó las siguientes correlaciones (en pg/mL):
07027702190 (analizador cobas e 801; x) generó las siguientes correlaciones (en pg/mL):
Número de muestras medidas: 121
|
Passing/Bablok22 |
Regresión lineal |
|
y = 0.996x + 0.951 |
y = 0.970x +5.75 |
|
τ = 0.986 |
r = 0.999 |
Las concentraciones de las muestras se situaron entre 4.45 y 4710 pg/mL.
c) Una comparación entre el test ELECSYS PROGRP, ![]() 09007695190 (analizador cobas e 402; y) y el test ELECSYS PROGRP,
09007695190 (analizador cobas e 402; y) y el test ELECSYS PROGRP, ![]() 09007695190 (analizador cobas e 801; x) generó las siguientes correlaciones (en pg/mL):
09007695190 (analizador cobas e 801; x) generó las siguientes correlaciones (en pg/mL):
Número de muestras medidas: 120
|
Passing/Bablok22 |
Regresión lineal |
|
y = 1.00x + 0.487 |
y = 0.997x +1.01 |
|
τ = 0.989 |
r = 1.00 |
Las concentraciones de las muestras se situaron entre 4.17 y 4593 pg/mL.
DATOS ESPECÍFICOS DEL FUNCIONAMIENTO DEL TEST:
A continuación, se indican los datos representativos del funcionamiento de los analizadores. Los resultados de cada laboratorio en particular pueden diferir de estos valores.
PRINCIPIO DEL TEST:
Principio sándwich. Duración total del test: 18 minutos.
• 1.ª incubación: 18 μL de muestra, un anticuerpo monoclonal biotinilado anti-ProGRP y un anticuerpo monoclonal anti-ProGRP marcado con quelato de rutenioa) forman un complejo sándwich.
• 2.ª incubación: después de incorporar las micropartículas recubiertas de estreptavidina, el complejo formado se fija a la fase sólida por interacción entre la biotina y la estreptavidina.
• La mezcla de reacción es trasladada a la célula de medida donde, por magnetismo, las micropartículas se fijan a la superficie del electrodo. Los elementos no fijados se eliminan posteriormente con ProCell II M. Al aplicar una corriente eléctrica controlada se produce una reacción quimioluminiscente cuya emisión de luz se mide con un fotomultiplicador.
• Los resultados se determinan mediante una curva de calibración generada específicamente para el instrumento a partir de una calibración a 2 puntos y una curva máster suministrada a través de cobas link.
a) Tris (2,2’-bipiridina) rutenio (II) (Ru(bpy)![]()
REACTIVOS - SOLUCIONES DE TRABAJO:
El cobas e pack está etiquetado como PROGRP.
M Micropartículas recubiertas de estreptavidina, 1 frasco, 5.8 mL: Micropartículas recubiertas de estreptavidina: 0.72 mg/mL, conservante.
R1 Anticuerpo anti-ProGRP~biotina, 1 frasco, 9.5 mL: Anticuerpo monoclonal biotinilado anti-ProGRP (ratón) 3.5 mg/L; tampón fosfato 40 mmol/L, pH 7.0; conservante.
R2 Anticuerpo anti-ProGRP~Ru(bpy) ![]() , 1 frasco, 9.5 mL: Anticuerpo monoclonal anti-ProGRP (ratón) marcado con quelato de rutenio 2.0 mg/L; tampón fosfato 40 mmol/L, pH 7.0; conservante.
, 1 frasco, 9.5 mL: Anticuerpo monoclonal anti-ProGRP (ratón) marcado con quelato de rutenio 2.0 mg/L; tampón fosfato 40 mmol/L, pH 7.0; conservante.
REALIZACIÓN DEL TEST:
Para garantizar el funcionamiento óptimo del test, observe las instrucciones de la presente metódica referentes al analizador empleado. Consulte el manual del operador apropiado para obtener las instrucciones de ensayo específicas del analizador.
Las micropartículas se mezclan automáticamente antes del uso.
Colocar el cobas e pack refrigerado (a 2-8°C) en el gestor de reactivos (reagent manager). Evitar la formación de espuma. El analizador realiza automáticamente los procesos de atemperar, abrir y tapar el cobas e pack.
REFERENCIAS BIBLIOGRÁFICAS:
1. Korse CM, Holdenrieder S, Zhi X-y, et al. Multicenter evaluation of a new progastrin-releasing peptide (ProGRP) immunoassay across Europe and China. Clin Chim Acta 2015;438:388-395.
2. Miyake Y, Kodama T, Yamaguchi K. Pro-gastrin-releasing peptide (31-98) is a specific marker in patients with small cell lung carcinoma. Cancer Res 1994;54:2136-2140.
3. Ischia J, Patel O, Shulkes A, et al. Gastrin-releasing peptide: Different forms, different functions. Biofactors 2009;35:69-75.
4. Holst JJ, Hansen M, Bork E, et al. Elevated plasma concentrations of c- flanking gastrin-releasing peptide in small-cell lung cancer. J Clin Oncol 1989;12:1831-1838.
5. Aoyagi K, Miyake Y, Urakami K, et al. Enzyme immunoassay of immunoreactive progastrin-releasing peptide (31-98) as tumor marker for small-cell lung carcinoma: development and evaluation. Clin Chem 1995;41:537-543.
6. Yamaguchi K, Aoyagi K, Urakami K, et al. Enzyme-linked immunosorbent assay of pro-gastrine-releasing peptide for small cell lung cancer patients in comparison with neuron-specific enolase measurement. Jpn J Cancer Res 1995;86:698-705.
7. Stieber P, Dienemann H, Schalhorn A, et al. Pro-gastrin-releasing peptide (ProGRP) - a useful marker in small cell lung carcinomas. Anticancer Res 1999;19:2673-2678.
8. Inaji H, Komoike Y, Motomura K, et al. Demonstration and diagnostic significance of Pro-gastrin-releasing peptide in medullary thyroid carcinoma. Oncology 2000;59:122-125.
9. Yashi M, Terauchi F, Nukui A, et al. Small-cell neuroendocrine carcinoma as a variant form of prostate cancer recurrence: a case report and short literature review. Urol Oncol 2006;24:313-317.
10. Molina R, Augé JM, Bosch X, et al. Usefulness of serum tumor markers, including progastrin-releasing peptide in patients with lung cancer: correlation with histology. Tumor Biol 2009;30:121-129.
11. Molina R, Augé JM, Alicarte J, et al. Pro-gastrin-releasing peptide in patients with benign and malignant diseases. Tumor Biol 2004;25:56-61.
12.Stieber P, Yamaguchi K. ProGRP enables diagnosis of small-cell lung cancer. In: Diamandiis EP, Fritsche HA, Lilja H, et al. (eds): Tumor Markers. Physiology, Pathobiology, Technology and Clinical Applications. AACC Press, Washington, 2002; pp 517-521.
13. Molina R, Filella X, Augé JM. ProGRP: a new biomarker for small cell lung cancer. Clin Biochem 2004;37:505-511.
14. Korse CM, Taal BG, Vincent A, et al. Choice of tumour markers in patients with neuroendocrine tumours is dependent on the histological grade. A marker study of Chromogranin A, Neuron specific enolase, Progastrin-releasing peptide and cytokeratin fragments. Eur J Cancer 2012;48:662-671.
15. Korse CM, Taal BG, Bonfrer JMG, et al. An elevated progastrin- releasing peptide level in patients with well-differentiated neuroendocrine tumours indicates a primary tumour in the lung and predicts a shorter survival. Ann Oncol 2011;22:2625-2630.
16. Okusaka T, Eguchi K, Kasai T, et al. Serum levels of pro-gastrin- releasing peptide for follow-up of patients with small cell lung cancer. Clin Cancer Res 1997;3:123-127.
17. Yamaguchi K, Abe K, Kameya T, et al. Production and molecular size heterogeneity of immunoreactive gastrinreleasing peptide in fetal and adult lungs and primary lung tumors. Cancer Res 1983;43:3932-3939.
18. Molina R. ProGRP: A New Biomarker for Small Cell Lung Cancer. EJCMO 2009;1:25-32.
19. Nordlund MS, Bjerner J, Warren DJ, et al. Progastrin-releasing peptide: stability in plasma/serum and upper reference limit. Tumor Biol 2008;29:204-210.
20. Kamata K, Uchida M, Takeuchi Y, et al. Increased serum concentrations of pro-gastrin-releasing peptide in patients with renal dysfunction. Nephrol Dial Transplant 1996;11:1267-1270.
21. Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009;150:604-612.
22. Bablok W, Passing H, Bender R, et al. A general regression procedure for method transformation. Application of linear regression procedures for method comparison studies in clinical chemistry, Part III. J Clin Chem Clin Biochem 1988 Nov;26(11):783-790.
Para más información acerca de los componentes, consultar el manual del operador del analizador, las hojas de aplicación, la información de producto y las metódicas correspondientes (disponibles en su país).
En la presente metódica se emplea como separador decimal un punto para distinguir la parte entera de la parte fraccionaria de un número decimal. No se utilizan separadores de millares.
Los antígenos ProGRP y los anticuerpos anti-ProGRP utilizados en los productos Roche ProGRP son licenciados por Fujirebio Diagnostics, Inc.
Todo incidente grave que se haya producido en relación con el producto se comunicará al fabricante y a la autoridad competente del Estado Miembro en el que se encuentre el usuario y/o el paciente.
Para el resumen del informe de seguridad y funcionamiento, consulte: https://ec.europa.eu/tools/eudamed