
ELECSYS PIVKA-II
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
VALORES TEÓRICOS:
Los siguientes valores de PIVKA-II (ng/mL) se encontraron en muestras de suero de 811 adultos aparentemente sanos (431 hombres y 380 mujeres; entre ellos 803 adultos caucásicos) de entre 20 y 79 años de edad (edad media 47.05):
|
Mín./máx. |
Valor medio DE |
Mediana (ICb) 95%) |
Percentil 95 (IC del 95%) |
|
|
Todos (N = 811) |
8.40/131 |
19.7 (6.38) |
18.7 (18.4; 19.0) |
28.4 (26.9; 29.4) |
|
Mujeres (N = 380) |
8.40/54.4 |
19.2 (5.32) |
18.1 (17.7; 18.7) |
27.8 (26.7; 31.1) |
|
Hombres (N = 431) |
11.2/131 |
20.3 (7.15) |
19.0 (18.7; 19.6) |
28.6 (26.7; 30.0) |
b) IC = Intervalo de confianza.
Cada laboratorio debería comprobar si los intervalos de referencia pueden aplicarse a su grupo de pacientes y, en caso necesario, establecer sus propios valores.
Cohorte de estudio para evaluar el rendimiento clínico de PIVKA-II: Se efectuó un estudio con 376 pacientes con enfermedad hepática. De éstos, 168 sufrieron de CHC y 208 tenían hepatopatías sin diagnóstico de CHC (control).
|
Edad media |
Sexo (masculino, %) |
Raza |
|||||
|
Asiática (%) |
Caucásica (%) |
Negra (%) |
Otra (%) |
Faltante (%) |
|||
|
Control (N = 208) |
53 |
60.6 |
47.6 |
48.6 |
1.4 |
0 |
2.4 |
|
CHC (N = 168) |
64 |
83.9 |
42.3 |
56.5 |
0 |
0.6 |
0.6 |
Intervalo de concentración PIVKA-II en pacientes con CHC en comparación con controles: La tabla y la gráfica siguientes indican el intervalo de concentración PIVKA-II en muestras de pacientes con CHC estadificados según la clasificación clínica de cáncer de hígado de Barcelona (BCLC)26 en comparación con controles. Para los 168 pacientes con un diagnóstico de CHC, la concentración de PIVKA-II aumentó con la progresión de la enfermedad. Todas las concentraciones se indican en ng/mL. La línea gruesa de las diagramas de caja representa el valor de la mediana.
|
Estadio de la enfermedad |
N |
Mín./máx. |
Valor medio (DE) |
Mediana |
Del 25 al 75 % c) |
|
Control d) |
208 |
9.92/465 |
31.7 (53.9) |
19.4 |
16.8-23.6 |
|
Temprano (estadios 0 + A) |
77 |
9.39/14233 |
783 (2493) |
63 |
32.3-329 |
|
BCLC estadio 0 |
10 |
14.4/44 |
27.5 (9.14) |
28.1 |
- |
|
BCLC estadio A |
67 |
9.39/14233 |
895 (2657) |
111 |
36.5-460 |
|
Tardío (estadios B, C y D) |
91 |
15.3/89918 |
7468 (15840) |
1486 |
252-5056 |
|
BCLC estadio B |
26 |
15.3/53067 |
4378 (13319) |
357 |
96.4-1094 |
|
BCLC estadio C |
57 |
18.7/89918 |
7636 (15858) |
2508 |
295-5672 |
|
BCLC estadio D |
8 |
520/62941 |
16309 (21339) |
7785 |
- |
c) No calculado si el número de muestras era igual o inferior a 20.
d) En la siguiente representación gráfica, este grupo se designa con una "X".
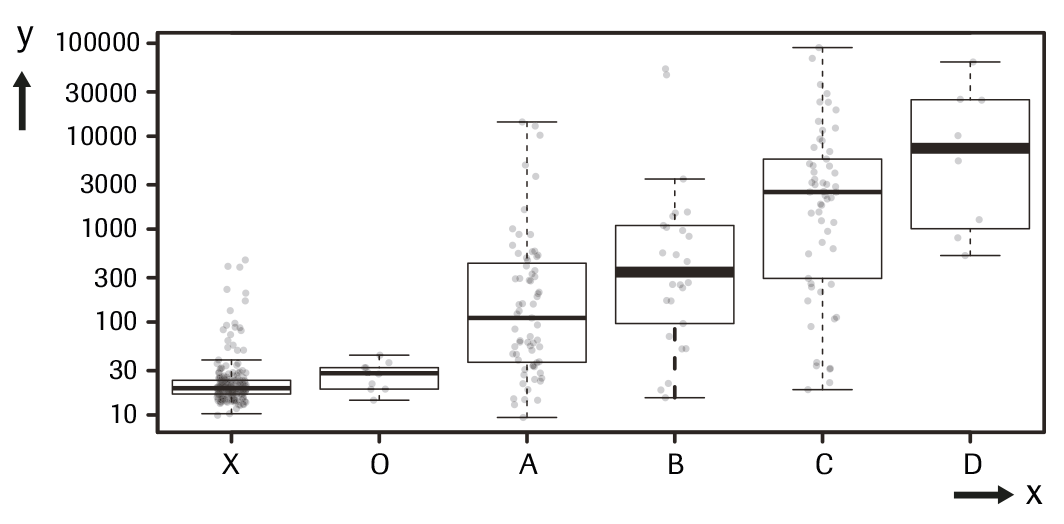
x ---> X: control; O: estadio 0; A: estadio A; B: estadio B; C: estadio C; D: estadio D.
y ---> PIVKA-II (ng/mL)
La concentración de PIVKA-II y la etiología de la enfermedad: La concentración de PIVKA-II según etiología para los dos grupos de pacientes (Control, 1-A a 1-F y CHC, 2-A a 2F) se muestra en la tabla y gráfica siguientes.
|
Grupo |
Etiología e) |
N |
Mín./máx. |
Valor medio (DE) |
Mediana |
Del 25 al 75% c) |
|
1-A |
Cirrosis |
79 |
11.7/465 |
50.6 (83.9) |
20.7 |
17.4-35.7 |
|
1-B |
Hepatitis B |
72 |
10.3/39 |
19.4 (5.26) |
18.2 |
16.1-21.3 |
|
1-C |
Hepatitis C |
27 |
9.92/24.9 |
18.0 (3.5) |
18.2 |
14.8-20.4 |
|
1-D |
NASH f) |
30 |
16.7/86.7 |
23.8 (12.3) |
21.3 |
18.9-24.9 |
|
1-E |
ALD g) |
0 |
- |
- |
- |
- |
|
1-F |
Otras |
0 |
- |
- |
- |
- |
|
2-A |
Cirrosis |
139 |
9.39/89918 |
4608 (13126) |
277 |
49.7-2177 |
|
2-B |
Hepatitis B |
14 |
37.3/24432 |
4229 (6831) |
625 |
- |
|
2-C |
Hepatitis C |
3 |
19/571 |
208 (315) |
32.3 |
- |
|
2-D |
NASH f) |
1 |
- |
30.7 (-) |
- |
- |
|
2-E |
ALD g) |
2 |
460/807 |
633 (245) |
633 |
- |
|
2-F |
Otras |
9 |
22.3/23205 |
4240 (7322) |
1620 |
- |
e) Todas las etiologías son no cirróticas, con excepción de la propia cirrosis.
f) Esteatohepatitis no alcohólica.
g) Enfermedad hepática alcohólica.
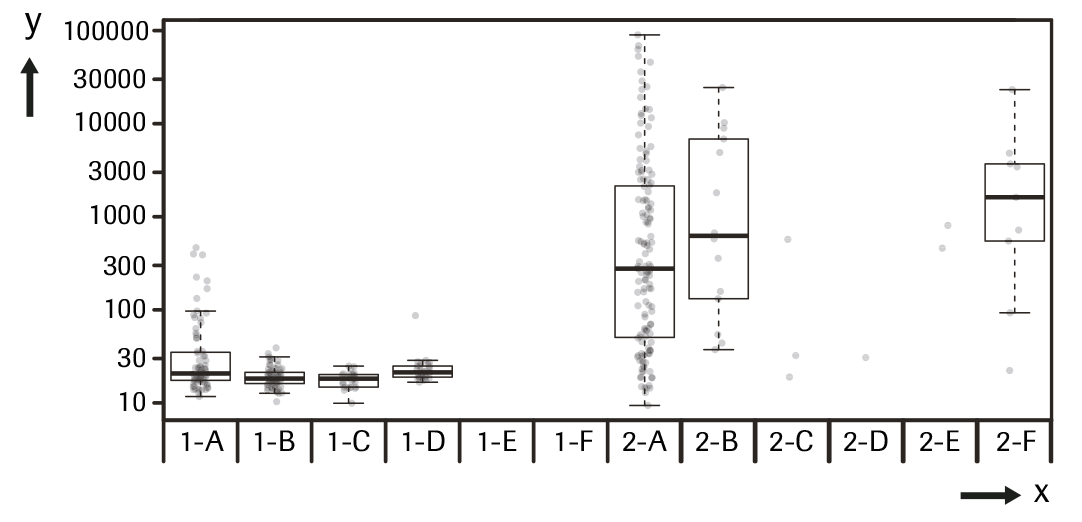
y---> PIVKA-II (ng/mL)
Funcionamiento clínico del ensayo ELECSYS PIVKA-II para la detección del CHC:
A continuación, se muestran la sensibilidad y especificidad del ensayo ELECSYS PIVKA-II en la detección del CHC con un punto de corte de 28.4 ng/mL (percentil 95 en la población aparentemente sana) y los resultados del análisis ROC (receiver operating characteristic).
|
CHC, en total |
CHC, estadio temprano h) |
CHC, estadio tardío i) |
|
|
Sensibilidad (IC del 95%) |
86.9% (80.8%, 91.6%) |
77.9% (67 %, 86.6%) |
94.5% (87.6%, 98.2%) |
|
Especificidad (IC del 95%) |
83.7 % (77.9 %, 88.4 %) |
83.7% (77.9 %, 88.4%) |
837% (77.9%, 88.4%) |
|
ROC ABC j) |
90.8% |
84.7% |
95.9% |
h) Estadios BCLC 0, A.
i) Estadios BCLC B, C, D.
j) Área bajo la curva.
|
Cirrosis |
Hep. B |
Hep. C |
NASH |
ALD |
Otros |
|
|
Sensibilidad (IC del 95%) k) |
85.6% (78.7%, 91%) |
- |
- |
- |
- |
- |
|
Especificidad (IC del 95%) k) |
68.4% (56.9%, 78.4%) |
90.3% (81%, 96%) |
100% (87.2%, 100%) |
93.3% (77.9%, 99.2%) |
- |
- |
|
ROC ABC j) |
85.6% |
97.3% |
96.4% |
|||
k) No calculada si el número de muestras es igual o inferior a 20.
Puntos de corte del ensayo ELECSYS PIVKA-II a la sensibilidad o especificidad indicada:
Las tablas siguientes indican el funcionamiento clínico del ensayo ELECSYS PIVKA-II a diferentes puntos de corte a la sensibilidad o especificidad indicada.
|
Especificidad |
Punto de corte de PIVKA-II (ng/mL) |
Sensibilidad (IC del 95%) |
|
95% |
86.7 |
67.9% (60.2%, 74.8%) |
|
90% |
35.9 |
81% (74.2%, 86.6%) |
|
85% |
28.5 |
86.9% (80.8%, 91.6%) |
|
80% |
25.3 |
88.7% (82.9%, 93.1%) |
|
75% |
23.5 |
89.9% (84.3%, 94%) |
|
70% |
22.7 |
90.5% (85%, 94.5%) |
|
Sensibilidad |
Punto de corte de PIVKA-II (ng/mL) |
Especificidad (IC del 95%) |
|
95% |
18.7 |
43.3% (36.4%, 50.3%) |
|
90% |
23.1 |
72.1% (65.5%, 78.1%) |
|
85% |
31.2 |
87.5% (82.2%, 91.7%) |
|
80% |
36.5 |
90.4% (85.5%, 94%) |
|
75% |
51.4 |
91.8% (87.2%, 95.2%) |
|
70% |
63.1 |
93.3% (89%, 96.3%) |
Valores de PIVKA-II en diferentes enfermedades benignas y malignas:
La tabla y la gráfica siguientes muestran la concentración de PIVKA-II (ng/mL) en un panel de muestras de pacientes con hepatopatía benigna, trastorno inmunológico o una enfermedad maligna que no sea CHC (N total 397; edad media 54 años, 58% femeninas, 39% asiáticos y 61% caucásicos).
|
Grupo |
Enfermedad |
N |
Mín./máx. |
Valor medio (DE) |
Mediana |
Del 25 al 75% c) |
|
A |
Hepatopatía benigna l) |
87 |
13.3/843 |
50.7 (134) |
20.9 |
17.1-28.0 |
|
B |
Artritis reumatoide |
38 |
13.0/51.1 |
19.5 (6.19) |
17.9 |
16.3-21.8 |
|
C |
Enfermedad de Crohn |
37 |
11.4/660 |
38.9 (105) |
19.9 |
17.3-25.8 |
|
D |
Colitis ulcerosa |
30 |
3.5/71.3 |
21.6 (10.9) |
19.5 |
17.2-23.1 |
|
E |
Otras enfermedades autoinmunes m) |
26 |
12.2/37.6 |
21.4 (7.38) |
18.0 |
16.6-26.4 |
|
F |
Cáncer pulmonar |
24 |
11.3/176 |
28.5 (32.8) |
19.7 |
16.3-26.1 |
|
G |
Cáncer de mama |
27 |
15.0/266 |
33.1 (47.8) |
21.3 |
18.7-27.2 |
|
H |
Cáncer renal |
10 |
13.9/4015 |
492 (1257) |
24.1 |
- |
|
I |
Colangiocarcinoma n) |
27 |
14.5/22463 |
2313 (5619) |
143 |
42.6-834 |
|
J |
Cáncer de páncreas o) |
10 |
17.6/3034 |
674 (966) |
211 |
- |
|
K |
Otros cánceres gastrointestinales p) |
55 |
12.8/2342 |
72.1 (314) |
19.9 |
17.5-29.4 |
|
L |
Cánceres ginecológicos q) |
26 |
14.7/3186 |
151 (619) |
21.4 |
18.8-39.2 |
l) Enfermedad poliquística hepática, quistes simples, hiperplasia nodular focal, hemangioma, adenoma hepatocelular, enfermedad hepática alcohólica no cirrótica.
m) Lupus eritematoso sistémico, tiroiditis autoinmune.
n) De los 8 pacientes con colangiocarcinoma o cáncer pancreático con una concentración de PIVKA-II > 1000 ng/mL, 5 pacientes tenían evidencia de enfermedad colestásica (por ejemplo, colestasis, colangitis, ictericia, obstrucción biliar) en el momento de la extracción de sangre. Paralos otros 3 pacientes no se pudo obtener información detallada.
o) De los 8 pacientes con colangiocarcinoma o cáncer pancreático con una concentración de PIVKA-II > 1000 ng/mL, 5 pacientes tenían evidencia de enfermedad colestásica (por ejemplo, colestasis, colangitis, ictericia, obstrucción biliar) en el momento de la extracción de sangre. Para los otros 3 pacientes no se pudo obtener información detallada.
p) Cáncer colorrectal, gástrico y esofágico.
q) Cáncer ovárico, endometrial y cervical.
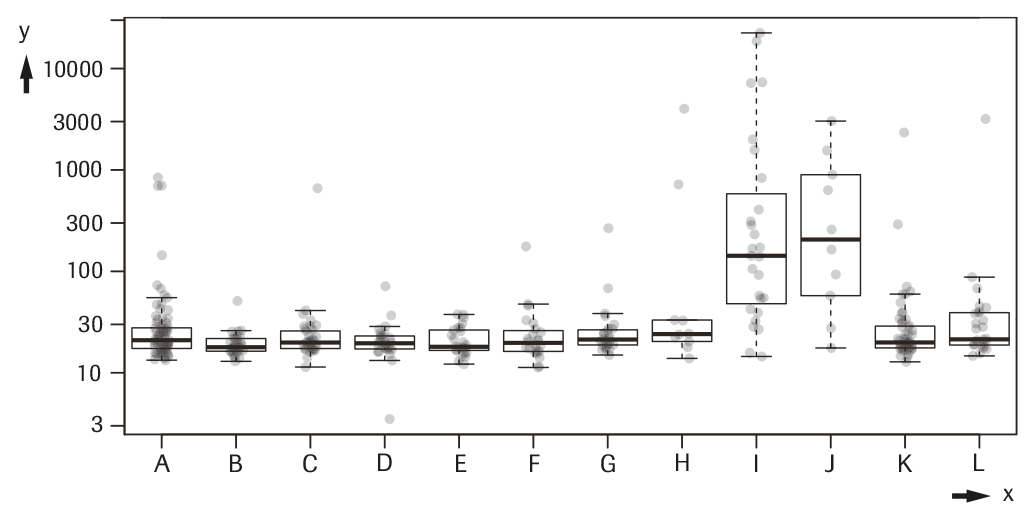
y---> PIVKA-II (ng/mL)
Comparación del rendimiento clínico: El funcionamiento clínico del ensayo ELECSYS PIVKA-II en cuanto a la discriminación entre casos de CHC (N = 168) y controles de enfermedad (N = 208) se comparó con el del test Fujirebio Lumipulse PIVKA-II mediante análisis ROC: el ensayo ELECSYS PIVKA-II presenta un ABC del 90.8% mientras que el test Fujirebio Lumipulse PIVKA-II presenta un ABC del 89.4%.
Consideraciones importantes:
• Para el diagnóstico, los resultados deberían considerarse en combinación con otros aspectos clínicos como por ejemplo los síntomas, los resultados de otras pruebas, la impresión clínica etc.
• Independientemente de los valores obtenidos, la concentración de PIVKA-II no constituye una evidencia absoluta de la presencia o ausencia de una enfermedad maligna. En los pacientes con evidencia o sospecha de cáncer, también deben considerarse otras pruebas y procedimientos que permitan establecer un diagnóstico y tratamiento adecuados.
• Las concentraciones de PIVKA-II, determinadas para una misma muestra con pruebas de diferentes fabricantes, pueden diferir debido a diferencias en los métodos de análisis y de calibración y en la especificidad de los reactivos.
Los siguientes factores pueden influir en la concentración individual de PIVKA-II
• Los medicamentos que contienen preparaciones de vitamina K pueden producir valores de PIVKA-II más bajos.
• Los antagonistas de la vitamina K y aquellas afecciones médicas que causan deficiencia de vitamina K (por ejemplo, obstrucción biliar o colestasis) pueden dar lugar a valores de PIVKA-II más altos. Las muestras de pacientes tratados con antagonistas de la vitamina K (warfarina, etc.) no deben analizarse con el ensayo ELECSYS PIVKA-II.
• En pacientes con una disfunción renal se han observado concentraciones elevadas de PIVKA-II.27 En el caso de altos valores de PIVKA-II que no coincidan con el diagnóstico ni con las características clínicas del paciente debería considerarse la evaluación de las concentraciones séricas de creatinina.
MEDIDAS DE PRECAUCIÓN Y ADVERTENCIAS:
Para el uso diagnóstico in vitro por los profesionales de la salud. Observe las medidas de precaución usuales para la manipulación de reactivos de laboratorio.
Residuos infecciosos o microbiológicos:
Advertencia: manipule los residuos como material biológico potencialmente peligroso. Deseche los residuos de acuerdo con las instrucciones y procedimientos de laboratorio aceptados.
Peligros ambientales:
Aplique todas las normas locales de eliminación pertinentes para asegurar una eliminación segura. Existe una ficha de datos de seguridad a disposición del usuario profesional que la solicite.
El presente estuche contiene componentes que han sido clasificados por la directiva CE No. 1272/2008 de la siguiente manera:
![]()
Advertencia:
|
H317 |
Puede provocar una reacción alérgica en la piel. |
|
Prevención: |
|
|
P261 |
Evitar respirar la niebla o el vapor. |
|
P272 |
Las prendas de trabajo contaminadas no podrán sacarse del lugar de trabajo. |
|
P280 |
Llevar guantes de protección. |
|
Respuesta: |
|
|
P333 + P313 |
En caso de irritación o erupción cutánea: consultar a un médico. |
|
P362 + P364 |
Quitar las prendas contaminadas y lavarlas antes de volver a usarlas. |
|
Eliminación: |
|
|
P501 |
Eliminar el contenido/el recipiente en una planta de eliminación de residuos aprobada. |
Las indicaciones de seguridad del producto corresponden a los criterios del sistema globalmente armonizado de clasificación y etiquetado de productos químicos (GHS por sus siglas en inglés) válidas en la UE.
Contacto telefónico internacional: +49-621-7590
Evite la formación de espuma en reactivos y muestras de todo tipo (especímenes, calibradores y controles).
CONSERVACIÓN Y ESTABILIDAD:
Conservar a 2-8°C.
No congelar.
Conservar el cobas e pack en posición vertical para garantizar la disponibilidad total de las micropartículas durante la mezcla automática antes del uso.
|
Estabilidad: |
|
|
Sin abrir, a 2-8°C |
Hasta la fecha de caducidad indicada |
|
En los analizadores |
16 semanas |
DILUCIÓN:
Las muestras con concentraciones de PIVKA-II superiores al intervalo de medición pueden diluirse con Diluent Universal. Se recomienda una dilución a 1:10 (automáticamente por los analizadores o bien de forma manual). La concentración de la muestra diluida debe superar los 1200 ng/mL.
Multiplicar los resultados obtenidos tras dilución manual por el factor de dilución.
El software de los analizadores tiene en cuenta la dilución automática al calcular la concentración de las muestras.
MATERIAL REQUERIDO ADICIONALMENTE (NO SUMINISTRADO):
• ![]() 08333637190, CalSet PIVKA-II para 4 x 1.0 mL
08333637190, CalSet PIVKA-II para 4 x 1.0 mL
• ![]() 08333645190, PreciControl HCC, para 4 x 1.0 mL o bien
08333645190, PreciControl HCC, para 4 x 1.0 mL o bien
• ![]() 08754551190, PreciControl HCC V2, para 4 x 1.0 mL
08754551190, PreciControl HCC V2, para 4 x 1.0 mL
• ![]() 07299001190, Diluent Universal, 36 mL de diluyente para muestras
07299001190, Diluent Universal, 36 mL de diluyente para muestras
• Equipo usual de laboratorio
• Analizador cobas e
Materiales adicionales para los analizadores cobas e 402 y cobas e 801:
• ![]() 06908799190, ProCell II M, 2 x 2 L de solución del sistema
06908799190, ProCell II M, 2 x 2 L de solución del sistema
• ![]() 04880293190, CleanCell M, 2 x 2 L de solución de limpieza para la célula de medida
04880293190, CleanCell M, 2 x 2 L de solución de limpieza para la célula de medida
• ![]() 07485409001, Reservoir Cup, 8 recipientes para ProCell II M y CleanCell M
07485409001, Reservoir Cup, 8 recipientes para ProCell II M y CleanCell M
• ![]() 06908853190, PreClean II M, 2 x 2 L de solución de lavado
06908853190, PreClean II M, 2 x 2 L de solución de lavado
• ![]() 05694302001, Bandeja de Assay Tip/Assay Cup, 6 x 6 bandejas, cada una con 105 cubetas y 105 puntas de pipeta (3780 determinaciones), 3 cartones de residuos sólidos
05694302001, Bandeja de Assay Tip/Assay Cup, 6 x 6 bandejas, cada una con 105 cubetas y 105 puntas de pipeta (3780 determinaciones), 3 cartones de residuos sólidos
• ![]() 07485425001, Liquid Flow Cleaning Cup, 2 recipientes para la solución de limpieza ISE Cleaning Solution/Elecsys SysClean para la unidad de detección Liquid Flow Cleaning Detection Unit
07485425001, Liquid Flow Cleaning Cup, 2 recipientes para la solución de limpieza ISE Cleaning Solution/Elecsys SysClean para la unidad de detección Liquid Flow Cleaning Detection Unit
• ![]() 07485433001, PreWash Liquid Flow Cleaning Cup, 1 recipiente para la solución de limpieza ISE Cleaning Solution/Elecsys SysClean para la unidad de prelavado Liquid Flow Cleaning PreWash Unit
07485433001, PreWash Liquid Flow Cleaning Cup, 1 recipiente para la solución de limpieza ISE Cleaning Solution/Elecsys SysClean para la unidad de prelavado Liquid Flow Cleaning PreWash Unit
• ![]() 11298500316, ISE Cleaning Solution/Elecsys SysClean, 5 x 100 mL de solución de limpieza para el sistema
11298500316, ISE Cleaning Solution/Elecsys SysClean, 5 x 100 mL de solución de limpieza para el sistema
MATERIAL SUMINISTRADO:
Consultar la sección "Reactivos - Soluciones de trabajo" en cuanto a los reactivos suministrados.
CALIBRACIÓN:
Trazabilidad: El presente método ha sido estandarizado frente a des-ℽ-carboxiprotrombina recombinante purificada.
La curva máster predefinida es adaptada al analizador a través del CalSet correspondiente.
Intervalo de calibraciones: Efectuar la calibración una vez por lote de reactivos con reactivos frescos de un cobas e pack registrado como máximo 24 horas antes en el analizador.
El intervalo de calibración puede ampliarse si el laboratorio asegura una verificación aceptable de la calibración.
Se recomienda repetir la calibración:
• Después de 12 semanas si se trata del mismo lote de reactivos.
• Después de 28 días (si se emplea el mismo cobas e pack en el analizador).
• En caso necesario: por ejemplo, si los valores del control de calidad están fuera del intervalo definido.
CONTROL DE CALIDAD:
Para el control de calidad, emplear PreciControl HCC o PreciControl HCC V2.
Adicionalmente pueden emplearse otros controles apropiados.
Los controles de los diferentes intervalos de concentración deberían efectuarse junto con el test en determinaciones simples por lo menos 1 vez cada 24 horas, con cada cobas e pack y después de cada calibración.
Adaptar los intervalos y límites de control a los requisitos individuales del laboratorio. Los resultados obtenidos deben hallarse dentro de los límites definidos. Cada laboratorio debería establecer medidas correctivas a seguir en caso de obtener valores fuera del intervalo definido.
Si fuera necesario, repetir la medición de las muestras en cuestión.
Cumplir con las regulaciones gubernamentales y las normas locales de control de calidad pertinentes.
LINEALIDAD:
El test ELECSYS PIVKA-II es lineal dentro del intervalo de medición de 3.5 a 12000 ng/mL. Las muestras se prepararon según el protocolo EP6-A del CLSI, diluyendo en diferentes pasos 3 muestras de suero y 3 de plasma con Diluent Universal empezando con > 12000 ng/mL y bajando la concentración hasta el límite de detección.
CÁLCULO:
El analizador calcula automáticamente la concentración de analito de cada muestra en ng/mL.
INFORMACIÓN DEL SISTEMA:
Nombre abreviado: PIVKA
ACN (código de aplicación): 10157
Advertencia: El valor medido de PIVKA-II de una muestra de paciente puede variar según el método de ensayo aplicado. Por lo tanto, el laboratorio siempre debe indicar el método de determinación de PIVKA-II empleado. Los valores de PIVKA-II de un paciente, obtenidos mediante diferentes procedimientos de test, no pueden compararse entre sí pudiendo dar lugar a interpretaciones erróneas por parte del médico.
LÍMITES E INTERVALOS:
3.5-12000 ng/mL (definido por el límite de detección y el máximo de la curva máster). Los valores inferiores al límite de detección se indican como < 3.5 ng/mL. Los valores superiores al intervalo de medición se indican como > 12000 ng/mL.
Límites inferiores de medición:
Límite de Blanco, Límite de Detección y Límite de Cuantificación:
• Límite de Blanco = ≤ 3.0 ng/mL
• Límite de Detección = ≤ 3.5 ng/mL
• Límite de Cuantificación = ≤ 4.5 ng/mL
El Límite de Blanco, el Límite de Detección y el Límite de Cuantificación fueron determinados cumpliendo con los requerimientos EP17-A2 del Instituto de Estándares Clínicos y de Laboratorio (CLSI-Clinical and Laboratory Standards Institute).
El Límite de Blanco es el valor del percentil 95 obtenido a partir de n ≥ 60 mediciones de muestras libres de analito en varias series independientes. El Límite de Blanco corresponde a la concentración por debajo de la cual se encuentran, con una probabilidad del 95%, las muestras sin analito.
El Límite de Detección se determina basándose en el Límite de Blanco y en la desviación estándar de muestras de baja concentración. El Límite de Detección corresponde a la menor concentración de analito detectable (valor superior al Límite de Blanco con una probabilidad del 95%).
El Límite de Cuantificación se define como la menor concentración de analito en una muestra que puede cuantificarse exactamente con un coeficiente de variación para la precisión intermedia de ≤ 20%.
PRECISIÓN:
La precisión ha sido determinada mediante reactivos Elecsys, muestras y controles según un protocolo (EP05-A3) del CLSI (Clinical and Laboratory Standards Institute): 2 ciclos diarios por duplicado, cada uno durante 21 días (n = 84). Se obtuvieron los siguientes resultados:
|
Analizadores cobas e 402 y cobas e 801 |
|||||
|
Repetibilidad |
Precisión intermedia |
||||
|
Muestra |
Media ng/mL |
DE ng/mL |
CV % |
DE ng/mL |
CV % |
|
Suero humano 1 |
7.42 |
0.112 |
1.50 |
0.511 |
6.90 |
|
Suero humano 2 |
18.5 |
0.215 |
1.20 |
1.19 |
6.40 |
|
Suero humano 3 |
25.9 |
0.314 |
1.20 |
1.57 |
6.10 |
|
Suero humano 4 |
6206 |
87.2 |
1.40 |
316 |
5.10 |
|
Suero humano 5 |
10563 |
110 |
1.00 |
452 |
4.30 |
|
Suero humano 6 |
9880 |
126 |
1.30 |
412 |
4.20 |
|
PreciControl HCC 1 |
22.5 |
0.396 |
1.80 |
1.33 |
5.90 |
|
PreciControl HCC 2 |
335 |
3.77 |
1.10 |
18.0 |
5.40 |
|
PreciControl 1 HCC V2 |
22.1 |
0.269 |
1.2 |
0.584 |
2.6 |
|
PreciControl 2 HCC V2 |
334 |
6.55 |
2.0 |
10.2 |
3.1 |
CARACTERÍSTICAS:
El carcinoma hepatocelular (CHC) es el 6° cáncer más común en todo el mundo y representa más del 90% de los casos de cáncer primario de hígado.1,2 Es la 2a causa de muerte más habitual entre pacientes con cáncer en hombres y la 6a entre mujeres. Los principales factores de riesgo para desarrollar CHC son la infección crónica por el virus de la hepatitis B (VHB) o de la hepatitis C (VHC), tal como lo indica la fuerte correlación entre la prevalencia de CHC y hepatitis B y C crónicas.3 El diagnóstico del CHC depende de hallazgos típicos de imágenes de cortes transversales como p. ej. la hipervascularidad arterial, así como del lavado de agentes de contraste en tiempo portal y tardío. Si no existe un corte transversal típico, se recomienda efectuar una biopsia hepática.4
Dado que la mayoría de los CHC se desarrollan en hígados cirróticos,5 se recomienda la vigilancia ecográfica de pacientes con enfermedad hepática crónica avanzada.6,7,8,9 Sin embargo, la calidad del ultrasonido depende del operador y es menor en pacientes obesos y con sobrepeso, además de no ser óptima para la detección temprana del CHC.10,11 En estos casos se recomienda realizar pruebas adicionales.12 La α1-fetoproteína (AFP) es el marcador más utilizado para los tumores hepáticos primarios en todo el mundo. La AFP está elevada durante la hepatocarcinogénesis, pero también puede encontrarse en otros tumores como el cáncer testicular, embrionario13 o gástrico.14 Los pacientes con CHC presentan sensibilidades del 39% al 65% y especificidades del 76% al 94% para la AFP.15 La divergencia en la sensibilidad y especificidad de la AFP en los estudios realizados se debe probablemente a una variedad de factores que incluyen etiologías, diseños de estudio y valores de corte diferentes. Tanto la proteína inducida por ausencia o antagonismo II de la vitamina K (PIVKA-II; también llamada des-α-carboxiprotrombina [DCP]) como la AFP-L3% (aglutinina de Lens culinaris-fracción reactiva de α-fetoproteína [AFP-L3] expresada como porcentaje de AFP) han sido identificadas como biomarcadores prometedores, los cuales pueden tener utilidad en el seguimiento, el diagnóstico y el manejo del CHC.16,17
La PIVKA-II es una variante anómala de la protrombina secretada al torrente sanguíneo cuando la actividad de la carboxilasa dependiente de la vitamina K del hígado es inhibida a causa de la ausencia de vitamina K o la presencia de antagonistas de la vitamina K.16,18 En diferentes estudios, en su mayoría con cohortes asiáticas, la PIVKA-II en suero tiene una sensibilidad del 48-62%, una especificidad del 81-98% y una precisión del 59-84% en el diagnóstico del CHC.19,20,21,22 Según datos recientes, el test PIVKA-II presenta una mejor eficacia de diagnóstico que la AFP para la diferenciación del CHC respecto a otras enfermedades distintas del CHC.
Adicionalmente, la combinación de ambos marcadores podría mejorar significativamente el diagnóstico.23 En otro estudio en el que se compararon PIVKA-II, AFP y AFP-L3%, PIVKA-II fue significativamente superior a los otros parámetros diferenciando el cáncer primario de hígado de la cirrosis (sensibilidad del 86% y especificidad del 93%).24 PIVKA-II es un predictor independiente de la presencia de CHC y un mejor biomarcador diagnóstico que la AFP para diferenciar entre lesiones neoplásicas y no neoplásicas en pacientes cirróticos con evidencia inicial por ultrasonido de nódulos hepáticos sospechosos.25
USO PREVISTO:
Inmunoensayo para la determinación cuantitativa de la proteína inducida por la ausencia de vitamina K o el antagonismo del factor II (PIVKA-II, por sus siglas en inglés) en suero y plasma humanos. Este ensayo se utiliza como ayuda en el diagnóstico del carcinoma hepatocelular (CHC). Los resultados obtenidos deben interpretarse teniendo en cuenta los resultados de otros métodos de acuerdo con los estándares vigentes para el manejo clínico.
Este inmunoensayo de electroquimioluminiscencia (electrochemiluminescence immunoassay) "ECLIA" está previsto para el uso en inmunoanalizadores cobas e.
LIMITACIONES DEL ANÁLISIS - INTERFERENCIAS:
Se analizaron los efectos de las siguientes sustancias endógenas y los siguientes compuestos farmacéuticos sobre el funcionamiento del test sin que se hayan observado interferencias.
Sustancias endógenas:
|
Compuesto |
Concentración analizada |
|---|---|
|
Bilirrubina |
≤ 66 mg/dL o ≤ 1129 μmol/L |
|
Hemoglobina |
≤ 1000 mg/dL o ≤ 0.621 mmol/L |
|
Intralipid |
≤ 2000 mg/dL |
|
Biotina |
≤ 1200 ng/mL |
|
Factores reumatoides |
≤ 1200 UI/mL |
|
IgG |
≤ 7.0 g/dL |
|
IgA |
≤ 1.6 g/dL |
|
IgM |
≤ 1.0 g/dL |
|
Albúmina |
≤ 7.0 g/dL |
Criterio: recuperación ± 3.0 ng/mL del valor inicial ≤ 30 ng/mL y dentro de ± 10% del valor inicial > 30 ng/mL.
No se ha registrado el efecto prozona (high-dose hook) a concentraciones de PIVKA-II de hasta 145000 ng/mL.
Se analizaron in vitro 17 fármacos de uso común sin encontrar interferencias con el presente ensayo.
Fármacos de uso común:
|
Fármaco |
Concentración analizada |
|
Acetilcisteína |
553 μg/mL |
|
Ampicilina sódica |
1000 μg/mL |
|
Ácido ascórbico |
300 μg/mL |
|
Ciclosporina |
5.00 μg/mL |
|
Cefoxitina |
2500 μg/mL |
|
Heparina |
5000 UI/L |
|
Levodopa |
20.0 μg/mL |
|
Metildopa + 1.5 |
20.0 μg/mL |
|
Metronidazol |
200 μg/mL |
|
Fenilbutazona |
400 μg/mL |
|
Doxiciclina |
50.0 μg/mL |
|
Acetilsalicílico, ácido |
1000 μg/mL |
|
Rifampicina |
60.0 μg/mL |
|
Paracetamol |
200 μg/mL |
|
Ibuprofeno |
500 μg/mL |
|
Teofilina |
100 μg/mL |
|
Itraconazol |
50.0 μg/mL |
Se analizaron adicionalmente los siguientes fármacos especiales sin encontrar interferencias con el presente ensayo.
Fármacos especiales:
|
Fármaco |
Concentración analizada |
|
5-FU (fluorouracilo) |
900 μg/mL |
|
Doxorrubicina |
165 μg/mL |
|
Cisplatino |
180 μg/mL |
|
Mitomicina |
25.0 μg/mL |
|
Epoetina |
25 mU/L |
|
Metoclopramida |
7.50 μg/mL |
|
Neupogen |
0.9 μg/mL |
|
Dexametasona |
20.0 μg/mL |
|
Sorafenib |
800 μg/mL |
|
SN-38 |
525 μg/mL |
|
Interferón alfa pegilado |
0.026 μg/mL |
|
Vitamina K |
0.09 μg/mL |
|
Ribavirina |
1200 μg/mL |
|
Trifosfato análogo de la uridina de sofosbuvir |
80.0 μg/mL |
|
Entecavir |
1.00 μg/mL |
|
Tenofovir |
245 μg/mL |
|
Ledipasvir |
18.0 μg/mL |
|
Daclatasvir |
60.0 μg/mL |
Las interferencias por fármacos se midieron según las recomendaciones dadas en las guías EP07 y EP37 del CLSI y en otras publicaciones. No se han caracterizado los efectos de concentraciones que exceden las recomendadas.
En casos aislados pueden presentarse interferencias por títulos extremadamente altos de anticuerpos dirigidos contra anticuerpos específicos del analito, la estreptavidina o el rutenio. Estos efectos se han minimizado gracias a un adecuado diseño del test.
Para el diagnóstico, los resultados del test siempre deben interpretarse teniendo en cuenta la anamnesis del paciente, la exploración clínica así como los resultados de otros exámenes.
SÍMBOLOS:
Roche Diagnostics utiliza los siguientes símbolos y signos adicionalmente a los indicados en la norma ISO 15223-1 (para los EE.UU.: consulte dialog.roche.com para la definición de los símbolos usados):
|
CONTENT |
Contenido del kit |
|
SYSTEM |
Analizadores/instrumentos adecuados para los reactivos |
|
REAGENT |
Reactivo |
|
CALIBRATOR |
Calibrador |
|
|
Volumen para reconstitución |
|
GTN |
Número Global de Artículo Comercial |
La barra del margen indica suplementos, eliminaciones o cambios.
© 2022 Roche Diagnostics
ROCHE DIAGNOSTICS GMBH
Sandhofer Strasse 116
D-68305 Mannheim
+800 5505 6606
OBTENCIÓN Y PREPARACIÓN DE LAS MUESTRAS:
Solo se ha analizado y considerado apto el tipo de muestras aquí indicado.
Suero recogido en tubos estándar de muestra o en tubos que contienen gel de separación.
Plasma tratado con heparina de litio o con EDTA di o tripotásico.
Pueden emplearse tubos para plasma con heparina de litio que contengan gel de separación.
Criterio: pendiente 0.9-1.1, coeficiente de correlación ≥ 0.95.
Estable durante 5 días a 20-25°C, 14 días a 2-8°C, 12 semanas a -20°C (± 5°C). Las muestras pueden congelarse hasta 3 veces.
(Criterio de aceptación para suero y plasma: ≤ 30 ng/mL ± 4.5 ng/mL; > 30 ng/mL ± 15%.)
Los tipos de muestra aquí indicados fueron analizados con tubos de recogida de muestras seleccionados, comercializados en el momento de efectuar el análisis, lo cual significa que no fueron analizados todos los tubos de todos los fabricantes. Los sistemas de recogida de muestras de diversos fabricantes pueden contener diferentes materiales que, en ciertos casos, pueden llegar a afectar los resultados de los análisis. Si las muestras se procesan en tubos primarios (sistemas de recogida de muestras), seguir las instrucciones del fabricante de tubos.
Centrifugar las muestras que contienen precipitado antes de realizar el ensayo.
No emplear muestras inactivadas por calor.
No utilizar muestras ni controles estabilizados con azida.
Se debe garantizar una temperatura de 20-25°C para la medición de muestras y calibradores.
Para evitar posibles efectos de evaporación, determinar las muestras y los calibradores que se sitúan en los analizadores dentro de un lapso de 2 horas.
PREPARACIÓN DE LOS REACTIVOS:
Los reactivos incluidos en el kit están listos para el uso y forman una unidad inseparable.
La información necesaria para el correcto funcionamiento está disponible a través de cobas link.
COMPARACIÓN DE MÉTODOS:
a) Una comparación entre el ensayo ELECSYS PIVKA-II, ![]() 08333629190 (analizador cobas e 402; y) y el ensayo ELECSYS PIVKA-II,
08333629190 (analizador cobas e 402; y) y el ensayo ELECSYS PIVKA-II, ![]() 08333629190 (analizador cobas e 801; x) generó las siguientes correlaciones (ng/mL):
08333629190 (analizador cobas e 801; x) generó las siguientes correlaciones (ng/mL):
Número de muestras de suero medidas: 134
|
Passing/Bablok28 |
Regresión lineal |
|
y = 1.03x + 0.131 |
y = 1.03x + 3.29 |
|
τ = 0.985 |
r = 1.00 |
Las concentraciones de las muestras se situaron entre 3.88 y 11530 ng/mL.
b) Una comparación entre el ensayo ELECSYS PIVKA-II, ![]() 09015043190 (analizador cobas e 801; y) y el ensayo ELECSYS PIVKA-II,
09015043190 (analizador cobas e 801; y) y el ensayo ELECSYS PIVKA-II, ![]() 08333629190 (analizador cobas e 801; x) generó las siguientes correlaciones (ng/mL):
08333629190 (analizador cobas e 801; x) generó las siguientes correlaciones (ng/mL):
Número de muestras de suero medidas: 136
|
Passing/Bablok28 |
Regresión lineal |
|
y = 1.01x + 0.953 |
y = 0.993x + 2.44 |
|
τ = 0.994 r |
r = 1.00 |
Las concentraciones de las muestras se situaron entre 3.80 y11945 ng/mL.
DATOS ESPECÍFICOS DEL FUNCIONAMIENTO DEL TEST:
A continuación, se indican los datos representativos del funcionamiento de los analizadores. Los resultados de cada laboratorio en particular pueden diferir de estos valores.
PRINCIPIO DEL TEST:
Técnica sándwich. Duración total del test: 18 minutos.
• 1.ª incubación: 24 μL de muestra se prediluyen automáticamente con Diluent Universal a 1:5. El antígeno (12 μL de muestra prediluida), un anticuerpo biotinilado monoclonal anti-PIVKA-II y un anticuerpo monoclonal anti-PIVKA-II marcado con quelato de rutenioa) forman un complejo sándwich.
• 2.ª incubación: Después de incorporar las micropartículas recubiertas de estreptavidina, el complejo formado se fija a la fase sólida por interacción entre la biotina y la estreptavidina.
• La mezcla de reacción es trasladada a la célula de medida donde, por magnetismo, las micropartículas se fijan a la superficie del electrodo. Los elementos no fijados se eliminan posteriormente con ProCell II M. Al aplicar una corriente eléctrica controlada se produce una reacción quimioluminiscente cuya emisión de luz se mide con un fotomultiplicador.
• Los resultados se determinan mediante una curva de calibración generada específicamente para el instrumento a partir de una calibración a 2 puntos y una curva máster suministrada a través de cobas link.
a) Quelato Tris (2,2’-bipiridina) rutenio (II) (Ru(bpy)![]() )
)
REACTIVOS - SOLUCIONES DE TRABAJO:
El cobas e pack está etiquetado como PIVKA.
M Micropartículas recubiertas de estreptavidina, 1 frasco, 12.4 mL: Micropartículas recubiertas de estreptavidina: 0.72 mg/mL; conservante.
R1 Anticuerpo anti-PIVKA-II~biotina, 1 frasco, 19.7 mL: Anticuerpo monoclonal anti-PIVKA-II (conejo) marcado con biotina 1.2 mg/L; tampón fosfato 40 mmol/L, pH 6.5; conservante.
R2 Anticuerpo anti-PIVKA-II~Ru(bpy)![]() , 1 frasco, 19.7 mL Anticuerpo monoclonal anti-PIVKA-II (conejo) marcado con quelato de rutenio 2.0 mg/L; tampón fosfato 40 mmol/L, pH 6.5; conservante.
, 1 frasco, 19.7 mL Anticuerpo monoclonal anti-PIVKA-II (conejo) marcado con quelato de rutenio 2.0 mg/L; tampón fosfato 40 mmol/L, pH 6.5; conservante.
REALIZACIÓN DEL TEST:
Para garantizar el funcionamiento óptimo del test, observe las instrucciones de la presente metódica referentes al analizador empleado. Consulte el manual del operador apropiado para obtener las instrucciones de ensayo específicas del analizador.
Las micropartículas se mezclan automáticamente antes del uso.
Colocar el cobas e pack refrigerado (a 2-8°C) en el gestor de reactivos (reagent manager). Evitar la formación de espuma. El analizador realiza automáticamente los procesos de atemperar, abrir y tapar el cobas e pack.
REFERENCIAS BIBLIOGRÁFICAS:
1. Ferlay J, Soerjomataram I, Ervik M, et al. GLOBOCAN 2020, Cancer Incidence and Mortality Worldwide: IARC Lyon, France: International Agency for Research on Cancer; 2020. Available from: https://gco.iarc.fr/today/fact-sheets-cancers.
2. Akinyemiju T, Abera S, Ahmed M, et al. The burden of primary liver cancer and underlying etiologies from 1990 to 2015 at the global, regional, and national level: Results From the Global Burden of Disease Study 2015. JAMA Oncol 2017;3:1683-1691.
3. El-Seraq HB. Epidemiology of Viral Hepatitis and Hepatocellular Carcinoma. Gastroenterology 2012;142(6):1264-1273.
4. Gonzalez SA and Keeffe EB. Diagnosis of Hepatocellular Carcinoma: Role of Tumor Markers and Liver Biopsy. Clin Liver Dis 2011;15:297-306.
4. Llovet JM, Zucman-Rossi J, Pikarsky E, et al. Hepatocellular carcinoma. Nature Reviews Disease Primers. 2016;14:2:16018.
6. Heimbach JK, Kulik LM, Finn RS, et al. AASLD Guidelines for the Treatment of Hepatocellular Carcinoma. Hepatology 2018;67(1): 358-80.
7. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol 2018;69(1):182-236.
8. Kokudo N, Hasegawa K, Akahane M, et al. Evidence-based Clinical Practice Guidelines for Hepatocellular Carcinoma: The Japan Society of Hepatology 2013 update (3rd JSH-HCC Guidelines). Hepatology Research 2015;45:123-127.
9. Omata M, Cheng AL, Kokudo N, et al. Asian Pacific Association for the Study of the Liver consensus recommendations on hepatocellular carcinoma. Hepatol Int 2017;11: 317-370.
10. Simmons O, Fetzer DT, Yokoo T, et al. Predictors of adequate ultrasound quality for hepatocellular carcinoma surveillance in patients with cirrhosis. Aliment Pharmacol Ther 2017;45:169-177.
11. Tzartzeva K, Obi J, Rich NE, et al. Surveillance Imaging and Alpha Fetoprotein for Early Detection of Hepatocellular Carcinoma in Patients With Cirrhosis: A Meta-analysis. Gastroenterology 2018; 154(6):1706-1718.e1.
12. Lok AS, Sterling RK, Everhart JE, et al. Des-gamma-Carboxy Prothrombin and alpha-Fetoprotein as Biomarkers for the Early Detection of Hepatocellular Carcinoma. Gastroenterology 2010;138:493-502.
13. Gupta S, Bent S, Kohlwes J. Test characteristics of alpha-fetoprotein for detecting hepatocellular carcinoma in patients with hepatitis C. A systematic review and critical analysis. Ann. Intern. Med. 2003;139(1):46-50.
14. Chen J, Röcken C, Treiber G, et al. Clinical implications of alpha- fetoprotein expression in gastric adenocarcinoma. Dig Dis 2003;21(4):357-362.
15. Daniele B, Bencivenga A, Megna AS, et al. Alpha-fetoprotein and ultrasonography screening for hepatocellular carcinoma. Gastroenterology 2004;127:108-112.
16 Liebmann HA, Furie BC, Tong MJ, et al. Des-gamma-carboxy (abnormal) prothrombin as a serum marker of primary hepatocellular carcinoma. N Eng J Med 1984;310:1427-1431.
17 Choi JY, Jung SW, Kim HY, et al. Diagnostic value of AFP-L3 and PIVKA-II in hepatocellular carcinoma according to total-AFP. World J. Gastroenterol 2013;19(3):339-346.
18 Bertino G, Ardiri AM, Boemi PM, et al. A study about mechanisms of des-gamma-carboxy prothrombin’s production in hepatocellular carcinoma. Panminerva Med 2008;50(3):221-226.
19 Bertino G, Ardiri AM, Calvagno GS, et al. Prognostic and diagnostic value of des-ℽ-carboxy prothrombin in liver cancer. Drug News Perspect 2010;23(8):498-508.
20 Marrero JA, Su GL, Wei W, et al. Des-gamma carboxyprothrombin can differentiate hepatocellular carcinoma from nonmalignant chronic liver disease in American patients. Hepatology 2003;3785):1114-1121.
21 Bertino G, Neri S, Bruno CM, et al. Diagnostic and prognostic value of alpha-fetoprotein, des-ℽ-carboxy prothrombin and squamous cell carcinoma antigen immunoglobulin M complexes in hepatocellular carcinoma. Minerva Med 2011;102(5):363-371.
22 Kim MJ, Hyuck C, Kwon D, et al. Protein induced by vitamin K antagonist-II (PIVKA-II) is a reliable prognostic factor in small hepatocellular carcinoma. World J Surg 2013;37(6):1371-1378.
23.Yu R, Tan Z, Xiang X, et al. Effectiveness of PIVKA-II in the detection of hepatocellular carcinoma based on real-world clinical data. BMC Cancer 2017;17:608.
24.Volk ML, Hernandez JC, Su GL, et al. Risk factors for hepatocellular carcinoma may impair the performance of biomarkers, a comparison of AFP, DCP, and AFP-L3. Cancer Biomarkers 2007;3(2):79-87.
25.Saitta C, Raffa G, Alibrandi A, et al. PIVKA-II is a useful tool for diagnostic characterization of ultrasound-detected livernodules in cirrhotic patients. Medicine, 2017;96:26(e7266).
26.Llovet JM, Brú C, Bruix J. Prognosis of hepatocellular carcinoma: the BCLC staging classification. Semin Liver Dis 1999;19(3):329-338.
27. McCabe KM, Adams MA, Holden RM. Vitamin K Status in Chronic Kidney Disease. Nutrients 2013;5(11):4390-4398.
28.Bablok W, Passing H, Bender R, et al. A general regression procedure for method transformation. Application of linear regression procedures for method comparison studies in clinical chemistry, Part III. J Clin Chem Clin Biochem 1988 Nov;26(11):783-790.
Para más información acerca de los componentes, consultar el manual del operador del analizador, las hojas de aplicación y las metódicas correspondientes (disponibles en su país).
En la presente metódica se emplea como separador decimal un punto para distinguir la parte entera de la parte fraccionaria de un número decimal. No se utilizan separadores de millares.
Todo incidente grave que se haya producido en relación con el producto se comunicará al fabricante y a la autoridad competente del estado miembro en el que se encuentre el usuario y/o el paciente.
Para el resumen del informe de seguridad y funcionamiento, consulte: https://ec.europa.eu/tools/eudamed