
ELECSYS CA 15-3 II
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
VALORES TEÓRICOS:
Personas sanas: Resultados de un estudio del intervalo de referencia con un panel de muestras de 374 donantes aparentemente sanas no embarazadas (estudio Roche N° RD000788).
|
Percentil (%) |
U/mL |
Intervalo de confianza (U/mL) |
|
95 |
26.2 |
25.2-27.9 |
|
97.5 |
28.5 |
26.7-34.5 |
|
99 |
34.5 |
28.7-57.8 |
Pacientes con enfermedades benignas y embarazadas: Distribución relativa de las concentraciones de CA 15-3 en pacientes con enfermedades benignas y en embarazadas (estudio de Roche N° B00P018).
|
Personas en total |
< 25 U/mL |
25-50 U/mL |
50-200 U/mL |
200 U/mL |
|
|
N |
Clasificación porcentual (%) |
||||
|
Enfermedad gastrointestinal |
109 |
84 |
16 |
0 |
0 |
|
Cáncer de mama |
58 |
88 |
12 |
0 |
0 |
|
Ginecopatías |
42 |
83 |
12 |
5 |
0 |
|
Insuficiencia renal |
37 |
81 |
19 |
0 |
0 |
|
Uropatías |
34 |
82 |
18 |
0 |
0 |
|
Infecciones bacterianas |
27 |
96 |
4 |
0 |
0 |
|
Embarazo |
34 |
97 |
0 |
3 |
0 |
Pacientes con enfermedades malignas (excepto el cáncer de mama): Distribución relativa de las concentraciones de Ca 15-3 en las personas con enfermedades malignas que no sean cánceres de mama.
|
Personas en total |
< 25 U/mL |
25-50 U/mL |
50-200 U/mL |
200 U/mL |
|
|
N |
Clasificación porcentual (%) |
||||
|
Cac) estomacal |
36 |
75 |
14 |
8 |
3 |
|
Ca hepatocelular |
37 |
59 |
32 |
3 |
5 |
|
Ca pulmonar |
38 |
82 |
13 |
5 |
0 |
|
Ca ovárico |
34 |
47 |
21 |
29 |
3 |
|
Ca ginecológico |
5 |
40 |
20 |
40 |
0 |
|
Ca prostático |
48 |
79 |
17 |
4 |
0 |
|
Ca colorrectal |
40 |
93 |
8 |
0 |
0 |
|
Ca pancreático |
40 |
65 |
33 |
3 |
0 |
c) Ca = Carcinoma
Pacientes con carcinoma de mama: Distribución relativa de las concentraciones de CA 15-3 en las pacientes con cáncer de mama. La clasificación de la paciente según los criterios de la Unión Internacional Contra el Cáncer (UICC) se efectuó en un diagnóstico primario antes de cualquier tratamiento. Las pacientes diagnosticadas con recidivas desarrollaron metástasis (M1).
|
Personas en total |
< 25 U/mL |
25-50 U/mL |
50-200 U/mL |
200 U/mL |
|
|
N |
Clasificación porcentual (%) |
||||
|
UICC I |
56 |
88 |
12 |
0 |
0 |
|
UICC II |
126 |
85 |
13 |
2 |
0 |
|
UICC III |
77 |
53 |
30 |
14 |
3 |
|
UICC IV |
24 |
25 |
17 |
37 |
21 |
|
Recidiva |
75 |
15 |
25 |
36 |
24 |
Cada laboratorio debería comprobar si los intervalos de referencia pueden aplicarse a su grupo de pacientes y, en caso necesario, establecer sus propios valores.
FUNCIONAMIENTO CLÍNICO EN EL SEGUIMIENTO:
Las pacientes diagnosticadas con cáncer de mama fueron examinadas en un estudio retrospectivo (al menos 4 muestras/paciente durante el estudio de seguimiento) y clasificadas como recurrentes (sí/no) después de que no había evidencia de cáncer de mama o de respuesta al tratamiento (sí/no) después de la metástasis del cáncer de mama, basándose en la información clínica (diagnóstico médico por imágenes y otros exámenes clínicos). Las concentraciones de CA 15-3 se midieron en paralelo. El análisis ROC (receiver operating characteristics) del cambio relativo de CA15-3 para determinar la recurrencia del cáncer de mama o la respuesta al tratamiento en el cáncer de mama metastásico se realizó para mostrar la precisión clínica en varios puntos de corte y para resumir el funcionamiento clínico independiente del punto de corte en un gráfico ROC y el ABC (área bajo la curva) relacionado.
Detección precoz de recidivas: Se hizo un seguimiento de cuarenta (40) pacientes tratadas por cáncer de mama en estadios II o III durante un máximo de 1351 días (mediana de 105 días). Se evaluó un total de 172 muestras (mediana de 4 muestras por paciente) para determinar la recurrencia de la enfermedad durante el periodo de seguimiento. La recurrencia se definió como la presencia de síntomas clínicos en las mujeres sin evidencia de enfermedad al comienzo del periodo de seguimiento. Dieciocho (18) pacientes experimentaron recurrencia de la enfermedad.
Tabla 2 x 2 para la detección temprana de la recurrencia:
|
Recurrencia |
||
|
Aumento de CA 15-3 25 % |
no |
sí |
|
no |
93 |
4 |
|
sí |
21 |
14 |
Los resultados correspondientes para el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN) en el intervalo de confianza del 95% para un incremento del punto de corte de 25% de CA 15-3 derivados de esta tabla son:
• Valor predictivo positivo: 40% (24-58%)
• Valor predictivo negativo: 90% (90-99%)
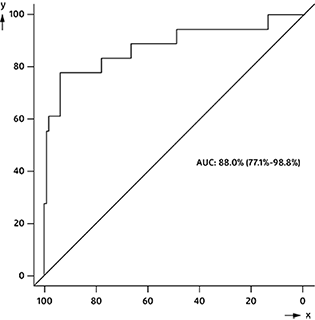
x = Especificidad (%); y = Sensibilidad (%)
Figura 1: Curva ROC: recurrencia del cáncer de mama por cambio relativo de CA 15-3 hasta el nivel basal
El área bajo la curva (ABC) fue de 0.8796 (IC del 95%: 0.7709-0.9884)
Seguimiento de la respuesta al tratamiento: Quince (15) pacientes con cáncer de mama metastásico se sometieron a tratamiento y la respuesta al tratamiento se evaluó según criterios clínicos. Se realizaron un total de 72 evaluaciones (mediana de 4 evaluaciones por paciente). Catorce (14) pacientes respondieron al tratamiento.
Tabla 2 x 2 de respuesta al tratamiento
|
Respuesta |
||
|
Reducción de CA 15-3 > 25% |
no |
sí |
|
no |
25 |
19 |
|
sí |
1 |
12 |
Los resultados correspondientes para los valores predictivos positivo y negativo en el intervalo de confianza del 95% derivados de esta tabla son:
• Valor predictivo positivo: 92% (64-100%)
• Valor predictivo negativo: 57% (41-72%)
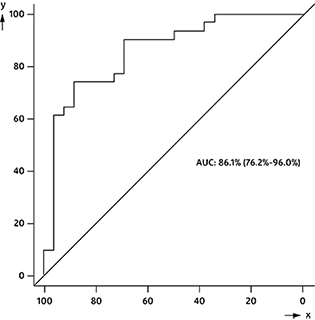
x = Especificidad (%); y = Sensibilidad (%)
Figura 2: Curva ROC: respuesta al tratamiento del cáncer de mama por cambio relativo de CA 15-3 hasta el nivel basal
El área bajo la curva (ABC) fue de 0.8610 (IC del 95%: 0.7623-0.9598).
MEDIDAS DE PRECAUCIÓN Y ADVERTENCIAS:
Para el uso diagnóstico in vitro por los profesionales de la salud. Observe las medidas de precaución usuales para la manipulación de reactivos de laboratorio.
Residuos infecciosos o microbiológicos:
Advertencia: manipule los residuos como material biológico potencialmente peligroso. Deseche los residuos de acuerdo con las instrucciones y procedimientos de laboratorio aceptados.
Peligros ambientales: Aplique todas las normas locales de eliminación pertinentes para asegurar una eliminación segura.
Existe una ficha de datos de seguridad a disposición del usuario profesional que la solicite.
El presente estuche contiene componentes que han sido clasificados por la directiva CE No. 1272/2008 de la siguiente manera:
![]()
Advertencia:
H317 Puede provocar una reacción alérgica en la piel.
Prevención:
P261 Evitar respirar el polvo/el humo/el gas/la niebla/los vapores/el aerosol.
P272 Las prendas de trabajo contaminadas no podrán sacarse del lugar de trabajo.
P280 Llevar guantes de protección.
Respuesta:
P333 + P313 En caso de irritación o erupción cutánea: consultar a un médico.
P362 + P364 Quitar las prendas contaminadas y lavarlas antes de volver a usarlas.
Eliminación:
P501 Eliminar el contenido/el recipiente en una planta de eliminación de residuos aprobada.
Las indicaciones de seguridad del producto corresponden a los criterios del sistema globalmente armonizado de clasificación y etiquetado de productos químicos (GHS por sus siglas en inglés) válidas en la UE.
Contacto telefónico internacional: +49-621-7590.
Evite la formación de espuma en reactivos y muestras de todo tipo (especímenes, calibradores y controles).
CONSERVACIÓN Y ESTABILIDAD:
Conservar a 2-8 °C.
No congelar.
Conservar el cobas e pack en posición vertical para garantizar la disponibilidad total de las micropartículas durante la mezcla automática antes del uso.
|
Estabilidad |
|
|---|---|
|
Sin abrir, a 2-8 °C |
Hasta la fecha de caducidad indicada |
|
En los analizadores |
16 semanas |
DILUCIÓN:
Usar Diluent Universal para la predilución automática de las muestras. Las muestras con concentraciones de CA 15-3 superiores al intervalo de medición pueden diluirse con Diluent Universal. Se recomienda una dilución a 1:10 (automáticamente por los analizadores o bien de forma manual). La concentración de la muestra diluida debe ser > 30 U/mL.
Multiplicar los resultados obtenidos tras dilución manual por el factor de dilución.
El software de los analizadores tiene en cuenta la dilución automática al calcular la concentración de las muestras.
MATERIAL REQUERIDO ADICIONALMENTE (NO SUMINISTRADO):
• ![]() 03045846122, CA 15-3 II CalSet, 4 x 1.0 mL
03045846122, CA 15-3 II CalSet, 4 x 1.0 mL
• ![]() 11776452122, PreciControl Tumor Marker, para 4 x 3.0 mL
11776452122, PreciControl Tumor Marker, para 4 x 3.0 mL
• ![]() 07299001190, Diluent Universal, 36 mL de diluyente para muestras
07299001190, Diluent Universal, 36 mL de diluyente para muestras
• Equipo usual de laboratorio
• Analizador cobas e
Materiales adicionales para los analizadores cobas e 402 y cobas e 801:
• ![]() 06908799190, ProCell II M, 2 x 2 L de solución del sistema
06908799190, ProCell II M, 2 x 2 L de solución del sistema
• ![]() 04880293190, CleanCell M, 2 x 2 L de solución de limpieza para la célula de medida
04880293190, CleanCell M, 2 x 2 L de solución de limpieza para la célula de medida
• ![]() 07485409001, Reservoir Cup, 8 recipientes para ProCell II M y CleanCell M
07485409001, Reservoir Cup, 8 recipientes para ProCell II M y CleanCell M
• ![]() 06908853190, PreClean II M, 2 x 2 L de solución de lavado
06908853190, PreClean II M, 2 x 2 L de solución de lavado
• ![]() 05694302001, Bandeja de Assay Tip/Assay Cup, 6 x 6 bandejas, cada una con 105 cubetas y 105 puntas de pipeta (3780 determinaciones), 3 cartones de residuos sólidos
05694302001, Bandeja de Assay Tip/Assay Cup, 6 x 6 bandejas, cada una con 105 cubetas y 105 puntas de pipeta (3780 determinaciones), 3 cartones de residuos sólidos
• ![]() 07485425001, Liquid Flow Cleaning Cup, 2 recipientes para la solución de limpieza ISE Cleaning Solution/Elecsys SysClean para la unidad de detección Liquid Flow Cleaning Detection Unit
07485425001, Liquid Flow Cleaning Cup, 2 recipientes para la solución de limpieza ISE Cleaning Solution/Elecsys SysClean para la unidad de detección Liquid Flow Cleaning Detection Unit
• ![]() 07485433001, PreWash Liquid Flow Cleaning Cup, 1 recipiente para la solución de limpieza ISE Cleaning Solution/Elecsys SysClean para la unidad de prelavado Liquid Flow Cleaning PreWash Unit
07485433001, PreWash Liquid Flow Cleaning Cup, 1 recipiente para la solución de limpieza ISE Cleaning Solution/Elecsys SysClean para la unidad de prelavado Liquid Flow Cleaning PreWash Unit
• ![]() 11298500316, ISE Cleaning Solution/Elecsys SysClean, 5 x 100 mL de solución de limpieza para el sistema
11298500316, ISE Cleaning Solution/Elecsys SysClean, 5 x 100 mL de solución de limpieza para el sistema
MATERIAL SUMINISTRADO:
Consultar la sección "Reactivos - Soluciones de trabajo" en cuanto a los reactivos suministrados.
CALIBRACIÓN:
Trazabilidad: El presente método ha sido estandarizado frente al test Elecsys CA 15-3, el cual ha sido estandarizado a su vez frente a los métodos Enzymun-Test CA 15-3 y CA 15-3 RIA de Fujirebio Diagnostics.
La curva máster predefinida es adaptada al analizador a través del CalSet correspondiente.
Intervalo de calibraciones: Efectuar la calibración una vez por lote con reactivos frescos de un cobas e pack registrado como máximo 24 horas antes en el analizador.
El intervalo de calibración puede ampliarse si el laboratorio asegura una verificación aceptable de la calibración.
Se recomienda repetir la calibración:
• Después de 12 semanas si se trata del mismo lote de reactivos.
• Después de 28 días (si se emplea el mismo cobas e pack en el analizador).
• En caso necesario: por ejemplo, si los valores del control de calidad están fuera del intervalo definido.
CONTROL DE CALIDAD:
Efectuar el control de calidad con PreciControl Tumor Marker.
Adicionalmente pueden emplearse otros controles apropiados.
Los controles de los diferentes intervalos de concentración deberían efectuarse junto con el test en determinaciones simples por lo menos 1 vez cada 24 horas, con cada cobas e pack y después de cada calibración.
Adaptar los intervalos y límites de control a los requisitos individuales del laboratorio. Los resultados obtenidos deben hallarse dentro de los límites definidos. Cada laboratorio debería establecer medidas correctivas a seguir en caso de obtener valores fuera del intervalo definido.
Si fuera necesario, repetir la medición de las muestras en cuestión.
Cumplir con las regulaciones gubernamentales y las normas locales de control de calidad pertinentes.
CÁLCULO:
El analizador calcula automáticamente la concentración de analito de cada muestra (en U/mL o kU/L).
ESPECIFICIDAD ANALÍTICA:
La prueba ELECSYS CA 15-3 II está basada en los anticuerpos monoclonales 115D8 y DF3, provistos exclusivamente por Fujirebio Diagnostics, sus concesionarios y representantes. Los datos de funcionamiento de los métodos de test que emplean estos anticuerpos no pueden aplicarse a métodos de test que utilizan otros anticuerpos.
INFORMACIÓN DEL SISTEMA:
Nombre abreviado: CA 15-3 2
ACN (código de aplicación): 10002
Nota: El valor de CA 15-3 de una muestra de paciente puede variar según el método de análisis aplicado. Por lo tanto, el laboratorio siempre debe indicar el método de determinación de CA 15-3 empleado. Los valores de CA 15-3 de un paciente, obtenidos mediante diferentes procedimientos de test, no pueden compararse entre sí y pueden dar lugar a interpretaciones erróneas por parte del médico. En caso de cambiar el método de determinación del CA 15-3 durante el control del tratamiento, los valores del mismo deben confirmarse en el periodo de transición mediante mediciones paralelas de ambos métodos.
LÍMITES E INTERVALOS:
Intervalo de medición: 1.5-300 U/mL (definido por el límite de detección y el máximo de la curva máster). Los valores inferiores al límite de detección se indican como < 1.5 U/mL. Los valores superiores al intervalo de medición se indican como > 300 U/mL (o hasta 3000 U/mL en muestras diluidas al 1:10).
Límites inferiores de medición:
Límite de blanco, límite de detección y límite de cuantificación:
• Límite de blanco = 1.0 U/mL
• Límite de detección = 1.5 U/mL
• Límite de cuantificación = 3 U/mL
El límite de blanco, el límite de detección y el límite de cuantificación fueron determinados cumpliendo con los requerimientos EP17-A2 del Instituto de estándares clínicos y de laboratorio (CLSI - Clinical and Laboratory Standards Institute).
El límite de blanco es el valor del percentil 95 obtenido a partir de n ≥ 60 mediciones de muestras libres de analito en varias series independientes. El límite de blanco corresponde a la concentración por debajo de la cual se encuentran, con una probabilidad del 95%, las muestras sin analito.
El límite de detección se determina basándose en el límite de blanco y en la desviación estándar de muestras de baja concentración. El límite de detección corresponde a la menor concentración de analito detectable (valor superior al límite de blanco con una probabilidad del 95%).
El límite de cuantificación es la menor concentración de analito cuya medición puede reproducirse con un coeficiente de variación para la precisión intermedia de ≤ 20%.
Se efectuó un estudio interno sobre la base del protocolo EP17-A2 del CLSI. El límite de blanco y el límite de detección se determinaron resultando:
• Límite de blanco = 0.576 U/mL
• Límite de detección = 1.10 U/mL
El límite de cuantificación se determinó con ≥ 4 muestras de suero humano durante 5 días en 5 réplicas por día en 1 analizador. El límite de cuantificación fue de 1.60 U/mL con un coeficiente de variación para la precisión intermedia de ≤ 20 %.
PRECISIÓN:
La precisión ha sido determinada mediante reactivos Elecsys, una mezcla de sueros humanos y controles según un protocolo (EP05-A3) del CLSI (Clinical and Laboratory Standards Institute): 2 ciclos diarios por duplicado, cada uno durante 21 días (n = 84). Se obtuvieron los siguientes resultados:
|
Analizadores cobas e 402 y cobas e 801 |
|||||
|---|---|---|---|---|---|
|
Repetibilidad |
Precisión intermedia |
||||
|
Muestra |
Media U/mL |
DE U/mL |
CV % |
DE U/mL |
CV % |
|
Suero humano 1 |
2.51 |
0.110 |
4.4 |
0.305 |
12.2 |
|
Suero humano 2 |
26.7 |
0.528 |
2.0 |
0.768 |
2.9 |
|
Suero humano 3 |
130 |
3.73 |
2.9 |
4.45 |
3.4 |
|
Suero humano 4 |
157 |
7.03 |
4.5 |
7.95 |
5.0 |
|
Suero humano 5 |
280 |
4.07 |
1.5 |
8.24 |
2.9 |
|
PCd) Tumor Marker1 |
23.2 |
0.300 |
1.3 |
0.621 |
2.7 |
|
PC Tumor Marker2 |
95.7 |
1.49 |
1.6 |
2.88 |
3.0 |
d) PC = PreciControl
CARACTERÍSTICAS:
El antígeno de cáncer CA 15-3 es un derivado de la glucoproteína MUC-1.1 El test CA 15-3 está basado en la técnica sándwich con dos anticuerpos monoclonales (AcM), 115D8 y DF3, para detectar dos sitios antigénicos asociados con células de carcinoma de mama. El AcM 115D8 está dirigido de forma directa contra las membranas de los glóbulos grasos lácteos humanos1,2,3 y el AcM DF3 está dirigido contra la fracción de membrana del cáncer de mama humano.4
En condiciones normales, el antígeno se encuentra en la secreción luminal de las células glandulares y no circula en la sangre. Pero cuando las células se vuelven cancerígenas, sus membranas basales se hacen permeables y el antígeno puede detectarse en el suero. 5 La sobreexpresión de MUC1 desempeña un papel vital en la transición epitelial-mesenquimal, fenómeno importante y complejo que determina la progresión del cáncer.6 En una evaluación realizada por Duffy y cols. se determinaron las guías pertinentes para la monitorización avanzada de enfermedades.7
Las guías de la ASCO (American Society of Clinical Oncology) y del EGTM (European Group on Tumor Markers) subrayan el bajo precio y el método mínimamente invasiva de CA 15-3 para la monitorización, sobre todo si la enfermedad no pueda diagnosticarse por técnicas de imagen convencionales.8 Las guías de la ESMO (European Society for Medical Oncology) sobre el cáncer de mama sugieren que los marcadores tumorales tales como el CA 15-3 pueden ser útiles para evaluar la respuesta al tratamiento, particularmente en las pacientes con enfermedad metastásica no medible. Un cambio en los marcadores tumorales por sí solo no debe utilizarse para iniciar un cambio en el tratamiento.7
USO PREVISTO:
Inmunoensayo in vitro para la determinación cuantitativa del antígeno CA 15-3 en suero y plasma humanos como ayuda en el manejo de pacientes con cáncer de mama. Conjuntamente con otros procedimientos clínicos y diagnósticos, las mediciones seriadas con este ensayo constituyen una herramienta útil:
• En la detección precoz de recidivas en pacientes con cáncer de mama de estadios II y III previamente tratadas.
• Para controlar la respuesta al tratamiento de pacientes con cáncer de mama metastásico.
Este inmunoensayo de electroquimioluminiscencia (electrochemiluminescence immunoassay) "ECLIA" está previsto para el uso en inmunoanalizadores cobas e.
LIMITACIONES DEL ANÁLISIS - INTERFERENCIAS:
Se analizaron los efectos de las siguientes sustancias endógenas y los siguientes compuestos farmacéuticos sobre el funcionamiento del test sin que se hayan observado interferencias.
Sustancias endógenas:
|
Compuesto |
Concentración analizada |
|
Bilirrubina |
≤ 1130 μmol/L o ≤ 66 mg/dL |
|
Hemoglobina |
≤ 0.621 mmol/L o ≤ 1000 mg/dL |
|
Intralipid |
≤ 1500 mg/dL |
|
Biotina |
≤ 287 nmol/L o ≤ 70 ng/mL |
|
Factores reumatoides |
≤ 1500 UI/mL |
Criterio: recuperación ± 1.5 U/mL del valor inicial para las muestras
≤ 15 U/mL, dentro de ± 10% del valor inicial para las muestras
> 15-50 U/mL y dentro de ± 13% del valor inicial para las muestras
< 50 U/mL
En pacientes en tratamiento con altas dosis de biotina (> 5 mg/día), no recoger la muestra antes de transcurridas como mínimo 8 horas tras la última administración.
En general, no se produce el efecto prozona (high-dose hook)b) a una concentración de CA 15-3 de hasta 20000 U/mL. Sin embargo, debido a la naturaleza heterogénea del antígeno CA 15-3, el efecto prozona no se puede excluir completamente a un valor inferior al indicado. En caso de obtener resultados inesperadamente bajos, se recomienda volver a diluir la muestra a 1:10 (consulte la sección "Dilución") y repetir el análisis.
Compuestos farmacéuticos: Se analizaron in vitro 16 fármacos de uso extendido sin encontrar interferencias con el presente ensayo.
Adicionalmente se analizaron los siguientes fármacos anticancerígenos sin encontrar interferencias con el presente ensayo.
Fármacos anticancerígenos:
|
Fármaco |
Concentración analizada en μg/mL |
|---|---|
|
Carboplatino |
200 |
|
Cisplatino |
225 |
|
Ciclofosfamida |
1000 |
|
Doxorrubicina |
75 |
|
Etopósido |
400 |
|
5-FU |
500 |
|
Flutamida |
1000 |
|
Metotrexato |
200 |
|
Mitomicina |
25 |
|
Tamoxifeno |
50 |
|
Taxol |
5.5 |
Las interferencias por fármacos se midieron según las recomendaciones dadas en las guías EP07 y EP37 del CLSI y en otras publicaciones. No se han caracterizado los efectos de concentraciones que exceden las recomendadas.
En casos aislados pueden presentarse interferencias por títulos extremadamente altos de anticuerpos dirigidos contra anticuerpos específicos del analito, la estreptavidina o el rutenio. Estos efectos se han minimizado gracias a un adecuado diseño del test.
Para el diagnóstico, los resultados del test siempre deben interpretarse teniendo en cuenta la anamnesis del paciente, la exploración clínica así como los resultados de otros exámenes.
b) Efecto prozona: una muestra con una concentración real claramente superior al intervalo de medición pero que aparece dentro del intervalo de medición
SÍMBOLOS:
Roche Diagnostics utiliza los siguientes símbolos y signos adicionalmente a los indicados en la norma ISO 15223-1 (para los EE.UU.: consulte dialog.roche.com para la definición de los símbolos usados):
|
CONTENT |
Contenido del kit |
|
SYSTEM |
Analizadores/instrumentos adecuados para los reactivos |
|
REAGENT |
Reactivo |
|
CALIBRATOR |
Calibrador |
|
|
Volumen para reconstitución |
|
GTN |
Número Global de Artículo Comercial |
La barra del margen indica suplementos, eliminaciones o cambios.
© 2022 Roche Diagnostics
ROCHE DIAGNOSTICS GMBH
Sandhofer Strasse 116
D-68305 Mannheim
+800 5505 6606
OBTENCIÓN Y PREPARACIÓN DE LAS MUESTRAS:
Solo se ha analizado y considerado apto el tipo de muestras aquí indicado.
Suero recogido en tubos estándar de muestra o en tubos que contienen gel de separación.
Plasma tratado con heparina de litio o con EDTA di o tripotásico.
Criterio: pendiente 0.9-1.1 + intersección dentro de ≤ ± 2 U/mL + coeficiente de correlación ≥ 0.95.
Estable durante 48 horas a 20-25 °C, 5 días a 2-8 °C, 90 días a -20 °C (± 5 °C). Congelar solo una vez.
Los tipos de muestra aquí indicados fueron analizados con tubos de recogida de muestras seleccionados y comercializados en el momento de efectuar el análisis, lo cual significa que no fueron analizados todos los tubos de todos los fabricantes. Los sistemas de recogida de muestras de diversos fabricantes pueden contener diferentes materiales que, en ciertos casos, pueden llegar a afectar los resultados de los análisis. Si las muestras se procesan en tubos primarios (sistemas de recogida de muestras), seguir las instrucciones del fabricante de tubos.
Centrifugar las muestras que contienen precipitado antes de realizar el ensayo.
No emplear muestras inactivadas por calor.
No utilizar muestras ni controles estabilizados con azida.
Se debe garantizar una temperatura de 20-25 °C para la medición de muestras y calibradores.
Para evitar posibles efectos de evaporación, determinar las muestras y los calibradores que se sitúan en los analizadores dentro de un lapso de 2 horas.
PREPARACIÓN DE LOS REACTIVOS:
Los reactivos incluidos en el kit están listos para el uso y forman una unidad inseparable.
La información necesaria para el correcto funcionamiento está disponible a través de cobas link.
COMPARACIÓN DE MÉTODOS:
Una comparación entre el ensayo ELECSYS CA 15-3 II ![]() 07027001190 (analizador cobas e 801; y) y el ensayo ELECSYS CA 15-3 II
07027001190 (analizador cobas e 801; y) y el ensayo ELECSYS CA 15-3 II ![]() 03045838122 (analizador cobas e 601; x) generó las siguientes correlaciones (U/mL):
03045838122 (analizador cobas e 601; x) generó las siguientes correlaciones (U/mL):
Número de muestras de suero medidas: 198
|
Passing/Bablok9 |
Regresión lineal |
|
y = 0.994x - 0.065 |
y = 0.978x + 0.686 |
|
τ = 0.969 |
r = 0.998 |
Las concentraciones de las muestras se situaron entre 5.14 y 279 U/mL.
Una comparación entre el ensayo ELECSYS CA 15-3 II ![]() 07027001190 (analizador cobas e 402; y) y el ensayo ELECSYS CA 15-3 II
07027001190 (analizador cobas e 402; y) y el ensayo ELECSYS CA 15-3 II ![]() 07027001190 (analizador cobas e 801; x) generó las siguientes correlaciones (U/mL):
07027001190 (analizador cobas e 801; x) generó las siguientes correlaciones (U/mL):
Número de muestras medidas: 138
|
Passing/Bablok9 |
Regresión lineal |
|
y = 1.07x - 0.190 |
y = 1.06x + 0.043 |
|
τ = 0.960 |
r = 0.994 |
Las concentraciones de las muestras se situaron entre 1.91 y 273 U/mL.
DATOS ESPECÍFICOS DEL FUNCIONAMIENTO DEL TEST:
A continuación, se indican los datos representativos del funcionamiento de los analizadores. Los resultados de cada laboratorio en particular pueden diferir de estos valores.
PRINCIPIO DEL TEST:
Técnica sándwich. Duración total del ensayo: 18 minutos.
• 1.ª incubación: 6 μL de muestra se prediluye automáticamente con Diluent Universal a 1:20. El antígeno (de 12 μL de muestra prediluida), un anticuerpo monoclonal biotinilado anti-CA 15-3 y un anticuerpo monoclonal anti-CA 15-3 marcado con quelato de rutenioa) forman un complejo sándwich.
• 2.ª incubación: después de incorporar las micropartículas recubiertas de estreptavidina, el complejo formado se fija a la fase sólida por interacción entre la biotina y la estreptavidina.
• La mezcla de reacción es trasladada a la célula de medida donde, por magnetismo, las micropartículas se fijan a la superficie del electrodo. Los elementos no fijados se eliminan posteriormente con ProCell II M. Al aplicar una corriente eléctrica controlada se produce una reacción quimioluminiscente cuya emisión de luz se mide con un fotomultiplicador.
• Los resultados se determinan mediante una curva de calibración generada específicamente para el instrumento a partir de una calibración a 2 puntos y una curva máster suministrada a través de cobas link.
a) Quelato Tris (2,2’bipiridina) rutenio (II) (Ru(bpy)![]() )
)
REACTIVOS - SOLUCIONES DE TRABAJO:
El cobas e pack está etiquetado como CA15-3 2.
M Micropartículas recubiertas de estreptavidina, 1 frasco, 12.4 mL: micropartículas recubiertas de estreptavidina: 0.72 mg/mL, conservante.
R1 Anticuerpo anti-CA 15-3~biotina, 1 frasco, 19.7 mL: Anticuerpo monoclonal biotinilado (115D8; ratón) 1.75 mg/L; tampón fosfato 20 mmol/L, pH 6.0; conservante.
R2 Anticuerpo anti-CA 15-3~Ru(bpy)![]() , 1 frasco, 19.7 mL: Anticuerpo monoclonal anti-CA 15-3 (DF3; ratón) marcado con quelato de rutenio 10 mg/L; tampón fosfato 100 mmol/L, pH 7.0; conservante.
, 1 frasco, 19.7 mL: Anticuerpo monoclonal anti-CA 15-3 (DF3; ratón) marcado con quelato de rutenio 10 mg/L; tampón fosfato 100 mmol/L, pH 7.0; conservante.
REALIZACIÓN DEL TEST:
Para garantizar el funcionamiento óptimo del test, observe las instrucciones de la presente metódica referentes al analizador empleado. Consulte el manual del operador apropiado para obtener las instrucciones de ensayo específicas del analizador.
Las micropartículas se mezclan automáticamente antes del uso.
Colocar el cobas e pack refrigerado (a 2-8 °C) en el gestor de reactivos (reagent manager). Evitar la formación de espuma. El analizador realiza automáticamente los procesos de atemperar, abrir y tapar el cobas e pack.
REFERENCIAS BIBLIOGRÁFICAS:
1 Duffy MJ. CA 15-3 and related mucins as circulating markers in breast cancer. Ann Clin Biochem,1999;36:579-586.
2 Hilkens J, Buijs F, Hilgers J, et al. Monoclonal antibodies against human milk-fat globule membranes detecting differentiation antigens of the mammary gland. Prot Biol Fluids 1982;29:813-816.
3 Hilkens J, Buijs F, Hilgers J, et al. Monoclonal antibodies against human milk-fat globule membranes detecting differentiation antigens of the mammary gland and its tumors. Int J Cancer 1984;34:197-206.
4 Kufe D, Inghirami G, Abe M, et al. Differential reactivity of a novel monoclonal antibody (DF3) with human malignant versus benign breast tumor. Hybridoma 1984;(3):223-232.
5 Sekine H, Ohno T, Kufe DW. Purification and characterization of a high molecular weight glycoprotein detectable in human milk and breast carcinomas. J Immunol 1985;135(5):3610-3615.
6 Ponnusamy MP, Seshacharyulu P, Lakshmanan I, et al. Emerging role of mucins in epithelial to mesenchymal transition. Curr cancer drug targets 2013;13(9):945-56.
7 Duffy MJ, Walsh S, McDermott EW, et al. Chapter One - Biomarkers in Breast Cancer: Where Are We and Where Are We Going?, In: Gregory S. Makowski, Editor(s), Advances in Clinical Chemistry, Elsevier, 2015;71: 1-23, ISSN 0065-2423, ISBN 9780128022566.
8 Cardoso F, et al. ESMO Guidelines for advanced breast cancer. Annals of Oncology,2018;29: 1634-1657.
9 Bablok W, Passing H, Bender R, et al. A general regression procedure for method transformation. Application of linear regression procedures for method comparison studies in clinical chemistry, Part III. J Clin Chem Clin Biochem 1988 Nov;26(11):783-790.
Para más información acerca de los componentes, consultar el manual del operador del analizador, las hojas de aplicación y las metódicas correspondientes (disponibles en su país).
En la presente metódica se emplea como separador decimal un punto para distinguir la parte entera de la parte fraccionaria de un número decimal. No se utilizan separadores de millares.
Todo incidente grave que se haya producido en relación con el producto se comunicará al fabricante y a la autoridad competente del estado miembro en el que se encuentre el usuario y/o el paciente.
Para el resumen del informe de seguridad y funcionamiento, consulte: https://ec.europa.eu/tools/eudamed