
ELECSYS AMH PLUS
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
VALORES TEÓRICOS:
Se realizó un estudio sobre el ensayo ELECSYS AMH PLUS basado en muestras de adultos caucásicos aparentemente sanos (148 hombres y 887 mujeres que no toman anticonceptivos) y de 149 mujeres con síndrome de ovario poliquístico (SOPQ). Se obtuvieron los resultados siguientes25:
|
N |
Percentil 2.5 ng/mL (ICb) del 95%) |
Percentil 5 ng/mL (IC del 95%) |
Mediana ng/mL (IC del 95%) |
Percentil 95 ng/mL (IC del 95%) |
Percentil 97.5 ng/mL (IC del 95%) |
|
|
Hombres sanos |
||||||
|
148 |
0.77 (0.17-1.58) |
1.43 (0.256-1.97) |
4.79 (4.35-5.35) |
11.6 (10.3-17.0) |
14.5 (10.9-17.6) |
|
|
Mujeres sanas (años) |
||||||
|
• 20-24 |
150 |
1.22 (0.478-1.67) |
1.52 (0.758-1.81) |
4.00 (3.60-4.44) |
9.95 (7.87-13.6) |
11.7 (9.11-15.7) |
|
• 25-29 |
150 |
0.890 (0.493-1.21) |
1.20 (0.797-1.75) |
3.31 (3.00-3.89) |
9.05 (7.59-10.3) |
9.85 (8.91-11.3) |
|
• 30-34 |
138 |
0.576 (0.256-0.958) |
0.711 (0.256-1.12) |
2.81 (2.35-3.47) |
7.59 (6.84-9.52) |
8.13 (7.27-9.72) |
|
• 35-39 |
138 |
0.147 (0.053-0.474) |
0.405 (0.053-0.496) |
2.00 (1.73-2.36) |
6.96 (5.31-9.37) |
7.49 (6.49-10.9) |
|
• 40-44 |
142 |
0.027 (0.010-0.063) |
0.059 (0.017-0.119) |
0.882 (0.726-1.13) |
4.44 (2.94-5.56) |
5.47 (3.92-6.76) |
|
• 45-50 |
169 |
0.010 (0.010-0.010) |
0.010 (0.010-0.010) |
0.194 (0.144-0.269) |
1.79 (1.43-2.99) |
2.71 (1.79-4.16) |
|
Mujeres con SOPQ* |
||||||
|
149 |
1.86 (1.54-2.50) |
2.41 (1.67-3.01) |
6.81 (6.30-7.42) |
17.1 (13.3-20.3) |
18.9 (16.0-21.1) |
|
b) IC = intervalo de confianza
|
N |
Percentil 2.5 pmol/L (IC del 95%) |
Percentil 5 pmol/L (IC del 95%) |
Mediana pmol/L (IC del 95%) |
Percentil 95 pmol/L (IC del 95%) |
Percentil 97.5 pmol/L (IC del 95%) |
|
|
Hombres sanos |
||||||
|
148 |
5.5 (1.2-11.3) |
10.2 (1.8-14.1) |
34.2 (31.1-38.2) |
82.8 (73.5-121) |
103 (78.1-125) |
|
|
Mujeres sanas (años) |
||||||
|
20-24 |
150 |
8.71 (3.41-11.9) |
10.9 (5.41-12.9) |
28.6 (25.7-31.7) |
71.0 (56.2-97.1) |
83.6 (65.0-112) |
|
25-29 |
150 |
6.35 (3.52-8.64) |
8.57 (5.69-12.5) |
23.6 (21.4-27.8) |
64.6 (54.2-73.5) |
70.3 (63.6-81.0) |
|
30-34 |
138 |
4.11 (1.83-6.84) |
5.08 (1.83-8.00) |
20.0 (16.8-24.8) |
54.2 (48.8-68.0) |
58.0 (51.9-69.4) |
|
35-39 |
138 |
1.05 (0.378-3.38) |
2.89 (0.378-3.54) |
14.2 (12.4-16.9) |
49.7 (37.9-66.9) |
53.5 (46.3-77.9) |
|
40-44 |
142 |
0.193 (0.071-0.450) |
0.421 (0.121-0.850) |
6.29 (5.18-8.07) |
31.7 (21.0-39.7) |
39.1 (28.0-48.3) |
|
45-50 |
169 |
0.071 (0.071-0.071) |
0.071 (0.071-0.071) |
1.39 (1.03-1.92) |
12.8 (10.2-21.3) |
19.3 (12.8-29.7) |
|
Mujeres con SOPQ* |
||||||
|
149 |
13.3 (11.0-17.8) |
17.2 (11.9-21.5) |
48.6 (45.0-53.0) |
122 (95.0-145) |
135 (114-151) |
|
* Según los criterios diagnósticos revisados de SOPQ establecidos por el panel de consenso de SOPQ de Róterdam auspiciado por la Sociedad Europea de Reproducción Humana y Embriología (ESHRE) y la Sociedad Americana de Medicina Reproductiva (ASRM).26
El análisis de las muestras de una cohorte pediátrica (484 niños de fenotipo aparentemente sano y 282 niñas de fenotipo aparentemente sano) con edades comprendidas entre 1 día después del nacimiento y 18 años arrojó los resultados siguientes.27
|
N |
Percentil 2.5 pmol/L (IC del 90%) |
Mediana |
Percentil 97.5 pmol/L (IC del 90%) |
|
|
Niños sanos (edad) |
||||
|
0-2 d c) |
42 |
78.11 (58.89-108.94) |
258.8 |
606.46 (409.51-699.86) |
|
3-7 d |
44 |
159.60 (57.93-199.81) |
554.3 |
1186.20 (982.69-1495.78) |
|
8-10 d |
15 |
225.52 (0-330.32) |
703.0 |
1391.71 (1113.36-1962.28) |
|
11-20 d |
43 |
161.70 (59.38-203.13) |
537.0 |
1310.46 (1138.87-1641.31) |
|
21-28 d |
25 |
244.98 (142.28-359.27) |
567.0 |
1102.37 (777.43-1284.35) |
|
29-364 d |
66 |
235.52 (155.15-323.18) |
551.2 |
1125.86 (706.65-1358.86) |
|
1-4.9 a d) |
60 |
310.70 (246.56-422.97) |
692.7 |
1425.29 (1089.83-1577.96) |
|
5-7.9 a |
39 |
238.33 (187.26-301.84) |
511.5 |
1108.32 (868.53-1296.48) |
|
8-11.9 a |
60 |
96.58 (0-100.14) |
426.3 |
1131.44 (1045.31-1497.03) |
|
12-14.9 a |
39 |
9.43 (0-15.48) |
71.65 |
331.80 (144.80-464.85) |
|
15-18.9 a |
51 |
16.76 (7.83-22.03) |
58.2 |
130.04 (95.39-153.18) |
|
Niñas sanas (edad) |
||||
|
0-28 d |
87 |
< LdCe) |
0.42 |
6.73 (2.49-9.93) |
|
29-364 d |
28 |
< LdC |
1.39 |
31.23 (7.77-57.05) |
|
1-4.99 a |
37 |
1.25 (0-2.06) |
11.55 |
43.72 (33.20-58.55) |
|
5-7.99 a |
29 |
1.36 (0-2.06) |
10.81 |
39.51 (24.21-58.55) |
|
8-11.99 a |
40 |
2.92 (0.11-4.63) |
16.99 |
52.82 (32.16-68.88) |
|
12-14.99 a |
31 |
2.97 (0-4.97) |
15.75 |
46.56 (28.19-61.91) |
|
15-18.99 a |
30 |
2.05 (0-2.82) |
19.76 |
84.09 (60.86-121.49) |
c) días
d) años
e) Límite de cuantificación
Cada laboratorio debería comprobar si los intervalos de referencia pueden aplicarse a su grupo de pacientes y, en caso necesario, establecer sus propios valores.
MEDIDAS DE PRECAUCIÓN Y ADVERTENCIAS:
Para el uso diagnóstico in vitro por los profesionales de la salud. Observe las medidas de precaución usuales para la manipulación de reactivos de laboratorio.
Residuos infecciosos o microbiológicos:
Advertencia: manipule los residuos como material biológico potencialmente peligroso. Deseche los residuos de acuerdo con las instrucciones y procedimientos de laboratorio aceptados.
Peligros ambientales:
Aplique todas las normas locales de eliminación pertinentes para asegurar una eliminación segura.
Existe una ficha de datos de seguridad a disposición del usuario profesional que la solicite.
El presente estuche contiene componentes que han sido clasificados por la directiva CE No. 1272/2008 de la siguiente manera:
![]()
Atención
H317 Puede provocar una reacción alérgica en la piel.
Prevención:
P261 Evitar respirar la niebla o el vapor.
P272 Las prendas de trabajo contaminadas no podrán sacarse del lugar de trabajo.
P280 Llevar guantes de protección.
Respuesta:
P333 + P313 En caso de irritación o erupción cutánea: Consultar a un médico.
P362 + P364 Quitar las prendas contaminadas y lavarlas antes de volver a usarlas.
Eliminación:
P501 Eliminar el contenido/el recipiente en una planta de eliminación de residuos aprobada.
Las indicaciones de seguridad del producto corresponden a los criterios del sistema globalmente armonizado de clasificación y etiquetado de productos químicos (GHS por sus siglas en inglés) válidas en la UE.
Contacto telefónico internacional: +49-621-7590
Evite la formación de espuma en reactivos y muestras de todo tipo (especímenes, calibradores y controles).
CONSERVACIÓN Y ESTABILIDAD:
Conservar a 2-8 °C.
No congelar.
Conservar el kit de reactivos Elecsys en posición vertical para garantizar la disponibilidad total de las micropartículas durante la mezcla automática antes del uso.
|
Estabilidad: |
|
|
Sin abrir, a 2-8 °C |
Hasta la fecha de caducidad indicada |
|
Una vez abierto, a 2-8 °C |
12 semanas |
|
En los analizadores |
8 semanas |
DILUCIÓN:
Las muestras con concentraciones de AMH superiores al intervalo de medición pueden diluirse automáticamente con Diluent Universal 2. La dilución manual puede efectuarse con Diluent Universal 2 o Diluent Universal. Se recomienda una dilución a 1:2 (automáticamente por los analizadores o de forma manual). Cuando sea necesario, es adecuada una dilución manual 1:10 (consulte la tabla de intervalos de referencia pediátricos). La concentración de la muestra diluida debe superar los > 71.4 pmol/L (> 10 ng/mL).
Multiplicar los resultados obtenidos tras dilución manual por el factor de dilución.
El software de los analizadores tiene en cuenta la dilución automática al calcular la concentración de las muestras.
MATERIAL REQUERIDO ADICIONALMENTE (NO SUMINISTRADO):
• ![]() 07957203190, CalSet AMH Plus para 4 x 1.0 mL
07957203190, CalSet AMH Plus para 4 x 1.0 mL
• ![]() 07957211190, PreciControl AMH Plus para 4 x 2.0 mL
07957211190, PreciControl AMH Plus para 4 x 2.0 mL
• ![]() 05192943190, Diluent Universal 2, 2 x 36 mL de diluyente para muestras o
05192943190, Diluent Universal 2, 2 x 36 mL de diluyente para muestras o
• ![]() 11732277122, Diluent Universal, 2 x 16 mL de diluyente para muestras o
11732277122, Diluent Universal, 2 x 16 mL de diluyente para muestras o
• ![]() 03183971122, Diluent Universal, 2 x 36 mL de diluyente para muestras
03183971122, Diluent Universal, 2 x 36 mL de diluyente para muestras
• Equipo usual de laboratorio
• Analizador cobas e
Material adicional para el analizador cobas e 411:
• ![]() 11662988122, ProCell, 6 x 380 mL de tampón del sistema
11662988122, ProCell, 6 x 380 mL de tampón del sistema
• ![]() 11662970122, CleanCell, 6 x 380 mL de solución de limpieza para la célula de medida
11662970122, CleanCell, 6 x 380 mL de solución de limpieza para la célula de medida
• ![]() 11930346122, Elecsys SysWash, 1 x 500 mL de aditivo para el agua del depósito de lavado
11930346122, Elecsys SysWash, 1 x 500 mL de aditivo para el agua del depósito de lavado
• ![]() 11933159001, Adaptador para SysClean
11933159001, Adaptador para SysClean
• ![]() 11706802001, AssayCup, 60 x 60 cubetas de reacción
11706802001, AssayCup, 60 x 60 cubetas de reacción
• ![]() 11706799001, AssayTip, 30 x 120 puntas de pipeta
11706799001, AssayTip, 30 x 120 puntas de pipeta
• ![]() 11800507001, Clean-Liner
11800507001, Clean-Liner
Material adicional para los analizadores cobas e 601 y cobas e 602:
• ![]() 04880340190, ProCell M, 2 x 2 L de tampón del sistema
04880340190, ProCell M, 2 x 2 L de tampón del sistema
• ![]() 04880293190, CleanCell M, 2 x 2 L de solución de limpieza para la célula de medida
04880293190, CleanCell M, 2 x 2 L de solución de limpieza para la célula de medida
• ![]() 03023141001, PC/CC-Cups, 12 recipientes para atemperar las soluciones ProCell M y CleanCell M antes de usar
03023141001, PC/CC-Cups, 12 recipientes para atemperar las soluciones ProCell M y CleanCell M antes de usar
• ![]() 03005712190, ProbeWash M, 12 x 70 mL de solución de limpieza al finalizar un ciclo y enjuagar tras cambio de reactivos
03005712190, ProbeWash M, 12 x 70 mL de solución de limpieza al finalizar un ciclo y enjuagar tras cambio de reactivos
• ![]() 03004899190, PreClean M, 5 x 600 mL de solución detergente de detección
03004899190, PreClean M, 5 x 600 mL de solución detergente de detección
• ![]() 12102137001, AssayTip/AssayCup, 48 bandejas con 84 cubetas de reacción y puntas de pipeta, bolsas de residuos
12102137001, AssayTip/AssayCup, 48 bandejas con 84 cubetas de reacción y puntas de pipeta, bolsas de residuos
• ![]() 03023150001, WasteLiner, bolsas de residuos
03023150001, WasteLiner, bolsas de residuos
• ![]() 03027651001, SysClean Adapter M
03027651001, SysClean Adapter M
Materiales adicionales para todos los analizadores:
• ![]() 11298500316, ISE Cleaning Solution/Elecsys SysClean, 5 x 100 mL de solución de limpieza para el sistema
11298500316, ISE Cleaning Solution/Elecsys SysClean, 5 x 100 mL de solución de limpieza para el sistema
MATERIAL SUMINISTRADO:
Consultar la sección “Reactivos - Soluciones de trabajo” en cuanto a los reactivos suministrados.
CALIBRACIÓN:
Trazabilidad: El presente método ha sido estandarizado frente al ensayo de Beckman Coulter AMH Gen II ELISA (versión no modificada sin predilución).
Cada reactivo Elecsys contiene un código de barras que incluye información específica para la calibración del lote de reactivos. La curva máster predefinida es adaptada al analizador a través del CalSet correspondiente.
Intervalo de calibraciones: Efectuar la calibración una vez por lote de reactivos con reactivo fresco de un kit de reactivos registrado como máximo 24 horas antes en el analizador.
El intervalo de calibración puede ampliarse si el laboratorio asegura una verificación aceptable de la calibración.
Se recomienda repetir la calibración:
• Después de 1 mes (28 días) si se trata del mismo lote de reactivos.
• Después de 7 días (si se utiliza el mismo kit de reactivos en el analizador).
• En caso necesario: por ejemplo, si los valores del control de calidad están fuera del intervalo definido.
CONTROL DE CALIDAD:
Efectuar el control de calidad con PreciControl AMH Plus.
También puede utilizarse material de control adicional en combinación con PreciControl AMH Plus.
Los controles de los diferentes intervalos de concentración deberían efectuarse junto con el test en determinaciones simples por lo menos 1 vez cada 24 horas, con cada estuche de reactivos y después de cada calibración.
Asegurar que los resultados para la exactitud y la precisión se encuentren dentro de un intervalo aceptable. Los resultados deben situarse dentro de los intervalos diana definidos para PreciControl AMH Plus. Además, el usuario debe asegurar que la desviación sistemática respecto del valor objetivo asignado quede dentro de ± 12%, la precisión intermedia CV ≤ 8% y el error total (ET) máximo dentro de ± 25% (ET = |desviación| + 1.65*CV). Se recomienda utilizar un software apto para las exigencias del control de calidad.
Adaptar los intervalos y límites de control a los requisitos individuales del laboratorio. Los resultados obtenidos deben hallarse dentro de los límites definidos. Cada laboratorio debería establecer medidas correctivas a seguir en caso de obtener valores fuera del intervalo definido.
Si fuera necesario, repetir la medición de las muestras en cuestión.
Cumplir con las regulaciones gubernamentales y las normas locales de control de calidad pertinentes.
CÁLCULO:
El analizador calcula automáticamente la concentración de analito de cada muestra (en pmol/L o ng/mL).
|
Factores de conversión: |
pmol/L x 0.14 = ng/mL |
|
ng/mL x 7.14 = pmol/L |
ESPECIFICIDAD ANALÍTICA:
Los anticuerpos monoclonales empleados en el test son altamente específicos de la AMH humana. Se han registrado las siguientes reactividades cruzadas:
|
Sustancia interferente |
Concentración analizada |
Reactividad cruzada % |
|
Inhibina A |
100 ng/mL |
n. d.f) |
|
Activina A |
100 ng/mL |
n. d. |
|
LH |
500 mUI/mL |
n. d. |
|
FSH |
500 mUI/mL |
n. d. |
f) n. d. = no detectable
INFORMACIÓN DEL SISTEMA:
Español:
Analizador cobas e 411: número de test 1590
Analizadores cobas e 601 y cobas e 602: código de aplicación 472
LÍMITES E INTERVALOS:
0.07-164 pmol/L (0.01-23 ng/mL), definido por el Límite de Detección y el máximo de la curva máster. Los valores inferiores al Límite de Detección se indican como < 0.07 pmol/L o < 0.01 ng/mL. Los valores superiores al intervalo de medición se indican como > 164 pmol/L o > 23 ng/mL (o bien, hasta 328 pmol/L o 46 ng/mL para muestras diluidas 1:2).
Límites inferiores de medición:
Límite de Blanco, Límite de Detección y Límite de Cuantificación.
Límite de Blanco = 0.049 pmol/L (0.007 ng/mL)
Límite de Detección = 0.07 pmol/L (0.01 ng/mL).
Límite de Cuantificación = 0.214 pmol/L (0.030 ng/mL).
El Límite de Blanco, el Límite de Detección y el Límite de Cuantificación fueron determinados cumpliendo con los requerimientos EP17-A2 del Instituto de Estándares Clínicos y de Laboratorio (CLSI - Clinical and Laboratory Standards Institute).
El Límite de Blanco es el valor del percentil 95 obtenido a partir de n ≥ 60 mediciones de muestras libres de analito en varias series independientes. El Límite de Blanco corresponde a la concentración por debajo de la cual se encuentran, con una probabilidad del 95%, las muestras sin analito.
El Límite de Detección se determina basándose en el Límite de Blanco y en la desviación estándar de muestras de baja concentración. El Límite de Detección corresponde a la menor concentración de analito detectable (valor superior al Límite de Blanco con una probabilidad del 95%).
El Límite de Cuantificación es la menor concentración de analito cuya medición puede reproducirse con un coeficiente de variación para la precisión intermedia de ≤ 20%.
PRECISIÓN:
La precisión ha sido determinada mediante reactivos Elecsys, muestras y controles según un protocolo (EP05-A3) del CLSI (Clinical and Laboratory Standards Institute): 2 ciclos diarios por duplicado, cada uno durante 21 días (n = 84). Se obtuvieron los siguientes resultados:
|
Analizador cobas e 411 |
|||||
|
Repetibilidad |
Precisión intermedia |
||||
|
Muestra |
Media ng/mL |
DE ng/mL |
CV % |
DE ng/mL |
CV % |
|
Suero humano 1 |
0.046 |
0.0008 |
1.7 |
0.002 |
3.6 |
|
Suero humano 2 |
0.807 |
0.010 |
1.3 |
0.028 |
3.5 |
|
Suero humano 3 |
4.32 |
0.076 |
1.8 |
0.158 |
3.7 |
|
Suero humano 4 |
12.5 |
0.148 |
1.2 |
0.419 |
3.4 |
|
Suero humano 5 |
20.1 |
0.295 |
1.5 |
0.738 |
3.7 |
|
PreciControl AMH 1 |
0.964 |
0.011 |
1.1 |
0.024 |
2.5 |
|
PreciControl AMH 2 |
4.86 |
0.060 |
1.2 |
0.141 |
2.9 |
|
Analizadores cobas e 601 y cobas e 602 |
|||||
|
Repetibilidad |
Precisión intermedia |
||||
|
Muestra |
Media ng/mL |
DE ng/mL |
CV % |
DE ng/mL |
CV % |
|
Suero humano 1 |
0.048 |
0.0007 |
1.5 |
0.002 |
3.2 |
|
Suero humano 2 |
0.816 |
0.011 |
1.3 |
0.027 |
3.4 |
|
Suero humano 3 |
4.24 |
0.047 |
1.1 |
0.164 |
3.9 |
|
Suero humano 4 |
12.8 |
0.221 |
1.7 |
0.477 |
3.7 |
|
Analizadores cobas e 601 y cobas e 602 |
|||||
|
Repetibilidad |
Precisión intermedia |
||||
|
Muestra |
Media ng/mL |
DE ng/mL |
CV % |
DE ng/mL |
CV % |
|
Suero humano 5 |
20.8 |
0.531 |
2.6 |
0.725 |
3.5 |
|
PreciControl AMH 1 |
0.957 |
0.009 |
1.0 |
0.023 |
2.5 |
|
PreciControl AMH 2 |
4.82 |
0.052 |
1.1 |
0.123 |
2.5 |
|
Analizador cobas e 411 |
|||||
|
Repetibilidad |
Precisión intermedia |
||||
|
Muestra |
Media pmol/L |
DE pmol/L |
CV % |
DE pmol/L |
CV % |
|
Suero humano 1 |
0.330 |
0.006 |
1.7 |
0.012 |
3.6 |
|
Suero humano 2 |
5.76 |
0.074 |
1.3 |
0.203 |
3.5 |
|
Suero humano 3 |
30.9 |
0.546 |
1.8 |
1.13 |
3.7 |
|
Suero humano 4 |
89.1 |
1.06 |
1.2 |
2.99 |
3.4 |
|
Suero humano 5 |
143 |
2.11 |
1.5 |
5.27 |
3.7 |
|
PreciControl AMH 1 |
6.88 |
0.076 |
1.1 |
0.173 |
2.5 |
|
PreciControl AMH 2 |
34.7 |
0.427 |
1.2 |
1.01 |
2.9 |
|
Analizadores cobas e 601 y cobas e 602 |
|||||
|
Repetibilidad |
Precisión intermedia |
||||
|
Muestra |
Media pmol/L |
DE pmol/L |
CV % |
DE pmol/L |
CV % |
|
Suero humano 1 |
0.345 |
0.005 |
1.5 |
0.011 |
3.2 |
|
Suero humano 2 |
5.83 |
0.078 |
1.3 |
0.196 |
3.4 |
|
Suero humano 3 |
30.3 |
0.338 |
1.1 |
1.17 |
3.9 |
|
Suero humano 4 |
91.1 |
1.58 |
1.7 |
3.41 |
3.7 |
|
Suero humano 5 |
148 |
3.79 |
2.6 |
5.18 |
3.5 |
|
PreciControl AMH 1 |
6.83 |
0.065 |
1.0 |
0.168 |
2.5 |
|
PreciControl AMH 2 |
34.4 |
0.372 |
1.1 |
0.877 |
2.5 |
CARACTERÍSTICAS:
La hormona anti-Mulleriana es una glucoproteína homodimérica que pertenece a la familia de los factores de crecimiento transformador beta (TGF-β). Todos los miembros de esta superfamilia están implicados en la regulación del crecimiento y de la diferenciación tisular. Antes de la secreción, la hormona se somete a la glucosilación y dimerización para producir un precursor de aproximadamente 140 kDa de dos subunidades idénticas de 70 kDa unidas por puentes disulfuro. Cada monómero contiene un gran dominio N-terminal (la región “pro”) y un dominio C-terminal mucho más pequeño (la región madura). Se piensa que la AMH, contrariamente a otros miembros de la familia de TGF-β, requiere el dominio N-terminal para potenciar la actividad del dominio C-terminal a fin de conseguir bioactividad completa.1,2
Después, una parte de la AMH se escinde en un sitio específico entre la región pro y la región madura durante el tránsito citoplasmático, para formar dos homodímeros biológicamente activos (uno de 110 kDa de dominio N-terminal y otro de 25 kDa de dominio C-terminal) asociados en un complejo no covalente. El receptor de tipo II de la AMH tiene la capacidad de unirse solamente al fragmento biológicamente activo de la AMH.2
En el hombre, la AMH se produce por las células de Sertoli del testículo. Durante el desarrollo fetal masculino, la secreción de AMH de las células testiculares de Sertoli es esencial para la regresión de los conductos Mullerianos y por tanto, el desarrollo normal del tracto reproductor masculino. La secreción de AMH por las células de Sertoli comienza durante la embriogénesis y continúa a lo largo de la vida. La AMH es producida continuamente por los testículos hasta la pubertad para después disminuir lentamente hasta alcanzar valores pospuberales.3
En la mujer, la AMH desempeña un papel importante en la foliculogénesis ovárica.4 El desarrollo folicular en los ovarios comprende dos etapas: el reclutamiento inicial en el cual los folículos primordiales empiezan a madurar y el reclutamiento cíclico que lleva al crecimiento de un conjunto de pequeños folículos en fase antral de entre los que se selecciona el folículo dominante (destinado a la ovulación). El reclutamiento cíclico es dirigido por la FSH (hormona folículoestimulante). La expresión de AMH en las células de la granulosa empieza en los folículos primarios alcanzando su máxima expresión en las células de la granulosa de folículos preantrales y antrales pequeños hasta un diámetro de 6 mm. Cuando el crecimiento folicular empieza a depender de la FSH, disminuye la expresión de la AMH hasta convertirse en indetectable. Estos patrones de expresión de la AMH favorecen su papel inhibidor en dos diferentes fases de la foliculogénesis.
Primero, la AMH inhibe la transición de folículos del estadio primordial al estadio de maduración teniendo un papel decisivo en la regulación del número de folículos que quedan en el pool primordial. Segundo, la AMH ejerce un efecto inhibidor sobre la sensibilidad de los folículos a la FSH influyendo de este modo en el proceso de selección folicular.5,6
En la mujer, los niveles séricos de AMH apenas pueden detectarse tras el nacimiento, alcanzan los valores máximos después de la pubertad y disminuyen progresivamente a lo largo de la vida convirtiéndose en indetectables en la menopausia.7,8 Se ha descubierto que los niveles séricos de AMH permanecen relativamente estables durante el ciclo menstrual aunque se han observado fluctuaciones sustanciales en mujeres jóvenes.9,10,11 Además, las concentraciones de AMH presentan menos variaciones intra e intercíclicas que la FSH basal.10 Los niveles séricos de AMH disminuyen significativamente al tomar anticonceptivos combinados.12 La medición de AMH se presta a una variedad de aplicaciones clínicas.13,14,15 Por ejemplo, la medición de niveles séricos de AMH en entornos clínicos se utiliza para evaluar la reserva ovárica, ya que refleja el número de folículos antrales, y preantrales, el así llamado recuento de folículos antrales (RFA) y para predecir la respuesta a la estimulación ovárica controlada,13,15,16 y para la identificación del PCOM como ayuda en el diagnóstico del SOPQ.17 Otras aplicaciones clínicas de la AMH consisten en facilitar el diagnóstico de diferencias de desarrollo sexual (DSD) en niños18,19,20 así como el seguimiento de tumores de células de la granulosa para detectar tumores residuales o recurrentes.21,22 Los niveles séricos de AMH varían en los trastornos relacionados con la fertilidad masculina, como la azoospermia no obstructiva o el síndrome de Klinefelter.23 Asimismo, la AMH se ha propuesto como biomarcador indirecto para predecir el momento de la menopausia.24
APLICACIÓN DE AMH EN LA DETERMINACIÓN DE LA DOSIS DIARIA INDIVIDUAL DE LA FOLITROPINA DELTA DE FERRING:
La folitropina delta se produce en una línea celular humana (PER.C6®) mediante la tecnología del ADN recombinante.33,36,37 Ferring es el titular de la autorización de comercialización de la folitropina delta.
La concentración de AMH (en pmol/L) ha sido determinada con el ensayo ELECSYS AMH PLUS y validada junto con el peso corporal para establecer la dosis diaria individual de folitropina delta en mujeres sometidas a una estimulación controlada del crecimiento de múltiples folículos en el marco de un programa de reproducción asistida (FIV o ciclo de inyección intracitoplasmática de espermatozoides, ICSI). El ensayo Elecsys AMH Plus ha sido evaluado exclusivamente para la determinación de dosis individuales de folitropina delta de Ferring. La posología individualizada de folitropina delta basada en la determinación de AMH ha sido validada en un ensayo clínico prospectivo de fase III aleatorizado, controlado, con evaluador ciego, en grupos paralelos, multicéntrico y multinacional denominado ESTHER-1 comparando la efectividad y la seguridad de la folitropina delta frente a la folitropina alfa (randomizada de 1:1).
Participaron mujeres de entre 18 y 40 años de edad que recibieron una estimulación ovárica controlada durante FIV o ICSI y que siguieron un protocolo con antagonistas de la GnRH.38 En este ensayo, 665 candidatas a FIV/ICSI distribuidas al azar en el grupo de folitropina delta fueron tratadas con dosis individuales de folitropina delta, determinadas sobre la base de su peso corporal y su concentración de AMH (en pmol/L) medida con el test ELECSYS AMH PLUS. La dosis diaria individual de folitropina delta fue mantenida durante la estimulación sin ajustar la dosis.
Información importante: Los médicos que desean recetar folitropina delta tienen que haber leído y entendido la información de prescripción actual de folitropina delta de Ferring vigente en su país antes de administrar este fármaco. Dicho documento proporciona detalles sobre la posología recomendada, la efectividad clínica y la seguridad del fármaco.39
APLICACIÓN DE AMH PARA PREDECIR LA RESPUESTA OVÁRICA A LA ESTIMULACIÓN OVÁRICA CONTROLADA:
AMH para la predicción de una respuesta elevada a la estimulación ovárica:
Los resultados indicados a continuación se obtuvieron en el estudio externo “Evaluación clínica del ensayo Elecsys AMH para predecir la respuesta a la estimulación ovárica controlada”.31
En este estudio, se determinó el valor de AMH en 149 mujeres sometidas a un protocolo de tratamiento con antagonistas durante su primer ciclo de estimulación ovárica controlada para la fecundación in vitro (FIV). Se incluyó a mujeres < 44 años de edad con un ciclo menstrual regular sin anomalías mayores por ecografía transvaginal. Se excluyó a mujeres con SOPQ o anomalías endocrinas o metabólicas así como a mujeres sometidas a FIV con donación de ovocitos. Todas las mujeres recibieron una dosis de estimulación estándar de FSH de 150 UI/día. Antes de empezar la estimulación de FSH se había extraído sangre para efectuar el análisis post-hoc de AMH después de concluirse el ciclo de tratamiento. En 16 mujeres se observó una hiperrespuesta. La hiperrespuesta se ha definido como sigue: número de ovocitos recuperados > 15 o interrupción del ciclo de estimulación en presencia de más de 20 folículos > 12 mm de diámetro con valores de estradiol > 11700 pmol/L o más de 30 folículos > 12 mm de diámetro. El funcionamiento clínico de Elecsys AMH respecto a la predicción de una hiperrespuesta a la estimulación ovárica controlada fue evaluado por análisis ROC (receiver operating characteristic) y aplicando un punto de corte de 15 pmol/L (2.1 ng/mL) que ya había sido publicado.32,33 La predicción de una hiperrespuesta fue significativa con una AUC (área bajo la curva) del 82.1% (IC 72.5-91.7%). En la tabla siguiente se indican la sensibilidad, la especificidad, el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN) con un punto de corte de AMH de 15.0 pmol/L (2.1 ng/mL).
|
Hiperrespuesta |
||
|
Punto de corte de AMH |
15.0 pmol/L (2.10 ng/mL) |
|
|
Estimación |
IC del 95% |
|
|
Sensibilidad |
81.3% |
54.4-96.0% |
|
Especificidad |
64.7% |
55.9-72.8% |
|
VPP |
21.7% |
12.1-34.2% |
|
VPN |
96.6% |
90.5-99.3% |
AMH para la predicción de una respuesta baja a la estimulación ovárica:
El uso de la AMH sérica, medida mediante el ensayo Elecsys AMH, para predecir una baja respuesta ovárica tras un tratamiento de fertilidad, se investigó en un estudio clínico retrospectivo y observacional realizado en un solo centro.34 En este estudio, se midieron los niveles séricos de AMH de 1248 mujeres adultas subfértiles antes de los seis meses previos a la estimulación ovárica con un tratamiento antagonista de la hormona liberadora de gonadotropina (GnRH). Las mujeres se dividieron en 4 grupos en función de su respuesta ovárica, medida por el rendimiento ovocitario: baja (0-3), subóptima (4-9), óptima (10-15) y elevada (> 15). La AUC de la AMH para predecir la respuesta ovárica fue de 0.85 (0.83-0.88) para la respuesta baja (rendimiento de 0-3 ovocitos). El punto de corte sérico óptimo de baja respuesta ovárica fue de 6.4 pmol/L (0.89 ng/mL). El funcionamiento clínico expresado como sensibilidad y especificidad diagnósticas fue del 74.4% y el 79.8%, respectivamente.
Uso de la AMH para la identificación del PCOM como ayuda para el diagnóstico del SOPQ:
En el estudio APHRODITE, se investigó el uso de la AMH para sustituir el recuento de folículos antrales (RFA) determinado por ultrasonido transvaginal (TVUS)35 para identificar la morfología de ovario poliquístico (PCOM), que es uno de los tres criterios utilizados para diagnosticar el síndrome de ovario poliquístico (SOPQ).17 APHRODITE es un estudio retrospectivo, no intervencionista, multicéntrico de casos y controles en el que se estableció y validó un punto de corte de 23 pmol/L (3.2 ng/mL) para AMH para identificar el PCOM y apoyar el diagnóstico de SOPQ en mujeres de 25-45 años. El punto de corte se obtuvo a partir de una cohorte formada por 1059 mujeres (484 casos de SOPQ y 575 controles) y se validó en otra cohorte formada por 955 mujeres (455 casos y 500 controles). En todos los casos se trataba de mujeres con el fenotipo A del SOPQ (es decir, que presentaban oligo/anovulación, hiperandrogenismo y PCOM). En la cohorte de validación, el punto de corte de AMH de 23 pmol/L (3.2 ng/mL) obtuvo un 88.6% de sensibilidad y un 84.6% de especificidad para el diagnóstico de PCOM, con un área bajo la curva característica operativa del receptor del 93.6%.
EMPLEO DE AMH PARA EVALUAR LA RESERVA OVÁRICA:
Se investigó el uso de AMH para analizar la reserva ovárica en un estudio prospectivo con n = 451 mujeres de entre 18 y 44 años de edad, donde los valores de AMH se correlacionaron con el recuento de folículos antrales (RFA).28 El RFA se determinó midiendo los folículos pequeños de entre 2 y 10 mm de diámetro visualizados por ecografía transvaginal. Tanto el RFA como la AMH se determinaron en los días 2-4 de un mismo ciclo menstrual. Se reclutaron de 17 a 115 mujeres por centro en 6 diferentes centros europeos y 1 centro australiano.
No se observaron diferencias significativas entre los diferentes centros en cuanto a los valores medios de AMH (pval = 0.301). Por contra, los valores medios de edad en los diferentes centros fueron significativamente diferentes y la correlación entre AMH y edad fue significativamente negativa (coeficiente de correlación de Spearman -0.47). El efecto de la AMH respecto del centro, con ajuste de la edad no era significativo (pval = 0.193). Los valores de RFA mostraron diferencias significativas entre los centros, con o sin ajuste de edad. La correlación total entre AMH y RFA fue de 0.68 (coeficiente de clasificación de Spearman).
La tabla siguiente muestra el diagrama de dispersión de AMH frente a RFA así como las distribuciones de AMH y RFA en los diferentes centros.
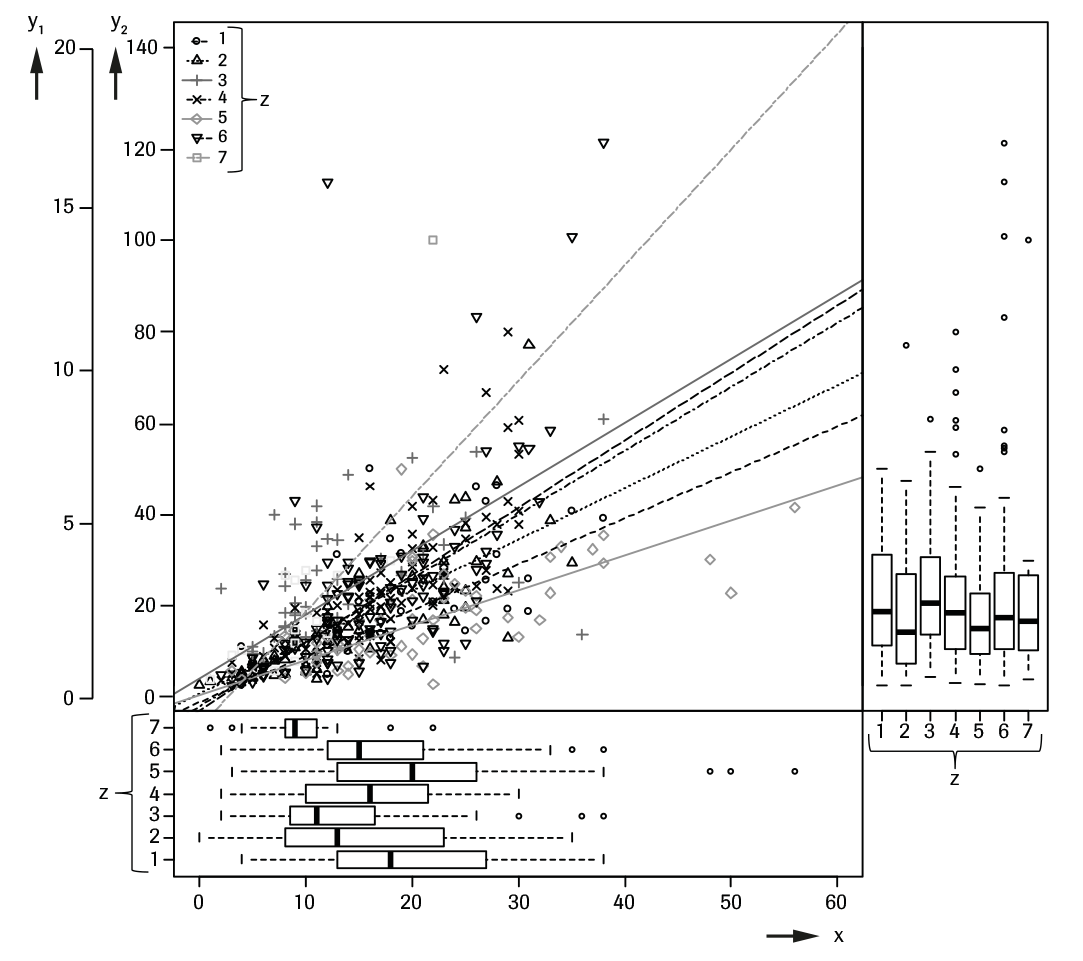
x: RFA (N)
y1: AMH (ng/mL)
y2: AMH (pmol/L)
z: centro
TABLA DE CONCORDANCIA DE NÚMEROS ABSOLUTOS DE RFA DE 7 Y 15:
Se definieron tres grupos de RFA29,30 a partir de dos puntos de corte para RFA: 7 y 15 (0-7, 8-15, > 15). De acuerdo con las prevalencias dentro de estos grupos (15%, 37%, 48%), se computaron cuantiles de AMH (c1 = 4.86 pmol/L o 0.681 ng/mL, c2 = 16.2 pmol/L o 2.27 ng/mL) para definir tres grupos. La concordancia se indica en números absolutos y porcentajes por grupo de AMH.
Teniendo en cuenta la gran variabilidad de los resultados de RFA dependiendo del centro y del ecógrafo, cada laboratorio debería adaptar la tabla de concordancia a sus propias condiciones específicas.
|
RFA 0-7 |
RFA 8-15 |
RFA > 15 |
N |
|
|
AMH ≤ 4.86 pmol/L (0.681 ng/mL) |
43 (63.2%) |
22 (32.4%) |
3 (4.4%) |
68 |
|
4.86 pmol/L (0.681 ng/mL) < AMH ≤ 16.2 pmol/L (2.27 ng/mL) |
20 (12.0%) |
95 (56.9%) |
52 (31.1%) |
167 |
|
AMH > 16.2 pmol/L (2.27 ng/mL) |
3 (1.4%) |
52 (24.1%) |
161 (74.5%) |
216 |
|
N |
66 |
169 |
216 |
451 |
Para pacientes con valores de AMH ≤ 4.86 pmol/L (0.681 ng/mL), la probabilidad de valores bajos de RFA (0-7) es del 63%, la probabilidad de encontrarse en el grupo medio de RFA (8-15) es de alrededor del 32% y la probabilidad de encontrarse en el grupo de RFA > 15 del 4.4% solamente.
Para pacientes con valores altos de AMH (> 16.2 pmol/L; > 2.27 ng/mL), la probabilidad de valores de RFA > 15 es del 75%, la probabilidad de encontrarse en el grupo medio de RFA (8-15) es del 24% y solamente el 1.4% tiene una probabilidad < 8.
USO PREVISTO:
Inmunoensayo in vitro para la determinación cuantitativa de la hormona anti-Mulleriana (AMH) en suero y plasma humanos. La determinación de AMH se utiliza para la evaluación de la reserva ovárica, para la predicción de la respuesta a la estimulación ovárica controlada (COS), para identificar la morfología ovárica poliquística (PCOM) como ayuda en el diagnóstico del síndrome de ovario poliquístico (SOPQ) y como ayuda en el diagnóstico de diferencias de desarrollo sexual (DSD), junto con otros hallazgos clínicos y de laboratorio. Asimismo, la determinación de AMH (en pmol/L), en combinación con el peso corporal, sirve para establecer la dosis diaria individual de la hormona folículoestimulante humana recombinante (rFSH), folitropina delta (de acuerdo con las informaciones de prescripción actuales de Ferring) en las mujeres sometidas a un tratamiento de estimulación ovárica controlada para favorecer el crecimiento de múltiples folículos en un programa de reproducción asistida. El test ELECSYS AMH PLUS no se ha diseñado para la identificación de pacientes elegibles para el tratamiento con folitropina delta (diagnóstico no complementario).
Este inmunoensayo de electroquimioluminiscencia (electrochemiluminescence immunoassay) ”ECLIA” está previsto para el uso en inmunoanalizadores cobas e.
LIMITACIONES DEL ANÁLISIS - INTERFERENCIAS:
Se analizaron los efectos de las siguientes sustancias endógenas y los siguientes compuestos farmacéuticos sobre el funcionamiento del test sin que se hayan observado interferencias.
Sustancias endógenas:
|
Compuesto |
Concentración analizada |
|
Bilirrubina |
≤ 1129 μmol/L o ≤ 66 mg/dL |
|
Hemoglobina |
≤ 0.621 mmol/L o ≤ 1000 mg/dL |
|
Intralipid |
≤ 1000 mg/dL |
|
Biotina |
≤ 4912 nmol/L o ≤ 1200 ng/mL |
|
IgG |
≤ 2.5 g/dL |
|
IgA |
≤ 1.8 g/dL |
|
IgM |
≤ 0.5 g/dL |
Criterio: Desviación ≤ 10%.
No se han observado interferencias por factores reumatoides hasta una concentración de 1000 UI/mL.
No se ha registrado el efecto hook de alta dosis con concentraciones de AMH de hasta 9996 pmol/L (1400 ng/mL).
Se analizaron in vitro 20 fármacos de uso extendido. Sin encontrar interferencias con el presente ensayo hasta las concentraciones indicadas en la tabla siguiente.
|
Agente activo |
Concentración analizada mg/L |
|
Acetilcisteína |
1660 |
|
Ampicilina sódica |
1000 |
|
Ácido ascórbico |
300 |
|
Ciclosporina |
5 |
|
Cefoxitina |
2500 |
|
Heparina |
5000 U |
|
Levodopa |
20 |
|
Metildopa |
20 |
|
Metronidazol |
200 |
|
Fenilbutazona |
400 |
|
Doxiciclina |
50 |
|
Acetilsalicílico, ácido |
1000 |
|
Rifampicina |
60 |
|
Acetaminofén |
200 |
|
Ibuprofeno |
500 |
|
Teofilina |
100 |
|
Acetato de triptorelina |
0.1 |
|
Metformina |
2000 |
|
Ácido fólico |
0.4 |
|
Levotiroxina |
0.2 |
En casos aislados pueden presentarse interferencias por títulos extremadamente altos de anticuerpos dirigidos contra anticuerpos específicos del analito, la estreptavidina o el rutenio. Estos efectos se han minimizado gracias a un adecuado diseño del test.
Para el diagnóstico, los resultados del test siempre deben interpretarse teniendo en cuenta la anamnesis del paciente, la exploración clínica así como los resultados de otros exámenes.
SÍMBOLOS:
Roche Diagnostics utiliza los siguientes símbolos y signos adicionalmente a los indicados en la norma ISO 15223-1 (para los EE. UU.: consulte navifyportal.roche.com para la definición de los símbolos usados):
|
CONTENT |
Contenido del kit |
|
SYSTEM |
Analizadores/instrumentos adecuados para los reactivos |
|
REAGENT |
Reactivo |
|
CALIBRATOR |
Calibrador |
|
|
Volumen para reconstitución |
|
GTIN |
Número Global de Artículo Comercial |
|
Rx only |
Para los EE.UU.: atención: según la ley federal estadounidense, este producto puede ser vendido exclusivamente por facultativos o por prescripción médica. |
La barra del margen indica suplementos, eliminaciones o cambios.
© 2024, Roche Diagnostics
Roche Diagnostics GmbH
Sandhofer Strasse 116,
D-68305 Mannheim www.roche.com
+800 5505 6606
OBTENCIÓN Y PREPARACIÓN DE LAS MUESTRAS:
Sólo se ha analizado y considerado apto el tipo de muestras aquí indicado.
Suero y plasma tratado con heparina de litio recogidos en tubos estándar de muestra o tubos con gel separador.
No emplear plasma con EDTA.
Criterio: recuperación dentro de ± 30% del valor sérico ≥ 3.57 pmol/L (≥ 0.5 ng/mL); recuperación dentro de ± 1.43 pmol/L (± 0.2 ng/mL) del valor sérico < 3.57 pmol/L (< 0.5 ng/mL) y la pendiente de 0.9-1.1 + desviación a 7.14 pmol/L (1 ng/mL) y 25 pmol/L (3.5 ng/mL) ≤ 10% + coeficiente de correlación ≥ 0.95.
Estabilidad: 3 días a 20-25 °C, 5 días a 2-8 °C, 6 meses a -20 °C (± 5 °C). Congelar sólo una vez.
Los tipos de muestra aquí indicados fueron analizados con tubos de recogida de muestras seleccionados, comercializados en el momento de efectuar el análisis, lo cual significa que no fueron analizados todos los tubos de todos los fabricantes. Los sistemas de recogida de muestras de diversos fabricantes pueden contener diferentes materiales que, en ciertos casos, pueden llegar a afectar los resultados de los análisis. Si las muestras se procesan en tubos primarios (sistemas de recogida de muestras), seguir las instrucciones del fabricante de tubos.
Centrifugar las muestras que contienen precipitado antes de realizar el ensayo.
No emplear muestras inactivadas por calor.
No utilizar muestras ni controles estabilizados con azida.
Se debe garantizar una temperatura de 20-25 °C para la medición de muestras, calibradores y controles.
Para evitar posibles efectos de evaporación, determinar las muestras, los calibradores y los controles que se sitúan en los analizadores dentro de un lapso de 2 horas.
PREPARACIÓN DE LOS REACTIVOS:
Los reactivos incluidos en el kit están listos para el uso y forman una unidad inseparable.
La información necesaria para el correcto funcionamiento se introduce en el analizador a través de los códigos de barras de los reactivos.
COMPARACIÓN DE MÉTODOS:
a) Una comparación entre el ensayo ELECSYS AMH PLUS, ![]() 08818061190 (analizador cobas e 601; y) y el ensayo ELECSYS AMH PLUS,
08818061190 (analizador cobas e 601; y) y el ensayo ELECSYS AMH PLUS, ![]() 07957190190 (analizador cobas e 601; x) generó las siguientes correlaciones (ng/mL):
07957190190 (analizador cobas e 601; x) generó las siguientes correlaciones (ng/mL):
Número de muestras medidas: 198
|
Passing/Bablok40 |
Regresión lineal |
|
y = 0.974x – 0.031 |
y = 0.974x – 0.020 |
|
τ = 0.986 |
r = 0.999 |
Las concentraciones de las muestras se situaron entre 0.132 y 22.7 ng/mL.
b) Una comparación entre el ensayo ELECSYS AMH PLUS, ![]() 08818061190 (analizador cobas e 601; y) y el ensayo ELECSYS AMH PLUS,
08818061190 (analizador cobas e 601; y) y el ensayo ELECSYS AMH PLUS, ![]() 07957190190 (analizador cobas e 601; x) generó las siguientes correlaciones (en pmol/L):
07957190190 (analizador cobas e 601; x) generó las siguientes correlaciones (en pmol/L):
Número de muestras medidas: 198
|
Passing/Bablok40 |
Regresión lineal |
|
y = 0.974x – 0.224 |
y = 0.974x – 0.145 |
|
τ = 0.986 |
r = 0.999 |
Las concentraciones de las muestras se situaron entre 0.941 y 162 pmol/L.
ELECSYS AMH PLUS ![]() 10059516190 equivale a ELECSYS AMH PLUS
10059516190 equivale a ELECSYS AMH PLUS ![]() 08818061190 en composición de reactivos y proceso de fabricación.
08818061190 en composición de reactivos y proceso de fabricación.
DATOS ESPECÍFICOS DEL FUNCIONAMIENTO DEL TEST:
A continuación, se indican los datos representativos del funcionamiento de los analizadores. Los resultados de cada laboratorio en particular pueden diferir de estos valores.
PRINCIPIO DEL TEST:
Técnica sándwich con una duración total de 18 minutos.
• 1ª incubación: 50 μL de muestra, un anticuerpo monoclonal biotinilado anti-AMH y un anticuerpo monoclonal anti-AMH marcado con quelato de rutenioa) forman un complejo sándwich.
• 2.ª incubación: después de incorporar las micropartículas recubiertas de estreptavidina, el complejo formado se fija a la fase sólida por interacción entre la biotina y la estreptavidina.
• La mezcla de reacción es trasladada a la célula de medida donde, por magnetismo, las micropartículas se fijan a la superficie del electrodo. Los elementos no fijados se eliminan posteriormente con ProCell/ProCell M. Al aplicar una corriente eléctrica definida se produce una reacción quimioluminiscente cuya emisión de luz se mide con un fotomultiplicador.
• Los resultados se determinan mediante una curva de calibración generada específicamente para el instrumento a partir de una calibración a 2 puntos y una curva máster proporcionada por el código de barras del reactivo o el código de barras electrónico.
a) Quelato Tris (2,2’-bipiridina) rutenio(II) (Ru(bpy)![]()
REACTIVOS - SOLUCIONES DE TRABAJO:
El pack de reactivos está etiquetado como AMHP.
M Micropartículas recubiertas de estreptavidina (tapa transparente), 1 frasco, 6.5 mL:
Micropartículas recubiertas de estreptavidina: 0.72 mg/mL; conservante.
R1 Anticuerpo anti-AMH~biotina (tapa gris), 1 frasco, 8 mL:
Anticuerpo biotinilado monoclonal anti-AMH (ratón) 1.0 mg/L; tampón fosfato 50 mmol/L, pH 7.5; conservante.
R2 Anticuerpo anti-AMH~Ru(bpy)![]() (tapa negra), 1 frasco, 8 mL:
(tapa negra), 1 frasco, 8 mL:
Anticuerpo monoclonal anti-AMH (ratón) marcado con quelato de rutenio 1.0 mg/L; tampón fosfato 50 mmol/L, pH 7.5; conservante.
REALIZACIÓN DEL TEST:
Para garantizar el funcionamiento óptimo del test, observe las instrucciones de la presente metódica referentes al analizador empleado. Consulte el manual del operador apropiado para obtener las instrucciones de ensayo específicas del analizador.
Las micropartículas se mezclan automáticamente antes del uso. Los parámetros de test se introducen a través de los códigos de barras impresos en el reactivo. Pero si, excepcionalmente, el analizador no pudiera leer el código de barras, el código numérico de 15 cifras deberá introducirse manualmente.
Analizadores cobas e 601 y cobas e 602: Se necesita la solución PreClean M.
Antes del uso, atemperar los reactivos refrigerados a aproximadamente 20 °C y colocarlos en el rotor de reactivos (20 °C) del analizador. Evitar la formación de espuma. El analizador realiza automáticamente los procesos de atemperar, abrir y tapar los reactivos.
REFERENCIAS BIBLIOGRÁFICAS:
1 Wilson CA, di Clemente N, Ehrenfels C, et al. Mullerian inhibiting substance requires its N-terminal domain for maintenance of biological activity, a novel finding within the transforming growth factor-beta superfamily. Mol Endocrinol 1993;7(2):247-257.
2 di Clemente N, Jamin SP, Lugovskoy A, et al. Processing of anti- mullerian hormone regulates receptor activation by a mechanism distinct from TGF-beta. Mol Endocrinol 2010;24(11):2193-206.
3 Grinspon RP, Rey RA. Anti-müllerian hormone and sertoli cell function in paediatric male hypogonadism. Horm Res Paediatr 2010;73(2):81-92.
4 Broekmans FJ, Visser JA, Laven JS, et al. Anti-Müllerian hormone and ovarian dysfunction. Trends Endocrinol Metab 2008;19(9):340-347.
5 Visser JA, de Jong FH, Laven JS, et al. Anti-Müllerian hormone: a new marker for ovarian function. Reproduction 2006;131(1):1-9.
6 Visser JA, Schipper I, Laven JS, et al. Anti-Müllerian hormone: an ovarian reserve marker in primary ovarian insufficiency. Nat Rev Endocrinol 2012;8(6):331-341.
7 Kelsey TW, Anderson RA, Wright P, et al. Data-driven assessment of the human ovarian reserve. Mol Hum Reprod 2012;18(2):79-87.
8 Nelson SM, Iliodromiti S, Fleming R, et al. Reference range for the antimüllerian hormone Generation II assay: a population study of 10,984 women, with comparison to the established Diagnostics Systems Laboratory nomogram. Fertil Steril 2014;101(2):523-529.
9 Tsepelidis S, Devreker F, Demeestere I, et al. Stable serum levels of anti-Mullerian hormone during the menstrual cycle: a prospective study in normo-ovulatory women. Hum Reprod 2007;22:1837-1840.
10 van Disseldorp J, Lambalk CB, Kwee J, et al. Comparison of inter- and intra-cycle variability of anti-Mullerian hormone and antral follicle counts. Hum Reprod 2010;25(1):221-227.
11 Biniasch M, Laubender RP, Hund M, Buck K, De Geyter C. Intra- and inter-cycle variability of anti-Müllerian hormone (AMH) levels in healthy women during non-consecutive menstrual cycles: the BICYCLE study. Clin Chem Lab Med. 2021;60(4):597-605.
12 Kallio S, Puurunen J, Ruokonen A, et al. Antimüllerian hormone levels decrease in women using combined contraception independently of administration route. Fertil Steril 2013;99(5):1305-1310.
13 Nelson SM. Biomarkers of ovarian response: current and future applications. Fertil Steril 2013;99(4):963-969.
14 Anderson RA, Wallace WH. Antimüllerian hormone, the assessment of the ovarian reserve, and the reproductive outcome of the young patient with cancer. FertilSteril 2013;99(6):1469-1475.
15 Dewailly D, Andersen CY, Balen A, et al. The physiology and clinical utility of anti-Mullerian hormone in women. Hum Reprod Update 2014;20(3):370-385.
16 La Marca A, Sunkara SK. Individualization of controlled ovarian stimulation in IVF using ovarian reserve markers: from theory to practice. Hum Reprod Update 2014;20(1):124-140.
17 Dietz de Loos A, Hund M, Buck K, et al. Antimüllerian hormone to determine polycystic ovarian morphology. Fertil Steril 2021;116(4):1149-1157.
18 Josso N, Rey RA. What does AMH tell us in pediatric disorders of sex development? Front Endocrinol (Lausanne) 2020;11:619.
19 Rey RA, Grinspon RP, Gottlieb S, et al. Male hypogonadism: an extended classification based on a developmental, endocrine physiology-based approach. Andrology 2013;1(1):3-16.
20 Johannsen TH, Andersson AM, Ahmed S, et al. Peptide hormone analysis in diagnosis and treatment of Differences of Sex Development: joint position paper of EU COST Action ‘DSDnet’ and European Reference Network on Rare Endocrine Conditions. Eur J Endocrinol 2020;182(6):1-15.
21 La Marca A, Volpe A. The Anti-Mullerian hormone and ovarian cancer. Hum Reprod Update 2007;13(3):265-273.
22 Geerts I, Vergote I, Neven P, et al. The role of inhibins B and antimüllerian hormone for diagnosis and follow-up of granulosa cell tumors. Int J Gynecol Cancer 2009;19(5):847-855.
23 Xu HY, Zhang HX, Xiao Z, et al. Regulation of anti-Müllerian hormone (AMH) in males and the associations of serum AMH with the disorders of male fertility. Asian J Androl 2019;21(2):109-114.
24 Nelson SM, Davis SR, Kalantaridou S, et al. Anti-Müllerian hormone for the diagnosis and prediction of menopause: a systematic review. Hum Reprod Update 2023:dmac045.
25 Anckaert E, Öktem M, Thies A, et al. Multicenter analytical performance evaluation of a fully automated anti-Müllerian hormone assay and reference interval determination. Clin Biochem 2016;49(3):260-267.
26 Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod 2004;19(1):41-47.
27 Yates AP, Jopling HM, Burgoyne NJ, et al. Paediatric reference intervals for plasma anti-Muellerian hormone: comparison of data from the Roche Elecsys assay and the Beckman Coulter Access assay using the same cohort of samples. Annals of Clinical Biochemistry 2019;56(5):536-547.
28 Anderson RA, Anckaert E, Bosch E, et al. Prospective study into the value of the automated Elecsys antimüllerian hormone assay for the assessment of the ovarian growing follicle pool. Fertil Steril 2015;103(4):1074-1080.e4.
29 Ferraretti AP, La Marca A, Fauser BC, et al. ESHRE working group on Poor Ovarian Response Definition. ESHRE consensus on the definition of ‘poor response’ to ovarian stimulation for in vitro fertilization: the Bologna criteria. Hum Reprod 2011;26(7):1616-1624.
30 van Tilborg TC, Eijkemans MJ, Laven JS, et al. The OPTIMIST study: optimisation of cost effectiveness through individualised FSH stimulation dosages for IVF treatment. A randomised controlled trial. BMC Womens Health 2012;18;12:29.
31 Anckaert E, Denk B, He Y, et al. Evaluation of the Elecsys® anti- Müllerian hormone assay for the prediction of hyper-response to controlled ovarian stimulation with a gonadotrophin-releasing hormone antagonist protocol. Eur J Obstet Gynecol Reprod Biol 2019;236:133-138.
32 Nelson SM, Yates RW, Fleming R. Serum anti-Müllerian hormone and FSH: prediction of live birth and extremes of response in stimulated cycles--implications for individualization of therapy. Hum Reprod 2007;22(9):2414-21.
33 Arce JC, Andersen AN, Fernández-Sánchez M, et al. Ovarian response to recombinant human follicle-stimulating hormone: a randomized, antimüllerian hormone-stratified, dose-response trial in women undergoing in vitro fertilization/intracytoplasmic sperm injection. Fertil Steril 2014;102(6):1633-40.e5.
34 Bosch E, Labarta E, Zuzuarregui J, et al. Prediction of ovarian response using the automated Elecsys anti-Müllerian hormone assay in gonadotrophin-releasing hormone antagonist cycles. Reprod Biomed Online 2023;46(2):295-301.
35 Teede HJ, Tay CT, Laven JSE, et al. International PCOS Network. Recommendations from the 2023 International Evidence-based Guideline for the Assessment and Management of Polycystic Ovary Syndrome. J Clin Endocrinol Metab 2023;108(10):2447-2469. doi: 10.1210/clinem/dgad463.”
36 Olsson H, Sandström R, Grundemar L. Different pharmacokinetic and pharmacodynamic properties of recombinant follicle-stimulating hormone (rFSH) derived from a human cell line compared with rFSH from a non-human cell line. J Clin Pharmacol 2014;54(11):1299-307.
37 Bosch E, Nyboe Andersen A, Barri P, et al. Follicular and endocrine dose responses according to anti-Müllerian hormone levels in IVF patients treated with a novel human recombinant FSH (FE 999049). Clin Endocrinol (Oxf) 2015;83(6):902-12.
38 Andersen AN, Nelson SM, Fausce BC, et al. ESTHER-1 study group. Individualized versus conventional randomized, controlled, assessor- blinded, phase 3 noninferiority trial. Fertil Steril. 2017;107(2):387-396.e4.
39 Applicable prescribing information of follitropin delta; Ferring.
40 Bablok W, Passing H, Bender R, et al. A general regression procedure for method transformation. Application of linear regression procedures for method comparison studies in clinical chemistry, Part III. J Clin Chem Clin Biochem 1988 Nov;26(11):783-790.
Para más información acerca de los componentes, consultar el manual del usuario o el manual del operador del analizador, las hojas de aplicación y las metódicas correspondientes (disponibles en su país).
En la presente metódica se emplea como separador decimal un punto para distinguir la parte entera de la parte fraccionaria de un número decimal. No se utilizan separadores de millares.
Todo incidente grave que se haya producido en relación con el producto se comunicará al fabricante y a la autoridad competente del Estado Miembro en el que se encuentre el usuario y/o el paciente.
Para el resumen del informe de seguridad y funcionamiento, consulte: https://ec.europa.eu/tools/eudamed