
DYSPORT
ALBÚMINA, SOLUCIÓN DE, LACTOSA, TOXINA BOTULÍNICA TIPO A
Polvo
1 Caja,1 Vial(es),3 ml,500 U
1 Caja , 1 Vial(es) , 3 ml , 300 Unidades
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada vial con polvo liofilizado para reconstituir contiene:
|
Complejo hemaglutinina-toxina Clostridium botulinum tipo A |
300 U* |
500 U* |
|
Solución de albúmina 20% |
125.0 mcg |
125.0 mcg |
|
Lactosa |
2.5 mg |
2.5 mg |
*Una unidad se define como la Dosis Letal Media (DL50) intraperitoneal en el ratón.
INDICACIONES TERAPÉUTICAS:
Indicado en el tratamiento de: La espasticidad del pie equino dinámico en niños con parálisis cerebral de dos años de edad y mayores; la tortícolis espasmódica; el blefarospasmo; el espasmo hemifacial; la espasticidad focalizada en brazo secundaria a accidente vascular cerebral (AVXC o ICTUS) en conjunto con fisioterapia; las líneas de expresión moderadas a severas; la hiperhidrosis axilar.
No se ha demostrado la seguridad ni la eficacia de la toxina botulínica tipo A en el tratamiento de: Tortícolis espasmódica, blefarospasmo, espasmo hemifacial, espasticidad del brazo e hiperhidrosis axilar en niños.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacodinámicas:
Grupo farmacológico: Otros relajantes musculares, agentes de acción periférica.
Código ATC: M03AX01
La toxina botulínica tipo A DYSPORT® es un complejo hemaglutinina toxina que bloquea la transmisión colinérgica periférica en la unión neuromuscular, por una acción presináptica en un sitio próximo al de la liberación de acetilcolina. La toxina actúa dentro de la terminación nerviosa antagonizando los eventos activados por el calcio, los cuales culminan en la liberación del transmisor. El mecanismo de acción de DYSPORT® no afecta la transmisión colinérgica postganglionar ni la transmisión simpática postganglionar.
La acción de la toxina implica una primera etapa en la que la toxina se une rápida y ávidamente a la membrana del nervio presináptico. A continuación, ocurre una segunda etapa denominada de internación, durante la cual la toxina cruza la membrana presináptica, sin que se inicie la parálisis. Finalmente, la toxina inhibe la liberación de acetilcolina al interrumpir su mecanismo de liberación mediado por el calcio, disminuyendo en consecuencia el potencial de acción de la placa neuromuscular y causando la parálisis. La recuperación de la transmisión del impulso tiene lugar gradualmente, a medida que brotan nuevas terminaciones nerviosas y se establece nuevamente el contacto con la placa motora postsináptica, proceso que tarda de 6 a 8 semanas en los animales de experimentación.
Se investigaron dosis alternativas de DYSPORT® para el tratamiento de blefarospasmo durante un ciclo de tratamiento en un estudio clínico. Se midió la eficacia por medio de las medianas de las diferencias en los valores del Porcentaje de Actividad Normal (PAN) (derivado de la escala de discapacidad por blefarospasmo) entre cada grupo de tratamiento y placebo. Al incrementar la dosis de DYSPORT®, fue evidente una mejoría dosis-dependiente en el blefarospasmo, siendo superior en todos los grupos de tratamiento en comparación con placebo.
|
Visita |
DYSPORT® 40 U (N=30) |
DYSPORT® 80 U (N=31) |
DYSPORT® 120 U (N=31) |
|
Semana 4: Diferencia entre la mediana de los cambios en los valores del PAN desde la basal del grupo activo vs. la basal del grupo placebo. |
31.2% |
41.3% |
48.5% |
|
Semana 8: Diferencia entre la mediana de los cambios en los valores del PAN desde la basal del grupo activo vs. la basal del grupo placebo. |
36.0% |
48.3% |
55.0% |
|
Semana 12: Diferencia entre la mediana de los cambios en los valores del PAN desde la basal del grupo activo vs. la basal del grupo placebo. |
36.0% |
36.3% |
50.0% |
|
Semana 16: Diferencia entre la mediana de los cambios en los valores del PAN desde la basal del grupo activo vs. la basal del grupo placebo. |
10.5% [a] |
24.2% |
31.3% |
[a] p > 0.001.
[b] PAN: Porcentaje de Actividad Normal.
Para los grupos tratados con DYSPORT® con 40 U, 80 U y 120 U, las medianas de los cambios versus los valores basales del PAN fueron estadística y significativamente mayores, en comparación con aquellos del grupo placebo, en las semanas 4, 8 y 12.
En la semana 16, se observó una diferencia estadísticamente significativa en los grupos tratados con DYSPORT® 80 U y 120 U, en comparación con el grupo placebo, indicando una duración mayor de la respuesta con dosis de 80 U y de 120 U.
La incidencia de Eventos Adversos Emergentes del Tratamiento (EAETs) relacionados, específicamente ptosis, fue mayor en el grupo tratado con DYSPORT® en comparación con el grupo tratado con placebo, fue dosis-dependiente, es decir, con dosis más altas de DYSPORT® se observó una mayor incidencia. Ver la tabla a continuación.
|
Estadística |
Placebo (N=26) |
DYSPORT® 40 U (N=31) |
DYSPORT® 80 U (N=31) |
DYSPORT® 120 U (N=31) |
|
|
Pacientes con EAETs relacionados |
n (%) |
3 (12) |
19 (61) |
23 (74) |
26 (84) |
|
Pacientes con EAETS oculares relacionados |
n (%) |
3 (12) |
16 (52) |
23 (74) |
26 (84) |
Propiedades farmacocinéticas:
Los estudios farmacocinéticos con toxina botulínica plantean problemas en el modelo con animales debido a la alta potencia, las muy pequeñas dosis implicadas, el elevado peso molecular del compuesto, la dificultad de realizar un marcado apropiado de la toxina y con ello exponer una actividad específica suficientemente alta.
Estudios realizados con toxina marcada con I125 han mostrado que la unión al receptor es específica y saturable; además, la alta densidad de los receptores a la toxina es un factor que contribuye a su elevada potencia.
En estudios en monos sobre la respuesta a dosis y tiempo, mostró que a dosis bajas hubo un retraso de 2-3 días con un efecto máximo pico a los 5-6 días después de la inyección. La duración de la acción, medida por la variación de la alineación ocular y la parálisis muscular, variaba entre 2 semanas y 8 meses. Este patrón también se observa en el hombre y se atribuye al proceso de unión, internalización y a los cambios en la unión neuromuscular.
Información de seguridad pre-clínica:
En los estudios de toxicidad reproductiva realizados en ratas y conejas gestantes, a las que se les administró toxina botulínica tipo A (complejo hemaglutinina-toxina Clostridium botulinum) mediante la inyección intramuscular diaria, en dosis de 6.6 U/kg (79 U/kg de dosis total acumulada) y 3.0 U/kg (42 U/kg dosis total acumulada) en ratas y conejos respectivamente, no produjeron toxicidad en el embrión o el feto. En ambas especies se observaron pérdidas de implantación a dosis más altas que las dosis tóxicas para la madre.
La toxina botulínica tipo A (complejo hemaglutinina-toxina Clostridium botulinum) no demostró actividad teratogénica ni en ratas ni en conejos y no se observaron efectos en el estudio pre y postnatal en la generación F1 en ratas. La fertilidad de las ratas macho y hembra se vio disminuida debido a la reducción en el apareamiento, secundaria a parálisis muscular en machos a dosis de 29.4 U/kg por semana y al aumento en las pérdidas en la implantación en hembras con dosis de 20 U/kg por semana.
Un estudio de toxicidad crónica realizado en ratas con dosis de hasta 12 U/animal, no mostró ningún indicio de toxicidad sistémica. Los efectos de toxicidad crónica en los estudios pre-clínicos se limitaron a cambios en los músculos inyectados, esto está relacionado con el mecanismo de acción de la toxina botulínica tipo A (complejo hemaglutinina-toxina Clostridium botulinum). En conejos no hubo ninguna irritación ocular, posterior a la administración intraocular de toxina botulínica tipo A (complejo hemaglutinina-toxina Clostridium botulinum).
CONTRAINDICACIONES: DYSPORT® está contraindicado durante el embarazo y la lactancia, en Miastenia gravis y síndrome de Eaton-Lambert, así como en los pacientes que presenten hipersensibilidad a alguno de los componentes de la fórmula.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: Se debe tener precaución cuando se prescribe a mujeres embarazadas.
Existe información limitada acerca del uso de toxina botulínica tipo A (complejo hemaglutinina- toxina Clostridium botulinum) en mujeres embarazadas. Estudios en animales han demostrado toxicidad reproductiva a las dosis elevadas que causan toxicidad materna (véase Información de seguridad pre-Clínica).
Lactancia: Se desconoce si el complejo hemaglutinina-toxina Clostridium botulinum tipo A se excreta en leche materna. La excreción del complejo hemaglutinina-toxina Clostridium botulinum tipo A en leche no ha sido estudiada en animales. No se puede recomendar la utilización del complejo hemaglutinina-toxina Clostridium botulinum tipo A durante la lactancia.
REACCIONES SECUNDARIAS Y ADVERSAS:
Eventos adversos:
Muy común > 1/10; Común > 1/100, < 1/10; Poco común > 1,1000, < 1/100; Raro > 1/10,000, < 1/1,000; Muy raro <1/10,000.
Se han reportado efectos secundarios relaciones con la difusión de la toxina en sitios alejados de donde ha sido administrada, en algunos de estos casos se reporta disfagia, neumonía y/o debilidad muscular significativa que finalizó con muerte en muy raras ocasiones (véase Precauciones generales).
General:
En el programa de estudios clínicos, aproximadamente 28% de los pacientes tratados con DYSPORT® experimentaron un efecto adverso. Las siguientes reacciones adversas fueron observadas en pacientes tratados por una variedad de indicaciones, incluyendo blefarospasmo, espasmo hemifacial, tortícolis, espasticidad asociada a parálisis cerebral infantil o secundaria a un accidente vascular cerebral.
Trastornos del sistema nervioso:
Raro: amiotrofia neurálgica.
Trastornos de la piel y tejido subcutáneo:
Poco común: prurito.
Raro: erupciones cutáneas.
Trastornos generales y condiciones asociadas al sitio de administración:
Común: debilidad generalizada, fatiga, cuadro gripal, dolor/contusión en el sitio de aplicación de la inyección.
Adicionalmente, se reportaron reacciones adversas específicas a indicaciones individuales:
Espasticidad del brazo:
Trastornos gastrointestinales:
Común: disfagia.
Trastornos del sistema músculo-esquelético y tejido conjuntivo:
Común: debilidad muscular en el brazo.
Lesión, intoxicación o complicaciones por el procedimiento:
Común: caídas/lesiones accidentales.
Espasticidad asociada a parálisis cerebral infantil:
Trastornos gastrointestinales:
Común: diarrea.
Trastornos del sistema músculo-esquelético y tejido conjuntivo:
Común: debilidad muscular en la pierna, dolor muscular.
Trastornos renales y urinarios:
Común: incontinencia urinaria.
Trastornos generales y condiciones asociadas al sitio de administración:
Común: trastornos de la marcha.
Lesión, intoxicación o complicaciones por el procedimiento:
Común: lesiones accidentales debido a caídas.
Las lesiones accidentales por caídas y los trastornos de la marcha pueden haberse dado debido al sobre-debilitamiento de los músculos blanco y/o la difusión local de DYSPORT® a otros músculos involucrados en la deambulación y el equilibrio.
Tortícolis espasmódica:
Trastornos del sistema nervioso:
Común: cefalea, mareo, parálisis facial.
Trastornos oculares:
Común: visión borrosa, disminución de la agudeza visual.
Trastornos respiratorios, torácicos y mediastinales:
Común: disfonía, disnea.
Rara: aspiración.
Trastornos gastrointestinales:
Muy común: disfagia, boca seca.
Trastornos del sistema músculo-esquelético y tejido conjuntivo:
Muy común: debilidad muscular.
Común: dolor en el cuello, dolor músculo-esquelético, mialgia, dolor en extremidades, rigidez músculo-esquelética.
Poco común: atrofia muscular, trastorno mandibular.
La disfagia resultó ser un evento dosis-dependiente que ocurrió con mayor frecuencia seguido de la inyección al músculo esternocleidomastoideo. Una dieta blanda puede requerirse hasta que los síntomas desaparezcan.
Blefarospasmo y espasmo hemifacial:
Trastornos del sistema nervioso:
Común: debilidad de los músculos faciales.
Poco común: parálisis facial.
Trastornos oculares:
Muy común: ptosis.
Común: diplopía, ojo seco, lagrimeo.
Raro: oftalmoplejía.
Trastornos de la piel y tejido subcutáneo:
Común: edema palpebral.
Raro: entropión.
Los efectos adversos pueden ocurrir debido a inyecciones de DYSPORT® profundas o en lugares incorrectos, paralizando temporalmente otros grupos musculares próximos.
Hiperhidrosis axilar:
Los siguientes efectos adversos fueron observados en pacientes tratados con DYSPORT® por hiperhidrosis.
Trastornos de la piel y tejido subcutáneo:
Común: sudoración compensatoria.
Arrugas glabelares moderadas a severas:
Los siguientes efectos adversos fueron observados en pacientes a los que se administró DYSPORT® para el mejoramiento temporal en la apariencia por arrugas glabelares moderadas a severas.
Trastornos oculares:
Común: astenopía, ptosis, edema palpebral, lagrimeo aumentado, ojo seco, contracciones musculares.
Poco común: visión borrosa, diplopía, alteraciones visuales, trastornos en los movimientos oculares.
Trastornos generales y condiciones asociadas al sitio de administración:
Muy común: reacciones en el sitio de inyección (incluyendo dolor, contusiones, prurito, parestesia, eritema, erupciones). Nota: estos eventos también fueron observados en el grupo placebo.
Trastornos del sistema inmune:
Poco común: hipersensibilidad.
Trastornos del sistema músculo-esquelético y tejido conjuntivo:
Común: debilidad de los músculos adyacentes al sitio de inyección. Esto comúnmente puede llevar a ptosis palpebral, astenopía o menos comúnmente a parálisis de los músculos faciales o alteraciones visuales.
Trastornos del sistema nervioso:
Muy común: cefalea.
Común: parálisis facial.
Trastornos de la piel y tejido subcutáneo:
Poco común: erupciones cutáneas.
Experiencia post-comercialización: El perfil de reacciones adversas que se reportó a la compañía durante el uso post-mercadotecnia refleja la farmacología del producto y aquellas observadas durante los ensayos clínicos. Ha habido reacciones de hipersensibilidad esporádicas reportadas.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: No se han efectuado estudios de teratogenicidad ni otros estudios reproductivos con DYSPORT® (toxina botulínica tipo A) en humanos.
En el modelo con animales gestantes, ratas y conejas, se ha descrito algunos hallazgos (véase Información de seguridad preclínica).
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacción con otros medicamentos y otras formas de interacción: Los efectos de la toxina botulínica pueden ser potenciados por medicamentos que interfieren tanto directa como indirectamente con la función neuromuscular (por ejemplo: aminoglucósidos o bloqueadores no despolarizantes similares al curare), por lo que dichos medicamentos deben usarse con precaución en pacientes bajo tratamiento con toxina botulínica.
Efectos sobre la capacidad de conducir o utilizar maquinaria: Existe un riesgo potencial de debilidad muscular o alteraciones visuales las cuales, en caso de presentarse, pueden alterar temporalmente la capacidad para conducir u operar maquinaria.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: No se han comunicado alteraciones de importancia clínica.
PRECAUCIONES GENERALES:
Los eventos adversos relacionados a la diseminación distante de la toxina desde el sitio de administración, han sido reportados (véase Reacciones secundarias y adversas) lo cual, en algunos casos, fue asociado con disfagia, neumonía y/o resultó en debilidad muscular significativa, que resultó, muy rara vez, en muerte. Los pacientes tratados con dosis terapéuticas quizá presenten debilidad muscular excesiva. El riesgo de que ocurran esos efectos indeseables puede ser reducido si se utiliza la menor dosis efectiva posible, además de no exceder la dosis máxima recomendada.
DYSPORT® sólo debe ser utilizado con precaución y bajo estrecha supervisión médica en pacientes con evidencia clínica o subclínica de déficit en la transmisión neuromuscular (por ejemplo: Miastenia gravis). Esos pacientes quizá tienen mayor riesgo de hipersensibilidad a agentes como DYSPORT® lo que puede resultar en excesiva debilidad muscular a dosis terapéuticas. Los pacientes con alteraciones neurológicas subyacentes están en mayor riesgo de tener eventos adversos.
Muy raros casos de muerte, ocasionalmente en el contexto de disfagia, neumopatía y/o en pacientes con astenia significante, han sido reportados después del tratamiento con toxina botulínica tipo A o B. Pacientes con alteraciones que resultan en la transmisión neuromuscular defectuosa, dificultad para deglutir o respirar, están en mayor riesgo de experimentar esos efectos. En esos pacientes, el tratamiento debe ser administrado bajo control de un especialista y sólo si el beneficio del tratamiento es mayor que el riesgo.
DYSPORT® debe ser administrado con precaución a pacientes con problemas previos para deglutir o respirar, debido a que éstos pueden empeorar después de que el efecto de la toxina se ha distribuido en los músculos que son relevantes en el caso de estas alteraciones. Síndrome por aspiración ha ocurrido en raros casos, y cuando se tratan pacientes quienes tienen una enfermedad respiratoria crónica esto es un riesgo.
La posología recomendada y la frecuencia de administración para DYSPORT® no debe ser excedida (véase Dosis y vía de administración).
Los pacientes y sus cuidadores deben ser advertidos de la necesidad de conseguir tratamiento médico en caso de problemas para deglutir, hablar o respirar.
En el tratamiento de espasticidad asociada a parálisis cerebral en población pediátrica, DYSPORT® sólo debe utilizarse en niños de dos años de edad y mayores.
DYSPORT® no debe ser utilizado para tratar espasticidad en pacientes que han desarrollado una contractura fija.
Como con cualquier otra inyección intramuscular, DYSPORT® sólo debe utilizarse cuando sea estrictamente necesario en pacientes con tiempos de coagulación prolongados o con presencia de infección y/o inflamación en el sitio propuesto donde se administrará el medicamento.
DYSPORT® debe ser usado para tratar a un paciente, durante una sola sesión. Se deben tomar precauciones especiales durante la preparación y administración del producto (véase Dosis y vía de administración) y para la inactivación y desecho de cualquier solución reconstituida sin utilizar (véase Recomendaciones sobre almacenamiento).
Este producto contiene una pequeña cantidad de albúmina humana. El riesgo de transmisión de una infección viral no puede excluirse con certeza absoluta, cuando se utiliza sangre humana o alguno de sus componentes.
Rara vez se ha observado la formación de anticuerpos hacia toxina botulínica en pacientes que se encuentran bajo tratamiento con DYSPORT®. Clínicamente, un deterioro sustancial en la respuesta al tratamiento y/o la necesidad constante de usar dosis mayores pueden orientar hacia la presencia de anticuerpos neutralizantes.
Antes de administrarse, debe darse una cuidadosa consideración a aquellos pacientes que previamente hayan padecido una reacción alérgica a algún producto que contenga toxina botulínica tipo A. Debe evaluarse el beneficio del tratamiento frente al riesgo de provocar una nueva reacción alérgica.
DOSIS Y VÍA DE ADMINISTRACIÓN: Las unidades de DYSPORT® son específicas de esta formulación y no son intercambiables con otras formulaciones de toxina botulínica.
Entrenamiento: DYSPORT® sólo debe ser administrado por médicos apropiadamente entrenados.
Ipsen puede facilitar el entrenamiento en la administración de DYSPORT®.
Método de administración: Para reconstituir el producto se debe retirar la cubierta central del casquillo de aluminio, la parte central del tapón de goma que queda expuesta, debe limpiarse con alcohol inmediatamente antes de perforar el diafragma, se debe utilizar una aguja estéril de calibre 23 o 25.
Espasticidad del brazo:
Posología:
La dosis recomendada es de 1,000 U, distribuida entre los siguientes cinco músculos:
|
Bíceps braquial (BB) |
Flexor común profundo de los dedos (FCP) |
Flexor común superficial de los dedos (FCS) |
Flexor cubital anterior (FCA) |
Flexor palmar mayor (FPM) |
Dosis total |
|
300-400 U (0.6-0.8 ml) |
150 U (0.3 ml) |
150-250 U (0.3-0.5 ml) |
150 U (0.3 ml) |
150 U (0.3 ml) |
1,000 U (2.0 ml) |
Los sitios de inyección serán guiados por la localización estándar utilizada para electromiografía, aunque el sitio exacto de la inyección será determinado mediante palpación. Todos los músculos excepto el bíceps braquial (BB) deben ser inyectados en un sitio único, mientras que el bíceps se inyectará en dos sitios. La dosis máxima administrada no debe exceder a 1,000 U.
La dosis de inicio deberá ser disminuida si hay evidencia que sugiera que esta dosis pueda terminar en un debilitamiento excesivo de los músculos blanco, como en el caso de los pacientes cuyos músculos blanco sean pequeños, donde el músculo BB no debe ser inyectado o para pacientes que requieran inyecciones concomitantes en otros grupos de músculos. La mejoría clínica debe esperarse dentro de las 2 semanas posteriores a la inyección. Las inyecciones podrán ser repetidas aproximadamente cada 16 semanas o con la frecuencia necesaria para mantener una respuesta adecuada, pero nunca en un intervalo menor de 12 semanas.
Niños: La seguridad y eficacia de DYSPORT® no ha sido demostrada en el tratamiento de espasticidad en brazo, secundaria a accidente vascular cerebral en niños.
Método de administración:
En los casos de espasticidad en brazo:
La reconstitución de DYSPORT® 300 U se realiza con 0.6 ml de cloruro de sodio (sin conservadores) al 0.9% para obtener una solución que contiene 500 U/ml de toxina botulínica tipo A.
La reconstitución de DYSPORT® 500 U se realiza con 1.0 ml de cloruro de sodio (sin conservadores) al 0.9% para obtener una solución que contiene 500 U/ml de toxina botulínica tipo A.
En los casos de espasticidad en brazo, DYSPORT® se administrará por inyección intramuscular en los cinco músculos citados en la tabla de Posología antes señalada.
Espasticidad asociada a parálisis cerebral infantil:
Posología: La dosis inicial recomendada es de 20 U/kg de peso corporal, administrada en dosis dividida en cada uno de los músculos de la pantorrilla. Si solamente está afectada una pantorrilla se administra una dosis de 10 U/kg de peso corporal. Se debe considerar la reducción de la dosis inicial en caso de existir evidencia que sugiera que esta dosis pueda resultar en debilidad excesiva de los músculos blanco, como en el caso de los pacientes cuyos músculos blanco son pequeños o para pacientes quienes requieren inyecciones concomitantes en otro grupo de músculos. Después de evaluar la respuesta a la dosis inicial, el tratamiento subsecuente podrá ser titulado dentro de un rango de 10 U/kg y 30 U/kg, dividida en las dos piernas. La máxima dosis administrada no debe exceder 30 U/kg o 1,000 U/paciente, administrándose la que sea menor.
La administración de las inyecciones deberá ser dirigida inicialmente al músculo gastrocnemio, aunque también se debe considerar la administración de las inyecciones al sóleo o al tibial posterior.
El uso de electromiografía (EMG) no es una práctica clínica habitual, pero puede facilitar la identificación de los músculos más activos.
La mejoría clínica generalmente se produce durante las dos semanas siguientes a la inyección. Las inyecciones podrán repetirse aproximadamente cada 16 semanas o con la frecuencia necesaria para mantener la respuesta, pero no en un tiempo menor a las 12 semanas.
Método de administración:
La reconstitución de DYSPORT® 300 U se realiza con 0.6 ml de cloruro de sodio (sin conservadores) al 0.9% para obtener una solución que contiene 500 U/ml de toxina botulínica tipo A.
La reconstitución de DYSPORT® 500 U se realiza con 1.0 ml de cloruro de sodio (sin conservadores) al 0.9% para obtener una solución que contiene 500 U/ml de toxina botulínica tipo A.
DYSPORT® se administrará por inyección intramuscular en los músculos de la pantorrilla, como se ha citado al inicio de esta sección de Posología.
Tortícolis espasmódica:
Posología: Las dosis recomendadas se aplican a los adultos de todas las edades, siempre y cuando se trate de personas de peso corriente y sin evidencia de reducción de la masa muscular del cuello. Es recomendable aplicar una dosis menor en pacientes con un peso claramente menor de lo esperado o en personas ancianas, en las que puede encontrarse una masa muscular reducida.
La dosis inicial recomendada para el tratamiento de la tortícolis espasmódica es de 500 U, administrada como dosis dividida en los dos o tres músculos más activos del cuello.
• En el caso de la tortícolis rotatoria, se deben distribuir las 500 U, administrando 350 U en el músculo esplenio de la cabeza ipsilateral a la dirección de la rotación mentón/cabeza y 150 U en el esternocleidomastoideo, contralateral a la rotación.
• En el caso de laterocolis, se deben distribuir las 500 U, administrando 350 U en el músculo esplenio de la cabeza ipsilateral y 150 U en el músculo esternocleidomastoideo ipsilateral. En aquellos asociados a elevación del hombro, también pueden necesitar tratamiento los músculos trapezoide ipsilateral o el elevador de la escápula, de acuerdo con la hipertrofia visible del músculo o a los hallazgos de la electromiografía (EMG). Cuando sea necesario inyectar tres músculos, distribuir las 500 U de la siguiente forma: 300 U en el esplenio de la cabeza, 100 U en el esternocleidomastoideo y 100 U en el tercer músculo.
• En el caso de retrocolis, distribuir las 500 U, administrando 250 U en cada uno de los músculos esplenios de la cabeza. La inyección bilateral en el esplenio puede aumentar el riesgo de debilidad muscular en cuello.
• Todas las otras formas de tortícolis dependen del conocimiento del especialista y de los hallazgos de la EMG para identificar y tratar los músculos más activos. Es recomendable utilizar la EMG para el diagnóstico de todas las formas complejas de tortícolis, para la reevaluación de la administración no exitosa en los casos complejos y para guiar la administración de las inyecciones en los músculos profundos o en el caso de pacientes con sobrepeso cuyos músculos del cuello sean difíciles de palpar.
En la administración subsecuente, la dosis podrá ser ajustada de acuerdo a la respuesta clínica y los eventos adversos observados. Se recomiendan dosis dentro de un rango de 250-1,000 U, aunque las dosis más altas pueden acompañarse por un aumento en los eventos adversos, particularmente disfagia. La dosis máxima administrada no debe exceder 1,000 U.
El alivio de la tortícolis puede esperarse en la semana siguiente a la administración.
Las inyecciones podrán repetirse aproximadamente cada 16 semanas o con la frecuencia necesaria para mantener una respuesta adecuada, pero no en un tiempo menor a las 12 semanas.
Niños: No se ha demostrado la seguridad ni la eficacia de DYSPORT® en el tratamiento de la tortícolis espasmódica en niños.
Método de administración: La reconstitución de DYSPORT® 300 U se realiza con 0.6 ml de cloruro de sodio (sin conservadores) al 0.9% para obtener una solución que contiene 500 U/ml de toxina botulínica tipo A.
La reconstitución de DYSPORT® 500 U se realiza con 1.0 ml de cloruro de sodio (sin conservadores) al 0.9% para obtener una solución que contiene 500 U/ml de toxina botulínica tipo A.
En los casos de tortícolis espasmódica, DYSPORT® se administrará por inyección intramuscular en los músculos citados al inicio de esta sección de Posología.
Blefarospasmo y espasmo hemifacial:
Posología: En un estudio clínico de búsqueda de rango de dosis en el uso de DYSPORT® para el tratamiento de blefarospasmo esencial benigno (BEB), una dosis de 40 U por ojo fue significativamente efectiva.
Dosis de 80 U y 120 U por ojo resultaron en una mayor duración del efecto. Sin embargo, la incidencia de eventos adversos locales, específicamente ptosis, fue dosis-dependiente. En el tratamiento de blefarospasmo y espasmo hemifacial, la dosis máxima utilizada no debe exceder una dosis total de 120 U por ojo.
Debe aplicarse una inyección de 10 U (0.05 ml) medialmente (1) y 10 U (0.05) lateralmente en la unión entre las partes preseptal (2) y orbital de los músculos orbiculares superior (3 y 4) e inferior (5 y 6) de cada ojo. Se debe evitar aplicar la inyección cerca del elevador del párpado superior con la finalidad de reducir el riesgo de ptosis.
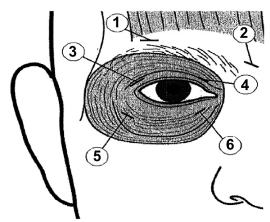
Para la inyección en el párpado superior, la aguja no debe estar dirigida hacia el centro, para evitar al músculo elevador. Se anexa un esquema para facilitar la localización de los sitios para las aplicaciones. El alivio de los síntomas se inicia entre dos y cuatro días después de la aplicación y su efecto máximo se obtiene al cabo de dos semanas.
Las inyecciones deben repetirse aproximadamente cada 12 semanas o de acuerdo a los requerimientos del paciente para evitar la recurrencia de los síntomas, pero no en un tiempo menor a 12 semanas. En caso de que la respuesta inicial al tratamiento se considere insuficiente, en las administraciones subsecuentes, la dosis por cada ojo quizá necesite ser incrementada a 60 U: 10 U (0.05 ml) medialmente y 20 U (0.1 ml) lateralmente, 80 U: 20 U (0.1 ml) medialmente y 40 U (0.2 ml) lateralmente por encima y debajo de cada ojo, con la técnica previamente descrita. Se podrán inyectar sitios adicionales en el músculo frontal por encima de la ceja (1 y 2) en caso de que los espasmos en este sitio interfieran con la visión.
En casos de blefarospasmo unilateral las inyecciones deben limitarse al ojo afectado. Los pacientes con espasmo hemifacial deben tratarse como blefarospasmo unilateral. Las dosis recomendadas son aplicables a adultos de todas las edades, incluyendo personas de edad avanzada.
Niños: No se ha demostrado la seguridad ni la eficacia de DYSPORT® en el tratamiento del blefarospasmo y del espasmo hemifacial en niños.
Método de administración: La reconstitución de DYSPORT® 300 U se realiza con 1.5 ml de cloruro de sodio al 0.9% (sin conservadores) para obtener una solución que contiene 200 U/ml de toxina botulínica tipo A.
La reconstitución de DYSPORT® 500 U se realiza con 2.50 ml de cloruro de sodio al 0.9% (sin conservadores) para obtener una solución que contiene 200 U/ml de toxina botulínica tipo A.
Debe administrarse por inyección subcutánea medial y lateralmente en la unión de las partes preseptal y orbital de ambos músculos orbiculares del ojo, superior e inferior.
Hiperhidrosis axilar:
Posología: La dosis inicial recomendada es de 100 U por axila. Si el efecto deseado no se obtiene, se puede aumentar a 200 U por axila en las inyecciones subsecuentes. El área que será inyectada debe ser determinada previamente usando el test de Yodo-Almidón. Ambas axilas deben ser lavadas exhaustivamente y desinfectadas. Se administra por inyección intradérmica en 10 puntos de 10 U cada una, en total 100 U por axila. En la mayoría de los casos la dosis descrita proporciona una supresión de la secreción de sudor por aproximadamente 48 semanas. El tiempo adecuado para una aplicación subsecuente es determinado en base a las características individuales de cada paciente. Los estudios a largo plazo con dosis de repetición muestran un efecto acumulativo, así que el tiempo para cada tratamiento debe ser determinado en forma individual para cada paciente.
Niños: No se ha demostrado la seguridad ni la eficacia de DYSPORT® en el tratamiento de la hiperhidrosis axilar en niños.
Método de administración: La reconstitución de DYSPORT® 300 U se realiza con 1.5 ml de cloruro de sodio al 0.9% (sin conservadores) para obtener una solución que contiene 200 U/ml de toxina botulínica tipo A.
La reconstitución de DYSPORT® 500 U se realiza con 2.50 ml de cloruro de sodio al 0.9% (sin conservadores) para obtener una solución que contiene 200 U/ml de toxina botulínica tipo A.
En los casos de hiperhidrosis axilar, DYSPORT® se administra por inyección intradérmica en diez sitios.
Líneas de expresión moderadas a severas:
Posología: Antes de la aplicación en líneas de expresión, se debe eliminar todo maquillaje y desinfectar la piel con antiséptico local. Las marcas anatómicas pueden ser identificadas con mayor facilidad si se observan y palpan con el área a aplicar fruncida. Se deben aplicar inyecciones intramusculares en ángulo recto con la piel, utilizando una aguja estéril del número 29 o 30.
La dosis recomendada es de 50 U (0.25 ml), distribuida en cinco sitios de inyección, 10 U (0.05 ml) se han de administrar intramuscularmente en cada uno de los cinco sitios: 2 inyecciones en cada músculo corrugador y una en el músculo prócer cercano al ángulo nasofrontal, como se muestra en el siguiente esquema:
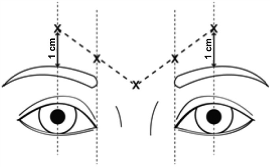
Con el fin de reducir el riesgo de presentar ptosis como evento adverso, se deben evitar las inyecciones cerca del músculo elevador del párpado superior, particularmente en pacientes con complejos ceja-depresor grande (depresor superciliar).
El intervalo de tratamiento depende de la respuesta individual de cada paciente durante las siguientes evaluaciones. La duración de eficacia es en promedio de 16 semanas; si fuese necesario aplicar antes de ese tiempo, el intervalo de tiempo no deberá ser menor a una aplicación por cada tres meses.
Niños: No se recomienda usar el producto para la mejoría temporal de arrugas glabelares moderadas a severas en pacientes menores de 18 años de edad.
Método de administración: En el caso de líneas de expresión moderadas a severas.
La reconstitución de DYSPORT® 300 U se realiza con 1.5 ml de cloruro de sodio al 0.9% (sin conservadores) para obtener una solución que contiene 200 U/ml de toxina botulínica tipo A.
La reconstitución de DYSPORT® 500 U se realiza con 2.50 ml de cloruro de sodio al 0.9% (sin conservadores) para obtener una solución que contiene 200 U/ml de toxina botulínica tipo A.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: El exceso de dosis puede producir una parálisis neuromuscular distante y profunda.
La sobredosis puede llevar a un incremento en el riesgo de que la neurotoxina ingrese al torrente sanguíneo y quizá cause complicaciones asociadas con los efectos de envenenamiento vía oral por toxina botulínica (por ejemplo: disfagia y disfonía). En aquellos casos en que un exceso de dosis cause la parálisis de los músculos respiratorios puede ser necesaria la respiración asistida. No existe un antídoto específico, no hay efectos benéficos de ninguna antitoxina y se recomiendan cuidados especiales. En caso de una sobredosis el paciente debe ser monitorizado por personal médico en busca de signos y/o síntomas de debilidad muscular significativa o parálisis muscular. Debe administrarse tratamiento sintomático en caso de ser necesario.
Los síntomas relacionados con la sobredosis pueden no presentarse inmediatamente después de la inyección. En caso de que ocurra una inyección o ingesta oral accidental, el paciente debe ser supervisado inmediatamente y durante varias semanas por personal médico, en busca de signos y/o síntomas de debilidad muscular significativa o parálisis muscular.
PRESENTACIONES:
Caja de cartón con 1 vial de vidrio tipo I de 3 ml, que contiene 300 U de toxina botulínica tipo A (complejo hemaglutinina-toxina Clostridium botulinum).
Caja de cartón con 1 vial de vidrio tipo I de 3 ml, que contiene 500 U de toxina botulínica tipo A (complejo hemaglutinina-toxina Clostridium botulinum).
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Vida útil en el estante, de producto empacado y sin abrir es de 18 meses a temperatura de 2-8°C.
El producto puede ser almacenado hasta 8 horas a temperatura de 2-8°C después de la reconstitución, cuando ésta se realizó en condiciones controladas y bajo una técnica aséptica.
Debido a que el producto no contiene agentes antimicrobianos, ni conservadores, el producto reconstituido debe ser utilizado lo más pronto posible después de la reconstitución.
DYSPORT® no debe ser congelado.
Precauciones especiales para su desecho:
Inmediatamente después de tratar al paciente, todo residuo de DYSPORT® que pudiera quedar en el vial o la jeringa debe ser inactivado mediante solución diluida de hipoclorito (1% de cloro disponible). A continuación se eliminará todo el material utilizado, según las prácticas hospitalarias estándar. Cualquier cantidad derramada de DYSPORT® debe ser enjuagada con un trapo absorbente empapado en solución diluida de hipoclorito.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Debe mantenerse en refrigeración entre 2°C y 8°C. No se congele. No se utilice este medicamento después de la fecha de caducidad. No se deje al alcance de los niños. No se use durante el embarazo o lactancia.
Hecho en Reino Unido por:
Ipsen Biopharm Limited
Ash Road, Wrexham Industrial, Estate, Wrexham, Clwyd, LL13 9UF Reino Unido
Almacenado y distribuido en México por:
BIOPHARMEX, S. A. de C. V.
Av. Ceylán No. 959 Bodega 15
Col. Industrial Vallejo, C.P. 02300
Deleg. Azcapotzalco, D.F., México
Reg. Núm. 218M2004, SSA IV
®Marca registrada