
DIGAMOT
ITOPRIDA
Tabletas
1 Caja, 30 Tabletas, 50 mg
1 Caja, 42 Tabletas, 50 mg
1 Caja, 84 Tabletas, 50 mg
FORMA FARMACÉUTICA Y FORMULACIÓN:
Fórmula
Cada TABLETA contiene:
Clorhidrato de ltoprida 50 mg equivalente a 45.4 mg de itoprida
Excipiente cbp 1 tableta
INDICACIONES TERAPÉUTICAS:
DIGAMOT® es un medicamento perteneciente al grupo de las benzamidas sustituidas (derivada del ácido benzoico) que cuenta con doble mecanismo de acción: actuando como antagonista de los receptores dopaminérgicos tipo D2 y ejerciendo acción inhibitoria selectiva sobre la enzima acetilcolinesterasa. La sinergia de estas dos acciones hace que DIGAMOT® sea útil para el tratamiento y alivio de los síntomas derivados de los trastornos directamente relacionados a la dismotilidad gastrointestinal y padecimientos asociados tales como la enfermedad ácido-péptica.
DIGAMOT® está indicado principalmente para:
• Tratamiento de la enfermedad por reflujo gastroesofágico (ERGE) erosiva y no erosiva (ERNE), particularmente aquella asociada al reflujo duodeno gastroesofágico (biliar).
• Dispepsia funcional (DF), de acuerdo con los criterios diagnósticos de Roma II, tipo dismotilidad y tipo inespecífico o de acuerdo con Roma III, síndrome de malestar postprandial y síndrome de dolor epigástrico.
• Gastroparesia idiopática y diabética.
• Terapia coadyuvante en algunos casos de síndrome de intestino irritable (SII), particularmente en la variante estreñimiento (Roma II y Roma III) y en algunos casos de pacientes con estreñimiento crónico idiopático.
• Útil en el alivio de algunos síntomas gastrointestinales ocasionales tales como la distensión abdominal, anorexia, plenitud posprandial, dolor o malestar abdominal por acidez y como coadyuvante en el control de la náusea y/o vómito.
FARMACOCINÉTICA Y FARMACODINAMIA:
El clorhidrato de itoprida pertenece al grupo de sustancias derivadas de la amida del ácido benzoico denominadas benzamidas sustituidas.
El nombre químico del clorhidrato de itoprida es:
Clorhidrato de N- [[4-(2-dimetilaminoetoxi)fenil]metil]-3,4-dimetoxi-benzamida o clorhidrato de N- (p-(2(-dimetilamino) etoxil) bencil) veratramida.
La fórmula condensada es C20H26N2O4·HCI y su peso molecular es de 394.40 g. La estructura química se representa a continuación:
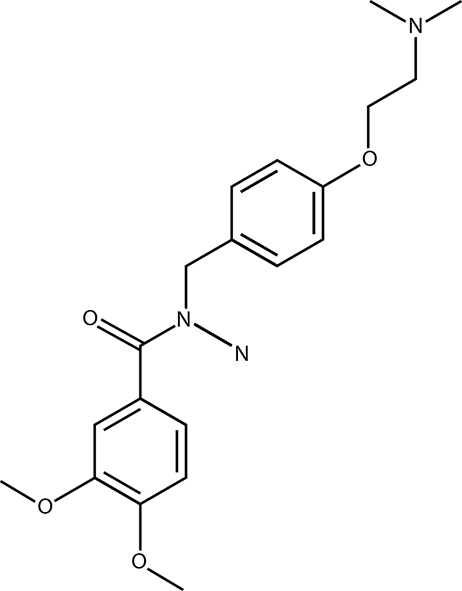
Es una sustancia inodora ligeramente amarga que se presenta en forma de polvo cristalino blanco o casi blanco, altamente soluble en agua, ácido acético y metanol, escasamente soluble en etanol y prácticamente insoluble en anhídrido acético. En solución acuosa tiene un pH entre 4.0 y 5.0 y tiene un punto de fusión entre 193 º y 198 ºC.
Propiedades farmacodinámicas:
En diversos estudios, el clorhidrato de itoprida ha demostrado eficacia terapéutica para el tratamiento de pacientes con trastornos de motilidad gastrointestinal, a través de su mecanismo de acción dual. Gracias a la sinergia de su acción como un antagonista dopaminérgico y de la acción (selectiva, reversible y dependiente de la dosis) inhibitoria de la acetilcolinesterasa, ha mostrado incremento de la motilidad gastrointestinal y favorece el vaciamiento gástrico.
Mecanismo de acción:
DIGAMOT® inhibe tanto la acetilcolinesterasa (AChE) como la butirilcolinesterasa (BuChE). Diversos ensayos han demostrado que la concentración media de inhibición (IC50) de la itoprida es 100 veces mayor con la AChE que con la BuChE.
Además de su acción sobre la acetilcolinesterasa, DIGAMOT® es un antagonista dopaminérgico que bloquea la inhibición de la motilidad de la musculatura gástrica inducida por la dopamina, de manera dosis-dependiente.
Los receptores dopaminérgicos están ligados a proteína G; la diferencia entre estos grupos de receptores radica en el tipo de proteína G y los agentes mensajeros utilizados. Todos los receptores ligados a proteína G cuentan con una porción extracelular que tiene el grupo amino-terminal, una porción proteínica con 7 dominios que atraviesan la membrana y una porción intracelular que posee la terminación carboxilo que con frecuencia se asocia a un grupo palmitol.
Las propiedades fisicoquímicas de DIGAMOT® influyen en su acción in vivo. Por su estructura química y su lipofilicidad, la itoprida muestra afinidad específica a los receptores periféricos mayor que a los receptores centrales. Es por ello por lo que no se han detectado efectos extrapiramidales clínicamente relevantes, al no atravesar la barrera hematoencefálica.
Toda vez que no interactúa con los receptores 5-HT4, DIGAMOT® no aumenta el intervalo QT.
Derivado de su alta selectividad y su exclusivo mecanismo de acción, DIGAMOT® difiere ampliamente de los compuestos procinéticos de generaciones anteriores, pues disminuye el potencial de efectos secundarios, proporcionando un perfil de seguridad favorable para obtener mejores resultados de alivio de síntomas relacionados con la hipomotilidad.
Propiedades farmacocinéticas:
Absorción:
La itoprida se absorbe rápidamente y casi por completo en el tracto gastrointestinal; la ingesta de alimentos no afecta la absorción del fármaco. La concentración plasmática máxima se alcanza 35 minutos después de la administración oral de una dosis de 50 mg. Tiene una biodisponibilidad en torno al 60% y su vida media es de 5.77 ± 0.33 horas.
En ensayos en modelos animales (ratas), se demostró que las concentraciones plasmáticas alcanzaron el máximo nivel en casi todos los órganos y tejidos entre 1 a 2 horas después de la administración oral de una dosis única (5 mg/kg) de itoprida.
Distribución:
La unión a proteínas plasmáticas es del 96%, principalmente a la albúmina.
Se alcanzan altas concentraciones de itoprida en riñones, intestino delgado, hígado, glándulas suprarrenales y estómago. Mientras que su penetración en el sistema nervioso central es mínima.
Metabolismo:
La itoprida se metaboliza ampliamente en el hígado, específicamente a través de la flavin-monooxigenasa (FMO1 y FMO3) y su metabolito principal se encuentra en forma de N-óxido. Por lo tanto, carece de riesgo de interacciones con fármacos que se metabolizan en el citocromo P450 (como macrólidos y antimicóticos).
Además, es muy poco probable que ocasione arritmias cardiacas o cambios en el electrocardiograma, ya que no se metaboliza por la vía del citocromo P450 isoenzima CYP3A4.
Eliminación:
Su excreción es principalmente por vía urinaria en un 89.4% en 24 horas, 67.5% en forma de N-óxido y 4.14% es eliminado sin cambios.
CONTRAINDICACIONES:
DIGAMOT® está contraindicado en pacientes con hipersensibilidad conocida al fármaco o a alguno de los componentes de la fórmula, así como en pacientes con hemorragia gastrointestinal, obstrucción mecanica, perforación intestinal o hiperprolactinemia. Tampoco debe usarse en menores de 12 años.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: No se ha establecido la seguridad del uso de DIGAMOT® en mujeres embarazadas. Por lo tanto, DIGAMOT® no debería ser utilizado en mujeres embarazadas o en mujeres que puedan estar embarazadas, a menos que por decisión médica los potenciales beneficios terapéuticos superen los eventuales riesgos del tratamiento.
Lactancia: Los datos sobre la excreción de itoprida en la leche materna se conocen sólo en animales. Debido a la falta de experiencia con el uso de DIGAMOT® durante la lactancia, no se recomienda para mujeres en periodo de lactancia. Por lo tanto, al no poder excluir el riesgo en lactantes, se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
REACCIONES SECUNDARIAS Y ADVERSAS:
La tabla muestra las reacciones adversas que pueden estar relacionadas con itoprida, acorde a la clasificación por órganos y sistemas de MedDRA, así como por frecuencia de aparición de acuerdo a la OMS: muy frecuente (≥1/10), frecuente (≥1/100 a <1/10), poco frecuente (≥1/1,000 a <1/100), raro (≥1/10,000 a <1/1,000), muy raro (<1/10,000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Trastornos de la sangre y el sistema linfático |
|
|
Poco frecuente |
Leucopenia* |
|
Frecuencia no conocida |
Trombocitopenia |
|
Trastornos del sistema inmunológico |
|
|
Frecuencia no conocida |
Reacción anafilactoide |
|
Trastornos endocrinos |
|
|
Poco frecuente |
Hiperprolactinemia** |
|
Muy raro |
Galactorrea, ginecomastía |
|
Trastornos psiquátricos |
|
|
Poco frecuente |
Irritabilidad |
|
Trastornos del sistema nervioso |
|
|
Poco frecuente |
Cefalea, alteraciones del sueño, mareo |
|
Frecuencia no conocida |
Temblor |
|
Trastornos gastrointestinales |
|
|
Poco frecuentes |
Diarrea, estreñimiento, dolor abdominal, sialorrea |
|
Frecuencia no conocida |
Náusea |
|
Trastornos hepatobiliares |
|
|
Raro |
Elevación de TGO (AST), TGP (ALT), gamma-TGP, fosfatasa alcalina, bilirrubina |
|
Frecuencia no conocida |
Ictericia |
|
Trastornos de la piel y el tejido subcutáneo |
|
|
Raro |
Rash, prurito, ardor, eritema |
|
Trastornos musculoesquléticos y del tejido conjuntivo |
|
|
Poco frecuente |
Dolor de espalda o pecho |
|
Trastornos renales y urinarios |
|
|
Poco frecuente |
Elevación del BUN (nitrógeno ureico en sangre) y creatinina |
|
Trastornos generales y alteraciones en el lugar de administración |
|
|
Poco frecuentes |
Fatiga |
* La observación debe hacerse a través de un examen hematológico. El tratamiento debe interrumpirse cuando se observe cualquier anomalía.
** La hiperprolactinemia es dosis-dependiente, habitualmente a las dosis terapéuticas de 50 mg tres veces al día, se presenta en 5.8% (vs. placebo [5.1%]) y a dosis de 100 mg tres veces al día, 16.4% y de 200 mg tres veces al día, 20.7%.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
El clorhidrato de itoprida ha demostrado en múltiples estudios preclínicos y clínicos su extenso perfil de seguridad. Hasta el momento, ningún estudio controlado ha detectado o reportado algún efecto potencial sobre la carcinogénesis, mutagénesis, teratogénesis o alguna alteración sobre la fertilidad en humanos o animales de laboratorio.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Debido a que DIGAMOT® se metaboliza a través de la flavin-monooxigenasa 1 y 3, no se esperarían interacciones medicamentosas con fármacos que se metabolizan en el citocromo P450 (como macrólidos y antimicóticos).
Si se administra DIGAMOT® conjuntamente con medicamentos anticolinérgicos, se debe tener precaución ya que pueden reducir la acción de la itoprida.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Al ser un antagonista de los receptores D2, DIGAMOT® puede causar hiperprolactinemia. Dicha elevación es transitoria y guarda una estrecha relación dosis-dependiente.
También puede presentarse elevación de TGO (AST), TGP (ALT), gamma-TGP, fosfatasa alcalina y bilirrubina.
PRECAUCIONES GENERALES:
La administración de DIGAMOT® en pacientes geriátricos requiere de estrecha evaluación del perfil riesgo/beneficio, toda vez que en este grupo de pacientes las condiciones fisiológicas pueden encontrarse disminuidas, lo que podría ocasionar la aparición de reacciones adversas. Como con el uso de cualquier otro medicamento, a pesar de no requerir específicamente el ajuste de la dosis en este grupo de pacientes, se recomienda que los pacientes geriátricos que consuman DIGAMOT® sean valorados cuidadosamente para que, de ser necesario, se reduzca la dosis o se interrumpa la administración del medicamento.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de Administración: Oral.
|
DOSIS TERAPÉUTICA DIARIA HABITUAL |
|
|
Adultos y mayores de 12 años: |
1 tableta de 50 mg tres veces al día (la dosis total diaria es de 150 mg), administrada de 20 a 30 minutos antes de la ingesta de alimentos*. |
|
La dosis total diaria puede ajustarse según la edad del paciente y/o la intensidad de sus síntomas. |
|
|
ENFERMEDAD POR REFLUJO GASTROESOFÁGICO (ERGE) LEVE A MODERADA en cualquiera de sus variantes (ERGE erosiva; grados A-B de "Los Ángeles" o en los casos de Enfermedad por Reflujo No Erosivo (ERNE)): |
|
|
1 tableta de 50 mg tres veces al día; de 20 a 30 minutos antes del desayuno, de la comida y de la cena, durante 4 a 8 semanas continuas. |
|
|
ERNE CON SÍNTOMAS "REFRACTARIOS" (Casos severos o de difícil control): |
|
|
2 tabletas de 50 mg tres veces al día, durante 8 a 12 semanas continuas. |
|
|
Incluso se puede requerir la asociación con un medicamento inhibidor de la bomba de protones o terapia con algún fármaco neuromodulador visceral (ATC o ISRS). La administración concomitante con un inhibidor de la bomba de protones puede llevarse a cabo sin esperar interacción medicamentosa alguna, pues el metabolismo de DIGAMOT® no interfiere de ninguna forma con el sistema enzimático del citocromo P450, encargado del metabolismo de los inhibidores de la bomba de protones. |
|
|
DISPEPSIA FUNCIONAL LEVE A MODERADA (De acuerdo con los criterios diagnósticos de Roma II (tipo úlcera, tipo dismotilidad o tipo inespecífico) o de Roma III (síndrome de malestar postprandial o síndrome de dolor epigástrico): |
|
|
1 tableta de 50 mg, tres veces al día; de 20 a 30 minutos antes de la ingesta de alimentos, durante 8 a 12 semanas continuas. |
|
|
Este esquema de tratamiento mejora el proceso de vaciamiento gastroduodenal, proporcionando alivio a gran parte de los síntomas, principalmente a los que se relacionan con la ingesta de alimentos como la saciedad temprana, sensación de plenitud postprandial, náusea, distensión, etc. |
|
|
DISPEPSIA FUNCIONAL SEVERA (Casos severos o de difícil control o en pacientes cuyo inicio de los síntomas dispépticos se presente después de los 50 años): |
|
|
La dosis de 1 tableta de 50 mg tres veces al día puede escalarse de manera progresiva hasta 3 tabletas de 50 mg tres veces al día (dosis total máxima diaria de 450 mg/día), durante 8 a 12 semanas continuas. |
|
|
Además de un riguroso protocolo estudio gastroenterológico que permita determinar la magnitud del problema, durante este periodo se recomienda monitorear los niveles séricos de prolactina y al menos durante las 4 semanas posteriores a la suspensión del medicamento. |
|
|
GASTROPARESIA DIABÉTICA LEVE A MODERADA (Algunos casos): |
|
|
2 o 3 tabletas de 50 mg, tres veces al día. |
|
|
Para los casos específicos de gastroparesia idiopática se debe indagar primero la causa que produce dicha gastroparesia, pues el tratamiento con DIGAMOT® solamente ayuda a manejar esta condición sin ser el tratamiento definitivo. |
|
* La concentración plasmática máxima (Cmáx) se alcanza aproximadamente a los 30 minutos de haber ingerido el medicamento.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Los datos obtenidos de los diversos estudios de toxicidad aguda y subaguda en diversos modelos animales con clorhidrato de itoprida a diversas dosis, no indican ningún riesgo potencial de toxicidad para este compuesto por sobredosificación. Sin embargo, en el caso de presentarse algún evento o episodio en donde se tenga alguna sospecha de sobredosis por ingesta accidental o intencionada en donde el paciente manifieste datos clínicos de intoxicación aguda, se deberá proceder inmediatamente a aplicar las medidas de soporte vital cerebro cardiopulmonar universalmente aceptadas para el manejo convencional de todas las intoxicaciones.
PRESENTACIONES:
Caja con 30, 42 u 84 tabletas de 50 mg de itoprida.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Consérvese la caja bien cerrada a no más de 30 ºC.
LEYENDAS DE PROTECCIÓN:
No se use durante el embarazo y lactancia. No se deje al alcance de los niños. No se administre en menores de 12 años. Su venta requiere receta médica. Literatura exclusiva para médicos.
Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx y
uc farmacovigilancia@sanfer.com.mx
Hecho en México por:
Serral, S.A. de C.V.
Camino Real a Cocotitlán S/N,
esq. con Constitución 5 Feb.,
Zona Industria Chalco,
C.P. 56600, Chalco, México, México.
Para:
Grimann, S.A. de C.V.
Circuito Nemesio Diez Riega No. 11,
Parque Industrial El Cerrillo II,
C.P. 52000, Lerma, México, México.
Reg. Núm. 157M2020 SSA IV
®Marca Registrada