
COBAS MAI
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
RESULTADOS:
La prueba COBAS® MAI detecta y diferencia automáticamente el ADN de M. avium y M. intracellulare para muestras y controles y permite visualizar la validez de la prueba y los resultados individuales de cada fragmento objetivo.
Control de calidad y validez de los resultados:
• Con cada serie de un tipo de resultado solicitado se procesan un control negativo para el buffer cobas® [(–) Ctrl] y un control positivo para MAI [MAI (+) C].
• Compruebe los avisos y los resultados asociados tanto en el software cobas® 6800/8800 como en el informe para garantizar la validez de la serie.
• Todos los avisos están descritos en la Guía del usuario o la Asistencia al usuario de los cobas® 6800/8800 Systems.
• La serie se considera válida cuando no hay avisos para ninguno de los controles. Si la serie no es válida, repita las pruebas para toda la serie.
La validación de los resultados de la serie se realiza automáticamente mediante el software cobas® 6800/8800 en función del rendimiento del control negativo y del control positivo, mientras que la validación de los resultados individuales de las muestras se lleva a cabo mediante el software cobas® 6800/8800 en función de los resultados del control interno.
Interpretación de los resultados:
Ilustración 3. Ejemplo de resultados de la prueba COBAS®MAI
|
Prueba |
ID muestra |
Válida |
Avisos |
Tipo de muestra |
Resultado global |
Fragmento objetivo 1 |
Fragmento objetivo 2 |
|---|---|---|---|---|---|---|---|
|
MAI 850 ul |
MAI_R_0001 |
NA |
Raw sputum |
NA |
MIN Negative |
MIN Positive |
|
|
MAI 850 ul |
MAI_R_0002 |
NA |
Raw sputum |
NA |
MIN Positive |
MAV Negative |
|
|
MAI 850 ul |
MAI_R_0003 |
NA |
P02T |
Raw sputum |
NA |
Invalid |
No válido |
|
MAI 850 ul |
MAI_R_0001 |
NA |
Sediment |
NA |
MIN Negative |
MIN Positive |
|
|
MAI 850 ul |
MAI_R_0002 |
NA |
Sediment |
NA |
MIN Positive |
MAV Negative |
|
|
MAI 850 ul |
MAI_R_0003 |
NA |
C02H1 |
Sediment |
NA |
Invalid |
No válido |
|
MAI 850 ul |
C161420284090428828404 |
Yes |
(–) Ctrl |
Valid |
Valid |
Valid |
|
|
MAI 850 ul |
C161420284093009580264 |
Yes |
MAI (+) C |
Valid |
Valid |
Valid |
Interpretación de los resultados:
En las series válidas, compruebe cada muestra para detectar avisos en el software cobas® 6800/8800 y/o en el informe. La interpretación de resultados se debe realizar del siguiente modo:
• Una serie válida puede incluir resultados de muestras tanto válidos como inválidos.
• Las columnas “Válida” y “Resultado global” no son aplicables a los resultados de las muestras de la prueba COBAS® MAI y aparecen marcadas como “NA”. Los valores indicados en estas columnas no son aplicables y no influyen en la validez de los resultados comunicados en las columnas de resultados de fragmentos objetivo individuales.
• Los resultados de fragmentos objetivo comunicados para muestras individuales son válidos a no ser que se indiquen como “Invalid” en la columna de resultado de fragmento objetivo individual.
• Los resultados de esta prueba solo deben interpretarse junto con la información disponible de la evaluación clínica del paciente y de su historial.
Los resultados y sus interpretaciones correspondientes para la detección de MAI se muestran en la Tabla 16.
Tabla 16. Resultados e interpretación de la prueba COBAS®MAI
|
Fragmento objetivo 1 |
Fragmento objetivo 2 |
Interpretación |
|
MIN Positive |
MAV Positive |
Todos los resultados solicitados son válidos. Se ha detectado una señal de fragmento objetivo para el ADN de M. intracellulare y M. avium. |
|
MIN Positive |
MAV Negative |
Todos los resultados solicitados son válidos. Se ha detectado una señal de fragmento objetivo para el ADN de M. intracellulare. No se ha detectado ninguna señal de fragmento objetivo para el ADN de M. avium. |
|
MIN Positive |
Invalid |
No todos los resultados solicitados son válidos. Se ha detectado una señal de fragmento objetivo para el ADN de M. intracellulare. El resultado para M. intracellulare es válido. El resultado para M. avium no es válido. La muestra original debe volver a analizarse para obtener resultados para M. avium válidos. Si el resultado sigue siendo no válido, deberá obtenerse una muestra nueva. |
|
MIN Negative |
MAV Positive |
Todos los resultados solicitados son válidos. No se ha detectado ninguna señal de fragmento objetivo para el ADN de M. intracellulare. Se ha detectado una señal de fragmento objetivo para el ADN de M. avium. |
|
MIN Negative |
MAV Negative |
Todos los resultados solicitados son válidos. No se ha detectado ninguna señal de fragmento objetivo para el ADN de M. intracellulare. No se ha detectado ninguna señal de fragmento objetivo para el ADN de M. avium. |
|
MIN Negative |
Invalid |
No todos los resultados solicitados son válidos. No se ha detectado ninguna señal de fragmento objetivo para el ADN de M. intracellulare. El resultado para M. intracellulare es válido. El resultado para M. avium no es válido. La muestra original debe volver a analizarse para obtener resultados para M. avium válidos. Si el resultado sigue siendo no válido, deberá obtenerse una muestra nueva. |
|
Invalid |
MAV Positive |
No todos los resultados solicitados son válidos. El resultado para M. intracellulare no es válido. La muestra original debe volver a analizarse para obtener resultados para M. intracellulare válidos. Si el resultado sigue siendo no válido, deberá obtenerse una muestra nueva. Se ha detectado una señal de fragmento objetivo para el ADN de M. avium. El resultado para M. avium es válido. |
|
Invalid |
MAV Negative |
No todos los resultados solicitados son válidos. El resultado para M. intracellulare no es válido. La muestra original debe volver a analizarse para obtener resultados para M. intracellulare válidos. Si el resultado sigue siendo no válido, deberá obtenerse una muestra nueva. No se ha detectado ninguna señal de fragmento objetivo para el ADN de M. avium. El resultado para M. avium es válido. |
|
Invalid |
Invalid |
Tanto el resultado para M. intracellulare como el resultado para M. avium son no válidos. La muestra original debe volver a analizarse para obtener resultados válidos para M. intracellulare y M. avium. Si los resultados siguen siendo no válidos, deberá obtenerse una muestra nueva. |
Limitaciones del procedimiento:
• La prueba COBAS® MAI siempre debe realizarse junto con un cultivo para minimizar el riesgo de obtener resultados falsos negativos además de para permitir la realización de pruebas de farmacosensibilidad del aislado de MAC como ayuda en la atención del paciente.
• El rendimiento de la prueba COBAS® MAI ha sido validado para muestras de esputo sin procesar y para muestras de sedimento de esputo y de LBA que han sido licuificadas, descontaminadas y concentradas con NALC-NaOH. El uso de otros tipos de muestras puede generar resultados falsos positivos, falsos negativos y/o inválidos.
• La digestión y la descontaminación deben realizarse mediante procedimientos con NALC-NaOH recomendados por el CDC.19 El uso de procedimientos preanalíticos alternativos para la preparación de las muestras puede generar resultados falsos positivos, falsos negativos y/o inválidos.
• La prueba COBAS® MAI se ha validado para su uso con muestras de esputo sin procesar y muestras de sedimento de esputo y de LBA tratadas con NALC-NaOH inactivadas químicamente con el reactivo MIS. No se ha evaluado la aplicación de otros procedimientos de inactivación y su uso puede generar resultados falsos positivos, falsos negativos y/o inválidos.
• El éxito de la inactivación micobacteriana depende del cumplimiento de los procedimientos descritos en este documento y de una mezcla total de la muestra con el reactivo MIS. El tratamiento preanalítico de las muestras de paciente mediante el MIS reduce, pero no elimina por completo, el riesgo de una infección micobacteriana.
• Superar las limitaciones de volumen y/o desviarse de los pasos de procedimiento descritos en los apartados “Procesamiento de muestras de esputo sin procesar”, “Procesamiento de sedimentos de esputo y de LBA” y “Sonicación de las muestras” puede conducir a resultados falsos positivos, falsos negativos y/o inválidos.
• Los ensayos de amplificación de ácidos nucleicos no pueden determinar la viabilidad de un organismo.
• El éxito o fracaso terapéutico no pueden determinarse con esta prueba.
• El uso de este producto debe limitarse al personal con experiencia en el empleo de técnicas de PCR y la utilización de los cobas® 6800/8800 Systems.
• La prueba COBAS® MAI se ha evaluado únicamente para su uso en combinación con el COBAS® MAI Positive Control Kit, el cobas® Buffer Negative Control Kit, el cobas omni MGP Reagent, el cobas omni Lysis Reagent, el cobas omni Specimen Diluent y el cobas omni Wash Reagent en los cobas® 6800/8800 Systems, el MIS y el sonicador de tubos TS 5 de Rinco Ultrasonics AG.
• La obtención de resultados fiables depende de que los procedimientos de recogida, almacenamiento y manipulación de muestras se realicen de manera adecuada.
• No se ha evaluado el uso de la prueba COBAS® MAI en pacientes menores de 18 años.
• La prueba COBAS® MAI no está indicada para su uso con muestras respiratorias de pacientes que reciben tratamiento con fármacos antimicobacterianos, para el control de la respuesta al tratamiento o como prueba de sanación.
• La prueba COBAS® MAI distingue entre M. intracellulare y M. avium. La prueba COBAS® MAI detecta otras especies del complejo M. avium, pero no las diferencia. La detección se lleva a cabo en el fragmento objetivo de M. intracellulare o de M. avium. Para obtener información detallada, consulte el estudio de inclusividad del apartado “Evaluación del rendimiento”.
• La detección del complejo M. avium depende del número de organismos presentes en la muestra y puede verse afectada por los métodos de obtención de las muestras y factores propios del paciente (como la edad, la gravedad de la enfermedad y el estado de VIH).
• Los pacientes infectados tanto por MAI como por VIH tienen una mayor probabilidad de que las muestras resulten negativas en la microscopía de frotis y que, por lo tanto, su nivel de ADN de MAC sea inferior al límite de detección del ensayo.
• Los profesionales sanitarios deben interpretar los resultados en el contexto del historial del paciente, la presentación clínica y otros resultados de las pruebas de laboratorio y radiográficas.
• Pueden obtenerse resultados falsos negativos o no válidos debido a la inhibición de la polimerasa. La prueba COBAS® MAI incluye el control interno para permitir la identificación de muestras que contienen sustancias que podrían interferir con el aislamiento de ácidos nucleicos y la amplificación mediante PCR.
• La incorporación de la enzima AmpErase al reactivo de Master Mix de la prueba COBAS® MAI permite realizar una amplificación selectiva del ADN objetivo; no obstante, es imprescindible emplear las mejores prácticas de laboratorio y cumplir estrictamente los procedimientos especificados en este documento de instrucciones de uso para evitar la contaminación de los reactivos.
• Aunque es poco probable, las mutaciones en las regiones muy conservadas del ADN genómico del complejo M. avium cubiertas por los cebadores y/o las sondas de la prueba COBAS® MAI pueden causar errores en la detección de la presencia de la bacteria.
• Debido a las diferencias específicas entre tecnologías, se recomienda a los usuarios que, antes de cambiar de una a otra, realicen estudios de correlación en el laboratorio para determinar las diferencias tecnológicas. No cabe esperar un porcentaje de concordancia del 100% entre los resultados debido a las diferencias entre tecnologías indicadas anteriormente.
• Para utilizar tubos distintos a los recomendados en la tabla 11, el usuario debe verificarlos antes de su implementación en el flujo de trabajo de la prueba COBAS® MAI en el laboratorio. El empleo de otros tipos de tubos puede dañar los tubos y contaminar las superficies del sonicador. También pueden obtenerse resultados falsos negativos debido a una transferencia de energía de sonicación insuficiente.
• Para utilizar códigos de barras distintos a los recomendados en la tabla 11, el usuario debe verificarlos antes de su implementación en el flujo de trabajo de la prueba COBAS® MAI en el laboratorio. El empleo de otros códigos de barras puede dañar el código de barras.
OBTENCIÓN, TRANSPORTE Y ALMACENAMIENTO DE LAS MUESTRAS:
Nota: Manipule todas las muestras y los controles como si pudieran transmitir agentes infecciosos.
Muestras:
Para la prueba COBAS® MAI pueden utilizarse muestras de esputo sin procesar y sedimentos de esputo y LBA tratados con NALC-NaOH.
Transporte y almacenamiento de las muestras:
Las muestras de esputo sin procesar pueden almacenarse y/o transportarse un máximo de 3 días a una temperatura de 2 °C a 35 °C, seguido de un periodo de hasta 7 días a una temperatura de 2 °C a 8 °C antes de los procesos de licuefacción e inactivación de la muestra mediante el reactivo MIS. Para el almacenamiento a largo plazo de muestras de esputo sin procesar no tratadas con MIS se recomiendan temperaturas ≤ –20 °C.
Las muestras de sedimento de esputo y de LBA tratadas con NALC-NaOH pueden almacenarse un máximo de 7 días a una temperatura de 2 °C a 8 °C antes de la inactivación de la muestra mediante el MIS. Para el almacenamiento a largo plazo de sedimentos de esputo y de LBA no tratados con MIS, las muestras pueden almacenarse congeladas a temperaturas ≤ –20° C un máximo de 9 meses incluidos dos ciclos de congelación/descongelación.
Si las muestras se van a transportar, es recomendable empaquetarlas y etiquetarlas de acuerdo con la reglamentación estatal y/o internacional relativa al transporte de muestras infecciosas y agentes etiológicos.
Almacenamiento de muestras inactivadas:
Las muestras de esputo sin procesar y los sedimentos de esputo y de LBA tratados con NALC-NaOH que se hayan tratado con el reactivo MIS (inactivadas) pueden almacenarse un máximo de 12 horas a una temperatura de 15 °C a 35 °C, seguido de un periodo de hasta 7 días a una temperatura de 2 °C a 8 °C y 30 días a ≤ –20 °C incluidos dos ciclos de congelación/ descongelación antes de procesarlas en los cobas® 6800/8800 Systems.
Nota: Es posible que las muestras tratadas con MIS no se congelen debido al elevado contenido de isopropanol.
Nota: La sonicación de las muestras puede realizarse en cualquier momento después de una incubación inicial con el reactivo MIS durante un mínimo de 60 minutos. Consulte el apartado “Sonicación de las muestras” para obtener información detallada.
PRECAUCIONES Y REQUISITOS DE MANIPULACIÓN:
Advertencias y precauciones:
Como sucede con cualquier procedimiento analítico, resulta esencial seguir las buenas prácticas de laboratorio recomendadas para obtener un rendimiento correcto del ensayo. Debido a la elevada sensibilidad de esta prueba, deben extremarse las precauciones para evitar cualquier tipo de contaminación de los reactivos y las mezclas de amplificación.
• Para diagnóstico in vitro exclusivamente.
• Todas las muestras de pacientes deben considerarse como potencialmente infecciosas. Por lo tanto, todas las muestras biológicas deben tratarse como si fueran infecciosas, utilizando los procedimientos de laboratorio recomendados que se describen en Biosafety in Microbiological and Biomedical Laboratories, en el documento M29-A4 del CLSI y en el Manual de bioseguridad en el laboratorio de tuberculosis de la OMS.16,17,18 Este procedimiento solamente debería llevarlo a cabo personal experto en la manipulación de material biopeligroso y en el uso de la prueba COBAS® MAI y los cobas® 6800/8800 Systems.
• Todo el personal debe utilizar un equipo de protección individual que incluya bata de laboratorio, guantes desechables y protección ocular y respiratoria de acuerdo con los procedimientos y prácticas de seguridad del centro, así como seguir los procedimientos de seguridad del centro referentes al trabajo con sustancias químicas y muestras biológicas.
• El proceso de inactivación de las muestras con el reactivo MIS debe realizarse en una cabina de seguridad biológica (BSC, tipo A2) en un laboratorio con nivel de bioseguridad 319 u otro entorno con control de bioseguridad de acuerdo con las directrices o regulaciones locales y del centro.
• El éxito de la inactivación micobacteriana depende del cumplimiento de los procedimientos descritos en este documento y de una mezcla total de la muestra con el reactivo MIS. El tratamiento preanalítico de las muestras de paciente mediante el MIS reduce, pero no elimina por completo, el riesgo de una infección micobacteriana.
• Si se produce un derrame de las muestras en el MIS (que contiene tiocianato de guanidinio), no permita que entre en contacto con soluciones de hipoclorito de sodio que contengan desinfectantes como la lejía. Tales mezclas pueden producir gases de alta toxicidad.
• El reactivo MIS es sensible a la luz y se suministra en botellas con protección lumínica. El MIS debe almacenarse en posición vertical.
• Utilice solo el material fungible suministrado o que se requiera expresamente para garantizar el rendimiento establecido para la prueba.
• Siga al pie de la letra los procedimientos y las directrices que se suministran para garantizar la correcta realización de la prueba. Cualquier variación de dichos procedimientos y directrices podría afectar el rendimiento establecido para la prueba.
• Podrían producirse resultados falsos positivos si no se evita la contaminación por arrastre de las muestras durante la manipulación y el procesamiento de las mismas.
• Puede solicitar Hojas de datos de seguridad (Safety Data Sheets, SDS) al representante local de Roche.
Manipulación de reactivos:
• Manipule todos los reactivos, controles y muestras de acuerdo con las mejores prácticas de laboratorio para evitar la contaminación por arrastre de las muestras, los reactivos o los controles.
• Antes de utilizarlos, revise cada casete de reactivo, diluyente, reactivo de lisis y reactivo de lavado para asegurarse de que no hay signos de fugas. No utilice el material si hay alguna evidencia de fuga.
• El cobas omni Lysis Reagent y el reactivo MIS contienen tiocianato de guanidinio, una sustancia química potencialmente peligrosa. Evite el contacto de reactivos con la piel, los ojos o las membranas mucosas. En caso de contacto, lave inmediatamente la zona afectada con abundante agua para evitar quemaduras.
• No permita que el cobas omni Lysis Reagent o el MIS, que contienen tiocianato de guanidinio, entren en contacto con la solución de hipoclorito de sodio (lejía). Tales mezclas pueden producir gases de alta toxicidad.
• Los kits de control usados contienen viales perforados con reactivo residual. Extreme la precaución durante su eliminación para evitar derrames y el contacto.
• El kit de la prueba COBAS® MAI, el COBAS® MAI Positive Control Kit, el cobas® Buffer Negative Control Kit, el cobas omni MGP Reagent y el cobas omni Specimen Diluent contienen azida sódica como conservante. Evite el contacto de reactivos con la piel, los ojos o las membranas mucosas. En caso de contacto, lave inmediatamente la zona afectada con abundante agua para evitar quemaduras. Si se producen salpicaduras de reactivos, diluya las manchas con agua antes de secarlas con un paño.
• Elimine todos los materiales que hayan estado en contacto con las muestras y los reactivos de acuerdo con la reglamentación nacional, estatal y local.
Buenas prácticas de laboratorio:
• No pipetee con la boca.
• No se debe comer, beber ni fumar en las áreas de trabajo.
• El proceso de inactivación de las muestras con el reactivo MIS debe realizarse en una cabina de seguridad biológica (BSC, tipo A2) en un laboratorio con nivel de bioseguridad 319 u otro entorno con control de bioseguridad de acuerdo con las directrices o regulaciones locales y del centro.
• Utilice guantes, bata de laboratorio y protección ocular y respiratoria cuando manipule las muestras y los reactivos de acuerdo con las directrices del centro. Evite la contaminación de los guantes durante la manipulación de las muestras y de los controles. Es necesario cambiarse los guantes entre la manipulación de las muestras y del kit COBAS® MAI, del COBAS® MAI Positive Control Kit, del cobas® 6800/8800 Buffer Negative Control Kit, de los reactivos cobas omni y del material fungible para evitar la contaminación.
• Desinféctese y lávese bien las manos después de manipular las muestras y los reactivos, y al quitarse los guantes.
• Limpie y desinfecte minuciosamente todas las superficies de trabajo del laboratorio usando una solución recién preparada de hipoclorito de sodio al 0,5% en agua destilada o desionizada (lejía doméstica diluida a 1:10). A continuación, límpielas con un trapo impregnado en etanol al 70%.
• Si el derrame se produce sobre los cobas® 6800/8800 Systems, siga las instrucciones descritas en la Guía del usuario de los cobas® 6800/8800 Systems para limpiar y descontaminar correctamente las superficies de los instrumentos.
REACTIVOS Y MATERIALES:
Reactivos y controles de COBAS® MAI:
Todos los reactivos y controles sin abrir deben almacenarse como se recomienda de la Tabla 1 a la Tabla 5.
Tabla 1. COBAS® MAI
|
COBAS® MAI Almacenar a 2-8 °C Casete para 384 pruebas (P/N 08412138190) |
||
|
Componentes del kit |
Ingredientes del reactivo |
Cantidad por kit |
|
Solución de proteinasa (PASE) |
Buffer Tris, < 0,05 % de EDTA, cloruro de calcio, acetato de calcio, 8% de proteinasa EUH210: puede solicitarse la ficha de datos de seguridad. EUH208: contiene subtilisina. Puede provocar una reacción alérgica. |
38 mL |
|
Control interno de ADN (DNA-IC) |
Buffer Tris, < 0,05% de EDTA, < 0,001% de constructo de ADN diferente de MAC, 0,002% de ARN Poli rA (sintético), < 0,1% de azida sódica |
38 mL |
|
Buffer de elución (EB) |
Buffer Tris, 0,2% de metil-4-hidroxibenzoato |
38 mL |
|
Reactivo 1 de Master Mix (MMX-R1) |
Acetato de manganeso, hidróxido potásico, < 0,1% de azida sódica |
14,5 mL |
|
Reactivo 2 de Master Mix para MAI (MAI MMX-R2) |
Buffer Tricina, acetato de potasio, EDTA, glicerol, < 18% de sulfóxido de dimetilo, < 0,12% de dATP, dCTP, dGTP y dUTP, < 0,1% de Tween 20, < 0,1% de azida sódica, < 0,1% de ADN polimerasa Z05, < 0,1% de enzima AmpErase (uracil-N-glicosilasa) (microbiana), < 0,01% de cebadores que van en un sentido y en otro para el control interno, < 0,01% de cebadores ascendente y descendente para MAI, < 0,01% de sondas oligonucleótidas marcadas con fluorescente específicas para MAI y el control interno de ADN, < 0,01% de aptámero oligonucleótido |
17,5 mL |
Tabla 2. COBAS® MAI Positive Control Kit
|
COBAS® MAI Positive Control Kit Almacenar a 2-8 °C (P/N: 07544863190) |
||
|
Componentes del kit |
Ingredientes del reactivo |
Cantidad por kit |
|
Control positivo para MAI (MAI (+) C) |
Buffer Tris, < 0,05% de azida sódica, < 0,05% de EDTA, < 0,002% de poli Ar, < 0,01% de ADN plasmídico no infeccioso (microbiano) con secuencias genómicas de M. avium y M. intracellulare. |
16 mL (16 x 1 mL) |
Tabla 3. cobas® 6800/8800 Buffer Negative Control Kit
|
cobas® 6800/8800 Buffer Negative Control Kit Almacenar a 2-8 °C (P/N 07002238190) |
||
|
Componentes del kit |
Ingredientes del reactivo |
Cantidad por kit |
|
Control negativo para el buffer de cobas®6800/8800 (BUF (–) C) |
Buffer Tris, < 0,1% de azida sódica, EDTA, < 0,002% de ARN poli Ar (sintético) |
16 mL (16 x 1 mL) |
Reactivos cobas omni para la preparación de muestras:
Tabla 4. Reactivos cobas omni para la preparación de muestras*
|
COBAS® HBV/HCV/HIV-1 Control Kit Almacenar a 2-8 °C (P/N: 06997767190) |
|||
|---|---|---|---|
|
Componentes del kit |
Composición del reactivo |
Cantidad por kit |
Símbolo de seguridad y advertencia* |
|
cobas omni MGP Reagent (MGP) Almacenar a 2-8 °C (P/N: 06997546190) |
Partículas de vidrio magnéticas, buffer Tris, 0,1 % de metil-4 hidroxi-benzoato, < 0,1 % de azida sódica |
480 pruebas |
No aplicable |
|
cobas omni Specimen Diluent (SPEC DIL) Almacenar a 2-8 °C (P/N: 06997511190) |
Buffer Tris, 0,1 % de metil-4 hidroxibenzoato, < 0,1 % de azida sódica |
4 × 875 mL |
No aplicable |
|
cobas omni Lysis Reagent (LYS) |
43 % (p/p) de tiocianato de guanidina***, 5 % (p/v) de polidocanol***, 2 % (p/v) de ditiotreitol***, citrato de sodio dihidratado |
4 × 875 ml |
PELIGRO: H302 + H332: Nocivo en caso de ingestión o inhalación. H314: Provoca quemaduras graves en la piel y lesiones oculares graves. H412: Nocivo para los organismos acuáticos, con efectos nocivos duraderos. EUH032: En contacto con ácidos libera gases muy tóxicos. P261: Evitar respirar el polvo/el humo/el gas/la niebla/los vapores/el aerosol. P273: Evítese su liberación al medio ambiente. P280: Llevar guantes/prendas/gafas/máscara de protección. P303 + P361 + P353: EN CASO DE CONTACTO CON LA PIEL (o el pelo): quitar inmediatamente todas las prendas contaminadas. Enjuagar la piel con agua. P304 + P340 + P310: EN CASO DE INHALACIÓN: transportar a la persona al aire libre y mantenerla en una posición que le facilite la respiración. Llamar inmediata-mente a un CENTRO DE TOXICOLOGÍA/médico. P305 + P351 + P338 + P310: EN CASO DE CONTACTO CON LOS OJOS: aclarar cuidadosamente con agua durante varios minutos. Quitar las lentes de contacto, si lleva y resulta fácil. Seguir aclarando. Llamar inmediatamente a un CENTRO DE TOXICOLOGÍA/médico. 593-84-0 Tiocianato de guanidina 9002-92-0 Polidocanol 3483-12-3 (R*,R*)-1,4-dimercaptobutano-2,3-diol |
|
cobas omni Wash Reagent (WASH) Almacenar a 15-30 °C (P/N: 06997503190) |
Citrato de sodio dihidratado, 0,1 % de metil-4-hidroxi-benzoato |
4,2 l |
No aplicable |
* Estos reactivos no están incluidos en el kit COBAS® MAI. Consulte el listado de material adicional necesario (Tabla 10).
** Las etiquetas de seguridad del producto se basan fundamentalmente en la regulación GHS de la UE.
*** Sustancia peligrosa.
Tabla 4. Reactivos cobas omni para la preparación de muestras*
|
cobas® Microbial Inactivation Solution Almacenar a 2-8 °C (P/N: 08185476001) |
|||
|---|---|---|---|
|
Componentes del kit |
Composición del reactivo |
Cantidad por kit |
Símbolo de seguridad y advertencia** |
|
cobas®Microbial Inactivation Solution (MIS) |
Buffer Tris, 60 % (v/v) de iso-propanol***, 1 % (p/v) de timol***, 18,9 % (p/v) de tiocianato de guanidina***, 1,4 % (p/v) de hidro-cloruro de fosfina tris (2-carbo-xetil)***, 0,4 % (p/v) de Tween 20 |
480 mL (16 × 30 mL) |
PELIGRO: H225: Líquido y vapores muy inflamables. H314: Provoca quemaduras graves en la piel y lesiones oculares graves. H336: Puede provocar somnolencia o vértigo. H412: Nocivo para los organismos acuáticos, con efectos nocivos duraderos. EUH032: En contacto con ácidos libera gases muy tóxicos. P210: Mantener alejado del calor, de superficies calientes, de chispas, de llamas abiertas y de cualquier otra fuente de ignición. No fumar. P280: Llevar guantes/prendas/gafas/máscara de protección. P303 + P361 + P353: EN CASO DE CONTACTO CON LA PIEL (o el pelo): quitar inmediatamente todas las prendas contaminadas. Enjuagar la piel con agua. P304 + P340 + P310: EN CASO DE INHALACIÓN: transportar a la persona al aire libre y mantenerla en una posición que le facilite la respiración. Llamar inmediatamente a un CENTRO DE TOXICOLOGÍA/médico. P305 + P351 + P338 + P310: EN CASO DE CONTACTO CON LOS OJOS: aclarar cuidadosamente con agua durante varios minutos. Quitar las lentes de contacto, si lleva y resulta fácil. Seguir aclarando. Llamar inmediatamente a un CENTRO DE TOXICOLOGÍA/médico. P370 + P378: En caso de incendio: utilizar arena seca, polvo químico seco o espuma resistente al alcohol para la extinción. 67-63-0 Propan-2-ol 593-84-0 Tiocianato de guanidina 51805-45-9 Clorhidrato de tris (2-carboxietil) fosfina 89-83-8 Timol |
* Este reactivo no está incluido en el kit COBAS® MAI.
** Las etiquetas de seguridad del producto se basan fundamentalmente en la regulación GHS de la UE.
*** Sustancia peligrosa.
Requisitos de almacenamiento y manipulación:
Los reactivos deben almacenarse y manipularse según las indicaciones de la Tabla 6 y la Tabla 7.
Cuando los reactivos no están cargados en los cobas® 6800/8800 Systems, almacénelos a la temperatura correspondiente especificada en la Tabla 6.
Tabla 6. Almacenamiento de reactivos (cuando el reactivo no está cargado en el sistema)
|
Reactivo |
Temperatura de almacenamiento |
|
cobas® MAI |
2-8 °C |
|
cobas® MAI Positive Control Kit |
2-8 °C |
|
cobas® Buffer Negative Control Kit |
2-8 °C |
|
cobas omni Lysis Reagent |
2-8 °C |
|
cobas omni MGP Reagent |
2-8 °C |
|
cobas omni Specimen Diluent |
2-8 °C |
|
cobas omni Wash Reagent |
15-30 °C (temperatura ambiente) |
Una vez cargados en los cobas® 6800/8800 Systems, los reactivos se almacenan automáticamente a la temperatura correspondiente adecuada y el sistema controla su fecha de caducidad. Los cobas® 6800/8800 Systems solamente permiten utilizar los reactivos cuando se cumplen todas las condiciones indicadas en la Tabla 7. El sistema evita automáticamente el uso de reactivos caducados. La Tabla 7 ayuda al usuario a entender las condiciones de manipulación de los reactivos de los cobas® 6800/8800 Systems.
Tabla 7. Condiciones de caducidad de los reactivos de los cobas® 6800/8800 Systems
|
Reactivo |
Estabilidad del kit abierto |
Series en las que se puede utilizar el kit |
Periodo de estabilidad (horas acumuladas de carga fuera de la nevera) |
|
COBAS® MAI |
90 días desde el primer uso |
Máx. 40 series |
Máx. 40 horas |
|
COBAS® MAI Positive Control Kit |
No aplicable |
No aplicable |
Máx. 10 horas |
|
cobas® Buffer Negative Control Kit |
No aplicable |
No aplicable |
Máx. 10 horas |
|
cobas omni Lysis Reagent |
30 días desde la carga* |
No aplicable |
No aplicable |
|
cobas omni MGP Reagent |
30 días desde la carga* |
No aplicable |
No aplicable |
|
cobas omni Specimen Diluent |
30 días desde la carga* |
No aplicable |
No aplicable |
|
cobas omni Wash Reagent |
30 días desde la carga* |
No aplicable |
No aplicable |
* El tiempo se calcula desde la primera vez que se carga el reactivo en los cobas® 6800/8800 Systems.
Almacene el reactivo MIS a la temperatura especificada en la Tabla 8.
Tabla 8. Almacenamiento de cobas® Microbial Inactivation Solution
|
Reactivo |
Temperatura de almacenamiento |
|
MIS |
2-8 °C |
Sin abrir, el reactivo MIS se conserva estable hasta la fecha de caducidad indicada. Una vez abierto, este reactivo se mantiene estable durante 30 días cuando se almacena a una temperatura comprendida entre 2 y 8 °C, incluidas 5 horas acumuladas a 15-30 °C (temperatura ambiente), o bien hasta la fecha de caducidad, lo que se produzca primero, según se especifica en la Tabla 9.
Tabla 9. Condiciones de caducidad de cobas® Microbial Inactivation Solution
|
Reactivo |
Fecha de caducidad del kit |
Estabilidad del kit abierto |
Series en las que se puede utilizar el kit |
Estabilidad a 15-30 °C (temperatura ambiente) |
|
MIS |
No caducado |
30 días desde el primer uso |
No aplicable |
Máx. 5 horas |
Material adicional necesario:
Tabla 10. Material y material fungible para uso en los cobas® 6800/8800 Systems
|
Material |
P/N |
|
cobas omni Processing Plate |
05534917001 |
|
cobas omni Amplification Plate |
05534941001 |
|
cobas omni Pipette Tips |
05534925001 |
|
cobas omni Liquid Waste Container |
07094388001 |
|
cobas omni Lysis Reagent |
06997538190 |
|
cobas omni MGP Reagent |
06997546190 |
|
cobas omni Specimen Diluent |
06997511190 |
|
cobas omni Wash Reagent |
06997503190 |
|
Bolsa para residuos sólidos y recipiente de residuos sólidos o Bolsa para residuos sólidos con complemento y actualización del kit del cajón de residuos sólidos |
07435967001 y 07094361001 o 08030073001 y 08387281001 |
|
MPA RACK 13 MM LIGHT GREEN 7001-7050* |
03.118.878.001 o equivalente |
* Se necesitan racks MPA de 13 mm para la prueba COBAS® MAI. Póngase en contacto con su representante local de Roche para obtener una lista de pedido detallada para racks de muestras, racks para puntas obstruidas y bandejas de racks compatibles con cada instrumento.
Tabla 11. Otros materiales y consumibles necesarios únicamente para el flujo de trabajo preanalítico
|
Material |
|
Sonicador de tubos TS 5 (Rinco Ultrasonics AG-P/N 46690) |
|
Tubos de polipropileno de 5 mL con tapones de rosca de 75 x 13 mm, base redonda (Sarstedt-P/N de los tubos 60.504.010, P/N de los tapones de rosca 65.163)* |
|
MPA RACK 13 MM LIGHT GREEN 7001-7050 (Roche-P/N 03118878001 o equivalente)** |
|
Centrífuga (opción para limitar la FCR a un máximo de 3.000 x g, compatible con tubos con tapón de rosca de 75 x 13 mm) |
|
Agitador vórtex |
|
Etiquetas de código de barras termoestables (OPAL Associates AG, P/N 20300824 TR PE-Folie Pharma o equivalente)*** |
* Para utilizar tubos distintos a los recomendados más arriba el usuario debe verificarlos antes de su implementación en el flujo de trabajo de la prueba COBAS® MAI en el laboratorio.
** Se requieren racks MPA de 13 mm para utilizar el sonicador de tubos TS 5. Póngase en contacto con su representante local de Roche para obtener una lista de pedido detallada para racks de muestras equivalentes en otros colores o rangos numéricos. Tenga en cuenta que los racks RD5 no son compatibles con el sonicador de tubos TS 5.
*** Para obtener más detalles sobre las especificaciones de los códigos de barras, consulte la Guía del usuario de los cobas® 6800/8800 Systems. Antes de utilizar etiquetas de códigos de barras distintas a las recomendadas, es necesario que el usuario compruebe si son compatibles con el flujo de trabajo COBAS® MAI del laboratorio. Póngase en contacto con su representante local de Roche para obtener más información sobre las etiquetas de códigos de barras compatibles así como sugerencias para la comprobación de la compatibilidad. El uso de etiquetas de códigos de barras no compatibles puede provocar daños en los tubos durante el proceso de sonicación y contaminación en el instrumento.
Instrumentos y software necesarios:
Es necesario instalar el software cobas® 6800/8800 y el paquete de análisis COBAS® MAI en los instrumentos. El IG (Instrument Gateway) se suministra con el sistema.
Tabla 12. Instrumentos
|
Equipo |
P/N |
|
cobas® 6800 System (plataforma móvil) |
05524245001 y 06379672001 |
|
cobas® 6800 System (plataforma fija) |
05524245001 y 06379664001 |
|
cobas® 8800 System |
05412722001 |
|
Módulo de suministro de muestras |
06301037001 |
|
Instrument Gateway |
06349595001 |
EVALUACIÓN DEL RENDIMIENTO:
Características clave de rendimiento:
Inactivación de la muestra:
La reducción del riesgo de infección micobacteriana mediante el tratamiento de las muestras con MIS ha sido evaluado mediante cultivos altamente positivos de dos cepas del complejo MTB (MTB CDC268 y MTB H37) en tres centros distintos y con tres lotes de reactivo MIS distintos. Para cada condición, se trataron cinco alícuotas de cultivo con niveles de concentración de hasta 5 x 107 UFC/mL con el reactivo MIS en una proporción de 1:2 durante 60 minutos a temperatura ambiente. A continuación, las muestras se centrifugaron durante 15 minutos a 3.000 x g, se lavaron dos veces con PBS estéril y finalmente se resuspendieron en 0,5 mL de PBS estéril. En dos de los centros se inoculó toda la muestra inactivada y se sometió a pruebas de crecimiento con el sistema de detección micobacteriana BACTEC™ MGIT™ 320 (Becton Dickinson). En el tercer centro se analizó la viabilidad de la bacteria MTB en un medio de Löwenstein-Jensen (LJ) sólido. Ninguna de las muestras inactivadas mostró crecimiento de las bacterias del complejo M. tuberculosis al final del periodo de incubación de 56 días.
Límite de detección (LoD):
El límite de detección de la prueba COBAS® MAI se determinó mediante el análisis de diluciones en serie de una cepa de M. intracellulare (ATCC® 13209™) y de una cepa de M. avium (ATCC® 19075™), cada una de ellas en dos matrices clínicas de pooles negativos (esputo sin procesar y sedimentos de esputo/LBA). Se analizaron paneles de niveles de concentración más un blanco con un total de 72 réplicas por concentración utilizando tres lotes de reactivo de la prueba COBAS® MAI, con múltiples series analíticas, días, operadores e instrumentos.
El LoD para M. intracellulare osciló entre 46,3 UFC/mL (sedimento de esputo/LBA) y 46,6 UFC/mL (esputo sin procesar). El LoD para M. avium osciló entre 43,5 UFC/mL (sedimento de esputo/LBA) y 44,9 UFC/mL (esputo sin procesar).
Inclusividad:
La inclusividad de la prueba COBAS® MAI se confirmó para once miembros del complejo M. avium mediante el análisis de un total de 25 cepas.
Se detectaron las siguientes especies que generaron resultados positivos para M. intracellulare:
• M. intracellulare (ATCC® 25130™, ATCC® 35763™, B99-03.25.0163, B99-04.23.0178, B00-08.20.1090, B99-05.19.0190, B98-10.30.0156)
• M. arosiense (E. Tortoli)
• M. chimaera (HO1421839)
• M. colombiense (DSM 45105)
• M. indicus pranii (DSM 45239)
• M. marseillense (CCUG 56325 T)
• M. timonense (11324/16)
• M. vulneris (DMS 45247)
• M. yongonense (B04-09.20.0164)
Se detectaron las siguientes especies que generaron resultados positivos para M. avium:
• M. avium (N-315 y N-337, aislado en cultivo de pacientes japoneses)
• M. avium subesp. avium (B95-X25 serotipo 3, B95-25522 serotipo 8, B95-18302 serotipo 15, ATCC® 35718™)
• M. avium subesp. hominissuis (ITM 960255)
• M. avium subesp. paratuberculosis (B98-11.02.0221)
• M. avium subesp. silvaticum (DSM 44157)
• M. bouchedurhonense (CCUG 56331)
Todas las cepas se detectaron a 256 UFC/mL y 241 UFC/mL para M. intracellulare y M. avium, respectivamente, utilizando el tipo de muestra de sedimento.
Precisión:
La precisión interna se examinó utilizando un panel formado por cultivos de M. intracellulare (ATCC® 13209™) y M. avium (ATCC® 19075™) diluidos en dos matrices de pooles clínicos negativos (esputo sin procesar y sedimentos de esputo/LBA). Las fuentes de variación se examinaron con un panel compuesto por tres niveles de concentración, utilizando tres lotes de reactivos para la prueba COBAS® MAI y dos instrumentos durante un periodo de 12 días y con un total de 24 series. En la Tabla 17 y en la Tabla 18 se muestra una descripción de los paneles de precisión y las tasas de positividad observadas. Todos los niveles de panel negativos resultaron negativos en todo el estudio. En el análisis de la desviación estándar y el porcentaje del coeficiente de variación de los valores de Ct de los ensayos realizados con los miembros del panel positivos (consulte la Tabla 19 y la Tabla 20) se obtuvieron CV (%) globales que oscilaban entre el 1,5% y el 2,7% para M. intracellulare y entre el 1,5% y el 2,5% para M. avium.
Tabla 17. Resumen de la precisión intralaboratorio-M. intracellulare
|
Concentración de fragmento objetivo |
N pruebas |
N MIN Positivas |
Tasa de positividad de MIN |
Intervalo de confianza al 95% |
|
|
Límite inferior |
Límite superior |
||||
|
M. intracellulare-esputo sin procesar |
|||||
|
Negativa |
48 |
0 |
0,0% |
0,0% |
7,4% |
|
77,4 UFC/mL |
48 |
48 |
100,0% |
92,6% |
100,0% |
|
232 UFC/mL |
48 |
48 |
100,0% |
92,6% |
100,0% |
|
M. intracellulare-sedimento |
|||||
|
Negativa |
48 |
0 |
0,0% |
0,0% |
7,4% |
|
74,3 UFC/mL |
48 |
48 |
100,0% |
92,6% |
100,0% |
|
223 UFC/mL |
48 |
48 |
100,0% |
92,6% |
100,0% |
Tabla 18. Resumen de la precisión intralaboratorio-M. avium
|
Concentración de fragmento objetivo |
N pruebas |
N MAV Positivas |
Tasa de positividad de MAV |
Intervalo de confianza al 95% |
|
|
Límite inferior |
Límite superior |
||||
|
M. avium-esputo sin procesar |
|||||
|
Negativa |
48 |
0 |
0,0% |
0,0% |
7,4% |
|
88,0 UFC/mL |
48 |
48 |
100,0% |
92,6% |
100,0% |
|
264 UFC/mL |
48 |
48 |
100,0% |
92,6% |
100,0% |
|
M. avium-sedimento |
|||||
|
Negativa |
48 |
0 |
0,0% |
0,0% |
7,4% |
|
71,1 UFC/mL |
48 |
48 |
100,0% |
92,6% |
100,0% |
|
213 UFC/mL |
48 |
48 |
100,0% |
92,6% |
100,0% |
Tabla 19. Media global, desviaciones estándar y coeficientes de variación (%) para el ciclo umbral, paneles de M. intracellulare positivos
|
Concentración de fragmento objetivo |
Tasa de positividad |
Ct medio |
Intra-series |
Entre series |
Entre días |
Entre instrumentos |
Entre lotes |
Total |
||||||
|
SD |
% de CV |
SD |
% de CV |
SD |
% de CV |
SD |
% de CV |
SD |
% de CV |
SD |
% de CV |
|||
|
M. intracellulare-esputo sin procesar |
||||||||||||||
|
77,4 UFC/mL |
100,0% |
37,6 |
0,83 |
2,2 |
0,00 |
0,0 |
0,48 |
1,3 |
0,20 |
0,5 |
0,00 |
0,0 |
0,98 |
2,6 |
|
232 UFC/mL |
100,0% |
36,5 |
0,74 |
2,0 |
0,47 |
1,3 |
0,33 |
0,9 |
0,00 |
0,0 |
0,29 |
0,8 |
0,98 |
2,7 |
|
M. intracellulare-sedimento |
||||||||||||||
|
74,3 UFC/mL |
100,0% |
38,1 |
0,56 |
1,5 |
0,34 |
0,9 |
0,00 |
0,0 |
0,17 |
0,4 |
0,13 |
1,8 |
0,69 |
1,8 |
|
223 UFC/mL |
100,0% |
36,9 |
0,37 |
1,0 |
0,25 |
0,7 |
0,00 |
0,0 |
0,33 |
0,9 |
0,00 |
0,0 |
0,56 |
1,5 |
Tabla 20. Media global, desviaciones estándar y coeficientes de variación (%) para el ciclo umbral, paneles de M. avium positivos
|
Concentración de fragmento objetivo |
Tasa de positividad |
Ct medio |
Intra-series |
Entre series |
Entre días |
Entre instrumentos |
Entre lotes |
Total |
||||||
|
SD |
% de CV |
SD |
% de CV |
SD |
% de CV |
SD |
% de CV |
SD |
% de CV |
SD |
% de CV |
|||
|
M. avium-esputo sin procesar |
||||||||||||||
|
88,0 UFC/mL |
100,0% |
37,9 |
0,87 |
2,3 |
0,00 |
0,0 |
0,25 |
0,7 |
0,24 |
0,6 |
0,00 |
0,0 |
0,94 |
2,5 |
|
264 UFC/mL |
100,0% |
36,4 |
0,48 |
1,3 |
0,40 |
1,1 |
0,35 |
1,0 |
0,16 |
0,4 |
0,00 |
0,0 |
0,73 |
2,0 |
|
M. avium-sedimento |
||||||||||||||
|
71,1 UFC/mL |
100,0% |
38,8 |
0,51 |
1,3 |
0,25 |
0,7 |
0,10 |
0,3 |
0,00 |
0,0 |
0,11 |
0,3 |
0,59 |
1,5 |
|
213 UFC/mL |
100,0% |
37,5 |
0,50 |
1,3 |
0,34 |
0,9 |
0,40 |
1,0 |
0,00 |
0,0 |
0,12 |
0,3 |
0,74 |
2,0 |
Especificidad analítica/reactividad cruzada:
Se analizó un panel de 173 bacterias, hongos y virus, incluidos los de mayor presencia en el tracto respiratorio, con la prueba COBAS® MAI a fin de valorar su especificidad analítica. Se analizaron los organismos indicados en la Tabla 21 con concentraciones de aproximadamente 1 x 106 unidades/mL para las bacterias y de aproximadamente 1 x 105 unidades/mL para los virus. Se analizaron todos los posibles organismos interferentes en ausencia y presencia del fragmento objetivo de M. intracellulare/M. avium (concentración de 200 UFC/mL). Ninguno de los organismos interfirió con el rendimiento de la prueba generando resultados falsos positivos. La detección del fragmento objetivo de M. intracellulare/M. avium no se vio afectada por los organismos analizados, a excepción de M. kansasii y M. szulgai con unos niveles de concentración > 1E+05 UFC/mL y de M. gastri con unos niveles de concentración > 1E+04 UFC/mL.
La posible reactividad cruzada de Histoplasma capsulatum, Mycobacterium africanum, Mycobaterium leprae, Mycobacterium microti, Mycobacterium pinnipedii y Mycobacterium suricattae se evaluó in silico. Los resultados de los análisis in silico predicen una probabilidad reducida de amplificación y detección de dichos organismos cuando se utiliza la prueba COBAS® MAI.
Tabla 21. Microorganismos analizados para la especificidad analítica/reactividad cruzada
|
Microorganismo |
Concentración |
Microorganismo |
Concentración |
|---|---|---|---|
|
Acinetobacter baumannii |
1,0E+06 UFC/mL |
Mycobacterium gordonae |
1,0E+06 UFC/mL |
|
Acinetobacter calcoaceticus |
1,0E+06 UFC/mL |
Mycobacterium haemophilum |
1,0E+06 UFC/mL |
|
Actinomyces israelii |
1,0E+06 UFC/mL |
Mycobacterium holsaticum |
1,0E+06 UFC/mL |
|
Actinomyces odontolyticus |
1,0E+06 UFC/mL |
Mycobacterium intermedium |
1,0E+06 UFC/mL |
|
Adenovirus |
1,0E+05 U/mL |
Mycobacterium kansasii |
1,0E+05 UFC/mL* |
|
Aeromonas hydrophila |
1,0E+06 UFC/mL |
Mycobacterium kumamontonense |
1,0E+06 UFC/mL |
|
Aspergillus fumigatus |
1,0E+06 UFC/mL |
Mycobacterium lentiflavum |
1,0E+06 UFC/mL |
|
Bacillus cereus |
1,0E+06 UFC/mL |
Mycobacterium malmoense |
1,0E+06 UFC/mL |
|
Bacillus subtilis subesp. subtilis |
1,0E+06 UFC/mL |
Mycobacterium mantenii |
1,0E+06 UFC/mL |
|
Bactericides fragilis |
1,0E+06 UFC/mL |
Mycobacterium marinum |
1,0E+06 UFC/mL |
|
Blastomyces dermatitidis |
1,0E+06 geq/mL |
Mycobacterium mucogenicum |
1,0E+06 UFC/mL |
|
Bordetella parapertussis |
1,0E+06 UFC/mL |
Mycobacterium neoaurum |
1,0E+06 UFC/mL |
|
Bordetella pertussis |
1,0E+06 UFC/mL |
Mycobacterium nonchromogeicum |
1,0E+06 UFC/mL |
|
Burkholderia cepacia |
1,0E+06 UFC/mL |
Mycobacterium orygis |
1,0E+06 UFC/mL |
|
Campylobacter jejuni subesp. jejuni |
1,0E+06 UFC/mL |
Mycobacterium peregrinum |
1,0E+06 UFC/mL |
|
Candida albicans |
1,0E+06 UFC/mL |
Mycobacterium scrofulaceum |
1,0E+06 UFC/mL |
|
Candida glabrata |
1,0E+06 UFC/mL |
Mycobacterium simiae |
1,0E+06 UFC/mL |
|
Candida krusei |
1,0E+06 UFC/mL |
Mycobacterium smegmatis |
1,0E+06 UFC/mL |
|
Candida parapsilosis |
1,0E+06 UFC/mL |
Mycobacterium szulgai |
1,0E+05 UFC/mL* |
|
Candida tropicalis |
1,0E+06 UFC/mL |
Mycobacterium terrae |
1,0E+06 UFC/mL |
|
Chlamydia trachomatis |
1,0E+06 UFI/mL |
Mycobacterium thermoresistible |
1,0E+06 UFC/mL |
|
Chlamydophila pneumoniaea |
1,0E+06 UFI/mL |
Mycobacterium triviale |
1,0E+06 UFC/mL |
|
Chromobacterium violaceum |
1,0E+06 UFC/mL |
Mycobacterium tuberculosis |
1,0E+06 UFC/mL |
|
Citrobacter freundii |
1,0E+06 UFC/mL |
Mycobacterium vaccae |
1,0E+06 UFC/mL |
|
Clostridium perfringens |
1,0E+06 UFC/mL |
Mycobacterium xenopi |
1,0E+06 UFC/mL |
|
Corynebacterium diphtheriae |
1,0E+06 UFC/mL |
Mycoplasma pneumoniae |
1,0E+06 ucc/mL |
|
Corynebacterium jeikeium |
1,0E+06 UFC/mL |
Neisseria gonorrhoeae |
1,0E+06 UFC/mL |
|
Corynebacterium pseudodiptheriticum |
1,0E+06 UFC/mL |
Neisseria lactamica |
1,0E+06 UFC/mL |
|
Corynebacterium ulcerans |
1,0E+06 geq/mL |
Neisseria meningitides |
1,0E+06 UFC/mL |
|
Corynebacterium xerosis |
1,0E+06 UFC/mL |
Neisseria mucosa |
1,0E+06 UFC/mL |
|
Cryptococcus neoformans |
1,0E+06 UFC/mL |
Neisseria sicca |
1,0E+06 UFC/mL |
|
Citomegalovirus |
1,0E+05 UFI/mL |
Nocardia asteroides |
1,0E+06 UFC/mL |
|
Eikenella corrodens |
1,0E+06 UFC/mL |
Nocardia brasiliensis |
1,0E+06 geq/mL |
|
Enterobacter aerogenes |
1,0E+06 UFC/mL |
Nocardia cyriacigeorgica |
1,0E+06 UFC/mL |
|
Enterobacter cloacae subesp. cloacae |
1,0E+06 UFC/mL |
Nocardia farcinica |
1,0E+06 UFC/mL |
|
Enterococcus avium |
1,0E+06 UFC/mL |
Nocardia nova |
1,0E+06 UFC/mL |
|
Enterococcus faecalis |
1,0E+06 UFC/mL |
Nocardia otitidiscaviarum |
1,0E+06 UFC/mL |
|
Enterococcus faecium |
1,0E+06 UFC/mL |
Nocardia transvalensis |
1,0E+06 UFC/mL |
|
Enterovirus tipo 68/2007 |
1,0E+05 U/mL |
Pasteurella multocida subesp. tigris |
1,0E+06 UFC/mL |
|
Escherichia coli |
1,0E+06 UFC/mL |
Pediococcus acidilactici |
1,0E+06 geq/mL |
|
Escherichia coli productora de CTX-M-15 ESBL |
1,0E+06 UFC/mL |
Pediococcus pentosaceus |
1,0E+06 UFC/mL |
|
Fusobacterium nucleatum subesp. nucleatum |
1,0E+06 UFC/mL |
Penicillium chermesinum |
1,0E+06 UFC/mL |
|
Gordona rubropertinctus |
1,0E+06 geq/mL |
Peptostreptococcus anaerobius |
1,0E+06 UFC/mL |
|
Haemophilus influenzae |
1,0E+06 UFC/mL |
Peptostreptococcus magnus |
1,0E+06 UFC/mL |
|
Haemophilus parahaemolyticus |
1,0E+06 UFC/mL |
Porphyromonas asaccharolytica |
1,0E+06 UFC/mL |
|
Haemophilus parainfluenzae |
1,0E+06 UFC/mL |
Prevotella melaninogenica |
1,0E+06 UFC/mL |
|
Virus del herpes simple tipo 1 |
1,0E+05 cp/mL |
Propionibacterium acnes |
1,0E+06 UFC/mL |
|
Virus del herpes simple tipo 2 |
1,0E+05 cp/mL |
Proteus mirabilis |
1,0E+06 UFC/mL |
|
Virus de inmunodeficiencia humana |
1,0E+05 cp/mL |
Proteus vulgaris |
1,0E+06 UFC/mL |
|
Virus de la gripe humana A |
1,0E+05 U/mL |
Providencia stuartii |
1,0E+06 UFC/mL |
|
Virus de la gripe humana B |
1,0E+05 U/mL |
Pseudomonas aeruginosa |
1,0E+06 UFC/mL |
|
Human metapneumovirus |
1,0E+05 U/mL |
Rhizopus spp. |
1,0E+06 UFC/mL |
|
Virus de la parainfluenza humana tipo 1 |
1,0E+05 U/mL |
Rhodococcus equi |
1,0E+06 UFC/mL |
|
Virus de la parainfluenza humana tipo 2 |
1,0E+05 U/mL |
Virus del sarampión |
1,0E+05 U/mL |
|
Virus de la parainfluenza humana tipo 3 |
1,0E+05 U/mL |
Virus de la rubeola |
1,0E+05 U/mL |
|
Virus de la parainfluenza humana tipo 4 |
1,0E+05 U/mL |
Rubulavirus |
1,0E+05 U/mL |
|
Virus sincitial respiratorio humano A |
1,0E+05 U/mL |
Salmonella enterica subesp. enterica serovar Dublín |
1,0E+06 UFC/mL |
|
Virus sincitial respiratorio humano B |
1,0E+05 U/mL |
Scedosporium spp. |
1,0E+06 UFC/mL |
|
Rinovirus humano 16 |
1,0E+05 U/mL |
Serratia marcescens subesp. marcescens |
1,0E+06 UFC/mL |
|
Kingella kingae |
1,0E+06 UFC/mL |
Shigella flexneri |
1,0E+06 UFC/mL |
|
Kingella oralis |
1,0E+06 UFC/mL |
Shigella sonnei |
1,0E+06 UFC/mL |
|
Klebsiella oxytoca |
1,0E+06 UFC/mL |
Staphylococcus aureus subesp. aureus |
1,0E+06 UFC/mL |
|
Klebsiella pneumoniae productora de KPC-3 |
1,0E+06 UFC/mL |
Staphylococcus capitis subesp. capitis |
1,0E+06 UFC/mL |
|
Klebsiella pneumoniae subesp. pneumoniae |
1,0E+06 UFC/mL |
Staphylococcus epidermidis |
1,0E+06 UFC/mL |
|
Lactobacillus acidophilus |
1,0E+06 UFC/mL |
Staphylococcus haemolyticus |
1,0E+06 UFC/mL |
|
Lactobacillus casei |
1,0E+06 UFC/mL |
Staphylococcus hominis subesp. hominis |
1,0E+06 UFC/mL |
|
Legionella micdadei |
1,0E+06 UFC/mL |
Staphylococcus lugdunensis |
1,0E+06 UFC/mL |
|
Legionella pneumophila subesp.pneumophila |
1,0E+06 UFC/mL |
Stenotrophomonas maltophilia |
1,0E+06 UFC/mL |
|
Leuconostoc mesenteroides subesp. |
1,0E+06 UFC/mL |
Streptococcus agalactiae |
1,0E+06 UFC/mL |
|
Listeria monocytogenes |
1,0E+06 UFC/mL |
Streptococcus constellatus subesp. constellatus |
1,0E+06 UFC/mL |
|
Moraxella catarrhalis |
1,0E+06 UFC/mL |
Streptococcus equi subesp. equi |
1,0E+06 UFC/mL |
|
Morganella morganii subesp. morganii |
1,0E+06 UFC/mL |
Streptococcus mitis |
1,0E+06 UFC/mL |
|
Mycobacterium abscessus |
1,0E+06 UFC/mL |
Streptococcus mutans |
1,0E+06 UFC/mL |
|
Mycobacterium asiaticum |
1,0E+06 UFC/mL |
Streptococcus parasanguinis |
1,0E+06 UFC/mL |
|
Mycobacterium bovis BCG |
1,0E+06 UFC/mL |
Streptococcus pneumoniae |
1,0E+06 UFC/mL |
|
Mycobacterium bovis subesp. bovis |
1,0E+06 UFC/mL |
Streptococcus pyogenes |
1,0E+06 UFC/mL |
|
Mycobacterium bovis subesp. caprae |
1,0E+06 UFC/mL |
Streptococcus salivarius subesp. salivarius |
1,0E+06 UFC/mL |
|
Mycobacterium canetti |
1,0E+06 UFC/mL |
Streptococcus sanguinis |
1,0E+06 UFC/mL |
|
Mycobacterium caprae |
1,0E+06 UFC/mL |
Streptococcus uberis |
1,0E+06 UFC/mL |
|
Mycobacterium celatum |
1,0E+06 UFC/mL |
Streptomyces anulatus |
1,0E+06 UFC/mL |
|
Mycobacterium chelonae |
1,0E+06 UFC/mL |
Streptomyces griseus |
1,0E+06 UFC/mL |
|
Mycobacterium chubuense |
1,0E+06 UFC/mL |
Tsukamurella spp. |
1,0E+06 geq/mL |
|
Mycobacterium confluentis |
1,0E+06 UFC/mL |
Virus de la varicela zóster |
1,0E+05 cp/mL |
|
Mycobacterium flavescens |
1,0E+06 UFC/mL |
Veillonella atypica |
1,0E+06 UFC/mL |
|
Mycobacterium fortuitum |
1,0E+06 UFC/mL |
Veillonella parvula |
1,0E+06 UFC/mL |
|
Mycobacterium fuerth |
1,0E+06 UFC/mL |
Weissella paramesenteroides |
1,0E+06 UFC/mL |
|
Mycobacterium gastri |
1,0E+04 UFC/mL* |
- |
- |
* Nivel al que no se observó ninguna interferencia con la detección de M. intracellulare y M. avium, analizado también con concentración de 1,0E+06 UFC/mL, en cuyo caso se produjeron interferencias con los fragmentos objetivo tanto de M. intracellulare como de M. avium.
Interferencia:
Se evaluó el efecto de sustancias exógenas potencialmente secretadas en las muestras respiratorias (Tabla 22). Cada sustancia potencialmente interferente se analizó a niveles iguales o superiores a los clínicamente relevantes en muestras de esputo artificiales en ausencia y en presencia del fragmento objetivo de M. intracellulare y M. avium (añadido a 200 UFC/mL).
Ninguna de las sustancias interfirió con el rendimiento de la prueba generando resultados falsos negativos o falsos positivos.
Tabla 22. Lista de sustancias exógenas analizadas para determinar la interferencia
|
Sustancia |
Concentración |
Sustancia |
Concentración |
|
Sulfato de albuterol |
0,5 μg/mL |
Monosulfato de kanamicina |
240 μg/mL |
|
Amikacina |
80,1 μg/mL |
Levofloxacina |
5 mg/mL |
|
Amoxicilina |
86,4 μg/mL |
Lidocaína HCl |
1,2% (p/v) |
|
Beclometasona |
3.459 pg/mL |
Mentol |
0,50% (p/v) |
|
Benzocaína |
1,2% (p/v) |
Salicilato de metilo |
0,06% (v/v) |
|
Budesónida |
3 mg/mL |
Mometasona |
100 μg/mL |
|
Petasita |
225 mg/mL |
Moxifloxacina |
15 μg/mL |
|
Capreomicina |
80 μg/mL |
Mupirocina |
5% (p/v) |
|
Cloruro de cetilpiridinio |
0,5% (p/v) |
NaCl |
5% (p/v) |
|
Gluconato de clorhexidina |
1% (v/v) |
Nicotina |
1 μg/mL |
|
Cicloserina |
105 μg/mL |
Nistatina |
1% (v/v) |
|
Claritromicina |
20 μg/mL |
Oximetazolina |
12 ng/mL |
|
Dexametasona |
601 ng/mL |
Pentamidina |
1366 ng/mL |
|
Hidrocloruro de efedrina |
1 mg/mL |
Fenilefrina |
5 mg/mL |
|
Epinefrina |
100 pg/mL |
Prednisolona |
3 μg/mL |
|
Etambutol |
50 μg/mL |
Pirazinamida |
240 μg/mL |
|
Etionamida |
15 μg/mL |
Rifampicina |
25 μg/mL |
|
Eucalipto |
0,002% (v/v) |
Extracto de ortiga (500 mg) |
5 mg |
|
Fluticasona |
400 μg/mL |
Estreptomicina |
240 μg/mL |
|
Propionato de fluticasona |
5 μg/mL |
Azufre |
0,01% (p/v) |
|
Formoterol fumarato |
66 μg/mL |
Aceite de árbol de té |
0,50% (v/v) |
|
Raíz de sello de oro (cápsulas de 570 mg) |
5,7 mg |
Teofilina |
20 μg/mL |
|
Guaifenesina |
5 mg/mL |
Tobramicina |
24,1 μg/mL |
|
Isoniazida |
50 μg/mL |
Zanamivir |
10 mg/mL |
Se analizaron sustancias endógenas que podrían estar presentes en muestras respiratorias a fin de determinar su interferencia (Tabla 23). Cada sustancia potencialmente interferente se analizó a niveles iguales o superiores a los clínicamente relevantes en muestras de esputo artificiales en ausencia y en presencia del fragmento objetivo de M. intracellulare y M. avium (añadido a 200 UFC/mL).
Ninguna de las sustancias interfirió con el rendimiento de la prueba generando resultados falsos positivos. Ninguna de las sustancias, a excepción de la mucina al 5%, interfirió con el rendimiento de la prueba generando resultados falsos negativos. No se observó ninguna interferencia para la mucina con niveles de concentración del 4% o inferiores.
Tabla 23. Lista de sustancias endógenas analizadas para determinar su interferencia
|
Sustancia |
Concentración |
Sustancia |
Concentración |
|---|---|---|---|
|
Jugo gástrico |
10% (v/v) |
Mucina |
4%* |
|
Hemoglobina |
2 g/L |
Pus |
5% |
|
Sangre total humana |
5% (v/v) |
Saliva |
10% (v/v) |
|
ADN humano |
4 mg/L |
- |
- |
* Nivel al que no se observó ninguna interferencia con la detección de M. intracellulare y M. avium, analizado también con una concentración del 5%, en cuyo caso se detectaron interferencias parciales con los fragmentos objetivo tanto de M. intracellulare como de M. avium.
Fallo de todo el sistema:
Las muestras analizadas en el estudio de fallo de todo el sistema fueron muestras de esputo y de sedimento de esputo artificiales a las que se añadió fragmento objetivo de M. intracellulare y M. avium con una concentración de aproximadamente 3 x LoD de la matriz respectiva. Los resultados de este estudio determinaron que todas las réplicas fueron válidas y positivas para M. intracellulare y M. avium, lo que representa una tasa de fallo de todo el sistema del 0% con un intervalo de confianza unilateral superior del 95% del 3,0%.
Contaminación por arrastre:
Se ha estudiado la posible contaminación por arrastre en los cobas® 6800/8800 Systems que utilizan la prueba COBAS® MAI mediante la prueba relacionada cobas® MTB y tipos de muestras y flujos de trabajo idénticos. La contaminación por arrastre puede causar resultados falsos positivos. El estudio de rendimiento ha determinado que la tasa de contaminación por arrastre entre muestras es del 0,0% (0/240) tras realizar alternativamente varias series para analizar tanto muestras positivas muy altas como muestras negativas. Las pruebas se realizaron utilizando muestras de sedimento de esputo artificial a las que se añadió fragmento objetivo del complejo MTB a una concentración de 2 x 106 UFC/mL, una concentración de muestra que genera valores de Ct antes que en el 95% de las muestras de pacientes infectados en la población objetivo.
Rendimiento con muestras clínicas:
El rendimiento de la prueba COBAS® MAI utilizando muestras clínicas se evaluó mediante el análisis de muestras prospectivas y archivadas (esputo sin procesar, sedimentos de esputo/LBA) procedentes de sujetos con presunta infección respiratoria micobacteriana en Alemania, Japón, Sudáfrica, Suiza y Texas. Se realizaron unas pruebas de comparación en paralelo con la prueba COBAS® TaqMan® MAI. La sensibilidad y especificidad se establecieron en comparación con el cultivo. La población de pacientes seleccionada para determinar la sensibilidad estaba formada por 51 frotis negativos a BAAR (49%), 13 frotis con BAAR insuficientes (13%), 19 frotis de BAAR 1+ (18%), 15 frotis de BAAR 2+ (14%), 4 frotis de BAAR 3+ (4%) y 2 frotis de BAAR indeterminados (2%) pertenecientes a sedimentos de esputo/LBA, lo que supone un total de 81 sedimentos de esputo y 23 sedimentos de LBA. En el caso de los esputos sin procesar, se analizaron 26 frotis negativos a BAAR (47%), 5 frotis con BAAR insuficientes (9%), 8 frotis de BAAR 1+ (15%), 12 frotis de BAAR 2+ (22%) y 4 frotis de BAAR 3+ (7%).
Los resultados se muestran en la Tabla 24.
Tabla 24. Sensibilidad y especificidad de la prueba COBAS® MAI utilizando muestras clínicas
|
Roche COBAS®MAI |
Roche COBAS® TaqMan®MAI |
||||
|
Sensibilidad |
Esputo sin procesar |
MIN C+ |
MIN |
16/24 66,7% [44,7-84,4%] |
N/A |
|
MAV C+ |
MAV |
27/31 87,1% [70,1-96,3%] |
N/A |
||
|
MIN y/o MAV C+ |
MIN/MAV |
44/55 80,0% [67,0-89,6%] |
N/A |
||
|
Sedimento |
MIN C+ |
MIN |
27/46 58,7% [43,2-73,0%] |
32/46 69,6% [54,2-82,3%] |
|
|
MAV C+ |
MAV |
35/58 60,3% [46,6-72,9%] |
36/58 62,1% [48,4-74,5%] |
||
|
MIN y/o MAV C+ |
MIN/MAV |
62/104 59,6% [49,5-69,1%] |
68/104 65,4% [55,4-74,4%] |
||
|
Especificidad |
Esputo sin procesar |
MIN C- |
MIN |
350/350 100,0% [99,0-100,0%] |
N/A |
|
MAV C- |
MAV |
350/350 100,0% [99,0-100,0%] |
N/A |
||
|
MIN y MAV C- |
MIN/MAV |
350/350 100,0% [99,0-100,0%] |
N/A |
||
|
Sedimento |
MIN C- |
MIN |
412/412 100,0% [99,1-100,0%] |
408/412 99,0% [97,5-99,7%] |
|
|
MAV C- |
MAV |
412/412 100,0% [99,1-100,0%] |
411/412 99,8% [98,7-100,0%] |
||
|
MIN y MAV C- |
MIN/MAV |
412/412 100,0% [99,1-100,0%] |
407/412 98,8% [97,2-99,6%] |
||
|
C = Cultivo |
|||||
USO PREVISTO:
COBAS® MAI para uso en los cobas®6800/8800 Systems es una prueba cualitativa automatizada de diagnóstico in vitro que utiliza la reacción en cadena de la polimerasa (PCR) a tiempo real para la detección directa y la diferenciación de ADN de Mycobacterium avium y Mycobacterium intracellulare en muestras respiratorias humanas, incluidas muestras de esputo sin procesar, así como muestras de esputo y muestras de lavado broncoalveolar (LBA) digeridas y descontaminadas (tratadas con N-acetil-L-cisteína/NaOH [NALC-NaOH]). Esta prueba se ha diseñado como complemento del cultivo en el diagnóstico de la infección por el complejo M. avium-intracellulare (MAC).
INSTRUCCIONES DE USO:
Notas sobre el procedimiento.
• No utilice la prueba COBAS® MAI, el COBAS® MAI Positive Control Kit, el cobas® Buffer Negative Control Kit, el MIS ni ningún reactivo cobas omni después de su fecha de caducidad.
• No reutilice el material fungible. Es de un solo uso.
• Asegúrese de que las etiquetas de código de barras termoestables de los tubos de muestras están orientadas hacia las ranuras situadas en la parte superior del lateral de los racks de muestras MPA y puedan verse a través de ellas. Consulte la Ilustración 1 y la Guía del usuario de los cobas® 6800/8800 Systems para conocer las especificaciones de códigos de barras adecuadas e información adicional sobre la carga de tubos de muestras.
• Cerciórese de destapar los tubos de muestras después de la sonicación y antes de cargarlos en los cobas® 6800/8800 Systems.
• Consulte la Guía del usuario de los cobas® 6800/8800 Systems para obtener información sobre el correcto mantenimiento de los instrumentos.
Antes de realizar la prueba MAI en los cobas® 6800/8800 Systems, las muestras deben procesarse de acuerdo con los apartados siguientes: “Procesamiento de muestras de esputo sin procesar” o “Procesamiento sedimentos de esputo y de LBA” y “Sonicación de las muestras”. Los flujos de trabajo representativos abreviados se resumen en la Tabla 13 para muestras de esputo sin procesar y en la Tabla 14 para muestras de sedimento. Para obtener más detalles, siga leyendo los apartados siguientes.
Nota: el proceso de inactivación de las muestras por el reactivo MIS debe realizarse en una cabina de seguridad biológica (BSC, tipo A2) en un laboratorio con nivel de bioseguridad 319 u otras medidas de bioseguridad de acuerdo con las directrices o regulaciones locales y del centro.
Nota: La sonicación de las muestras tratadas con MIS puede llevarse a cabo en un laboratorio de tipo BSL-2 o en otro entorno con control de bioseguridad de acuerdo con las directrices o regulaciones locales y del centro.
Tabla 13. Resumen de flujos de trabajo-Muestra de esputo sin procesar

Tabla 14. Resumen de flujos de trabajo-Muestra de sedimento
Procesamiento de muestras de esputo sin procesar:
• Confirme que el contenedor de esputo sin procesar está correctamente etiquetado y contiene un mínimo de 0,4 mL de esputo. Si se ha almacenado congelada, descongele y equilibre la muestra a temperatura ambiente.
• Invierta las botellas de MIS de dos a cuatro veces antes de su uso.
• Abra el contenedor de esputo y añada aproximadamente dos partes de MIS a una parte de muestra de esputo (p. ej., 2 mL de MIS a 1 mL de muestra de esputo) mediante una estimación de volumen visual y con una pipeta desechable. Cierre bien el contenedor de esputo.
• Cierre las botellas de MIS inmediatamente después de usarlas.
• Agite fuertemente o mezcle por vórtice durante 30-60 segundos.
Nota: Asegúrese de que la muestra de esputo se mezcla completamente con el reactivo MIS.
• Incube la muestra como mínimo 60 minutos a 15-30° C (temperatura ambiente).
Nota: Consulte el apartado “Almacenamiento de muestras inactivadas” para conocer las condiciones de almacenamiento máximas.
• Agite fuertemente o mezcle por vórtice durante 30-60 segundos o hasta que la muestra esté completamente homogeneizada.
• Transfiera un mínimo de 1,2 mL y un máximo de 3,6 mL de muestra de esputo tratada con MIS a un tubo de polipropileno de 5 mL con tapón de rosca y código de barras termoestable de 75 x 13 mm y base redonda (Sarstedt-P/N del tubo 60.504.010, P/N del tapón 65.163). Cierre bien el tubo.
Nota: Antes de transferir la muestra, confirme que la información del código de barras del contenedor de esputo coincide con la del tubo secundario de 5 mL.
Nota: Consulte la Tabla 15.
• Lleve a cabo la sonicación de la muestra inactivada de acuerdo con el apartado “Sonicación de las muestras” antes de realizar la prueba COBAS® MAI.
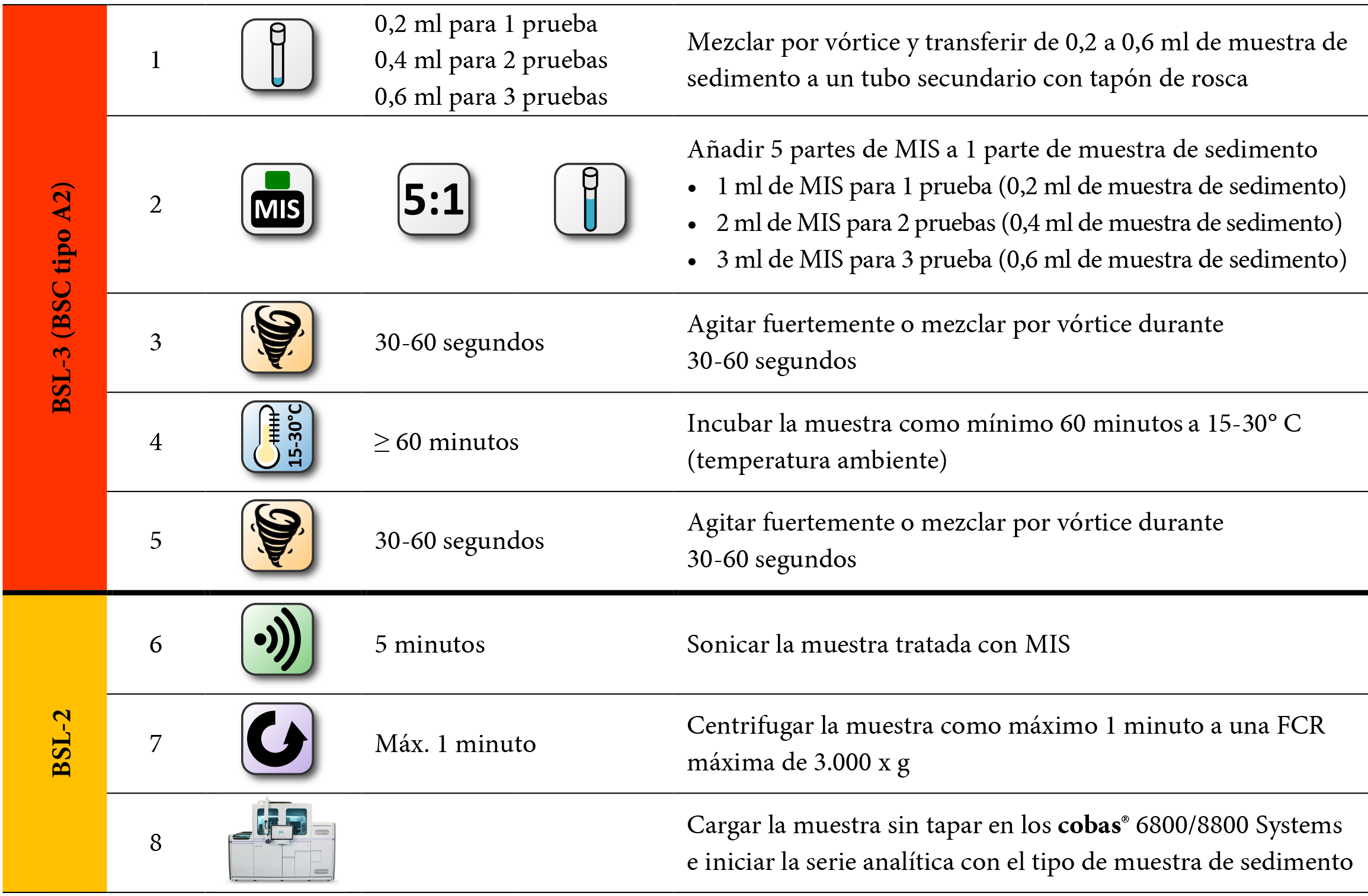
Procesamiento de sedimentos de esputo y de LBA:
• Confirme que el contenedor de sedimento de esputo y de LBA tratado con NALC-NaOH está correctamente etiquetado y contiene un mínimo de 0,2 mL de muestra. Si se ha almacenado congelada, descongele y equilibre la muestra a temperatura ambiente.
• Agite la muestra de sedimento durante un mínimo de 10 segundos.
• Transfiera un mínimo de 0,2 mL y un máximo de 0,6 mL de muestra de sedimento a un tubo de polipropileno de 5 mL con tapón de rosca y código de barras de 75 x 13 mm y base redonda (Sarstedt-P/N del tubo 60.504.010, P/N del tapón 65.163).
Nota: Antes de transferir la muestra confirme que la información del código de barras del contenedor de muestra coincide con la del tubo secundario de 5 mL.
• Invierta las botellas de MIS de dos a cuatro veces antes de su uso.
• Añada cinco partes de MIS a una parte de muestra (p. ej., 1 mL de MIS a 0,2 mL de muestra). Cierre bien el tubo.
Nota: Consulte la Tabla 15.
• Cierre las botellas de MIS inmediatamente después de usarlas.
• Agite fuertemente de 10 a 20 veces o mezcle por vórtice durante 30-60 segundos. Nota: un movimiento hacia delante y hacia atrás se considera una sola sacudida. Nota: asegúrese de que la muestra se mezcla completamente con el reactivo MIS.
• Incube la muestra como mínimo 60 minutos a 15-30° C (temperatura ambiente).
Nota: Consulte el apartado “Almacenamiento de muestras inactivadas” para conocer las condiciones de almacenamiento máximas.
• Agite fuertemente o mezcle por vórtice durante 30-60 segundos.
• Lleve a cabo la sonicación de la muestra inactivada de acuerdo con el apartado “Sonicación de las muestras” antes de realizar la prueba COBAS® MAI.
Tabla 15 Requisitos de volumen de muestra tratada con cobas® Microbial Inactivation Solution para realizar la prueba COBAS® MAI
|
Pruebas que se realizarán desde tubo secundario |
Volumen mínimo requerido de muestra tratada con MIS |
Volumen máximo permitido de muestra tratada con MIS |
|
1 petición de prueba |
1,2 mL |
3,6 mL |
|
2 peticiones de pruebas* |
2,4 mL |
3,6 mL |
|
3 peticiones de pruebas* |
3,6 mL |
3,6 mL |
* Se puede usar para el procesamiento en un lote mixto con otros ensayos cobas® 6800/8800 utilizando el mismo tipo de muestra o para una prueba de repetición.
Sonicación de las muestras:
• El proceso de sonicación de las muestras para realizar la prueba COBAS® MAI debe llevarse a cabo en un dispositivo sonicador de tubos TS 5 de Rinco Ultrasonics AG (P/N 46690). El uso de otros dispositivos de sonicación puede generar resultados falsos positivos, falsos negativos y/o inválidos. El funcionamiento del sonicador se describe con detalle en la Guía del usuario del fabricante.
• Coloque cinco tubos con tapón de rosca cerrados y etiquetados con código de barras que contengan de 1,2 mL a 3,6 mL de muestra tratada con MIS en un rack MPA.
Nota: Asegúrese de que las etiquetas de código de barras termoestables de los tubos de muestras están orientadas hacia las ranuras situadas en la parte superior del lateral de los racks de muestras MPA y puedan verse a través de ellas (consulte la Ilustración 1).
Nota: Compruebe que cada tubo contiene una etiqueta de código de barras.
Nota: Asegúrese de que están ocupadas las cinco posiciones de tubo del rack MPA. Si hay disponibles menos de cinco tubos con muestra tratada con MIS, las posiciones restantes deben ocuparse con tubos “comodín” llenos de agua o MIS del mismo tipo de tubo y con una etiqueta de código de barras.
Ilustración 1. Colocación correcta de los tubos de muestra en un rack MPA antes de la sonicación

• Inicie el sonicador de tubos.
• Seleccione el perfil de sonicación predefinido “Respiratory Samples” (Muestras respiratorias).
• Abra el dispositivo sonicador de tubos e inserte el rack MPA siguiendo las instrucciones del fabricante.
• Cierre el sonicador de tubos.
• Inicie la serie de sonicación.
• Confirme que la serie de sonicación ha finalizado correctamente y retire el rack MPA.
Nota: Los tubos de muestra se calientan durante la serie de sonicación. Preste atención cuando retire el rack MPA con los tubos de muestra.
Nota: Si la sonicación no se realiza correctamente, consulte las instrucciones del fabricante, corrija la causa del fallo y repita la serie de sonicación después de permitir el enfriamiento de las muestras durante 15 minutos como mínimo.
• Ahora, las muestras tratadas con MIS y sonicadas pueden ejecutarse con la prueba COBAS® MAI o bien almacenarse según las condiciones especificadas en el apartado “Almacenamiento de muestras inactivadas”.
Ejecución de la prueba COBAS® MAI:
La prueba COBAS® MAI puede ejecutarse con un volumen de muestra mínimo requerido de 1,2 mL. El funcionamiento del instrumento se describe con detalle en la Guía del usuario o la Asistencia al usuario de los cobas® 6800/8800 Systems. En la Ilustración 2 se resume el procedimiento.
Antes de destapar los tubos y cargar las muestras en los cobas® 6800/8800 Systems, se recomienda sedimentar los restos celulares y de la matriz mediante centrifugación de la muestra durante 1 minuto como máximo a una FCR máxima de 3.000 x g.
Nota: Mezcle por vórtice las muestras un mínimo de 10 segundos si las muestras han estado almacenadas durante más de 1 hora después de la sonicación y antes de la centrifugación.
Nota: La omisión del paso de centrifugación puede resultar en un incremento de la tasa de coágulos en la muestra en los cobas® 6800/8800 Systems.
Ilustración 2. Procedimiento de la prueba COBAS® MAI
|
1 |
Inicie sesión en el sistema. Pulse el botón “Iniciar” para preparar el sistema. Solicite las pruebas. • Seleccione “Raw sputum” (Esputo sin procesar) para solicitar muestras de esputo sin procesar tratadas con MIS. • Seleccione “Sediment” (Sedimento) para solicitar muestras de sedimento de esputo/LBA tratadas con MIS. |
|
2 |
Cargue los reactivos y el material fungible según las indicaciones del sistema. • Cargue el casete de reactivo específico de la prueba. • Cargue los casetes de control. • Cargue las puntas de pipeta. • Cargue las placas de procesamiento. • Cargue el reactivo MGP. • Cargue las placas de amplificación. • Cargue el diluyente de muestras. • Cargue el reactivo de lisis. • Cargue el reactivo de lavado. |
|
3 |
Cargue las muestras en el sistema. • Para cada muestra: • Retire el tapón del tubo. • Transfiera el tubo a un rack. • Cargue el rack de muestras y los racks para puntas obstruidas en el módulo de suministro de muestras. • Confirme que las muestras han sido aceptadas en el módulo de transferencia. |
|
4 |
Inicie la serie analítica. |
|
5 |
Revise y exporte los resultados. |
|
6 |
Retire y tape todos los tubos de muestra que cumplan los requisitos de volumen mínimo para utilizarlos en el futuro, en caso necesario. Limpie el instrumento. • Descargue los casetes de control vacíos. • Vacíe el cajón de placas de amplificación. • Vacíe los residuos líquidos. • Vacíe los residuos sólidos. |
INFORMACIÓN ADICIONAL:
Características principales del ensayo:
|
Tipos de muestras |
• Esputo sin procesar • Sedimentos de esputo y LBA tratados con NALC-NaOH |
|
Cantidad de muestra procesada |
• ≥ 0,4 mL de muestra de paciente tratada con MIS en una concentración de 1:2 (volumen total ≥ 1,2 mL) requerida en un tubo de muestra para esputo sin procesar; el instrumento procesa 0,85 mL • ≥ 0,2 mL de muestra de paciente tratada con MIS en una concentración de 1:5 (volumen total ≥ 1,2 mL) requerida en un tubo de muestra para sedimento de esputo/LBA; el instrumento procesa 0,85 mL |
|
Duración de la prueba |
• < 3,5 horas hasta la obtención del primer resultado |
Símbolos:
Los símbolos siguientes se emplean en el rotulado de todos los productos de diagnóstico por PCR de Roche.
Tabla 25. Símbolos utilizados en las etiquetas de los productos de PCR para diagnóstico de Roche


Marcas registradas y patentes:
Este producto está cubierto por una o más patentes de EE. UU. con n.º 8097717, 8192958, 10059993, 10358675, 8609340, 9234250, 8129118 y 6727067, y por las patentes equivalentes extranjeras.
COBAS, COBAS OMNI y AMPERASE son marcas comerciales de Roche.
El resto de nombres de productos y marcas comerciales son propiedad de sus respectivos propietarios.
La tecnología de prevención de contaminación cruzada de la enzima AmpErase® está protegida por la patente estadounidense 7,687,247 propiedad de Life Technologies y con licencia para Roche Molecular Systems, Inc. Consulte http://www.roche-diagnostics.us/patents
Copyright
©2021 Roche Molecular Systems, Inc.
Bibliografía:
1. Wolinsky E, Rynearson TK. Mycobacteria in soil and their relation to disease-associated strains. Am Rev Respir Dis. 1968;97:1032-7.
2. Chapman JS. The ecology of the atypicalmycobacteria. Arch Environ Health. 1971;22:41-6.
3. Goslee S, Wolinsky E. Water as a source of potentially pathogenic mycobacteria. Am Rev Respir Dis.;1976:113:287-92.
4. Gruft H, Falkinham JO 3rd, Parker BC. Recent experience in the epidemiology of disease caused by atypical mycobacteria. Rev Infect Dis. 1981;3:990-6.
5. Griffith DE, Aksamit T, Brown-Elliott BA, et al. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. AmericanJ Respir Crit Care Med. 2007;175:367-416.
6. Cayrou C, Turenne C, Behr MA, Drancourt M. Genotyping of Mycobacterium avium complex organisms using multispacer sequence typing. Microbiology. 2010;156:687-94.
7. Tortoli E. Microbiological features and clinical relevance of new species of the genus mycobacterium. Clin Microbiol Rev. 2014;27:727-52.
8. Saito H, Tomioka H, Sato K, Tasaka H, Dawson DJ. Identification of various serovar strains of Mycobacterium avium complex by using DNA probes specific for Mycobacterium avium and Mycobacterium intracellulare. J Clin Microbiol. 1990;28:1694-7.
9. Horsburgh CR Jr. Epidemiology of Mycobacterium avium complex disease. Am J Med. 1996;102:11-5.
10. Cassidy PM, Hedberg K, Saulson A, McNelly E, Winthrop KL. Nontuberculous mycobacterial disease prevalence and risk factors: a changing epidemiology. Clin Infect Dis. 2009; 49:e124-9.
11. Maugein J, Dailloux M, Carbonnelle B, Vincent V, Grosset J. Sentinel-site surveillance of Mycobacterium avium complex pulmonary disease. Eur Respir J. 2005;26:1092-6.
12. Freeman J, Morris A, Blackmore T, Hammer D, Munroe S, McKnight L. Incidence of nontuberculous mycobacterial disease in New Zealand, 2004. N Z Med J. 2007;120:U2580.
13. Longo MC, Berninger, MS, Hartley JL. Use of uracil DNA glycosylase to control carry-over contamination in polymerase chain reactions. Gene. 1990;93:125-8.
14. Higuchi R, Dollinger, G, Walsh PS, Griffith R. Simultaneous amplification and detection of specific DNA sequences. Biotechnology (NY). 1992;10:413-7.
15. Heid CA, Stevens J, Livak JK, Williams PM. Real time quantitative PCR. Genome Research. 1996;6:986-94.
16. Centers for Disease Control and Prevention. Biosafety in Microbiological and Biomedical Laboratories, 5th ed. U.S. Department of Health and Human Services, Public Health Service, Centers for Disease Control and Prevention, National Institutes of Health HHS Publication No. (CDC) 21-1112, revised December 2009.
17. Clinical and Laboratory Standards Institute (CLSI). Protection of laboratory workers from occupationally acquired infections. Approved Guideline-Fourth Edition. CLSI Document M29-A4:Wayne, PA;CLSI, 2014.
18. World Health Organization. Tuberculosis laboratory biosafety manual. Geneva, Switzerland; WHO, 2012.
19. Kent PT, Kubica GP. Public Health Mycobacteriology: A Guide for the Level III Laboratory:Atlanta, GA U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, 1985.
Fabricado en los Estados Unidos
Roche Diagnostics GmbH Sandhofer Strasse 116
68305 Mannheim, Germany www.roche.com
Fabricado en los EE. UU.
Distributed by
Roche Diagnostics GmbH Sandhofer Strasse 116
68305 Mannheim, Germany
Roche Diagnostics
9115 Hague Road
Indianapolis, IN 46250-0457 USA
(For Technical Assistance call the
Roche Response Center
Toll-free: 1-800-526-1247)
RESUMEN Y EXPLICACIÓN DE LA PRUEBA:
Información de referencia:
M. avium y M. intracellulare son dos especies distintas estrechamente relacionadas entre sí de micobacterias no tuberculosas (NTM), que forman parte del MAC, y que también pueden agruparse como M. avium intracellulare (MAI). Las NTM son especies micobacterianas distintas de M. tuberculosis y M. leprae. Por lo general, las NTM son organismos vivos libres ubicuos en el entorno.1-4 Se encuentran en las aguas superficiales, el agua del grifo, la tierra, los animales domésticos y salvajes, la leche y los productos alimenticios. Si bien las NTM pueden colonizar superficies corporales y secreciones sin causar enfermedades, se han asociado con cuatro síndromes clínicos distintos: enfermedad pulmonar progresiva (MAC, M. kansasii y M. abscessus), linfadenitis superficial, observada comúnmente en poblaciones pediátricas, (MAC, M. scrofulaceum, M. malmoense), enfermedad diseminada en pacientes gravemente inmunodeprimidos e infección cutánea y de tejidos blandos derivada por lo general de la inoculación directa.5
Actualmente el MAC incluye doce especies de micobacterias de crecimiento lento asociadas al entorno o de origen animal: M. avium, M. intracellulare, M. chimaera, M. colombiense, M. arosiense, M. bouchedurhonense, M. marseillense, M. timonense, M. indicus pranii, M. mantenii, M. vulneris, M. yongonense.6,7 Existen 28 serotipos de M. avium y M. intracellulare8, y M. avium consta de 4 subespecies: M. avium subesp. avium, M. avium subesp. paratuberculosis, M. avium subesp. hominissuis y M. avium subesp. silvaticum.6 El MAC es la NTM más comúnmente asociada a la enfermedad en humanos.5
El MAC es fundamentalmente un patógeno pulmonar que afecta a personas inmunodeprimidas (p. ej., pacientes con SIDA, leucemia de células pilosas o que reciben quimioterapia inmunosupresora). El MAC se transmite al tracto respiratorio mediante la inhalación y al tracto gastrointestinal mediante la ingestión. No hay pruebas de que pueda transmitirse de animales a humanos o entre humanos, por lo que no se considera contagiosa. Las infecciones pulmonares causadas por MAC se asocian a enfermedades pulmonares crónicas como la EPOC, la bronquitis crónica, la bronquiectasia, la fibrosis quística y el cáncer de pulmón. El MAC también puede provocar osteomielitis, tenosinovitis y sinovitis, y la infección por MAC diseminada (DMAC) puede afectar a los ganglios linfáticos, al SNC, al hígado, al bazo y a la médula ósea. Las infecciones cutáneas suelen producirse por inoculación directa. El MAC es la causa más común de infección por NTM en pacientes con SIDA. Más del 95% de los casos de pacientes con SIDA que han desarrollado infecciones por MAC están causados por la especie M. avium. El desarrollo de enfermedades pulmonares derivadas del MAC es poco frecuente en sujetos inmunocompetentes. La especie M. intracellulare es la responsable del 40% de las infecciones en pacientes inmunocompetentes. El síndrome de Lady Windermere hace referencia a un patrón de infección pulmonar causada por MAC que se cree que está asociado a la supresión de la tos en mujeres delgadas de edad avanzada que, por lo demás, se encuentran sanas.
Es difícil determinar la incidencia de la enfermedad por NTM, dado que las NTM se consideran no contagiosas y, por lo tanto, en muchos países los casos no se comunican a los organismos de salud pública. Las estimaciones de la tasa de incidencia se basan en el número de aislados de NTM comunicados y parecen similares en la mayoría de los países desarrollados, con oscilaciones de entre 1,0 y 1,8 casos por cada 100.000 personas.5,9 En un estudio realizado en Oregón en 2009, se calculó una tasa anualizada estimada de 5,6 casos de infección pulmonar por MAC por cada 100.000 habitantes, de los cuales la mayoría (60%) afectaban a mujeres.10 El mayor número de casos de DMAC comunicados en los Estados Unidos fue de 37.000 y se produjo en 1994, durante el momento más crítico de la epidemia de SIDA, si bien la incidencia ha disminuido desde la adopción de la terapia antirretroviral de gran actividad. Un estudio de vigilancia calculó la incidencia estimada de las infecciones pulmonares por NTM en pacientes sin infección por VIH en 0,72-0,74 por cada 100.000 habitantes en Francia en el periodo comprendido entre 2001 y 2003.11 En 2004, un estudio similar realizado en Nueva Zelanda estimó la incidencia de la enfermedad por NTM en 1,92 en poblaciones de 100.000 habitantes.12
Se debe valorar la opción de diagnosticar una infección pulmonar por MAC en pacientes sintomáticos que presenten opacidades nodulares o cavitarias en radiografía de tórax o en una tomografía computarizada de alta resolución que muestre bronquiectasia con múltiples nódulos pequeños una vez excluida la infección por MTB y otros diagnósticos pertinentes.5 Se recomienda efectuar un cultivo y un frotis de BAAR para precisar el diagnóstico.
Requisitos para el diagnóstico:
(i) Cultivos positivos de como mínimo dos muestras de esputo expectoradas individuales, o
(ii) Resultados de cultivo positivos de como mínimo un lavado o enjuagado bronquial, o
(iii) Biopsia transbronquial o pulmonar de cualquier otro tipo con características histopatológicas micobacterianas y un cultivo positivo de la biopsia, y uno o más esputos o lavados bronquiales con cultivo positivo para MAC confirman la infección.5
Deben identificarse las especies de NTM, incluido el MAC. El tratamiento incluye 2 o 3 antimicrobianos de primera línea durante 12 meses. La terapia de primera línea incluye macrólidos (claritromicina o azitromicina), etambutol y rifamicinas (rigampina), mientras que la terapia antimicrobiana de segunda línea se compone de aminoglucósidos (estreptomicina o amikacina). Se recomienda realizar pruebas de susceptibilidad rutinarias de los aislados de MAC únicamente para la claritromicina debido a la baja correlación entre los resultados clínicos e in vitro.5
El diagnóstico de la infección por MAC puede establecerse a partir tanto de la presentación clínica como de los hallazgos radiográficos y puede confirmarse mediante la recuperación del organismo en un cultivo tal como se ha descrito anteriormente5, aunque cabe destacar que la realización del cultivo es lenta y puede prolongarse durante días o semanas. Otra opción consiste en realizar pruebas de amplificación de ácidos nucleicos para detectar y diferenciar las especies M. avium y M. intracellulare directamente a partir de muestras clínicas en cuestión de horas con el objetivo de obtener un diagnóstico e iniciar la terapia empírica con mayor rapidez. No obstante, para confirmar la eficacia del tratamiento empírico es necesario realizar pruebas de farmacosensibilidad, que requieren un subcultivo de aislados clínicos, cuyos resultados pueden tardar entre días y semanas según el método empleado.
Explicación de la prueba:
La prueba COBAS® MAI para uso en los cobas® 6800/8800 Systems (referida en lo sucesivo como COBAS® MAI en el resto de este documento) es una prueba cualitativa automatizada de PCR a tiempo real diseñada para detectar y diferenciar el ADN de Mycobacterium avium y Mycobacterium intracellulare en muestras respiratorias humanas, incluidas muestras de esputo sin procesar así como sedimentos de esputo y de lavado broncoalveolar (LBA) digeridos y descontaminados tratados con NALC-NaOH. El control interno de ADN, utilizado para supervisar el proceso completo de preparación de la muestra y amplificación de la PCR, se introduce en cada muestra durante el procesamiento en los cobas® 6800/8800 Systems. Además, la prueba utiliza un control positivo de título bajo y un control negativo.
Principios del procedimiento:
La prueba COBAS® MAI se basa en la licuefacción de la muestra y la inactivación de micobacterias en la preanalítica seguidas de una sonicación y preparación de la muestra totalmente automatizada (extracción y purificación de los ácidos nucleicos) y la amplificación y detección mediante PCR. Los procesos de licuefacción de la muestra e inactivación de micobacterias tienen lugar de forma simultánea durante la incubación de la muestra con el reactivo cobas® Microbial Inactivation Solution (MIS). La sonicación de la muestra licuada e inactivada se realiza antes de cargarla en los cobas® 6800/8800 Systems. Los cobas® 6800/8800 Systems constan del módulo de suministro de muestras, el módulo de transferencia, el módulo de procesamiento y el módulo analítico. La gestión automática de los datos se realiza mediante el software cobas® 6800/8800, que asigna los resultados de las pruebas como positivos, negativos o no válidos. Los resultados pueden revisarse directamente en la pantalla del sistema, exportarse o imprimirse como informe.
La extracción de ácidos nucleicos de las muestras de paciente, los controles externos y las moléculas de ADN del control interno añadido (DNA-IC) se realiza simultáneamente. En resumen, los ácidos nucleicos bacterianos se liberan mediante la ruptura química (MIS, cobas omni Lysis Reagent), enzimática (proteinasa) y física (sonicación) de las bacterias. Los ácidos nucleicos liberados se unen a la superficie de sílice de las partículas de vidrio magnéticas añadidas. Las sustancias sin unir y las impurezas, como las proteínas desnaturalizadas, los restos celulares y los posibles inhibidores de la PCR se eliminan en los siguientes pasos de lavado, mientras que los ácidos nucleicos purificados se eluyen de las partículas de vidrio magnéticas mediante el buffer de elución a temperatura elevada.
La amplificación selectiva de los ácidos nucleicos del fragmento objetivo de la muestra se lleva a cabo mediante un cebador que va en un sentido y en sentido contrario específico para el fragmento objetivo del complejo M. avium que se selecciona de una región altamente conservada dentro del respectivo organismo objetivo. El MAC se detecta mediante un conjunto selectivo de cebadores y M. avium y M. intracellulare se diferencian mediante dos sondas distintas dentro de la región de amplificación (gen ARNr 16S). La amplificación selectiva del control interno de ADN (DNA-IC) se realiza mediante cebadores que van en un sentido y en sentido contrario específicos de la secuencia y que se seleccionan de modo que no presenten ninguna homología con la región del fragmento objetivo del complejo M. avium. Para el proceso de amplificación mediante PCR se utiliza una enzima ADN polimerasa termoestable. La amplificación de las secuencias de fragmento objetivo y DNA-IC se realiza simultáneamente mediante un perfil universal de amplificación mediante PCR que incluye unos pasos de temperatura y número de ciclos predefinidos. El reactivo de Master Mix incluye trifosfato de deoxiuridina (dUTP), en lugar de trifosfato desoxitimidina (dTTP), que se incorpora al ADN recién sintetizado (amplicón). La enzima AmpErase, que se incluye en la Master Mix para PCR cuando se calienta durante la primera ciclación térmica, elimina los amplicones contaminados de las series de PCR anteriores.13 Sin embargo, no se eliminan los amplicones nuevos porque la enzima AmpErase se inactiva cuando se expone a temperaturas superiores a los 55 °C.
El reactivo de Master Mix de COBAS® MAI contiene una sonda de detección para M. avium y otra para M. intracellulare, además de una tercera sonda para el DNA-IC. Las sondas específicas para el fragmento objetivo están marcadas con diferentes marcadores emisores fluorescentes para permitir la detección simultánea de fragmentos objetivo de M. avium, fragmentos objetivo de M. intracellulare y DNA-IC en tres canales objetivo distintos.14,15 Cuando no se une a la secuencia de fragmento objetivo, la señal fluorescente de las sondas intactas se elimina mediante un marcador silenciador. Durante el paso de amplificación mediante PCR, la hibridación de las sondas con la plantilla específica de ADN monocatenario provoca la escisión de la sonda por la actividad de la exonucleasa 5" a 3" de la ADN polimerasa, lo que causa la separación de los marcadores emisor y silenciador y la emisión de una señal fluorescente. Con cada ciclo de PCR, se generan cantidades crecientes de sondas escindidas y la señal acumulada del marcador emisor aumenta concomitantemente. La detección y diferenciación en tiempo real de los productos de PCR se consiguen mediante la cuantificación de la fluorescencia liberada por los marcadores emisores para los fragmentos objetivo del complejo M. avium y del DNA-IC, respectivamente.