
COBAS HIV-1
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
RESULTADOS:
Los cobas® 6800/8800 Systems determinan automáticamente la concentración de ARN del VIH-1 en muestras y controles. La concentración de ARN del VIH-1 se expresa en copias por mililitro (cp/mL) o Unidades Internacionales por mililitro (UI/mL). El factor de conversión para COBAS® HIV-1 es de 0,6 cp/UI.
Control de calidad y validez de los resultados:
• Con cada lote se procesan un control negativo (–) C y dos controles positivos, un control positivo bajo (HIV-1 L(+)C) y un control positivo alto (HIV-1 H(+)C).
• Compruebe la validez de la serie en el software cobas® 6800/8800 y/o en el informe.
• La serie se considera válida siempre y cuando no haya avisos para ninguno de los tres controles, es decir, el control negativo y los dos controles positivos: HIV-1 L(+)C y HIV-1 H(+)C. El resultado del control negativo se muestra como (–) C, mientras que los controles positivos bajo y alto se presentan como HxV L(+)C y HxV H(+)C.
El software cobas® 6800/8800 invalida automáticamente los resultados cuando fallan los controles positivos y negativos.
Avisos de controles:
Tabla 12. Avisos de controles para los controles negativo y positivo
|
Control negativo |
Aviso |
Resultado |
Interpretación |
|
(–) C |
Q02 (Serie de control errónea) |
Invalid |
Un resultado inválido o el resultado del título calculado del control negativo no es negativo. |
|
Control positivo |
Aviso |
Resultado |
Interpretación |
|
HxV L(+)C |
Q02 (Serie de control errónea) |
Invalid |
Un resultado inválido o el resultado del título calculado para el control positivo bajo no está dentro del intervalo asignado. |
|
HxV H(+)C |
Q02 (Serie de control errónea) |
Invalid |
Un resultado inválido o el resultado del título calculado para el control positivo alto no está dentro del intervalo asignado. |
Si la serie no es válida, repita las pruebas para toda la serie, incluyendo muestras y controles.
En el software cobas® 6800/8800, HxV L(+)C hace referencia al control positivo bajo cobas® HBV/HCV/HIV-1 y HxV H(+)C, al control positivo alto cobas® HBV/HCV/HIV-1.
Interpretación de los resultados:
En las series válidas, compruebe cada muestra para detectar avisos en el software cobas® 6800/8800 y/o en el informe.
La interpretación de resultados se debe realizar del siguiente modo:
• Una serie válida puede incluir resultados de muestras tanto válidos como inválidos.
Tabla 13. Resultados de fragmento objetivo para la interpretación de los resultados de fragmento objetivo individuales
|
Resultados |
Interpretación |
|
Target Not Detected |
No se ha detectado ARN del VIH. Los resultados se indican como “VIH no detectado”. |
|
< Titer Min |
El título calculado está por debajo del límite inferior de cuantificación (LLoQ) del ensayo. Los resultados se indican como “VIH detectado, inferior a (título mínimo)”. Título mínimo = 20 cp/mL y 33 UI/mL (500 μL de plasma) Título mínimo = 50 cp/mL y 83 UI/mL (200 μL de plasma) Título mínimo = 790 cp/mL y 1.317 UI/mL (PSC) |
|
Título |
El título calculado está comprendido en el intervalo lineal del ensayo: mayor o igual que el título mínimo y menor o igual que el título máximo. Los resultados se indican como “(Título) de VIH-1 detectado. |
|
> Titer Maxa |
El título calculado está por encima del límite superior de cuantificación (ULoQ) del ensayo. Los resultados se indican como “VIH detectado, superior a (título máximo).” Título máximo = 1,00E+07 cp/mL y 1,67E+07 UI/mL (500 μL, 200 μL y PSC) |
a Un resultado de muestra “> Titer Max” hace referencia a las muestras positivas para VIH-1 detectadas con títulos superiores al límite de cuantificación superior (ULoQ). Si desea obtener resultados cuantitativos, diluya la muestra original con plasma conservado en EDTA negativo al VIH-1 (según el tipo de la muestra original) y repita la prueba. Multiplique el resultado comunicado por el factor de dilución.
Limitaciones del procedimiento:
• El flujo de trabajo de las muestras de plasma para la prueba COBAS® HIV-1 se ha evaluado para ser utilizado únicamente con el cobas® HBV/HCV/HIV-1 Control Kit, el cobas® NHP Negative Control Kit, el cobas omni MGP Reagent, el cobas omni Lysis Reagent, el cobas omni Specimen Diluent y el cobas omni Wash Reagent y exclusivamente en los cobas® 6800/8800 Systems.
• El flujo de trabajo de las muestras de PSC para la prueba COBAS® HIV-1 se ha evaluado en la función de serie combinada únicamente con el procedimiento de muestras de sangre seca para la prueba cobas® HIV-1/HIV-2 Qualitative.
• La obtención de resultados fiables depende de que los procedimientos de recogida, almacenamiento y manipulación de muestras sean adecuados.
• La cuantificación de ARN del VIH-1 depende del número de partículas víricas presentes en las muestras y se puede ver afectada por los métodos de obtención de las mismas, factores propios del paciente (como la edad o la presencia de síntomas) y/o la fase de infección.
• Aunque es poco probable, las mutaciones en las regiones muy conservadas del genoma vírico cubiertas por la prueba COBAS® HIV-1 pueden afectar la unión de cebadores y/o sondas y causar una cuantificación a la baja del virus o incluso impedir su detección.
• Debido a las diferencias específicas entre tecnologías, se recomienda a los usuarios que realicen estudios de correlación en el laboratorio para determinar las diferencias tecnológicas antes de cambiar de una a otra. Los usuarios deberán adherirse a las políticas y los procedimientos específicos.
• La prueba COBAS® HIV-1 no se ha concebido para el cribado de la presencia de VIH-1 en sangre o productos sanguíneos.
OBTENCIÓN, TRANSPORTE Y ALMACENAMIENTO DE LAS MUESTRAS:
Nota: Manipule todas las muestras y los controles como si pudieran transmitir agentes infecciosos.
Almacene todas las muestras a las temperaturas especificadas.
La estabilidad de las muestras se ve afectada por las temperaturas elevadas.
Si se utilizan muestras congeladas en tubos secundarios, deje que se descongelen a temperatura ambiente (15-30 °C) por completo y, a continuación, agítelas unos instantes (entre 3 y 5 segundos) y centrifúguelas para que todo el volumen de la muestra se deposite en la parte inferior del tubo.
Nota: Después de la centrifugación existe la posibilidad de que las células se hayan resuspendido en el plasma, por lo que es importante plantearse una recentrifugación antes del procesamiento en el instrumento.
Muestras de plasma conservadas en EDTA:
• La sangre debería recogerse en tubos para preparación de plasma BD Vacutainer® PPT™ para métodos de pruebas de diagnóstico molecular o en tubos estériles y utilizar EDTA como anticoagulante. Siga las instrucciones del fabricante de los tubos de recogida de muestras. Consulte la Ilustración 1.
• La sangre total recogida en tubos EDTA puede almacenarse un máximo de 24 horas a una temperatura comprendida entre 2 °C y 25 °C antes de la preparación del plasma. La centrifugación debe realizarse conforme a las instrucciones del fabricante.
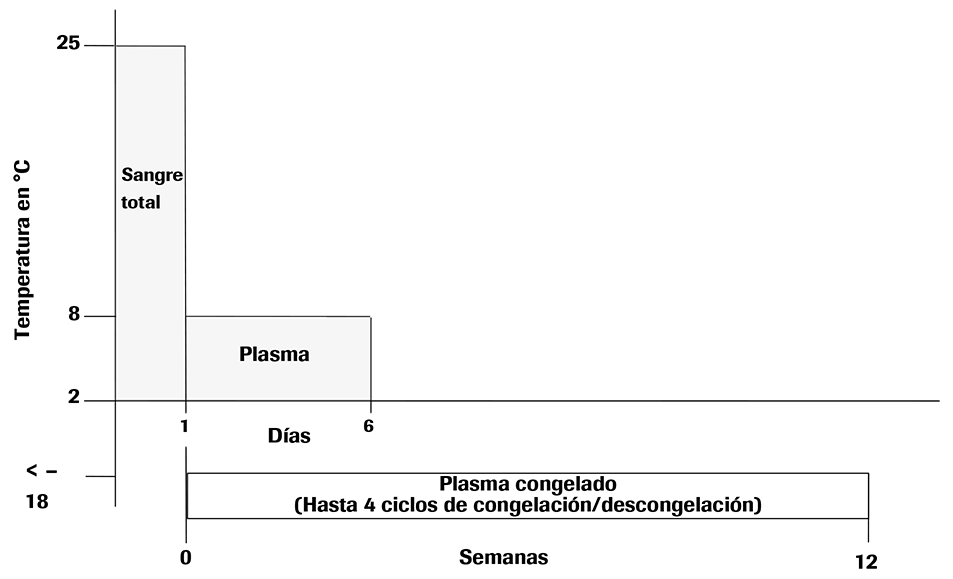
• Después de la separación, las muestras de plasma conservadas en EDTA pueden almacenarse en tubos secundarios durante un máximo de 6 días a una temperatura comprendida entre 2 °C y 8 °C o un máximo de 12 semanas a ≤ –18 °C. Para un almacenamiento a más largo plazo se recomiendan temperaturas ≤ –60 °C.
• Las muestras de plasma se mantienen estables hasta un máximo de cuatro ciclos de congelación/descongelación si se congelan a ≤ –18 °C.
Ilustración 1. Condiciones de almacenamiento de muestras de plasma conservadas en EDTA
Si las muestras se van a transportar, es recomendable empaquetarlas y etiquetarlas de acuerdo con la reglamentación estatal y/o internacional relativa al transporte de muestras y agentes etiológicos.
Muestras de plasma seco de PSC:
• Para recoger muestras de plasma seco de una PSC, utilice los procedimientos clínicos adecuados (consulte las instrucciones de la PSC ms_09411763190).
• Compruebe la fecha de caducidad de la PSC y continúe únicamente si la PSC todavía no ha caducado.
• Asegúrese de que la bolsa en la que está sellada la PSC está completamente cerrada e intacta.
• Etiquete la PSC con el nombre del paciente, su fecha de nacimiento y la fecha y hora de obtención de la muestra.
• Aplique 140 μL de sangre total en cada uno de los círculos de la membrana de la PSC delineados por la lámina de muestras mediante un capilar y un dispensador adecuados. Se recomienda rellenar las tres muestras de la PSC para posibilitar las repeticiones.
• No aplique muestras de más de un paciente en la misma PSC.
• No permita que las membranas entren en contacto con guantes, herramientas o cualquier superficie potencialmente contaminada durante este proceso.
• Asegúrese de que AMBAS caras de las muestras de la PSC (frontal: membrana con sangre; posterior: muestra con plasma) están saturadas transcurridos 5 minutos. Compruebe la cara posterior a través de la lámina posterior transparente.
• Deje secar la PSC a temperatura ambiente durante 4 horas como mínimo (y como máximo durante toda la noche), protegiéndola de la luz solar directa.
• No retire la lámina de muestras. Se retirará en el laboratorio, antes de la extracción de la muestra.
• Tras el secado, guarde la PSC en una bolsa de muestras individual con 4 gramos de desecante y séllela. Las bolsas de muestras recogidas deben empaquetarse en una bolsa de transporte junto con las hojas informativas de paciente correspondientes. Se recomienda empaquetar un máximo de 25 PSC por bolsa de transporte (consulte la Ilustración 2 para obtener una visión general).
|
PSC y desecante |
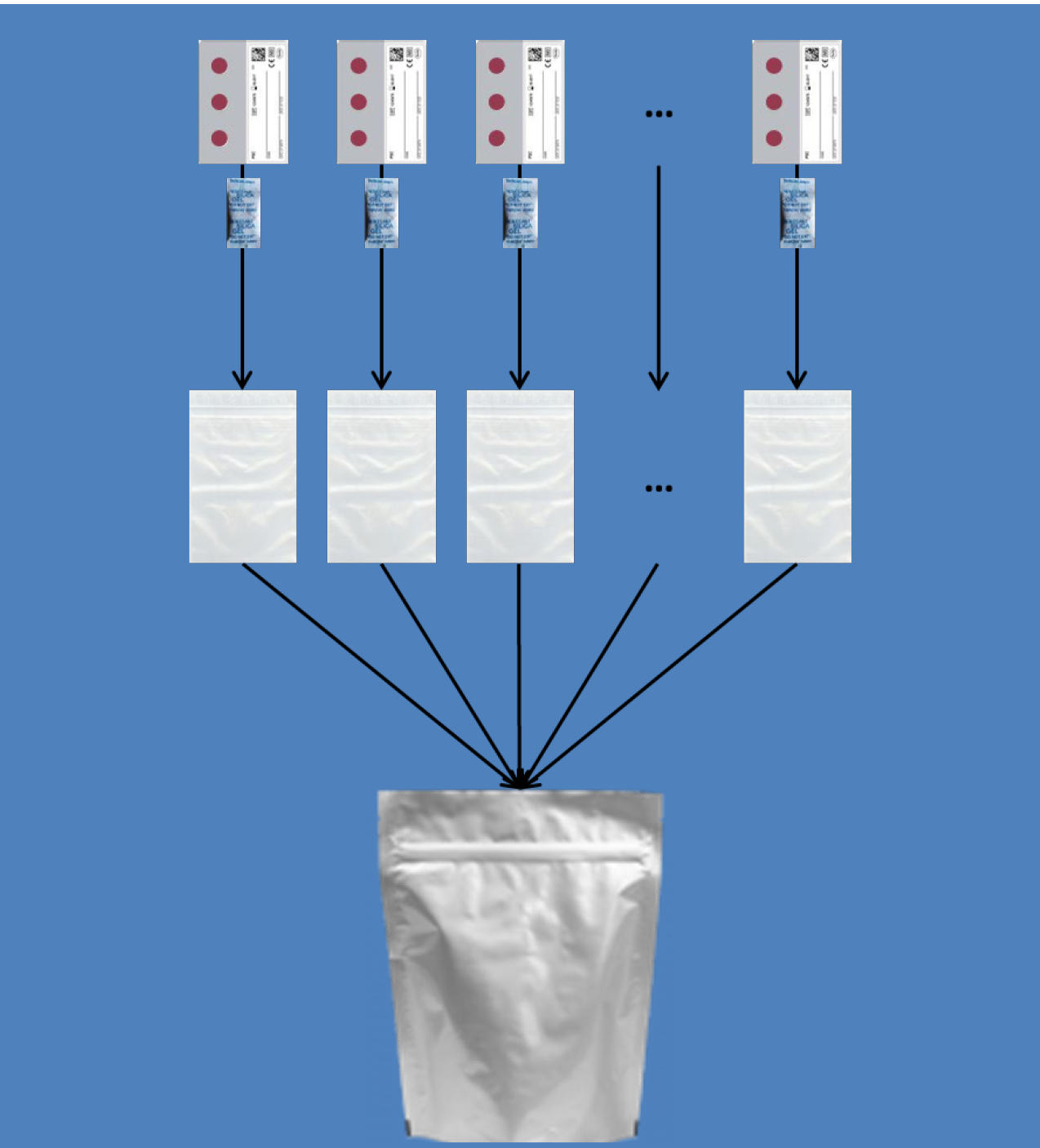
|
|
Bolsa de muestras |
|
|
Bolsa de transporte para albergar las muestras y la información de paciente |
• Si las muestras se van a transportar, es recomendable empaquetarlas y etiquetarlas de acuerdo con la reglamentación estatal y/o internacional relativa al transporte de muestras y agentes etiológicos. Las PSC pueden transportarse durante un periodo de 28 días antes de su análisis a 18-45 °C con una humedad de hasta el 85%.
• Tras el transporte, las PSC en bolsas de muestras individuales con 4 gramos de desecante colocadas dentro de una bolsa de transporte pueden almacenarse a temperatura ambiente (18-30 °C), a 2-8 °C o a ≤ –10 °C durante un máximo de 56 días (con y sin separación de las láminas).
PRECAUCIONES Y REQUISITOS DE MANIPULACIÓN:
Advertencias y precauciones:
Como sucede con cualquier procedimiento analítico, resulta esencial seguir las buenas prácticas de laboratorio recomendadas para obtener un rendimiento correcto del ensayo. Debido a la elevada sensibilidad de esta prueba, deben extremarse las precauciones para evitar cualquier tipo de contaminación de los reactivos y las mezclas de amplificación.
• Para diagnóstico in vitro exclusivamente.
• No se ha evaluado el uso de la prueba COBAS® HIV-1 para el cribado de la presencia de VIH-1 en sangre o productos sanguíneos.
• Todas las muestras de pacientes deben tratarse como si fueran infecciosas, utilizando los procedimientos de laboratorio recomendados que se describen en la publicación Biosafety in Microbiological and Biomedical Laboratories y en el documento M29-A4 del CLSI.18,19 Este procedimiento solamente debería llevarlo a cabo personal experto en la manipulación de material biopeligroso y en el uso de la prueba COBAS® HIV-1 y los cobas® 6800/8800 Systems.
• Todos los materiales de origen humano deben considerarse potencialmente infecciosos y manipularse teniendo en cuenta las precauciones generales. En caso de que se produzca un derrame, desinfecte de inmediato con una solución recién preparada de hipoclorito de sodio al 0,5% en agua destilada o desionizada (lejía doméstica diluida a 1:10) o siga los procedimientos apropiados del laboratorio.
o Si se produce un derrame de muestras de plasma seco procedentes de una PSC en el cobas® Specimen Pre-Extraction Reagent (que contiene tiocianato de guanidina), no permita que entre en contacto con soluciones de hipoclorito de sodio que contengan desinfectantes como la lejía. Tales mezclas pueden producir gases de alta toxicidad.
• El cobas® HBV/HCV/HIV-1 Control Kit y el cobas® NHP Negative Control Kit contienen plasma procedente de sangre humana. Se ha analizado el material original mediante las pruebas para anticuerpos autorizadas y no se ha considerado reactivo para la presencia de anticuerpos del VHC, del VIH-1/2, HBsAg y anticuerpos anti-HBc. En el análisis del plasma humano normal con métodos de PCR no se ha detectado ARN de VIH-1 (grupos M y O), ARN de VIH-2, ARN de VHC o ADN de VHB. Ningún método de prueba conocido puede garantizar totalmente que un producto derivado de la sangre humana no transmita agentes infecciosos.
• Consulte las instrucciones de la PSC ms_09411763190 para conocer las advertencias y precauciones adicionales.
• No congele la sangre total ni las muestras almacenadas en tubos primarios.
• El cobas® Specimen Pre-Extraction Reagent es sensible a la luz y se suministra en botellas con protección lumínica.
• Utilice solo el material fungible suministrado o que se requiera expresamente para garantizar el óptimo rendimiento de la prueba.
• Puede solicitar Hojas de datos de seguridad (Safety Data Sheets, SDS) al representante local de Roche.
• Siga al pie de la letra los procedimientos y las directrices que se suministran para garantizar la correcta realización de la prueba. Cualquier variación de dichos procedimientos y directrices podría afectar al rendimiento óptimo de la prueba.
• Podrían producirse falsos positivos si no se evita la contaminación por arrastre de las muestras durante la manipulación y el procesamiento de las mismas.
Manipulación de reactivos:
• Manipule todos los reactivos, controles y muestras de acuerdo con las prácticas de laboratorio recomendadas para evitar la contaminación por arrastre de las muestras o los controles.
• Antes de utilizarlos, revise cada casete de reactivo, diluyente, reactivo de lisis y reactivo de lavado para asegurarse de que no hay signos de fugas. No utilice el material si hay alguna evidencia de fuga.
• El cobas omni Lysis Reagent contiene tiocianato de guanidina, una sustancia química potencialmente peligrosa. Evite el contacto de reactivos con la piel, los ojos o las membranas mucosas. En caso de contacto, lave inmediatamente la zona afectada con abundante agua para evitar quemaduras.
• Los kits de la prueba COBAS® HIV-1, el cobas omni MGP Reagent y el cobas omni Specimen Diluent contienen azida sódica como conservante. Evite el contacto de reactivos con la piel, los ojos o las membranas mucosas. En caso de contacto, lave inmediatamente la zona afectada con abundante agua para evitar quemaduras. Si se producen salpicaduras de reactivos, diluya las manchas con agua antes de secarlas con un paño.
• No permita que el cobas omni Lysis Reagent o el cobas® Specimen Pre-Extraction Reagent, que contienen tiocianato de guanidina, entren en contacto con la solución de hipoclorito de sodio (lejía). Tales mezclas pueden producir gases de alta toxicidad.
• Elimine todos los materiales que hayan estado en contacto con las muestras y los reactivos de acuerdo con la reglamentación nacional, estatal y local.
Buenas prácticas de laboratorio:
• No pipetee con la boca.
• No se debe comer, beber ni fumar en las áreas de trabajo.
• Utilice guantes, bata de laboratorio y protección ocular cuando manipule las muestras y los reactivos. Es necesario cambiarse los guantes entre la manipulación de las muestras y de los kits COBAS® HIV-1 y los reactivos cobas omni para evitar la contaminación. Evite la contaminación de los guantes durante la manipulación de las muestras y de los controles.
• Lávese bien las manos después de manipular las muestras y los reactivos del kit, y cuando se saque los guantes.
• Limpie y desinfecte minuciosamente todas las superficies de trabajo del laboratorio usando una solución recién preparada de hipoclorito de sodio al 0,5% en agua destilada o desionizada (lejía doméstica diluida a 1:10). A continuación, límpielas con un trapo impregnado en etanol al 70%.
• Si se produce algún derrame sobre el cobas® 6800/8800 instrument, siga las instrucciones descritas en el Manual de usuario de los cobas® 6800/8800 Systems para limpiar y descontaminar correctamente la superficie de los instrumentos.
REACTIVOS Y MATERIALES:
Reactivos y controles de COBAS® HIV-1:
Todos los reactivos y controles sin abrir deben almacenarse como se recomienda de la Tabla 1 a Tabla 5.
Tabla 1. COBAS® HIV-1
|
COBAS® HIV-1 Almacenar a 2-8 °C Casete para 96 pruebas (P/N 07000995190) |
||
|---|---|---|
|
Componentes del kit |
Ingredientes del reactivo |
Cantidad por kit 96 pruebas |
|
Solución de proteinasa (PASE) |
Buffer Tris, < 0,05% de EDTA, cloruro de calcio, acetato de calcio, 8% (p/v) de proteinasa EUH210: Puede solicitarse la ficha de datos de seguridad. EUH208: Contiene subtilisina. Puede provocar una reacción alérgica. |
13 mL |
|
Estándar de cuantificación de ARN (RNA-QS) |
Tampón Tris, < 0,05% de EDTA, < 0,001% de constructo de Armored RNA diferente del VIH que contiene regiones de secuencia específicas del cebador y la sonda (ARN no infeccioso encapsulado en bacteriófago MS2), < 0,1% de azida sódica |
13 mL |
|
Buffer de elución (EB) |
Buffer Tris, 0,2% de metil-4-hidroxibenzoato |
13 mL |
|
Reactivo 1 de Master Mix (MMX-R1) |
Acetato de manganeso, hidróxido potásico, < 0,1% de azida sódica |
5,5 mL |
|
Reactivo 2 de Master Mix para VIH-1 (HIV-1 MMX-R2) |
Buffer Tricina, acetato de potasio, 18% de sulfóxido de dimetilo, glicerol, < 0,1% de Tween 20, EDTA, < 0,12% de dATP, dCTP, dGTP, dUTPs, < 0,01% de cebadores que van en un sentido y en sentido contrario para VIH, < 0,01% de cebadores que van en un sentido y en sentido contrario para el estándar de cuantificación, < 0,01% de sondas oligo-nucleótidas marcadas con fluorescente específicas para VIH y el estándar de cuantificación del VIH, < 0,01% de aptámero oligonucleótido, < 0,1% de ADN polimerasa Z05D, < 0,10% de enzima AmpErase (uracil-N-glicosilasa) (microbiana), < 0,1% de azida sódica |
6 mL |
Tabla 2. COBAS® HBV/HCV/HIV-1 Control Kit
|
COBAS® HBV/HCV/HIV-1 Control Kit Almacenar a 2-8 °C (P/N: 06997767190) |
|||
|
Componentes del kit |
Composición del reactivo |
Cantidad por kit |
Símbolo de seguridad y advertencia* |
|
Control positivo bajo para HBV/HCV/HIV-1 (HBV/HCV/HIV-1 L(+)C) |
< 0,001 % de Armored ARN de HIV-1 grupo M (ARN no infeccioso encapsulado en bacteriófago MS2), < 0,001 % de ADN (plasmídico) sintético de HBV encapsulado en proteína recubierta de bacteriófago Lambda, < 0,001 % de ARN (Armored) sintético de HCV encapsulado en proteína recubierta de bacteriófago MS2, plasma humano normal, no reactivo según las pruebas autorizadas para anticuerpos frente al HCV y el HIV-1/2, HBsAg y anticuerpos anti-HBc; ARN de HIV-1, ARN de HIV-2, ARN de HCV y ADN de HBV no detectables mediante métodos de PCR 0,1 % de conservante ProClin® 300** |
5,2 mL (8 × 0,65 mL) |
ADVERTENCIA: H317: Puede provocar una reacción alérgica en la piel. H412: Nocivo para los organismos acuáticos, con efectos nocivos duraderos. P261: Evitar respirar el polvo/el humo/el gas/la niebla/ los vapores/el aerosol. P273: Evítese su liberación al medio ambiente. P280: Utilice guantes protectores. P333 + P313: En caso de irritación o erupción cutánea: consultar a un médico. P362 + P364: Quitarse las prendas contaminadas y lavarlas antes de volver a usarlas. P501: Eliminar el contenido/el recipiente en una planta de eliminación de residuos autorizada. 55965-84-9 masa reactiva de: 5-cloro-2-metil-4-isotiazolin-3-ona [n.º CE 247-500-7] y 2-metil-2H-isotiazol-3-ona [n.º CE 220-239-6] (3:1). |
|
Control positivo alto para HBV/HCV/HIV-1 (HBV/HCV/HIV-1 H(+)C) |
< 0,001 % de Armored ARN de HIV-1 grupo M (ARN no infeccioso encapsulado en bacteriófago MS2), < 0,001 % de ADN (plasmídico) sintético de HBV encapsulado en proteína recubierta de bacteriófago Lambda, < 0,001 % de ARN (Armored) sintético de HCV encapsulado en proteína recubierta de bacteriófago MS2, plasma humano normal, no reactivo según las pruebas autorizadas para anticuerpos frente al HCV y el HIV-1/2, HBsAg y anticuerpos anti-HBc; ARN de HIV-1, ARN de HIV-2, ARN de HCV y ADN de HBV no detectables mediante métodos de PCR 0,1 % de conservante ProClin® 300** |
5,2 mL (8 × 0,65 mL) |
ADVERTENCIA: H317: Puede provocar una reacción alérgica en la piel. P261: Evitar respirar el polvo/el humo/el gas/la niebla/ los vapores/el aerosol. P272: Las prendas de trabajo contaminadas no podrán sacarse del lugar de trabajo. P280: Utilice guantes protectores. P333 + P313: En caso de irritación o erupción cutánea: consultar a un médico. P362 + P364: Quitarse las prendas contaminadas y lavarlas antes de volver a usarlas. P501: Eliminar el contenido/el recipiente en una planta de eliminación de residuos autorizada. 55965-84-9 masa reactiva de: 5-cloro-2-metil-4-isotiazolin-3-ona [n.º CE 247-500-7] y 2-metil-2H-isotiazol-3-ona [n.º CE 220-239-6] (3:1). |
* Las etiquetas de seguridad del producto se basan fundamentalmente en la regulación GHS de la UE.
** Sustancia peligrosa.
Tabla 3. COBAS® NHP Negative Control Kit
|
COBAS® NHP Negative Control Kit Almacenar a 2-8 °C (P/N: 07002220190) |
|||
|
Componentes del kit |
Ingredientes del reactivo |
Cantidad por kit |
Símbolo de seguridad y advertencia* |
|
Control negativo para plasma humano normal (NHP-NC) |
Plasma humano normal, no reactivo según pruebas autorizadas para anticuerpos del VHC, anticuerpos del VIH-1/2, HBsAg y anticuerpos anti-HBc; ARN de VIH-1, ARN de VIH-2, ARN de VHC y ADN de VHB no detectables mediante métodos de PCR < 0,1% de conservante ProClin® 300** |
16 mL (16 × 1 mL) |
ATENCIÓN: H317: Puede provocar una reacción alérgica en la piel. P261: Evitar respirar el polvo/el humo/el gas/la niebla/los vapores/el aerosol. P272: Las prendas de trabajo contaminadas no podrán sacarse del lugar de trabajo. P280: Utilice guantes protectores. P333 + P313: En caso de irritación o erupción cutánea: Consultar a un médico. P362 + P364: Quitarse las prendas contaminadas y lavarlas antes de volver a usarlas. P501: Eliminar el contenido/el recipiente en una planta de eliminación de residuos autorizada. 55965-84-9, mezcla de: 5-cloro-2-metil-4-isotiazolin-3-ona [n.º CE 247-500-7] y 2-metil-2H-isotiazol-3-ona [n.º CE 220-239-6] (3:1) |
* Las etiquetas de seguridad del producto se basan fundamentalmente en la regulación GHS de la UE.
** Sustancia peligrosa
Reactivos cobas omni para la preparación de muestras:
Tabla 4. Reactivos cobas omni para la preparación de muestras*
|
COBAS® NHP Negative Control Kit Almacenar a 2-8 °C (P/N: 07002220190) |
|||
|---|---|---|---|
|
Reactivos |
Ingredientes del reactivo |
Cantidad por kit |
Símbolo de seguridad y advertencia** |
|
cobas omni MGP Reagent (MGP) Almacenar a 2-8 °C (P/N: 06997546190) |
Partículas de vidrio magnéticas, buffer Tris, 0,1% de metil-4 hidroxibenzoato, < 0,1% de azida sódica |
480 pruebas |
No aplicable |
|
cobas omni Specimen Diluent (SPEC DIL) Almacenar a 2-8 °C (P/N: 06997511190) |
Buffer Tris, 0,1% de metil-4 hidroxibenzoato, < 0,1% de azida sódica |
4 x 875 mL |
No aplicable |
|
cobas omni Lysis Reagent (LYS) Almacenar a 2-8 °C (P/N: 06997538190) |
43 % (p/p) de tiocianato de guanidina***, 5 % (p/v) de polidocanol***, 2 % (p/v) de ditiotreitol***, citrato de sodio dihidratado |
4 x 875 mL |
PELIGRO H302 + H332: Nocivo en caso de ingestión o inhalación. H314: Provoca quemaduras graves en la piel y lesiones oculares graves. H412: Nocivo para los organismos acuáticos, con efectos nocivos duraderos. EUH032: En contacto con ácidos libera gases muy tóxicos. P261: Evitar respirar el polvo/el humo/el gas/la niebla/ los vapores/el aerosol. P273: Evítese su liberación al medio ambiente. P280: Llevar guantes/prendas/gafas/máscara de protección. P303 + P361 + P353: EN CASO DE CONTACTO CON LA PIEL (o el pelo): quitar inmediatamente todas las prendas contaminadas. Enjuagar la piel con agua. P304 + P340 + P310: EN CASO DE INHALACIÓN: transportar a la persona al aire libre y mantenerla en una posición que le facilite la respiración. Llamar inmediatamente a un CENTRO DE TOXICOLOGÍA/médico. P305 + P351 + P338 + P310: EN CASO DE CONTACTO CON LOS OJOS: aclarar cuidadosamente con agua durante varios minutos. Quitar las lentes de contacto, si lleva y resulta fácil. Seguir aclarando. Llamar inmediatamente a un CENTRO DE TOXICOLOGÍA/médico. 593-84-0 Tiocianato de guanidina 9002-92-0 Polidocanol 3483-12-3 (R*,R*)-1,4-dimercaptobutano-2,3-diol |
|
cobas omni Wash Reagent (WASH) Almacenar a 15-30 °C (P/N: 06997503190) |
Citrato de sodio dihidratado, 0,1% de metil-4-hidroxi-benzoato |
4,2 L |
No aplicable |
* Estos reactivos no están incluidos en el kit de la prueba COBAS® HIV-1. Consulte el listado de material adicional necesario (Tabla 9).
** Las etiquetas de seguridad del producto se basan fundamentalmente en la regulación GHS de la UE.
*** Sustancia peligrosa
cobas® Specimen Pre-Extraction Reagent
Nota: este reactivo es opcional y únicamente debe utilizarse en combinación con la PSC para generar muestras de plasma seco. Consulte las instrucciones ms_09411763190, correspondientes a la PSC.
Tabla 5. COBAS® Specimen Pre-Extraction Reagent
|
COBAS® Specimen Pre-Extraction Reagent Almacenar a 2-8 °C (P/N 08064695190) |
|||
|---|---|---|---|
|
Reactivos |
Composición del reactivo |
Cantidad por kit |
Símbolo de seguridad y advertencia** |
|
COBAS® Specimen Pre-Extraction Reagent (SPER) |
28 % (p/p) de tiocianato de guanidina**, 6 % (p/v) de polidocanol**, 1 % (p/v) de ditiotreitol, citrato de sodio dihidratado |
600 mL (15 × 40 mL) |
PELIGRO H302: Nocivo por ingestión. H314: Provoca quemaduras graves en la piel y lesiones oculares graves. H412: Nocivo para los organismos acuáticos, con efectos nocivos duraderos. EUH032: En contacto con ácidos libera gases muy tóxicos. P273: Evítese su liberación al medio ambiente. P280: Llevar guantes/prendas/gafas/máscara de protección. P301 + P330 + P331: EN CASO DE INGESTIÓN: Emjuagarse la boca. NO provocar el vómito. P304 + P340 + P310: EN CASO DE INHALACIÓN: transportar a la persona al aire libre y mantenerla en una posición que le facilite la respiración. Llamar inmediatamente a un CENTRO DE TOXICOLOGÍA/médico. P305 + P351 + P338 + P310: EN CASO DE CONTACTO CON LOS OJOS: aclarar cuidadosamente con agua durante varios minutos. Quitar las lentes de contacto, si lleva y resulta fácil. Seguir aclarando. Llamar inmediatamente a un CENTRO DE TOXICOLOGÍA/médico. 593-84-0 Tiocianato de guanidina 9002-92-0 Polidocanol |
* Las etiquetas de seguridad del producto se basan fundamentalmente en la regulación GHS de la UE.
** Sustancia peligrosa.
Requisitos de almacenamiento y manipulación:
Los reactivos deben almacenarse y manipularse según las indicaciones de la Tabla 6 y la Tabla 7. El cobas® Specimen Pre-Extraction Reagent, utilizado en el flujo de trabajo de muestras de plasma seco procedentes de una PSC, debe almacenarse y manipularse tal como se especifica en la Tabla 8. Los requisitos para el almacenamiento y la manipulación de la PSC se especifican en las instrucciones de la PSC ms_09411763190.
Cuando los reactivos no están cargados en los cobas® 6800/8800 Systems, almacénelos a la temperatura correspondiente especificada en la Tabla 6.
Tabla 6. Almacenamiento de reactivos (cuando el reactivo no está cargado en el sistema)
|
Reactivo |
Temperatura de almacenamiento |
|
COBAS® HIV-1 |
2-8 °C |
|
COBAS® HBV/HCV/HIV-1 Control Kit |
2-8 °C |
|
COBAS® NHP Negative Control Kit |
2-8 °C |
|
cobas omni Lysis Reagent |
2-8 °C |
|
cobas omni MGP Reagent |
2-8 °C |
|
cobas omni Specimen Diluent |
2-8 °C |
|
cobas omni Wash Reagent |
15-30 °C |
Los reactivos cargados en los cobas® 6800/8800 Systems se almacenan a la temperatura correspondiente adecuada y el sistema controla su fecha de caducidad. Los cobas® 6800/8800 Systems solamente permiten utilizar los reactivos cuando se cumplen todas las condiciones indicadas en la Tabla 7. El sistema evita automáticamente el uso de reactivos caducados. La Tabla 7 ayuda al usuario a entender las condiciones de manipulación de los reactivos de los cobas® 6800/8800 Systems.
Tabla 7. Condiciones de caducidad de los reactivos de los cobas® 6800/8800 Systems
|
Reactivo |
Fecha de caducidad del kit |
Estabilidad del kit abierto |
Series en las que se puede utilizar el kit |
Periodo de estabilidad (horas acumuladas de carga fuera de la nevera) |
|
COBAS® HIV-1 |
No caducado |
30 días desde el primer uso |
Máx. 10 series |
Máx. 8 horas |
|
COBAS® HBV/HCV/HIV-1 Control Kit |
No caducado |
No aplicable |
No aplicable |
Máx. 8 horas |
|
COBAS® NHP Negative Control Kit |
No caducado |
No aplicable |
No aplicable |
Máx. 10 horas |
|
cobas omni Lysis Reagent |
No caducado |
30 días desde la carga* |
No aplicable |
No aplicable |
|
cobas omni MGP Reagent |
No caducado |
30 días desde la carga* |
No aplicable |
No aplicable |
|
cobas omni Specimen Diluent |
No caducado |
30 días desde la carga* |
No aplicable |
No aplicable |
|
cobas omni Wash Reagent |
No caducado |
30 días desde la carga* |
No aplicable |
No aplicable |
* El tiempo se calcula desde la primera vez que se carga el reactivo en los cobas® 6800/8800 Systems.
El cobas® Specimen Pre-Extraction Reagent permanece estable hasta la fecha de caducidad indicada. Una vez abierto, este reactivo se mantiene estable durante 30 días cuando se almacena a una temperatura comprendida entre 2 y 8 °C, incluidas 13 horas acumuladas a 30 °C, o bien hasta la fecha de caducidad, lo que se produzca primero, según se especifica en la Tabla 8.
Tabla 8. Condiciones de caducidad del cobas® Specimen Pre-Extraction Reagent
|
Reactivo |
Fecha de caducidad del kit |
Estabilidad del kit abierto |
Series en las que se puede utilizar el kit |
Estabilidad a 30 °C fuera de la nevera (tiempo acumulado) |
|
COBAS® Specimen Pre-Extraction Reagent |
No caducado |
30 días desde el primer uso |
No aplicable |
Máx. 13 horas |
Material adicional necesario:
Tabla 9. Materiales y material fungible para uso con los cobas® 6800/8800 Systems
|
Material |
P / N |
|
cobas omni Processing Plate |
05534917001 |
|
cobas omni Amplification Plate |
05534941001 |
|
cobas omni Pipette Tips |
05534925001 |
|
cobas omni Liquid Waste Container |
07094388001 |
|
cobas omni Lysis Reagent |
06997538190 |
|
cobas omni MGP Reagent |
06997546190 |
|
cobas omni Specimen Diluent |
06997511190 |
|
cobas omni Wash Reagent |
06997503190 |
|
Bolsa para residuos sólidos |
07435967001 |
|
Recipiente de residuos sólidos |
07094361001 |
Tabla 10. Otros materiales y consumibles necesarios únicamente para el uso con muestras de plasma seco de PSC
|
Material |
|---|
|
cobas® Plasma Separation Card (P/N 07963084190 o P/N 09411763190)* |
|
Fórceps o pinzas estériles o desechables** |
|
Capilar de 140 μL (p. ej., tubo de plástico Vitrex) con dispensador compatible (p. ej., soporte para pipetas Vitrex)* |
|
Dispositivo de punción de un solo uso (p. ej., Greiner Bio-One: MiniCollect® Safety Lancet, profundidad de penetración de 2,00 mm)* |
|
Bolsa de muestras (de plástico transparente resellable con cierre hermético) y bolsas desecantes de gel de sílice (para un total de 4 gramos) (si desea obtener más información sobre el almacenamiento y la entrega de la PSC, consulte las instrucciones de la PSC ms_09411763190) |
|
Bolsa de transporte (p. ej., Wicoseal 180 x 60 x 240 mm) |
|
Pipeta (p. ej., pipeta Multistepper) |
|
Eppendorf Thermomixer® (p. ej., el modelo R 5355, C o equivalente) con termobloque para 24 criotubos |
|
Tubos de polipropileno de 5 mL y 12,5 mm de diámetro con rosca interior (p. ej., Greiner Bio-One Cryo.s™) y con tapones |
* Consulte las instrucciones de la PSC ms_09411763190 para obtener más información sobre la recogida de muestras en PSC.
** Para evitar la contaminación por arrastre, utilice únicamente un par de fórceps por paciente. Se recomienda utilizar fórceps de metal y esterilizarlos en un autoclave tras cada uso.
Instrumentos y software necesarios:
Es necesario instalar el software cobas® 6800/8800 y el paquete de análisis COBAS® HIV-1 en los instrumentos. Para la aplicación de muestras de plasma seco procedentes de una PSC, es necesario instalar la prueba COBAS® HIV-1 PSC ASAP en los instrumentos. El IG (Instrument Gateway) se suministra con el sistema.
Tabla 11. Instrumentos
|
Equipo |
P/N |
|
COBAS® 6800 System (opción móvil) |
05524245001 y 06379672001 |
|
COBAS® 6800 System (fijo) |
05524245001 y 06379664001 |
|
COBAS® 8800 System |
05412722001 |
|
Módulo de suministro de muestras |
06301037001 |
Consulte el Manual de usuario de los cobas® 6800/8800 Systems para obtener información adicional sobre los tubos primarios y secundarios compatibles con cada instrumento.
Nota: Póngase en contacto con su representante local de Roche para obtener una lista de pedido detallada para racks de muestras, racks para puntas obstruidas y bandejas de racks compatibles con cada instrumento.
EVALUACIÓN NO CLÍNICA DEL RENDIMIENTO:
Características clave de rendimiento para muestras de plasma conservado en EDTA:
Límite de detección (LoD):
Estándar internacional de la OMS:
El límite de detección de la prueba COBAS® HIV-1 se determinó mediante el análisis de diluciones en serie del estándar internacional de la OMS para ARN del VIH-1 en ensayos mediante tecnología de amplificación de ácidos nucleicos (segundo estándar internacional de la OMS) para el grupo M subtipo B obtenido de NIBSC, en plasma humano conservado en EDTA negativo al VIH con volúmenes de procesamiento de muestras de 500 μL y 200 μL. Se analizaron paneles con cinco niveles de concentración más uno negativo con tres lotes de reactivo de la prueba COBAS® HIV-1, con múltiples series analíticas, días, operadores e instrumentos.
Los resultados del plasma conservado en EDTA correspondientes a los dos volúmenes de procesamiento se resumen en la Tabla 14 y la Tabla 15. El estudio demuestra que la prueba COBAS® HIV-1 es capaz de detectar ARN del VIH-1 en una concentración de 13,2 cp/mL (22,0 UI/mL) según el análisis Probit con una tasa de positividad del 95% para el volumen de procesamiento de muestras de 500 μL y en una concentración de 35,5 cp/mL (59,2 UI/mL) o superior según el análisis PROBIT con una tasa de positividad del 95% para el volumen de procesamiento de muestras de 200 μL.
Tabla 14. Límite de detección en plasma conservado en EDTA (500 μL)
|
Concentración del título de entrada (ARN del VIH-1 cp/mL) |
Concentración del título de entrada (ARN del VIH-1 UI/mL) |
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % |
|
40,0 |
66,7 |
189 |
189 |
100,0% |
|
20,0 |
33,3 |
189 |
186 |
98,4% |
|
10,0 |
16,7 |
189 |
171 |
90,5% |
|
5,0 |
8,3 |
189 |
125 |
66,1% |
|
2,5 |
4,2 |
189 |
67 |
35,4% |
|
0,0 |
0,0 |
189 |
0 |
0,0% |
|
LoD según PROBIT con una tasa de positividad del 95% |
13,2 cp/mL; intervalo de confianza del 95%: 11,4-15,9 cp/mL 22,0 UI/mL; intervalo de confianza del 95%: (19,0-26,5 UI/mL) |
|||
Tabla 15. Límite de detección en plasma conservado en EDTA (200 μL)
|
Concentración del título de entrada (ARN del VIH-1 cp/mL) |
Concentración del título de entrada (ARN del VIH-1 UI/mL) |
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % |
|
200,0 |
333,3 |
189 |
189 |
100,0% |
|
100,0 |
166,7 |
188 |
188 |
100,0% |
|
50,0 |
83,3 |
189 |
186 |
98,4% |
|
25,0 |
41,7 |
189 |
164 |
86,8% |
|
12,5 |
20,8 |
189 |
112 |
59,3% |
|
0,0 |
0,0 |
188 |
0 |
0,0% |
|
LoD según PROBIT con una tasa de positividad del 95% |
35,5 cp/mL; intervalo de confianza del 95%: 30,8-43,2 cp/mL 59,2 UI/mL; intervalo de confianza del 95%: (51,3-72,0 UI/mL) |
|||
Intervalo lineal:
El estudio de linealidad de la prueba COBAS® HIV-1 se llevó a cabo con una serie de diluciones formadas por un panel de 12 miembros (volumen de procesamiento de muestras de 500 μL) y un panel de 11 miembros (volumen de procesamiento de muestras de 200 μL) con el que se cubría el intervalo lineal para el VIH-1 grupo M subtipo B. Los miembros del panel se prepararon a partir de una muestra de sobrenadante de cultivos celulares positivos para ARN del VIH-1 de título elevado. La evaluación se realizó según las directrices del EP06-A del CLSI.20 Se analizaron tres lotes de reactivo en tres cobas® 6800/8800 Systems, con tres operadores y un total de 16 réplicas por miembro del panel y lote durante cuatro días de análisis (cuatro réplicas por lote de kit y día).
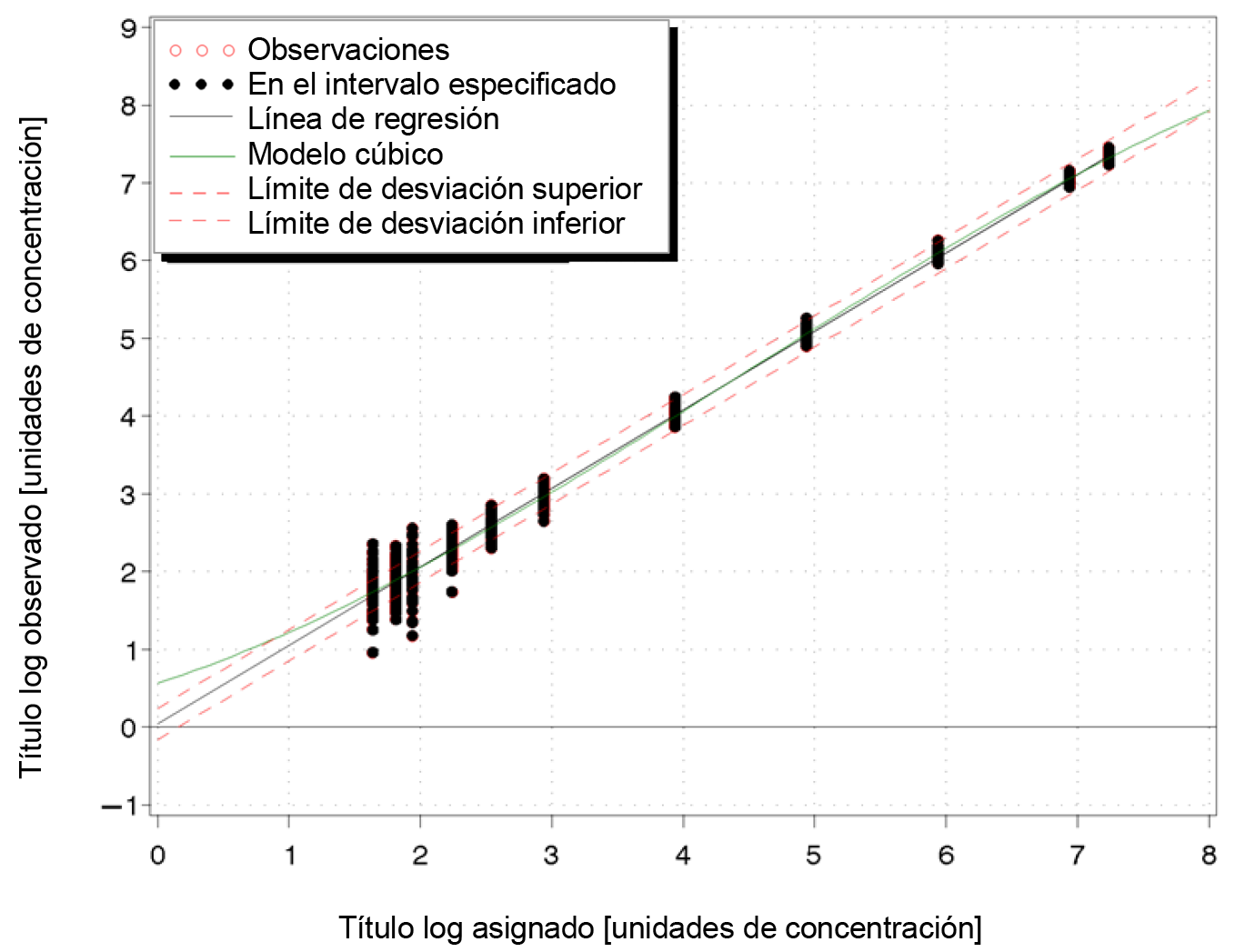
Para el volumen de procesamiento de 500 μL, la prueba COBAS® HIV-1 es lineal de 20 cp/mL a 1,00E+07 cp/mL (de 33,3 UI/mL a 1,67E+07 UI/mL) y presenta una desviación absoluta respecto al mejor ajuste de la regresión no lineal inferior a ± 0,2 log10 en plasma humano conservado en EDTA (consulte la Ilustración 15). En el intervalo lineal, la exactitud de la prueba estuvo comprendida entre ± 0,2 log10.
Para el volumen de procesamiento de 200 μL, la prueba COBAS® HIV-1 es lineal de 50 cp/mL a 1,00E+07 cp/mL (de 83,3 UI/mL a 1,67E+07 UI/mL) y presenta una desviación absoluta respecto al mejor ajuste de la regresión no lineal inferior a ± 0,2 log10 en plasma humano conservado en EDTA (consulte la Ilustración 16). En el intervalo lineal, la exactitud de la prueba estuvo comprendida entre ± 0,2 log10.
Ilustración 15. Determinación del intervalo lineal en plasma conservado en EDTA (500 μL)

Ilustración 16. Determinación del intervalo lineal en plasma conservado en EDTA (200 μL)
Precisión intralaboratorio:
La precisión de la prueba COBAS® HIV-1 se determinó mediante el análisis de diluciones en serie de una muestra positiva alta para VIH-1 (grupo M subtipo B; cultivos de virus) en plasma conservado en EDTA negativo para el VIH. Se analizaron ocho niveles de dilución (volumen de procesamiento de muestras de 500 μL) y siete niveles de dilución (volumen de procesamiento de muestras de 200 μL) en 48 réplicas para cada nivel y volumen de procesamiento con tres lotes de los reactivos de la prueba COBAS® HIV-1 en tres instrumentos distintos y con tres operadores diferentes durante 12 días. Cada muestra se sometió al procedimiento completo de la prueba COBAS® HIV-1 en los cobas® 6800/8800 Systems totalmente automatizados. Los resultados de precisión mostrados en este documento engloban todos los aspectos del procedimiento de la prueba. Los resultados se muestran en la Tabla 16 y la Tabla 17.
La prueba COBAS® HIV-1 presentó una alta precisión para los tres lotes de reactivo analizados en un intervalo de concentración de 1,00E+02 cp/mL a 1,00E+07 cp/mL con un volumen de procesamiento de muestras de 500 μL y de 2,00E+02 cp/mL a 1,00E+07 cp/mL con un volumen de procesamiento de muestras de 200 μL.
Tabla 16 Precisión intralaboratorio de la prueba COBAS® HIV-1 (muestras de plasma conservado en EDTA – volumen de procesamiento de 500 μL)*
|
Concentración nominal (cp/mL) |
Concentración asignada (cp/mL) |
Material de origen |
Plasma conservado en EDTA |
|||
|
Lote 1 |
Lote 2 |
Lote 3 |
Lote 4 |
|||
|
SD |
SD |
SD |
SD agrupada |
|||
|
1,00E+07 |
8,67E+06 |
Cultivo celular |
0,04 |
0,06 |
0,03 |
0,05 |
|
1,00E+06 |
8,67E+05 |
Cultivo celular |
0,06 |
0,05 |
0,04 |
0,05 |
|
1,00E+05 |
8,67E+04 |
Cultivo celular |
0,05 |
0,07 |
0,04 |
0,05 |
|
1,00E+04 |
8,67E+03 |
Cultivo celular |
0,06 |
0,06 |
0,04 |
0,05 |
|
1,00E+03 |
8,67E+02 |
Cultivo celular |
0,07 |
0,06 |
0,07 |
0,07 |
|
4,00E+02 |
3,47E+02 |
Cultivo celular |
0,09 |
0,10 |
0,09 |
0,09 |
|
2,00E+02 |
1,73E+02 |
Cultivo celular |
0,11 |
0,08 |
0,14 |
0,11 |
|
1,00E+02 |
8,67E+01 |
Cultivo celular |
0,15 |
0,11 |
0,10 |
0,12 |
* Se considera que los datos de título cuentan con una distribución log-normal y se analizan según la transformación de log10. Las columnas de desviaciones estándar (SD) presentan el total del título log-transformado para cada uno de los tres lotes de reactivo.
Tabla 17 Precisión intralaboratorio de la prueba COBAS® HIV-1 (muestras de plasma conservado en EDTA – volumen de procesamiento de 200 μL)*
|
Concentración nominal (cp/mL) |
Concentración asignada (cp/mL) |
Material de origen |
Plasma conservado en EDTA |
|||
|
Lote 1 |
Lote 2 |
Lote 3 |
Lote 4 |
|||
|
SD |
SD |
SD |
SD agrupada |
|||
|
1,00E+07 |
8,67E+06 |
Cultivo celular |
0,04 |
0,05 |
0,04 |
0,04 |
|
1,00E+06 |
8,67E+05 |
Cultivo celular |
0,07 |
0,05 |
0,05 |
0,06 |
|
1,00E+05 |
8,67E+04 |
Cultivo celular |
0,07 |
0,07 |
0,06 |
0,07 |
|
1,00E+04 |
8,67E+03 |
Cultivo celular |
0,08 |
0,08 |
0,06 |
0,08 |
|
1,00E+03 |
8,67E+02 |
Cultivo celular |
0,12 |
0,12 |
0,08 |
0,11 |
|
4,00E+02 |
3,47E+02 |
Cultivo celular |
0,11 |
0,13 |
0,09 |
0,11 |
|
2,00E+02 |
1,73E+02 |
Cultivo celular |
0,20 |
0,12 |
0,15 |
0,16 |
* Se considera que los datos de título cuentan con una distribución log-normal y se analizan según la transformación de log10. Las columnas de desviaciones estándar (SD) presentan el total del título log-transformado para cada uno de los tres lotes de reactivo.
Verificación de los subtipos:
Se evaluó el rendimiento de la prueba COBAS® HIV-1 para los subtipos del grupo M, el grupo O y el grupo N del VIH-1 mediante:
• Verificación del límite de detección para los subtipos del grupo M, el grupo O y el grupo N
• Verificación de la linealidad para los subtipos del grupo M, el grupo O y el grupo N
• Asignación de título realizada mediante COBAS® HIV-1
Verificación del límite de detección para los subtipos del grupo M, el grupo O y el grupo N:
Se diluyeron cultivos de muestras del VIH-1 para VIH-1M (A, C, D, F, G, H, CRF01_AE, CRF02_AG), VIH-1O y VIH-1N a tres niveles de concentración diferentes en plasma conservado en EDTA. La determinación de la tasa de positividad se llevó a cabo con 63 réplicas para cada nivel. El análisis se realizó con 1 lote de reactivo de COBAS® HIV-1. En la Tabla 18 se muestran los resultados obtenidos con el plasma conservado en EDTA con un volumen de 500 μL. Estos resultados verifican que la prueba COBAS® HIV-1 es capaz de detectar el VIH para VIH-1M (A, C, D, F, G, H, CRF01_AE, CRF02_AG), VIH-1O y VIH-1N en la concentración esperada de 20 cp/mL o inferior con un intervalo de confianza unilateral superior del 95% igual o mayor que la tasa de positividad esperada del 95%.
Tabla 18. Verificación del LoD para los subtipos del grupo M, el grupo O y el grupo N del VIH-1 en 500 μL de plasma conservado en EDTA
|
Grupo |
Subtipo |
10 cp/mL |
20 cp/mL |
40 cp/mL |
||||||
|
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % (IC del 95% *) |
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % (IC del 95% *) |
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % (IC del 95% *) |
||
|
M |
A |
63 |
59 |
93,7 % (97,8 %) |
63 |
63 |
100 % (100 %) |
63 |
63 |
100 % (100 %) |
|
C |
63 |
51 |
81,0 % (88,6 %) |
63 |
61 |
96,8 % (99,4 %) |
63 |
63 |
100 % (100 %) |
|
|
D |
63 |
48 |
76,2 % (84,7 %) |
62 |
60 |
96,8 % (99,4 %) |
63 |
63 |
100 % (100 %) |
|
|
F |
63 |
59 |
93,7 % (97,8 %) |
63 |
63 |
100 % (100 %) |
63 |
63 |
100 % (100 %) |
|
|
G |
63 |
54 |
85,7 % (92,3 %) |
63 |
63 |
100 % (100 %) |
63 |
63 |
100 % (100 %) |
|
|
H |
63 |
52 |
82,5 % (89,9 %) |
63 |
63 |
100 % (100 %) |
63 |
63 |
100 % (100 %) |
|
|
CRF01_AE |
63 |
52 |
82,5 % (89,9 %) |
63 |
62 |
98,4 % (99,9 %) |
63 |
63 |
100 % (100 %) |
|
|
CRF02_AG |
63 |
56 |
88,9 % (94,7 %) |
63 |
62 |
98,4 % (99,9 %) |
63 |
63 |
100 % (100 %) |
|
|
O |
63 |
49 |
77,8 % (86,0 %) |
63 |
57 |
90,5 % (95,8 %) |
63 |
63 |
100 % (100 %) |
|
|
N |
63 |
57 |
90,5 % (95,8 %) |
63 |
63 |
100 % (100 %) |
63 |
63 |
100 % (100 %) |
|
* Intervalo de confianza unilateral superior del 95%
Asimismo, se verificó el límite de detección para los 10 subtipos analizados con un volumen inicial de 200 μL. Los datos se resumen en la Tabla 19. Los resultados verifican que la prueba COBAS® HIV-1 es capaz de detectar ARN del VIH para VIH-1M (A, C, D, F, G, H, CRF01_AE, CRF02_AG), y VIH-1N a la concentración esperada de 50 cp/mL o inferior con un intervalo de confianza unilateral superior del 95% igual o mayor que la tasa de positividad esperada del 95%. La verificación del VIH-1O se realizó con 100 cp/mL.
Tabla 19. Verificación del LoD para los subtipos del grupo M, el grupo O y el grupo N del VIH-1 en 200 μL de plasma conservado en EDTA
|
Grupo |
Subtipo |
10 cp/mL |
20 cp/mL |
40 cp/mL |
||||||
|---|---|---|---|---|---|---|---|---|---|---|
|
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % (IC del 95% *) |
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % (IC del 95% *) |
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % (IC del 95% *) |
||
|
M |
A |
63 |
54 |
85,7 % (92,3 %) |
63 |
60 |
95,2 % (98,7 %) |
63 |
63 |
100 % (100 %) |
|
C |
63 |
50 |
79,4 % (87,3 %) |
63 |
62 |
98,4 % (99,9 %) |
63 |
63 |
100 % (100 %) |
|
|
D |
63 |
51 |
81,0 % (88,6 %) |
62 |
63 |
100 % (100 %) |
63 |
63 |
100 % (100 %) |
|
|
F |
63 |
56 |
88,9 % (94,7 %) |
63 |
62 |
98,4 % (99,9 %) |
63 |
63 |
100 % (100 %) |
|
|
G |
63 |
52 |
82,5 % (89,9 %) |
63 |
62 |
98,4 % (99,9 %) |
63 |
63 |
100 % (100 %) |
|
|
H |
63 |
61 |
96,8 % (99,4 %) |
63 |
63 |
100 % (100 %) |
63 |
63 |
100 % (100 %) |
|
|
CRF01_AE |
63 |
53 |
84,1 % (91,1 %) |
63 |
57 |
90,5 % (95,8 %) |
63 |
63 |
100 % (100 %) |
|
|
CRF02_AG |
63 |
49 |
77,8 % (86,0 %) |
63 |
63 |
100 % (100 %) |
63 |
63 |
100 % (100 %) |
|
|
O |
63 |
44 |
69,8 % (79,3 %) |
63 |
56 |
88,9 % (94,7 %) |
63 |
63 |
100 % (100 %) |
|
|
N |
63 |
55 |
87,3 % (93,5 %) |
63 |
63 |
100 % (100 %) |
63 |
63 |
100 % (100 %) |
|
* Intervalo de confianza unilateral superior del 95%
Verificación del intervalo de linealidad para los subtipos del grupo M, el grupo O y el grupo N:
La serie de diluciones utilizada para la verificación del estudio de linealidad de los subtipos de la prueba COBAS® HIV-1 consta de siete miembros del panel (volumen de procesamiento de muestras de 500 μL) y seis miembros del panel (volumen de procesamiento de muestras de 200 μL) que abarcan la totalidad del intervalo de linealidad. Los miembros del panel se prepararon a partir de muestras de sobrenadante de cultivos celulares positivos para el ARN del VIH-1 de título elevado del subtipo respectivo. El análisis se realizó con dos lotes de reactivo de COBAS® HIV-1; se analizaron 14 réplicas por nivel en plasma conservado en EDTA.
Se verificó el intervalo lineal de la prueba COBAS® HIV-1 para los subtipos del grupo M, el grupo O y el grupo N. La desviación máxima entre la regresión lineal y el mejor ajuste de la regresión no lineal fue igual a o inferior a 0,2 log10.
Especificidad:
La especificidad de la prueba COBAS® HIV-1 se determinó mediante el análisis de muestras de plasma conservadas en EDTA negativas para el VIH obtenidas de donantes individuales. Se analizaron 600 muestras de plasma conservado en EDTA con dos lotes de reactivo de COBAS® HIV-1. Todas las muestras dieron negativo para ARN del VIH-1. En el panel de la prueba, la especificidad de la prueba COBAS® HIV-1 fue del 100% (límite de confianza del 95%: ≥ 99,5%).
Especificidad analítica:
La especificidad analítica de la prueba COBAS® HIV-1 se evaluó mediante la dilución de un panel de microorganismos en plasma conservado en EDTA positivo para ARN del VIH y negativo para ARN del VIH. Los microorganismos se añadieron al plasma humano conservado en EDTA negativo al virus y se analizaron con y sin ARN del VIH. Ninguno de los patógenos distintos del VIH interfirió en el rendimiento de la prueba. La prueba COBAS® HIV-1 generó resultados negativos para todas las muestras de microorganismos sin fragmento objetivo del VIH-1 y resultados positivos para todas las muestras de microorganismos con fragmento objetivo del VIH-1. El título log10 medio de cada una de las muestras positivas para VIH-1 con organismos de posible reacción cruzada se situó entre ± 0,3 log10 del título log10 medio del control positivo respectivo añadido.
Tabla 20. Microorganismos analizados para reactividad cruzada
|
Virus |
Bacterias |
Levadura |
|
|---|---|---|---|
|
Adenovirus tipo 5 |
Virus de la varicela zóster |
Propionibacterium acnes |
Candida albicans |
|
Citomegalovirus |
Virus del Nilo Occidental |
Staphylococcus aureus |
|
|
Virus Epstein-Barr |
Virus de la encefalitis de St. Louis |
||
|
Virus de la hepatitis A |
Virus de la encefalitis del Valle Murray |
||
|
Virus de la hepatitis B |
Virus del dengue tipos 1, 2, 3 y 4 |
||
|
Virus de la hepatitis C |
Virus FSME (cepa HYPR) |
||
|
Virus de la hepatitis D |
Virus de la gripe A |
||
|
Virus linfotrópico de células T humanas tipos 1 y 2 |
Virus Zika |
||
|
Virus del herpes humano tipo 6 |
Virus del papiloma humano |
||
|
Virus del herpes simple tipos 1 y 2 |
Virus de la fiebre amarilla |
||
Especificidad analítica: sustancias interferentes:
Se analizaron niveles elevados de triglicéridos (hasta 34,5 g/L), bilirrubina conjugada (0,25 g/L), bilirrubina no conjugada (0,25 g/L), albúmina (58,7 g/L), hemoglobina (2,9 g/L) y ADN humano (2 mg/L) en muestras, así como la presencia de enfermedades autoinmunes como el lupus eritematoso sistémico (LES), artritis reumatoidea (AR) y anticuerpos antinucleares (ANA), en presencia y ausencia de ARN del VIH.
También se analizaron los compuestos farmacológicos de la Tabla 21 con una concentración tres veces superior a la Cmax tanto en presencia como en ausencia de ARN del VIH.
Ninguna de las posibles sustancias interferentes afecta al rendimiento de la prueba. La prueba COBAS® HIV-1 generó resultados negativos para todas las muestras sin fragmento objetivo del VIH y resultados positivos para todas las muestras con fragmento objetivo del VIH-1. El título log10 medio de cada una de las muestras positivas para el VIH-1 con organismos potencialmente interferentes se situó entre ± 0,3 log10 del título log10 medio del control positivo respectivo añadido.
Tabla 21. Compuestos farmacológicos analizados para la interferencia mediante cuantificación del ARN del VIH con la prueba COBAS® HIV-1
|
Clase de fármaco |
Nombre genérico del fármaco |
|
|
Moduladores del sistema inmunológico |
Peginterferón α-2a Ribavirina |
Peginterferón α-2b |
|
Inhibidor de la entrada del VIH |
Maraviroc |
|
|
Inhibidores de la integrasa del VIH |
Elvitegravir/ Cobicistat |
Raltegravir |
|
Inhibidores de la transcriptasa inversa no nucleósidos del VIH |
Efavirenz Etravirina |
Nevirapina Rilpivirina |
|
Inhibidores de la proteasa del VIH |
Atazanavir Tipranavir Darunavir Fosamprenavir |
Lopinavir Nelfinavir Ritonavir Saquinavir |
|
Inhibidores de la proteasa del VHC |
Boceprevir Simeprevir |
Telaprevir |
|
Inhibidores de la transcriptasa inversa o de la polimerasa de ADN |
Abacavir Emtricitabina Entecavir Foscarnet Cidofovir Lamivudina Ganciclovir |
Tenofovir Adefovir dipivoxil Telbivudina Zidovudina Aciclovir Valganciclovir Sofosbuvir |
|
Compuestos para el tratamiento de infecciones oportunistas |
Azitromicina Claritromicina Etambutol Fluconazol Isoniazida |
Pirazinamida Rifabutina Rifampicina Sulfametoxazol Trimetoprima |
Comparación del rendimiento con la prueba cobas® AmpliPrep/cobas® TaqMan® HIV-1, v2.0:
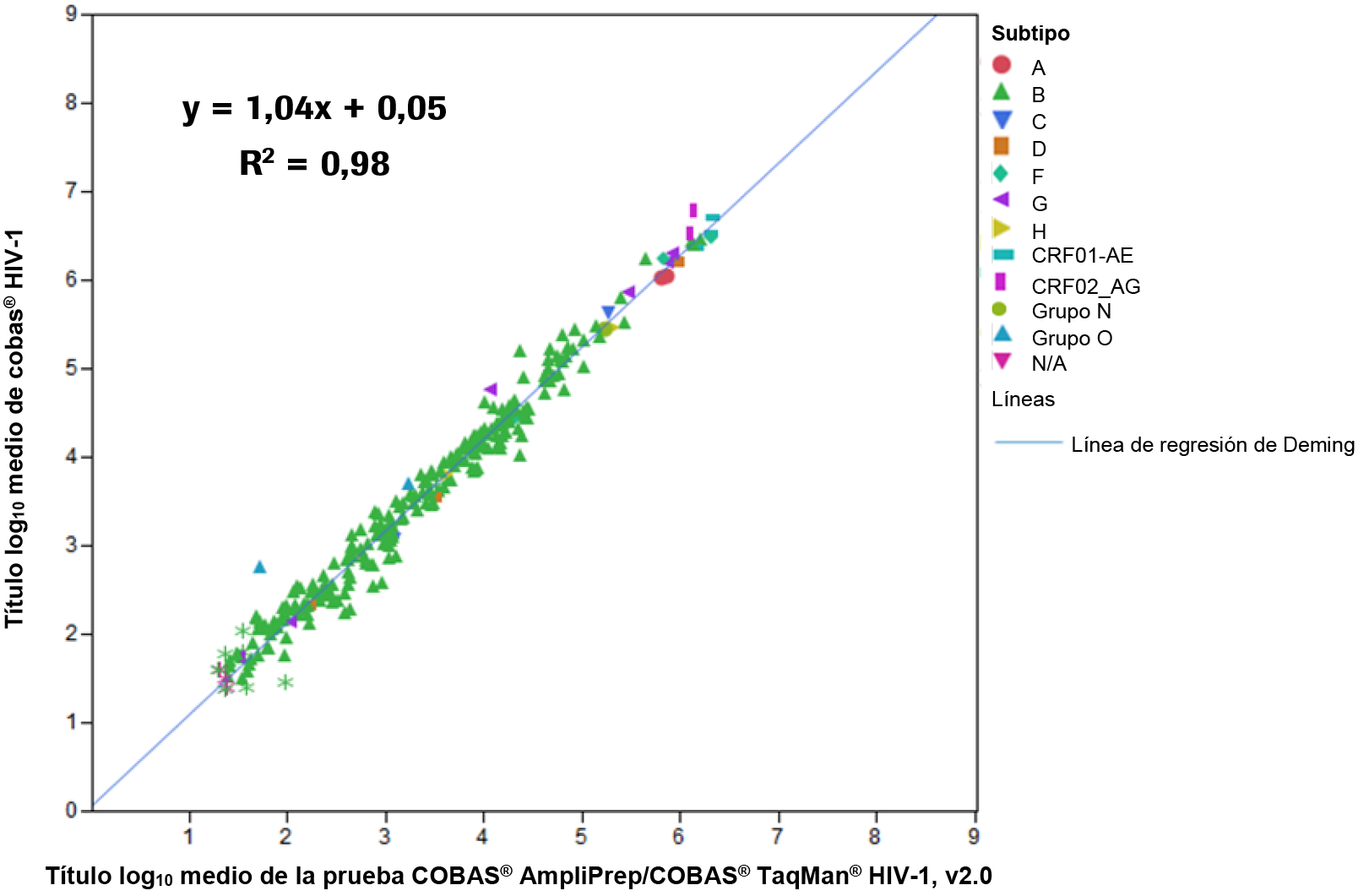
Se comparó el rendimiento de la prueba COBAS® HIV-1 y la prueba cobas® AmpliPrep/cobas® TaqMan® HIV-1 v2.0 (prueba TaqMan® HIV-1, v2.0) mediante el análisis de 251 muestras de plasma conservado en EDTA de pacientes infectados por el VIH-1 y el análisis de 16 sobrenadantes de cultivos celulares diluidos. Las muestras contenían VIH-1 M (A–D, F–H, CRF01_AE, CRF02_AG), VIH-1 O y VIH-1N y se analizaron por duplicado en un laboratorio externo. Se generaron títulos inferiores al intervalo de cuantificación inferior (< 20 cp/mL) para una de las dos réplicas de cinco muestras tanto en el cobas® AmpliPrep/cobas® TaqMan® System como en los cobas® 6800/8800 Systems, y para cinco muestras en el cobas® AmpliPrep/cobas® TaqMan® System exclusivamente. Una muestra en el cobas® AmpliPrep/cobas® TaqMan® generó una alícuota válida solamente. Los títulos inferiores al intervalo de cuantificación se excluyeron del análisis. Se realizó una regresión de Deming con los títulos log-transformados. En el caso de las muestras para las que ambas réplicas se situaron dentro del intervalo de cuantificación, se utilizó el título log10 medio para el análisis.
En la Ilustración 17 se muestran los resultados de la regresión de Deming. El símbolo * en la Ilustración 17 indica una única determinación.
Ilustración 17. Comparación del análisis de regresión entre las pruebas COBAS® HIV-1 y TaqMan® HIV-1, v2.0 en muestras de plasma conservado en EDTA
Fallo de todo el sistema:
La tasa de fallo de todo el sistema de la prueba COBAS® HIV-1 se determinó mediante el análisis de 100 réplicas de plasma conservado en EDTA al que se añadió VIH-1 grupo M subtipo B. Dichas muestras se analizaron con una concentración de fragmento objetivo de aproximadamente 3 x LoD.
Los resultados del estudio indican que todas las réplicas fueron válidas y positivas para el fragmento objetivo del VIH-1, lo que representa una tasa de fallo de todo el sistema del 0%. El intervalo de confianza bilateral exacto del 95% fue del 0% para el límite inferior y del 3,6% para el límite superior [0%: 3,6%].
Contaminación cruzada:
La tasa de contaminación por arrastre de la prueba COBAS® HIV-1 se determinó mediante el análisis de 240 réplicas de una muestra de plasma humano conservado en EDTA negativo al virus VIH y de 225 réplicas de una muestra de VIH-1 con un título alto de 4,00E+06 cp/mL. El estudio se realizó mediante el cobas® 6800 System. En total, se realizaron cinco series con muestras positivas y negativas utilizando un método de ensayo con configuración de tablero de ajedrez.
Las 240 réplicas de la muestra negativa resultaron negativas, por lo que la tasa de contaminación por arrastre fue del 0%. El intervalo de confianza bilateral exacto del 95% fue del 0% para el límite inferior y del 1,5% para el límite superior [0%: 1,5%].
Características clave de rendimiento para muestras de plasma seco de PSC:
Límite de detección (LoD):
El límite de detección del plasma de la prueba COBAS® HIV-1 en combinación con la PSC se determinó mediante el análisis de títulos de plasma asignados a diluciones en serie del sobrenadante del cultivo celular del grupo M del VIH-1 en sangre total humana negativa para VIH. Se analizaron paneles con cinco niveles de concentración más uno negativo con tres lotes de muestras de PSC y tres lotes de reactivos de la prueba COBAS® HIV-1, con múltiples series analíticas, días, operadores e instrumentos. Se centrifugaron muestras del miembro del panel más alto y la asignación del título del plasma se realizó mediante el método de calibradores de referencia (CBM) a través de la prueba COBAS® HIV-1 con el tercer estándar internacional de la OMS para el grupo M, subtipo B, del VIH-1 para la preparación de los calibradores alto y bajo.
Los resultados combinados de estos tres lotes de PSC, donantes negativos y series de dilución con asignaciones de títulos de plasma individuales (CBM) se muestran en la Tabla 22. El estudio demuestra que la prueba COBAS® HIV-1 en combinación con la PSC detectó el ARN del VIH-1 a una concentración de 790,2 cp/mL con una tasa de positividad del 95%, según determinan los análisis PROBIT.
Tabla 22. Límite de detección en combinación con la PSC
|
Concentración del título de plasma asignado (ARN del VIH-1 cp/mL) |
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % |
|---|---|---|---|
|
1971,1 |
62 |
62 |
100,00 |
|
1925,3 |
63 |
63 |
100,00 |
|
1358,1 |
62 |
62 |
100,00 |
|
985,5 |
63 |
62 |
98,41 |
|
962,6 |
63 |
62 |
98,41 |
|
679 |
63 |
59 |
93,65 |
|
657 |
63 |
59 |
93,65 |
|
641,8 |
63 |
57 |
90,48 |
|
452,7 |
63 |
52 |
82,54 |
|
328,5 |
63 |
47 |
74,60 |
|
320,9 |
63 |
46 |
73,02 |
|
226,3 |
62 |
49 |
79,03 |
|
164,3 |
63 |
36 |
57,14 |
|
160,4 |
63 |
35 |
55,56 |
|
113,2 |
63 |
38 |
60,32 |
|
0 |
189 |
0 |
0,00 |
|
LoD según PROBIT con una tasa de positividad del 95% |
790,2 cp/mL; intervalo de confianza del 95%: 658,9-1.003,6 cp/mL 1.317 UI/mL; intervalo de confianza del 95%: (1.098,2-1.672,7 UI/mL) |
||
Estimación del LoD en sangre total
No es posible determinar con exactitud los títulos correspondientes en sangre total de la misma muestra, dado que la sangre total no es un tipo de muestra adecuado para las pruebas de carga viral. Para la estimación del LoD, no se utilizaron los títulos de sangre total basados en la cantidad de ARN del VIH-1 añadida a las muestras de sangre total, ya que la cantidad de ARN añadido no se corresponde necesariamente con la cantidad de ARN en plasma. Incluso después de la centrifugación, el ARN puede permanecer en la capa leucocitaria o asociado a la fracción celular de la sangre total. Sin embargo, dado que existen otras tecnologías (como las muestras de sangre seca) que han utilizado los títulos de sangre total añadidos para realizar estimaciones del límite de detección en sangre total, se puede proporcionar una estimación del LoD de sangre total de PSC basada en un factor empírico que se presupone relacionado con el contenido medio de hematocrito (45%) de las muestras (Tabla 23).
Los valores del LoD en sangre total son estimaciones basadas en el siguiente supuesto:
Estimación del LoD en sangre total = LoD del plasma de PSC/1,8.
Tabla 23. Estimación del LoD en sangre total
|
LOD según análisis PROBIT (tasa de positividad del 95%) |
439,0 cp/mL |
|
Intervalo de confianza del 95% |
366,1-557,6 cp/mL |
Intervalo lineal con la PSC:
El estudio de linealidad de la prueba COBAS® HIV-1 en combinación con la PSC se llevó a cabo con una serie de diluciones formadas por un panel de 9 miembros con el que se cubría el intervalo lineal del grupo M, subtipo B, del VIH-1. Los miembros del panel se prepararon a partir de una muestra de sobrenadante de cultivos celulares positivos para ARN del VIH-1 de título elevado. La evaluación se realizó según las directrices del EP06-A del CLSI.20 Se analizaron dos lotes de PSC y dos lotes de reactivo en dos cobas® 6800/8800 Systems, con tres operadores y un total de 20 réplicas por miembro del panel y lote de reactivo/PSC.
Se centrifugaron muestras de un miembro del panel y la asignación del título del plasma se realizó mediante el método de calibradores de referencia (CBM) a través de la prueba COBAS® HIV-1 con el tercer estándar internacional de la OMS para el grupo M, subtipo B, del VIH-1 para la preparación del calibrador alto y bajo.
En combinación con la PSC, la prueba COBAS® HIV-1 es lineal de 790 cp/mL a 1,00E+07 cp/mL y presenta una desviación absoluta respecto al mejor ajuste de la regresión no lineal inferior a ± 0,24 log10 con la PSC (consulte la Ilustración 18). En el intervalo lineal, la exactitud de la prueba estuvo comprendida dentro de una desviación ± 0,3 log10 respecto al ajuste de la regresión lineal.
Ilustración 18. Determinación del intervalo lineal con la PSC
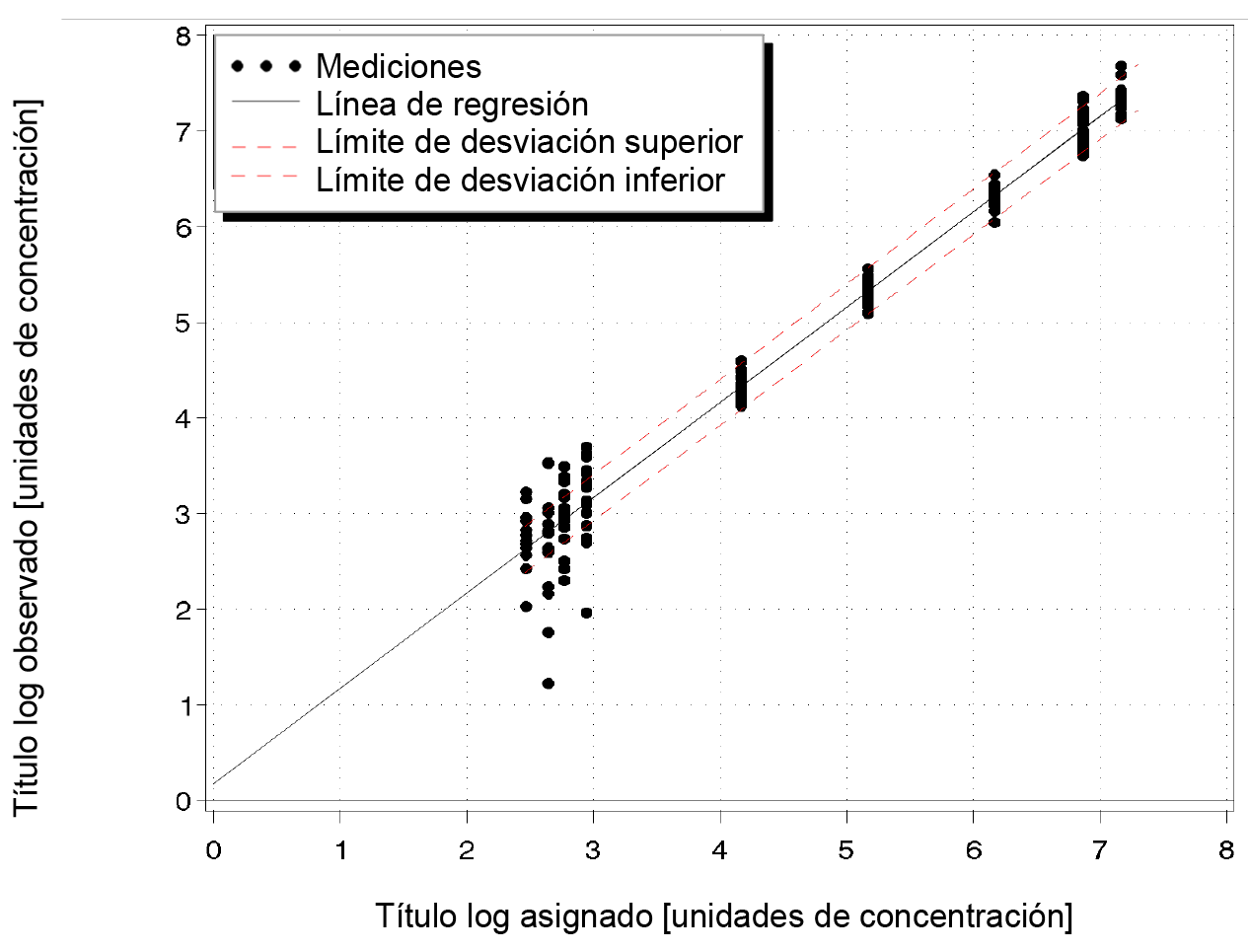
Precisión intralaboratorio con la PSC:
La precisión de la prueba COBAS® HIV-1 en combinación con la PSC se determinó mediante el análisis de diluciones en serie de una muestra positiva alta para VIH-1 (muestra de sobrenadante de cultivo celular positiva para el ARN del VIH-1 de título elevado) en sangre total conservada en EDTA negativa para el VIH. Se analizaron cinco niveles de dilución en 48 réplicas para cada nivel y volumen de procesamiento en dos lotes de PSC y dos lotes de reactivos para la prueba COBAS® HIV-1 en dos instrumentos diferentes y con dos usuarios distintos durante 12 días. Cada muestra se sometió al flujo de trabajo de PSC y al procedimiento de la prueba COBAS® HIV-1 completos en los cobas® 6800/8800 Systems totalmente automatizados. Los resultados de precisión mostrados en este documento engloban todos los aspectos del procedimiento de la prueba. Los resultados se muestran en la Tabla 24.
La prueba COBAS® HIV-1 en combinación con la PSC mostró una elevada precisión para dos lotes de PSC y reactivos analizados en un intervalo de concentración de 2,00E+03 cp/mL a 1,00E+07 cp/mL.
Tabla 24. Precisión intralaboratorio de la prueba COBAS® HIV-1 en combinación con la PSC
|
Concentración medida (cp/mL en plasma conservado en EDTA centrifugado) |
Material de origen |
SD agrupada |
|
1,02E+07 |
Cultivo celular |
0,08 |
|
9,12E+05 |
Cultivo celular |
0,08 |
|
8,32E+04 |
Cultivo celular |
0,09 |
|
7,94E+03 |
Cultivo celular |
0,13 |
|
2,00E+03 |
Cultivo celular |
0,23 |
Verificación del subtipo con la PSC:
Si bien el subtipo del VIH no debería afectar al rendimiento de la PSC, las muestras del VIH-1 cultivadas para los subtipos comunes del grupo M del VIH-1 (A, C y D) se diluyeron a un nivel de concentración en sangre total. La determinación de la precisión y exactitud se llevó a cabo con 12 réplicas para cada muestra. La prueba se realizó con un lote de PSC y un lote de reactivos para COBAS® HIV-1.
Se centrifugó cada muestra de sangre total y la asignación del título del plasma se realizó mediante el método de calibradores de referencia (CBM) a través de la prueba COBAS® HIV-1 con el tercer estándar internacional de la OMS para el grupo M, subtipo B, del VIH-1 para la preparación del calibrador alto y bajo.
Los resultados se muestran en la Tabla 25. Estos resultados confirman que la prueba COBAS® HIV-1 en combinación con la PSC detectó y cuantificó correctamente los subtipos A, C y D del grupo M del VIH-1.
Tabla 25. Verificación de los subtipos A, C y D del grupo M del VIH-1
|
Subtipo VIH-1 M |
Número de réplicas válidas |
Exactitud |
Precisión |
Equivalencia entre plasma y plasma de PSC |
|
Subtipo A |
12 |
–0,13 |
0,14 |
–0,20 |
|
Subtipo C |
12 |
–0,08 |
0,12 |
–0,10 |
|
Subtipo D |
12 |
–0,04 |
0,11 |
–0,10 |
Especificidad con la PSC:
La especificidad de la prueba COBAS® HIV-1 en combinación con la PSC se determinó mediante el análisis de muestras de sangre total conservada en EDTA negativas para el VIH obtenidas de donantes individuales. Se analizaron un total de 159 muestras de sangre total conservada en EDTA individuales con dos lotes de PSC y dos lotes de reactivos para la prueba COBAS® HIV-1. Todas las muestras dieron negativo para ARN del VIH-1. En el panel de la prueba, la especificidad de COBAS® HIV-1 fue del 100% (límite de confianza del 95%: ≥ 98,13%).
Tasa de fallo de todo el sistema con la PSC:
La tasa de fallo de todo el sistema de la prueba COBAS® HIV-1 en combinación con la PSC se determinó mediante el análisis de 100 réplicas de sangre total conservada en EDTA a la que se añadió subtipo B del grupo M del VIH-1. Dichas muestras se analizaron con una concentración de fragmento objetivo de aproximadamente 3 x LoD.
Los resultados del estudio indican que todas las réplicas fueron válidas y positivas para el fragmento objetivo del VIH-1, lo que representa una tasa de fallo de todo el sistema del 0%.
Rendimiento de las muestras de plasma seco procedentes de una PSC en comparación con las muestras de plasma:
El rendimiento de las muestras de plasma seco procedentes de una PSC se comparó con las muestras de plasma conservado en EDTA centrifugadas mediante el análisis de 132 muestras procedentes de pacientes infectados por el VIH-1 (FP = recogida prospectiva, VL = pruebas de carga viral, CD = recuento de CD4 de muestras sobrantes). Las muestras se analizaron con una réplica de cada (muestra de plasma seco de PSC y plasma conservado en EDTA) en un centro externo. Los títulos inferiores al intervalo de cuantificación se excluyeron del análisis. Se realizó una regresión de Deming con los títulos log-transformados.
En la Ilustración 19 se muestran los resultados de la regresión de Deming. Los símbolos * y • de la Ilustración 19 muestran determinaciones únicas.
Ilustración 19. Regresión de Deming
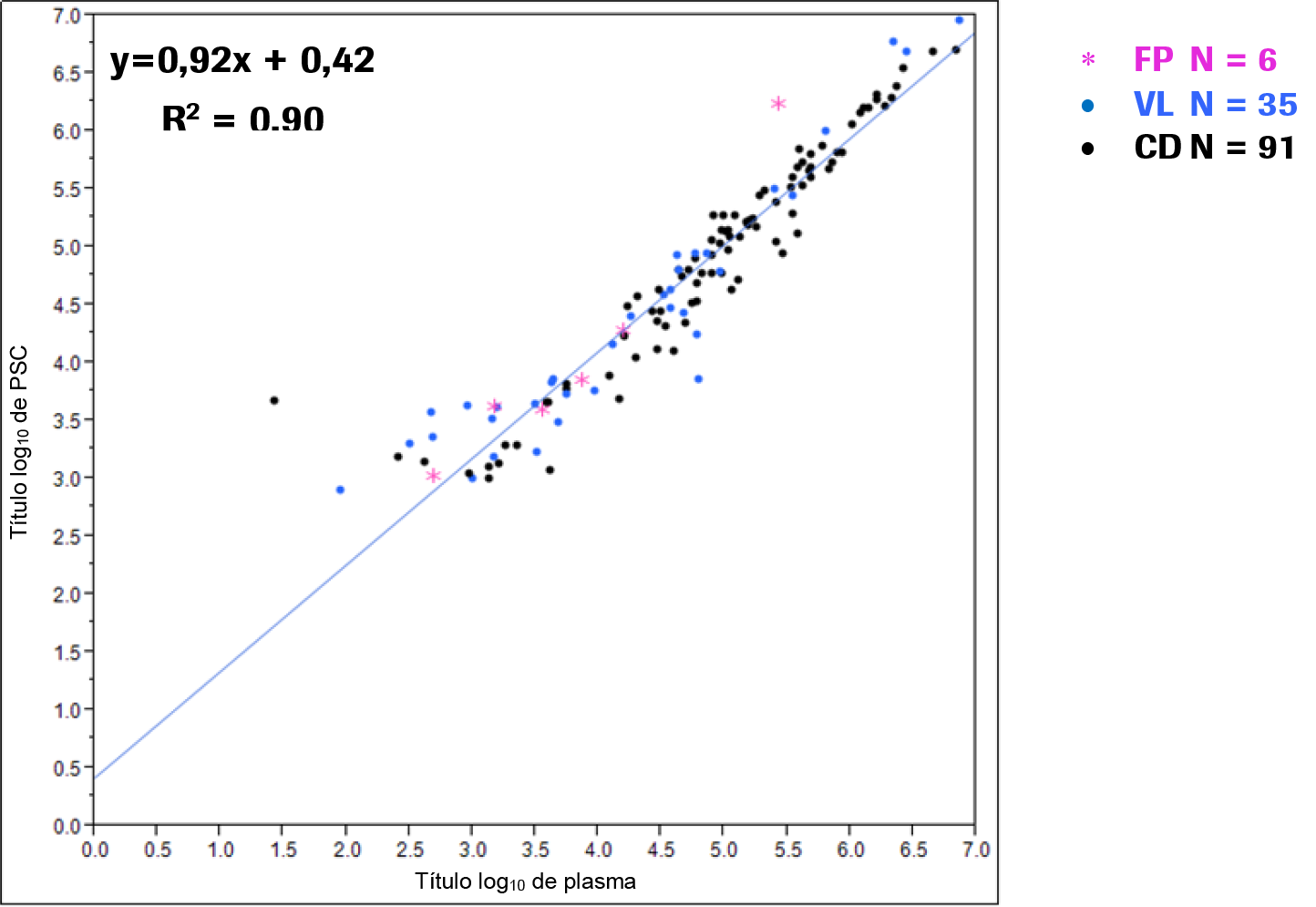
Tabla 26. Resumen de datos estadísticos
|
Equivalencia de matriz (tipo de plasma) |
Número de muestras con título válido |
Análisis de Bland Altman |
Análisis de regresión de Deming |
|||
|
Diferencia de log10 medio |
IC del 95% [inferior/superior] |
Pendiente |
Punto de intersección |
R cuadrado |
||
|
Plasma de PSC y plasma líquido |
132 |
0.05 |
[-0,01; 0,11] |
0,92 |
0,42 |
0,90 |
USO PREVISTO:
COBAS® HIV-1 es una prueba de amplificación de ácidos nucleicos in vitro para la cuantificación del virus de la inmunodeficiencia humana de tipo 1 (VIH-1) en plasma conservado en EDTA o en una muestra de plasma seco procedente de una cobas® Plasma Separation Card (PSC) de pacientes infectados por el VIH-1.
Esta prueba se emplea junto con datos clínicos u otros marcadores de laboratorio para el seguimiento clínico de los pacientes infectados por el VIH-1. La prueba se puede usar para confirmar la infección por el VIH-1 en pacientes con anticuerpos reactivos y para valorar el pronóstico del paciente por medio de la determinación de la carga viral del VIH-1 o monitorizar los efectos de la terapia antirretroviral por medio de la determinación de los cambios de los niveles de ARN del VIH-1 durante el curso del tratamiento antirretroviral.
INSTRUCCIONES DE USO:
Notas sobre el procedimiento:
• No utilice los reactivos de la prueba COBAS® HIV-1, el cobas® HBV/HCV/HIV-1 Control Kit, el cobas® NHP Negative Control Kit o los reactivos cobas omni después de la fecha de caducidad.
• No reutilice el material fungible. Es de un solo uso.
• Consulte el Manual de usuario de los cobas® 6800/8800 Systems para obtener información sobre el correcto mantenimiento de los instrumentos.
Preparación de muestras de plasma seco de PSC y procedimiento preanalítico:
• Compruebe la integridad de la bolsa de transporte antes de abrirla. Siga con el procedimiento únicamente si la bolsa de transporte está completamente cerrada.
• Abra la bolsa de transporte y proceda con cada bolsa de muestras únicamente si:
o El formulario de solicitud del laboratorio está totalmente cumplimentado.
o Los códigos de barras del formulario de solicitud del laboratorio y la PSC coinciden.
o La bolsa de muestras está completamente cerrada y contiene una PSC con 4 gramos de desecante.
o La fecha de recogida de las muestras está disponible y tuvo lugar durante los últimos 28 días y antes de la fecha de caducidad de la PSC (consulte la Ilustración 3).
o La PSC no está caducada.
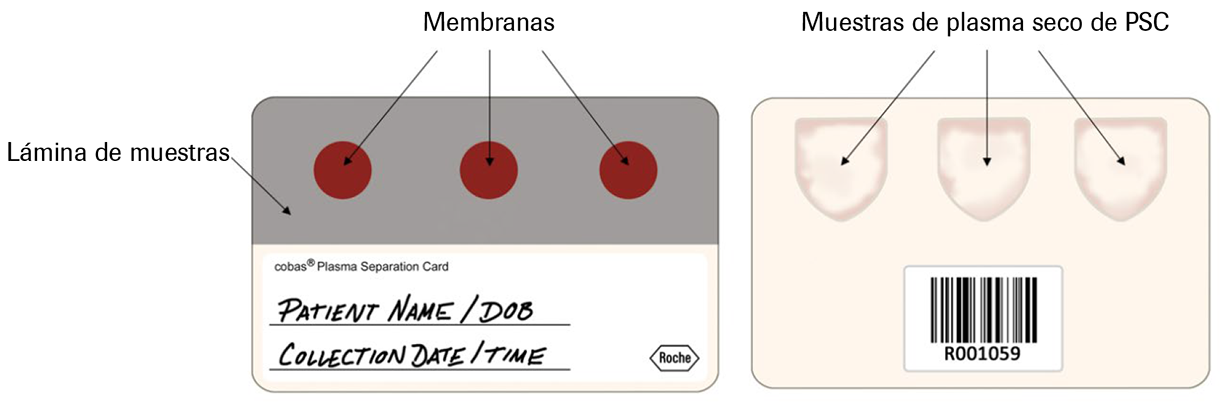
o La muestra de plasma seco de la PSC parece homogénea en la cara frontal y completamente cubierta de plasma si se observa desde la parte posterior (consulte la Ilustración 3).
Ilustración 3. Muestras de plasma seco de PSC para procesar (izquierda: parte frontal; derecha: parte posterior)
o Es necesario marcar y rechazar las muestras de plasma seco de PSC si:
◊ Hay derrames de sangre visibles (Ilustración 4b) o la membrana no está totalmente cubierta de sangre (Ilustración 4c) y, por lo tanto, la muestra de PSC no presenta un área frontal homogénea y/o la cara posterior no está completamente cubierta de plasma (visible a través del transportador).
◊ La membrana está dañada (Ilustración 4a) y, por lo tanto, la muestra de la PSC no presenta un área frontal homogénea y muestra una cara posterior entre rojo oscuro y marrón (visible a través del transportador).
Nota: Las tres muestras permiten realizar repeticiones de la prueba. Una PSC puede incluir una muestra errónea, pero seguir proporcionando una buena muestra para el análisis. Marque correctamente las muestras erróneas para poder reconocerlas. Evite marcarlas en la lámina de muestras. Compare siempre las tres muestras entre ellas para valorar su calidad.
Ilustración 4. Criterios de rechazo de las muestras de PSC (izquierda: parte frontal; derecha: parte posterior).
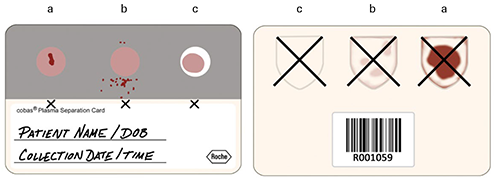
Las muestras con derrames (b), membrana parcialmente sin cubrir (c) o membrana visiblemente dañada (a) no deben procesarse. Las muestras deben marcarse claramente cuando se rechazan.
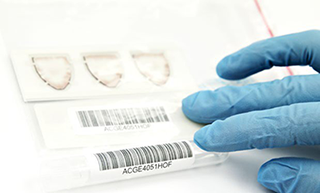
• Etiquete un tubo (5 mL y 12,5 mm de diámetro con rosca interior y de propileno [p. ej., Greiner Bio-One Cryo.s™]) para cada PSC con el código de barras correspondiente del formulario de solicitud de laboratorio (Ilustración 5) y colóquelo en un rack. Transfiera los tubos a una cabina de flujo laminar junto con las bolsas de muestras que contienen las PSC. Consulte el Manual de usuario de los cobas® 6800/8800 Systems para obtener información sobre el correcto etiquetado de códigos de barras.
Ilustración 5. Etiquetado del tubo con el código de barras de la PSC correspondiente
• Retire los tapones de los tubos de la cabina de flujo laminar.
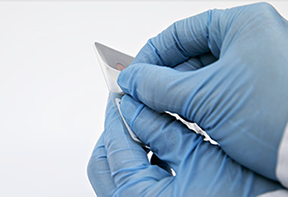
• Abra la bolsa de muestras de la PSC seleccionada y retire la lámina de muestras (Ilustración 6).
Ilustración 6. Retirada de la lámina de muestras
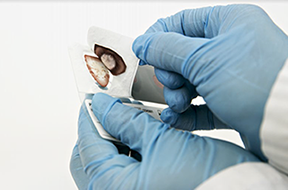
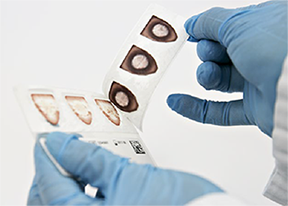
• Doble ligeramente la PSC y extraiga una muestra de plasma seco con fórceps o pinzas estériles tirando de ella hacia arriba. Doble la muestra de plasma seco extraída en la PSC para facilitar la inserción del tubo (Ilustración 7). Utilice un par de fórceps o pinzas por paciente.
Nota: Las muestras de plasma seco pueden volverse frágiles tras su almacenamiento. Consulte los requisitos de almacenamiento para las PSC. Manipúlelas con cuidado al introducirlas en el tubo.
Ilustración 7. Extracción y doblado de la muestra de plasma seco de la PSC
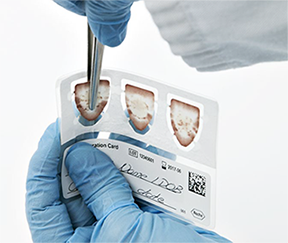
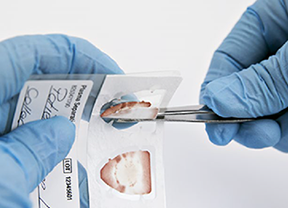

• Transfiera una muestra de plasma seco de la PSC previamente doblada al tubo correspondiente de forma que la punta inferior toque el fondo del tubo y la muestra se adhiera a la pared del tubo para evitar errores de pipeteo (Ilustración 8). En caso necesario, ajuste la posición de la muestra de plasma seco de la PSC con una punta de pipeta estéril. Cerciórese de que el tubo y la PSC de la muestra de plasma seco de PSC transferida tienen el mismo código de barras.
Ilustración 8. Transferencia de la muestra de plasma seco de la PSC al tubo


• Vuelva a colocar la PSC con las muestras de plasma seco restantes en su bolsa de muestras original con 4 gramos de desecante nuevo para repetir el análisis, en caso necesario (Ilustración 9). Las PSC pueden almacenarse durante un periodo de 56 días después del transporte con o sin separación de lámina de muestras (a 18-30 °C, a 2-8 °C o a ≤ –10 °C).
Ilustración 9. PSC en bolsa de muestras para posible repetición

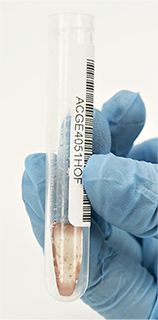
• Deje que el cobas® Specimen Pre-Extraction Reagent (SPER) alcance la temperatura ambiente antes de utilizarlo. Pipetee 1.300 μL de SPER en los tubos que contienen las muestras de plasma seco de la PSC (Ilustración 10) y coloque los tapones. Asegúrese de que los tapones de los tubos se han colocado correctamente para evitar la evaporación.
Ilustración 10. Incorporación de 1.300 μL de SPER

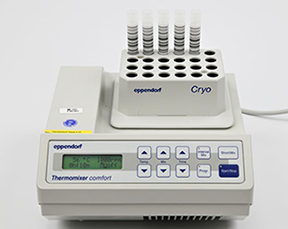
• Coloque los tubos en las posiciones de la 1 a la 24 en un Eppendorf Thermomixer® (p. ej., modelo R 5355, C o equivalente) precalentado con termobloque para 24 criotubos e incube durante 10 minutos a 56 °C y 1.000 rpm para extraer el virus del plasma seco (Ilustración 11). Inicie la incubación inmediatamente después de incorporar el SPER.
Ilustración 11. Incubación
• Transfiera los tubos a un rack de muestras y quíteles el tapón uno a uno para minimizar la posibilidad de que se produzca contaminación por arrastre (Ilustración 12). Cámbiese los guantes después de retirar los tapones.
Ilustración 12. Retirada del tapón de los tubos
• Asegúrese de que la muestra de plasma seco de la PSC está colocada correctamente junto a la pared del tubo (Ilustración 13) para evitar coágulos en la muestra. En caso necesario, ajuste la posición de la muestra de plasma seco de la PSC con una punta de pipeta estéril.
• Elimine cualquier película líquida que se haya podido crear por encima del nivel del líquido mediante una punta de pipeta estéril para evitar la detección de nivel precoz.
• Cargue los tubos en los cobas® 6800/8800 Systems.
Ilustración 13. Preparación de la muestra de plasma seco de la PSC antes de realizar el flujo de trabajo analítico
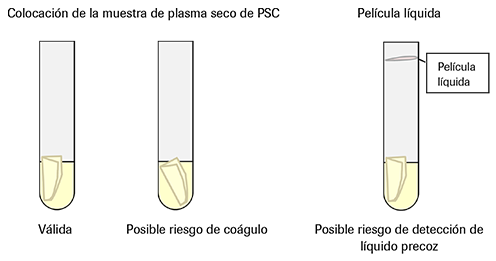
Nota: asegúrese de retirar cualquier película líquida que se haya creado durante el proceso.
Ejecución de la prueba COBAS® HIV-1
La prueba COBAS® HIV-1 puede ejecutarse con dos volúmenes de muestra mínimos obligatorios: 350 μL (para el flujo de trabajo de muestras de 200 μL) y 650 μL (para el flujo de trabajo de muestras de 500 μL). El procedimiento de la prueba se describe con detalle en el Manual de usuario de los cobas® 6800/8800 Systems. En la Ilustración 14 se resume el procedimiento.
La prueba COBAS® HIV-1 puede ejecutarse con 1.300 μL de cobas® Specimen Pre-Extraction Reagent (para el flujo de trabajo de muestras de PSC de 850 μL). El procedimiento de la prueba se describe con detalle en el Manual de usuario de los cobas® 6800/8800 Systems. En la Ilustración 14, también se resume el procedimiento para las muestras de plasma seco de PSC.
Verifique que se utiliza el tipo de muestra correcto (PSC) y el ASAP correspondiente (cobas® HIV-PSC ASAP) antes de iniciar el procedimiento de la prueba.
Ilustración 14. Procedimiento de la prueba COBAS® HIV-1
|
1 |
Carga de reactivos y material fungible según las indicaciones del sistema: • Carga del reactivo de lavado, el reactivo de lisis y el diluyente • Carga de las placas de procesamiento y las placas de amplificación • Carga de las partículas de vidrio magnéticas • Carga de reactivos específicos de la prueba • Carga de los casetes de control • Carga de las bandejas de puntas • Sustitución de los racks para puntas obstruidas |
|
2 |
Carga de las bandejas con las muestras |
|
3 |
Revisión y exportación de resultados |
|
4 |
Descarga del material fungible: • Descarga de las placas de amplificación del módulo analítico • Descarga de los casetes de control vacíos • Vaciado de los residuos sólidos • Vaciado de los residuos líquidos |
INFORMACIÓN ADICIONAL:
Funciones clave de la prueba para muestras de plasma conservado en EDTA:
|
Tipo de muestra |
Plasma conservado en EDTA |
|
Cantidad mínima de muestra necesaria |
650 μL o 350 μL |
|
Volumen de procesamiento de muestras |
500 μL o 200 μL |
|
Sensibilidad analítica |
13,2 cp/mL (500 μL) 35,5 cp/mL (200 μL) |
|
Intervalo lineal |
500 μL: 20 cp/mL - 1,0E+07 cp/mL 200 μL: 50 cp/mL - 1,0E+07 cp/mL |
|
Especificidad |
100% (intervalo de confianza unilateral del 95%: 99,5%) |
|
Genotipos detectados |
VIH-1M (A–D, F–H, CRF01_AE, CRF02_AG), VIH-1O, VIH-1N |
Funciones clave de la prueba para muestras de plasma seco de PSC:
|
Tipo de muestra |
Muestra de plasma seco procedente de una Plasma Separation Card (PSC) |
|
Cantidad mínima de muestra necesaria |
140 μL de sangre total |
|
Volumen de procesamiento de muestras |
850 μL |
|
Sensibilidad analítica |
790,2 cp/mL |
|
Intervalo lineal |
790 cp/mL - 1,0E+07 cp/mL |
|
Especificidad |
100% (intervalo de confianza unilateral del 95%: 98,3%) |
Símbolos:
Los símbolos siguientes se emplean en el rotulado de todos los productos de diagnóstico por PCR de Roche.
Tabla 27. Símbolos utilizados en las etiquetas de los productos de PCR para diagnóstico de Roche

Marcas registradas y patentes:
Este producto está cubierto por una o más patentes de EE. UU. con n.º 8962293, 9102924, 8609340, 9234250, 8097717, 8192958, 10059993, 10358675 y 6727067, y por las patentes equivalentes extranjeras.
COBAS, COBAS OMNI, AMPERASE, AMPLIPREP y TAQMAN son marcas comerciales de Roche.
La marca comercial “Armored RNA®” es propiedad de Asuragen, Inc. y Cenetron Diagnostics, Ltd.
ProClin® es una marca registrada de Rohm and Haas Company.
El resto de nombres de productos y marcas comerciales son propiedad de sus respectivos propietarios.
La tecnología de prevención de contaminación cruzada de la enzima AmpErase® está protegida por la patente estadounidense 7,687,247 propiedad de Life Technologies y con licencia para Roche Molecular Systems, Inc.
Algunos componentes de este producto están cubiertos por una o varias patentes de EE. UU. y por sus equivalentes internacionales propiedad de Novartis Vaccines and Diagnostics, Inc. y con licencia para Roche Molecular Systems, Inc. y F. Hoffman-La Roche Ltd.
Consulte http://www.roche-diagnostics.us/patents
Copyright
©2022 Roche Molecular Systems, Inc.
Bibliografía:
1. Mellors JW, Muñoz A, Giorgi JV, et al. Plasma viral load and CD4+ lymphocytes as prognostic markers of HIV-1 infection. Ann Intern Med. 1997;126:946-954.
2. Mellors JW, Margolick JB, Phair JP, et al. Prognostic value of HIV-1 RNA, CD4 cell count, and CD4 cell count slope for progression to AIDS and death in untreated HIV-1 infection. JAMA. 2007;297:2349-2350.
3. Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. Department of Health and Human Services. Available at: http://aidsinfo.nih.gov/ContentFiles/AdultandAdolescentGL.pdf. Updated 2016.
4. Cohen MS, Chen YQ, McCauley M, et al. HPTN Study Team. Prevention of HIV-1 infection with early antiretroviral therapy. N Engl J Med. 2011;365:493-505.
5. Phillips AN, Pillay D, Garnett G, et al. Effect on transmission of HIV-1 resistance of timing of implementation of viral load monitoring to determine switches from first to second-line antiretroviral regimens in resource-limited settings. AIDS. 2011;25:843-850.
6. Sigaloff KC, Hamers RL, Wallis CL, et al.; PharmAccess African Studies to Evaluate Resistance (PASER). Unnecessary antiretroviral treatment switches and accumulation of HIV resistance mutations; two arguments for viral load monitoring in Africa. J Acquir Immune Defic Syndr. 2011;58:23-31.
7. European AIDS Clinical Society 2017 Guidelines. http://www.eacsociety.org/guidelines/eacs-guidelines/eacs-guidelines.html
8. Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection – Recommendations for a public health approach. World Health Organization HIV/AIDS Programme, Geneva. 2016.
9. Günthard HF, Aberg JA, Eron JJ, et al.; Antiretroviral treatment of adult HIV infection: 2014 recommendations of the International Antiviral Society – USA panel. JAMA. 2014;312:410-25.
10. Do T, Duncan J, Butcher A, Liegler T. Comparative frequencies of HIV low-level viremia between real-time viral load assays at clinically relevant thresholds. J Clin Virol. 2011;52 Suppl 1:S83-S89.
11. Paba P, Fabeni L, Ciccozzi M, Perno CF, Ciotti M. Performance evaluation of the COBAS/TaqMan HIV-1 v2.0 in HIV-1 positive patients with low viral load: a comparative study. J Virol Methods. 2011;173:399-402.
12. Deeks SG. Durable HIV treatment benefit despite low-level viremia: reassessing definitions of success or failure. JAMA. 2011;286:224-226.
13. Longo MC, Berninger MS, Hartley JL. Use of uracil DNA glycosylase to control carry-over contamination in polymerase chain reactions. Gene. 1990;93:125-128.
14. Savva R, McAuley-Hecht K, Brown T, Pearl L. The structural basis of specific base-excision repair by uracil-DNA glycosylase. Nature. 1995;373:487-493.
15. Mol CD, Arvai AS, Slupphaug G, et al. Crystal structure and mutational analysis of human uracil-DNA glycosylase: structural basis for specificity and catalysis. Cell. 1995;80:869-878.
16. Higuchi R, Dollinger G, Walsh PS, Griffith R. Simultaneous amplification and detection of specific DNA sequences. Biotechnology (NY). 1992;10:413-417.
17. Heid CA, Stevens J, Livak JK, Williams PM. Real time quantitative PCR. Genome Res. 1996;6:986-994.
18. Center for Disease Control and Prevention. Biosafety in Microbiological and Biomedical Laboratories, 5th ed. U.S. Department of Health and Human Services, Public Health Service, Centers for Disease Control and Prevention, National Institutes of Health HHS Publication No. (CDC) 21-1112, revised December 2009.
19. Clinical and Laboratory Standards Institute (CLSI). Protection of laboratory workers from occupationally acquired infections. Approved Guideline-Fourth Edition. CLSI Document M29-A4:Wayne, PA;CLSI, 2014.
20.Clinical and Laboratory Standards Institute (CLSI) EP06-A. Evaluation of the linearity of quantitative measurement procedures: A statistical approach. CLSI Document EP06-A:Wayne, PA; CLSI, 2003.
Asistencia técnica:
Para obtener asistencia técnica, póngase en contacto con su filial local: https://www.roche.com/about/business/roche_worldwide.htm
Fabricado en los Estados Unidos
Roche Diagnostics GmbH
Sandhofer Strasse 116
68305 Mannheim, Germany
Fabricado en los EE. UU.
cobas® HIV-1 P/N: 07000995190
cobas® HBV/HCV/HIV-1 Control Kit
P/N: 06997767190
cobas® NHP Negative Control Kit
P/N: 07002220190
RESUMEN Y EXPLICACIÓN DE LA PRUEBA:
Información de referencia:
El virus de la inmunodeficiencia humana (VIH) es el agente etiológico del síndrome de inmunodeficiencia adquirida (SIDA). Tras la seroconversión, las personas infectadas, por lo general, entran en una fase relativamente asintomática, clínicamente estable, que puede prolongarse durante años. El periodo asintomático se caracteriza por una viremia plasmática persistente en determinados momentos condicionada por la genética del paciente y por una pérdida gradual de linfocitos T CD4+. Aunque las concentraciones de virus en sangre periférica son relativamente bajas durante la fase asintomática de la infección, la replicación y eliminación del virus son procesos dinámicos en los que los altos índices de producción de virus e infección de los linfocitos CD4+ quedan equilibrados por los altos índices de eliminación vírica, muerte de las células infectadas y reabastecimiento de linfocitos CD4+, lo que da lugar a niveles relativamente estables de viremia plasmática y linfocitos CD4+ durante aproximadamente 8 años en la mayoría de personas infectadas por el VIH.
La cuantificación de la viremia plasmática para el VIH ha demostrado que una carga viral elevada está relacionada con una progresión clínica más rápida de la enfermedad del VIH.1,2 Además, casi dos décadas de ensayos clínicos han determinado que la reducción de la carga viral en plasma por acción de los tratamientos antirretrovirales (TAR) reduce significativamente el riesgo de progresión clínica, incluidos la muerte, el desarrollo del SIDA, infecciones oportunistas y la morbilidad asociada al VIH.3 La carga viral del VIH también constituye un factor predictivo del riesgo de transmisión del VIH, y los ensayos clínicos controlados y aleatorizados han establecido que un inicio temprano del tratamiento TAR con supresión de la carga viral reduce la transmisión del VIH en un 96%.4
Motivos para el uso de la prueba del VIH-1:
En la actualidad existe un gran número de fármacos antirretrovirales que atacan la proteasa viral, la integrasa, la cápside y la transcriptasa inversa. Los análisis genotípicos de virus de diferentes clases han puesto de manifiesto cambios de nucleótidos, polimorfismos y mutaciones secundarias en las regiones de la transcriptasa inversa, integrasa y proteasa del gen pol del VIH-1 producidos tanto de forma natural como inducidos por los fármacos. Los análisis de resistencia se han convertido en una herramienta de diagnóstico fundamental para la monitorización de las infecciones por el VIH-1 y se inician cuando la carga viral del paciente aumenta a un nivel capaz de ser detectado mediante ensayos de secuenciación. Se ha demostrado que la monitorización de la carga viral reduce el riesgo de resistencia a los fármacos. La carga viral se considera clínicamente un indicador centinela de replicación viral activa consecuencia de la evolución viral en pacientes sometidos a tratamiento.5,6 Por este motivo, múltiples directrices tanto nacionales como internacionales recomiendan la cuantificación de la carga viral del VIH-1.3,7-9
Durante muchos años, las directrices indicaban que el objetivo principal del tratamiento era la supresión de la carga viral del VIH-1 por debajo del límite de detección de una prueba (p. ej., 50 copias/mL). En el año 2011, en las directrices de los Estados Unidos se empezó a indicar que una carga viral de 200 copias/mL en pacientes sometidos a tratamiento TAR no significaba necesariamente que el tratamiento hubiera fallado, puesto que algunos pacientes pueden presentar un nivel bajo de viremia sin que se produzca un avance de la carga viral.3 En Europa, las directrices siguen indicando que el objetivo pasa por reducir los resultados de la carga viral por debajo de 50 copias/mL.7 Las pequeñas diferencias existentes entre unas pruebas de carga viral y otras pueden generar diferencias significativas en la interpretación clínica de los resultados de la carga viral durante la monitorización de la respuesta al tratamiento,10,11 dado que el objetivo del tratamiento es la supresión del virus a un nivel por debajo del cual es menos probable que se produzca una resistencia a los fármacos y que, por otra parte, todavía está por definir.12 En julio de 2013, la OMS también empezó a recomendar la utilización de pruebas de carga viral en situaciones de recursos limitados y estableció en 1.000 copias/mL el umbral para determinar un fracaso virológico que exija decisiones de gestión del tratamiento. En la actualidad, la OMS también recomienda el uso de muestras secas para ampliar el alcance de las pruebas de carga viral en situaciones de recursos limitados sin acceso inmediato a servicios de flebotomía u opciones sólidas de transporte de muestras de plasma conservadas en EDTA.8 Las muestras de plasma seco procedentes de PSC, que también estabilizan el ARN del VIH en plasma seco, pueden mejorar la cobertura de las pruebas de carga viral en estas situaciones, ya que permiten transportar las muestras durante distancias más largas y en condiciones ambientales más rigurosas que el plasma conservado en EDTA.
Además de la monitorización de la respuesta al tratamiento, las directrices recomiendan valorar la carga viral para determinar si un paciente con un recuento de células CD4+ > 500 células/mm3 (carga viral > 100.000 copias/mL) debería iniciar un tratamiento TAR y para garantizar que la secuenciación de resistencia a los fármacos será satisfactoria en los pacientes correspondientes (pacientes con una carga viral > 1.000 copias/mL o con una respuesta subóptima de carga viral tras el TAR). La valoración de la carga viral debería realizarse en el ámbito prenatal para determinar si es necesario practicar una cesárea a fin de evitar la transmisión madre-hijo de la infección por el VIH (para mujeres embarazadas con una carga viral > 1.000 copias/mL).
Explicación de la prueba:
La prueba COBAS® HIV-1 es una prueba cuantitativa realizada en el cobas® 6800 System y en el cobas® 8800 System. La prueba COBAS® HIV-1 permite la detección y cuantificación de ARN del VIH-1 en plasma conservado en EDTA o en una muestra de plasma seco procedente de una PSC de pacientes infectados. La detección y la cuantificación se realizan mediante dos sondas, que no discriminan entre los subtipos del grupo M del VIH-1 ni entre los grupos O y N del VIH-1. La carga viral se cuantifica mediante un estándar de cuantificación de Armored RNA diferente del VIH-1 (RNA-QS) y que se añade a cada una de las muestras durante su procesamiento. El RNA-QS actúa como control interno para monitorizar todo el proceso de preparación de las muestras y amplificación mediante PCR. Además, la prueba utiliza tres controles externos: uno positivo de título alto, uno positivo de título bajo y uno negativo.
Principios del procedimiento:
La prueba COBAS® HIV-1 se basa en la preparación de muestras totalmente automática (extracción y purificación de ácidos nucleicos) seguida de un proceso de amplificación y detección mediante PCR. Los cobas® 6800/8800 Systems constan del módulo de suministro de muestras, el módulo de transferencia, el módulo de procesamiento y el módulo analítico. La gestión de datos automática se realiza mediante el software cobas® 6800/8800, que asigna los resultados de la prueba a todas las pruebas como fragmento objetivo no detectado, < LLoQ (límite de cuantificación inferior), > ULoQ (límite de cuantificación superior) o ARN de VIH-1 detectado, un valor del intervalo lineal LLoQ < x < ULoQ. Los resultados pueden revisarse directamente en la pantalla del sistema, exportarse o imprimirse como informe.
La extracción de ácidos nucleicos de las muestras de paciente, controles externos y moléculas de Armored RNA añadido (RNA-QS) se realiza simultáneamente. En resumen, los ácidos nucleicos víricos se liberan al añadir proteinasa y reactivo de lisis a la muestra. Los ácidos nucleicos liberados se unen a la superficie de sílice de las partículas de vidrio magnéticas añadidas. Las sustancias sin unir y las impurezas, como las proteínas desnaturalizadas, los restos celulares y potenciales inhibidores de la PCR se eliminan en los siguientes pasos con el reactivo de lavado y los ácidos nucleicos purificados se eluyen de las partículas de vidrio magnéticas mediante el buffer de elución a temperatura elevada.
La amplificación selectiva de los ácidos nucleicos del fragmento objetivo de la muestra se lleva a cabo mediante cebadores que van en un sentido y en sentido contrario específicos del virus para el fragmento objetivo que se seleccionan de regiones altamente conservadas del genoma del VIH-1. La prueba COBAS® HIV-1 amplifica el gen gag del VIH-1 y la región LTR del VIH-1 (fragmento objetivo doble). La amplificación selectiva de RNA-QS se realiza mediante cebadores que van en un sentido y en sentido contrario específicos de la secuencia que se seleccionan de modo que no presenten homología alguna con el genoma del VIH-1. Para los procesos de transcripción inversa y amplificación mediante PCR se utiliza una enzima ADN polimerasa termoestable. La amplificación de las secuencias objetivo y de RNA-QS se realiza simultánea-mente mediante un perfil universal de amplificación mediante PCR con unos pasos de temperatura y número de ciclos predefinidos. El reactivo de Master Mix incluye trifosfato de deoxiuridina (dUTP), en lugar de trifosfato desoxitimidina (dTTP), que se incorpora al ADN recién sintetizado (amplicón).13-15 La enzima AmpErase, que se incluye en la Master Mix para PCR cuando se calienta durante la primera ciclación térmica, elimina los amplicones contaminados de las series de PCR anteriores. Sin embargo, no se eliminan los amplicones nuevos porque la enzima AmpErase se inactiva cuando se expone a temperaturas superiores a los 55 °C.
El reactivo Master Mix de COBAS® HIV-1 contiene dos sondas de detección específicas para las secuencias objetivo del VIH-1 y una para RNA-QS. Las sondas están marcadas con marcadores emisores fluorescentes que permiten la detección simultánea del fragmento objetivo del VIH-1 y el RNA-QS en dos canales objetivo distintos.16,17 Cuando no se une a la secuencia objetivo, la señal fluorescente de las sondas intactas se elimina mediante un marcador silenciador. Durante el paso de amplificación mediante PCR, la hibridación de las sondas con la plantilla específica de ADN monocatenario provoca la escisión de la sonda por la actividad de la exonucleasa 5" a 3" de la ADN polimerasa, lo que produce la separación de los marcadores emisor y silenciador y la emisión de una señal fluorescente. Con cada ciclo de PCR, se generan cantidades crecientes de sondas escindidas y la señal acumulada del marcador emisor aumenta concomitantemente. La detección y diferenciación en tiempo real de los productos de PCR se consigue mediante cuantificación de la fluorescencia liberada por los marcadores emisores para los fragmentos objetivo vírico y RNA-QS respectivamente.