
COBAS HBV
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
RESULTADOS:
El cobas® 5800 System y los cobas® 6800/8800 Systems determinan automáticamente la concentración de ADN del HBV en muestras y controles. La concentración de ADN del HBV se expresa en unidades internacionales por mililitro (UI/mL).
Control de calidad y validez de los resultados en el cobas® 5800 System:
• Con cada serie se procesan un control negativo ([–] C) y dos controles positivos, un control positivo bajo (HBV L[+]C) y un control positivo alto (HBV H[+]C) al menos cada 72 horas o con cada lote de kit nuevo. Los controles positivos y/o negativo pueden programarse con mayor frecuencia en función de los procedimientos de laboratorio y/o la reglamentación local.
• Compruebe los avisos y los resultados asociados tanto en el software cobas® 5800 como en el informe para garantizar la validez de la serie.
• La serie se considera válida siempre y cuando no haya avisos para ninguno de los tres controles, es decir, el control negativo y los dos controles positivos: HBV L(+)C, HBV H(+)C. El resultado del control negativo se muestra como (–) C, mientras que los controles positivos bajo y alto se presentan como HxV L(+)C y HxV H(+)C.
El software cobas® 5800 invalida automáticamente los resultados cuando los controles positivos o negativos fallan.
Nota: El cobas® 5800 System se suministra con la configuración estándar para el análisis de un conjunto de controles (positivo y negativo) con cada serie, pero se puede modificar por un programa menos frecuente de hasta cada 72 horas según los procedimientos de laboratorio y la reglamentación local. Póngase en contacto con su ingeniero técnico de Roche y/o con el representante del servicio técnico de Roche para obtener más información.
Resultados del control en el cobas® 5800 System: Los resultados de los controles se muestran en el software del cobas® 5800, en la aplicación de controles.
• Los controles se marcan como “Válido” en la columna “Resultados de control” cuando todas las dianas del control se han notificado como válidas. Los controles se marcan como “No válido” en la columna “Resultados de control” cuando todas o alguna de las dianas del control se han notificado como no válidas.
• Los controles marcados como “No válido” muestran un aviso en la columna “Aviso”. En la vista de detalles podrá encontrar más información sobre el motivo por el que el control se ha notificado como no válido, además de información sobre el aviso.
• Si uno de los controles positivos no es válido, repita el análisis de todos los controles positivos y de todas las muestras asociadas. Si el control negativo no es válido, repita el análisis de todos los controles y de todas las muestras asociadas.
Control de calidad y validez de los resultados en los cobas® 6800/8800 Systems:
• Con cada serie se procesan un control negativo ([–] C) y dos controles positivos, un control positivo bajo (HBV L[+]C) y un control positivo alto [HBV H(+)C].
• Compruebe los avisos y los resultados asociados tanto en el software de los cobas® 6800/8800 Systems como en los informes para garantizar la validez de la serie.
• La serie se considera válida siempre y cuando no haya avisos para ninguno de los tres controles, es decir, el control negativo y los dos controles positivos: HBV L(+)C, HBV H(+)C. El resultado del control negativo se muestra como (–) C, mientras que los controles positivos bajo y alto se presentan como HxV L(+)C y HxV H(+)C.
El software cobas® 6800/8800 invalida automáticamente los resultados cuando los controles positivos y negativos fallan.
Avisos de controles en los cobas® 6800/8800 Systems:
Tabla 11. Avisos de controles para los controles negativo y positivo
|
Control negativo |
Aviso |
Resultado |
Interpretación |
|
(–) C |
Q02 (Serie de control errónea) |
No válida |
Un resultado inválido o el resultado del título calculado del control negativo no es negativo. |
|
Control positivo |
Aviso |
Resultado |
Interpretación |
|
HxV L(+)C |
Q02 (Serie de control errónea) |
No válida |
Un resultado inválido o el resultado del título calculado para el control positivo bajo no está dentro del intervalo asignado. |
|
HxV H(+)C |
Q02 (Serie de control errónea) |
No válida |
Un resultado inválido o el resultado del título calculado para el control positivo alto no está dentro del intervalo asignado. |
Si la serie no es válida, repita las pruebas para toda la serie, incluyendo muestras y controles.
En el software cobas® 6800/8800, HxV L(+)C hace referencia al control positivo bajo COBAS® HBV/HCV/HIV-1 y HxV H(+)C, al control positivo alto COBAS® HBV/HCV/HIV-1.
Interpretación de los resultados: En las series de control válidas, compruebe cada muestra para detectar avisos en el software y/o los informes del cobas® 5800 System y de los cobas® 6800/8800 Systems. La interpretación de resultados se debe realizar del siguiente modo:
• Una serie válida puede incluir resultados de muestras tanto válidos como no válidos.
Tabla 12. Resultados de diana para la interpretación de los resultados de diana individuales
|
Resultados |
Interpretación |
|
Target Not Detected |
ADN de HBV no detectado Los resultados se indican como “HBV no detectado” |
|
< Titer Min |
El título calculado está por debajo del límite inferior de cuantificación (LLoQ) del ensayo. Los resultados se indican como “HBV detectado, inferior a (título mínimo)” Título mínimo = 10 UI/mL (500 μL) Título mínimo = 25 UI/mL (200 μL) |
|
Titer |
El título calculado está comprendido en el intervalo lineal del ensayo: mayor o igual que el título mínimo y menor o igual que el título máximo Los resultados se indican como “(Título) de HBV detectado”. |
|
> Titer Maxa |
El título calculado está por encima del límite superior de cuantificación (ULoQ) del ensayo. Los resultados se indican como “HBV detectado, superior a (título máximo)” Título máximo = 1,00E+09 UI/mL (500 μL y 200 μl) |
a El resultado de muestra “> Titer Max” hace referencia a las muestras positivas para HBV detectadas con títulos superiores al límite de cuantificación superior (ULoQ). Si desea obtener resultados cuantitativos, diluya la muestra original con suero o plasma conservado en EDTA negativos al HBV (según el tipo de la muestra original) y repita la prueba. Multiplique el resultado comunicado por el factor de dilución.
Interpretación de los resultados en el cobas® 5800 System: Los resultados de las muestras se muestran en el software del cobas® 5800, en la aplicación de resultados.
En las series de control válidas, compruebe cada muestra para detectar avisos en el software cobas® 5800 System y/o en el informe. La interpretación de resultados se debe realizar del siguiente modo:
• Las muestras asociadas con las series de control válidas se muestran como “Válido” en la columna “Resultados de control” cuando todos los resultados de las dianas del control se han notificado como válidos. Las muestras asociadas con las series de control erróneas se muestran como “No válido” en la columna “Resultados de control” cuando todos los resultados de las dianas del control se han notificado como no válidos.
• Si los controles asociados de un resultado de muestra no son válidos, se añadirá un aviso específico al resultado de la muestra de la siguiente manera:
° Q05D: fallo en la validación de resultados debido a un control positivo no válido
° Q06D: fallo en la validación de resultados debido a un control negativo no válido
• Los valores en la columna “Resultados” para el resultado de la diana de la muestra individual deben interpretarse como se muestra en la Tabla 12 anterior.
• Si una o más dianas de la muestra están marcadas como “No válido”, el software cobas® 5800 muestra un aviso en la columna de avisos. En la vista de detalles podrá encontrar más información sobre el motivo por el que la(s) diana(s) de la muestra se ha notificado como no válidas, además de información sobre el aviso.
Interpretación de los resultados en los cobas® 6800/8800 Systems: En las series válidas, compruebe cada muestra para detectar avisos en el software cobas® 6800/8800 Systems y/o en el informe. La interpretación de resultados se debe realizar del siguiente modo:
• Las muestras presentan un “Yes” en la columna “Válida” si todos los resultados de las dianas solicitadas muestran resultados válidos. Las muestras que presentan un “No” en la columna “Válida” pueden requerir alguna interpretación o acción adicional.
• Los valores para el resultado de la diana de la muestra individual deben interpretarse como se muestra en la Tabla 12 anterior.
Limitaciones del procedimiento:
• La prueba COBAS® HBV se ha evaluado para ser utilizada únicamente con el COBAS® HBV/HCV/HIV-1 Control Kit, el cobas® NHP Negative Control Kit, el cobas omni MGP Reagent, el cobas omni Lysis Reagent, el cobas omni Specimen Diluent y el cobas omni Wash Reagent en los cobas® 5800/6800/8800 Systems.
• La obtención de resultados fiables depende de que los procedimientos de recogida, almacenamiento y manipulación de muestras sean adecuados.
• Esta prueba se ha validado únicamente para su uso con muestras de suero o plasma conservado en EDTA. La realización de la prueba en otros tipos de muestras puede dar lugar a resultados inexactos.
• La cuantificación de ADN de HBV depende del número de partículas víricas presentes en las muestras y se puede ver afectada por los métodos de obtención de las mismas, factores propios del paciente (como la edad o la presencia de síntomas) y/o la fase de infección.
• Aunque es poco probable, las mutaciones en las regiones muy conservadas del genoma vírico cubiertas por la prueba COBAS® HBV pueden afectar la unión de cebadores y/o sondas, y causar una cuantificación a la baja del virus o incluso impedir su detección.
• Debido a las diferencias específicas entre tecnologías, se recomienda a los usuarios que realicen estudios de correlación en el laboratorio para determinar las diferencias tecnológicas antes de cambiar de una a otra. Los usuarios deberán adherirse a las políticas y los procedimientos específicos.
• La prueba COBAS® HBV no se ha concebido para el cribado de la presencia de HBV en sangre o productos sanguíneos, ni como una prueba de diagnóstico para confirmar la presencia de una infección de HBV.
OBTENCIÓN, TRANSPORTE Y ALMACENAMIENTO DE LAS MUESTRAS:
Nota: Manipule todas las muestras y los controles como si pudieran transmitir agentes infecciosos.
Almacene todas las muestras a las temperaturas especificadas.
La estabilidad de las muestras se ve afectada por las temperaturas elevadas.
Si se utilizan muestras congeladas en tubos secundarios, deje que se descongelen a temperatura ambiente (15-30 °C) por completo y, a continuación, agítelas unos instantes (entre 3 y 5 segundos) y centrifúguelas para que todo el volumen de la muestra se deposite en la parte inferior del tubo.
Muestras:
• La sangre total debería recogerse en tubos de separación de suero SST™, en tubos para preparación de plasma BD Vacutainer® PPT™ para métodos de pruebas de diagnóstico molecular o en tubos estériles y utilizar EDTA como anticoagulante. Siga las instrucciones del fabricante de los tubos de recogida de muestras. Consulte la Ilustración 1.
• La sangre total recogida en tubos de separación de suero SST™, tubos para preparación de plasma BD Vacutainer® PPT™ para métodos de pruebas de diagnóstico molecular o tubos estériles con EDTA como anticoagulante pueden almacenarse y/o transportarse durante un máximo de 24 horas a una temperatura comprendida entre 2 °C y 25 °C antes de la preparación del plasma/suero. La centrifugación debe realizarse conforme a las instrucciones del fabricante.
• Después de la separación, las muestras de plasma/suero pueden almacenarse en tubos secundarios durante un máximo de 6 días a una temperatura comprendida entre 2 °C y 8 °C o durante un máximo de 12 semanas a ≤ -18 °C.
• Para el almacenamiento a largo plazo de hasta 6 meses se recomiendan temperaturas ≤ -60 °C.
• Las muestras de plasma/suero se mantienen estables hasta un máximo de cuatro ciclos de congelación/descongelación si se congelan a ≤ -18 °C.

Ilustración 1. Condiciones de almacenamiento de muestras
• Si las muestras se van a transportar, es recomendable empaquetarlas y etiquetarlas de acuerdo con la reglamentación estatal y/o internacional relativa al transporte de muestras y agentes etiológicos.
PRECAUCIONES Y REQUISITOS DE MANIPULACIÓN:
Advertencias y precauciones: Como sucede con cualquier procedimiento analítico, resulta esencial seguir las buenas prácticas de laboratorio recomendadas para obtener un rendimiento correcto del ensayo. Debido a la elevada sensibilidad de esta prueba, deben extremarse las precauciones para evitar cualquier tipo de contaminación de los reactivos y las mezclas de amplificación.
• Para diagnóstico in vitro exclusivamente.
• No se ha evaluado el uso de la prueba COBAS® HBV para uso como prueba de cribado para la presencia de HBV en sangre y hemoderivados, o como una prueba de diagnóstico para confirmar la presencia de una infección por HBV.
• Todas las muestras de paciente deben tratarse como si fueran infecciosas, utilizando los procedimientos de laboratorio recomendados tal como se describe en la publicación Biosafety in Microbiological and Biomedical Laboratories y en el documento M29-A4 del CLSI.19,20 Solamente el personal competente en la manipulación de material biopeligroso y en el uso de la prueba COBAS® HBV, y el cobas® 5800 System o los cobas® 6800/8800 Systems deberían llevar a cabo este procedimiento.
• Todos los materiales de origen humano deben considerarse potencialmente infecciosos y manipularse teniendo en cuenta las precauciones generales. En caso de que se produzca un derrame, desinfecte de inmediato con una solución recién preparada de hipoclorito de sodio al 0,5% en agua destilada o desionizada (lejía doméstica diluida a 1:10), o siga los procedimientos apropiados del laboratorio.
• El COBAS® HBV/HCV/HIV-1 Control Kit y el cobas® NHP Negative Control Kit contienen plasma procedente de sangre humana. Se ha analizado el material original mediante las pruebas para anticuerpos autorizadas y no se ha considerado reactivo para la presencia de anticuerpos del HCV, del HIV-1/2, HBsAg y anticuerpos anti-HBc. En el análisis del plasma humano normal con métodos de PCR no se ha detectado ARN de HIV-1 (grupos M y O), ARN de HIV-2, ARN de HCV ni ADN de HBV. Ningún método de prueba conocido puede garantizar totalmente que un producto derivado de la sangre humana no transmita agentes infecciosos.
• No congele la sangre entera ni las muestras almacenadas en tubos primarios.
• Utilice solo el material fungible suministrado o que se requiera expresamente para garantizar el óptimo rendimiento de la prueba.
• Puede solicitar Hojas de datos de seguridad (Safety Data Sheets [SDS]) al representante local de Roche.
• Siga al pie de la letra los procedimientos y las directrices que se suministran para garantizar la correcta realización de la prueba. Cualquier variación de dichos procedimientos y directrices podría afectar al rendimiento óptimo de la prueba.
• Podrían producirse resultados falsos positivos si no se evita la contaminación por arrastre de las muestras durante la manipulación y el procesamiento de las mismas.
• Informe a la autoridad competente local de cualquier incidente grave que pueda tener lugar durante la realización del ensayo.
Manipulación de reactivos:
• Manipule todos los reactivos, controles y muestras de acuerdo con las prácticas de laboratorio recomendadas para evitar la contaminación por arrastre de las muestras o los controles.
• Antes de utilizarlos, revise cada casete de reactivo, diluyente, reactivo de lisis y reactivo de lavado para asegurarse de que no hay signos de fugas. No utilice el material si hay alguna evidencia de fuga.
• El cobas omni Lysis Reagent contiene tiocianato de guanidina, una sustancia química potencialmente peligrosa. Evite el contacto de reactivos con la piel, los ojos o las membranas mucosas. En caso de contacto, lave inmediatamente la zona afectada con abundante agua para evitar quemaduras.
• El kit de la prueba COBAS® HBV, el cobas omni MGP Reagent y el cobas omni Specimen Diluent contienen azida sódica como conservante. Evite el contacto de reactivos con la piel, los ojos o las membranas mucosas. En caso de contacto, lave inmediatamente la zona afectada con abundante agua para evitar quemaduras. Si se producen salpicaduras de reactivos, diluya las manchas con agua antes de secarlas con un paño.
• No permita que el cobas omni Lysis Reagent, que contiene tiocianato de guanidina, entre en contacto con la solución de hipoclorito de sodio (lejía). Tales mezclas pueden producir gases de alta toxicidad.
• Elimine todos los materiales que hayan estado en contacto con las muestras y los reactivos de acuerdo con la reglamentación nacional, estatal y local.
Buenas prácticas de laboratorio:
• No pipetee con la boca.
• No se debe comer, beber ni fumar en las áreas de trabajo.
• Utilice guantes, bata de laboratorio y protección ocular cuando manipule las muestras y los reactivos. Es necesario cambiarse los guantes entre la manipulación de las muestras y de los kits COBAS® HBV y los reactivos cobas omni para evitar la contaminación. Evite la contaminación de los guantes durante la manipulación de las muestras y de los controles.
• Lávese bien las manos después de manipular las muestras y los reactivos del kit, y cuando se saque los guantes.
• Limpie y desinfecte minuciosamente todas las superficies de trabajo del laboratorio usando una solución recién preparada de hipoclorito de sodio al 0,5% en agua destilada o desionizada (lejía doméstica diluida a 1:10). A continuación, límpielas con un trapo impregnado en etanol al 70%.
• Si el derrame se produce sobre un instrumento cobas® 5800, siga las instrucciones descritas en la Asistencia al usuario y/o la Guía del usuario del cobas® 5800 System para limpiar y descontaminar correctamente la superficie del instrumento.
• Si el derrame se produce sobre un instrumento cobas® 6800/8800, siga las instrucciones descritas en la Asistencia al usuario y/o la Guía del usuario de los cobas® 6800/8800 Systems para limpiar y descontaminar correctamente la superficie de los instrumentos.
REACTIVOS Y MATERIALES:
Reactivos y controles de COBAS® HBV: Todos los reactivos y controles sin abrir deben almacenarse como se recomienda desde la Tabla 1 hasta la Tabla 4.
Tabla 1. COBAS® HBV:
COBAS® HBV
Almacenar a 2-8 °C
Casete para 192 pruebas (P/N 09040820190)
|
Componentes del kit |
Composición del reactivo |
Cantidad por kit 192 pruebas |
|
Solución de proteinasa (PASE) |
Buffer tris, < 0,05% de EDTA, cloruro de calcio, acetato de calcio, 8% de proteinasa EUH210: puede solicitarse la ficha de datos de seguridad EUH208: puede provocar una reacción alérgica Contiene: subtilisina, 9014-01-1 |
22,3 mL |
|
Estándar de cuantificación de ADN (DNA-QS) |
Buffer tris, < 0,05% de EDTA, < 0,001% de constructo de ADN diferente de HBV con una región de unión a cebador diferente de HBV y una región exclusiva de unión a sonda (ADN no infeccioso), 0,002% de ARN Poli rA (sintético), < 0,1% de azida sódica |
21,2 mL |
|
Buffer de elución (EB) |
Buffer tris, 0,2% de metil-4-hidroxibenzoato |
21,2 mL |
|
Reactivo 1 de Master Mix (MMX-R1) |
Acetato de manganeso, hidróxido potásico, < 0,1% de azida sódica |
7,5 mL |
|
Reactivo 2 de Master Mix para HBV (HBV MMX-R2) |
Buffer tricina, acetato de potasio, 18% de sulfóxido de dimetilo, glicerol, < 0,1% de Tween 20, EDTA, < 0,12% de dATP, dCTP, dGTP, dUTPs, < 0,01% de cebadores ascendente y descendente para HBV, < 0,01% de cebadores que van en un sentido y en sentido contrario para el estándar de cuantificación, < 0,01% de sondas oligonucleótidas marcadas con fluorescente específicas para HBV y el estándar de cuantificación del HBV, < 0,01% de aptámero oligonucleótido, < 0,01% de ADN polimerasa Z05D, < 0,10% de enzima AmpErase (uracil-N-glicosilasa) (microbiana), < 0,1% de azida sódica |
9,7 mL |
* Las etiquetas de seguridad del producto se basan fundamentalmente en la regulación GHS de la UE.
** Sustancia peligrosa.
Tabla 2. COBAS® HBV/HCV/HIV-1 Control Kit
COBAS® HBV/HCV/HIV-1 Control Kit
Almacenar a 2-8 °C
Para uso en el sistema cobas® 5800 (P/N 09040773190)
Para uso en sistemas cobas® 6800/8800 (P/N 06997767190 y P/N 09040773190)
|
Componentes del kit |
Composición del reactivo |
Cantidad por kit |
Símbolo de seguridad y advertencia* |
|
Control positivo bajo para HBV/HCV/HIV-1 (HBV/HCV/HIV-1 L[+]C) |
< 0,001% de ARN (Armored) de HIV-1 grupo M encapsulado en proteína recubierta de bacteriófago MS2, < 0,001% de ADN (plásmido) sintético de HBV encapsulado en proteína recubierta de bacteriófago lambda, < 0,001% de ARN (Armored) sintético de HCV encapsulado en proteína recubierta de bacteriófago MS2, plasma humano normal no reactivo según las pruebas autorizadas para anticuerpos frente al HCV, anticuerpos frente al HIV-1/2, HBsAg y anticuerpos anti-HBc; ARN de HIV-1, ARN de HIV-2, ARN de HCV y ADN de HBV no detectables mediante métodos de PCR 0,1% de conservante ProClin® 300** |
5,2 mL (8 × 0,65 mL) |
ADVERTENCIA H317: puede provocar una reacción alérgica en la piel H412: nocivo para los organismos acuáticos, con efectos nocivos duraderos P261: evitar respirar el polvo/el humo/el gas/la niebla/los vapores/el aerosol P273: evítese su liberación al medio ambiente. P280: utilice guantes protectores P333 + P313: en caso de irritación o erupción cutánea: consultar a un médico P362 + P364: quitarse las prendas contaminadas y lavarlas antes de volver a usarlas P501: eliminar el contenido/el recipiente en una planta de eliminación de residuos autorizada 55965-84-9 masa de reacción de: 5-cloro-2-metil-4- isotiazolin-3-ona (n.º CE 247-500-7) y 2-metil-2H- isotiazol-3-ona (n.º CE 220-239-6) (3:1) |
|
Control positivo alto para HBV/HCV/HIV-1 (HBV/HCV/HIV-1 H[+]C) |
< 0,001% de ARN (Armored) sintético de título alto de HIV-1 grupo M encapsulado en proteína recubierta de bacteriófago MS2, < 0,001% de ADN (plásmido) sintético de HBV encapsulado en proteína recubierta de bacteriófago lambda, < 0,001% de ARN (Armored) sintético de HCV encapsulado en proteína recubierta de bacteriófago MS2, plasma humano normal no reactivo según las pruebas autorizadas para anticuerpos frente al HCV, anticuerpos frente al HIV-1/2, HBsAg y anticuerpos anti-HBc; ARN de HIV-1, ARN de HIV-2, ARN de HCV y ADN de HBV no detectables mediante métodos de PCR 0,1% de conservante ProClin® 300** |
5,2 mL (8 × 0,65 mL) |
ADVERTENCIA H317: puede provocar una reacción alérgica en la piel P261: evitar respirar el polvo/el humo/el gas/la niebla/los vapores/el aerosol P272: las prendas de trabajo contaminadas no podrán sacarse del lugar de trabajo P280: utilice guantes protectores P333 + P313: en caso de irritación o erupción cutánea: consultar a un médico P362 + P364: quitarse las prendas contaminadas y lavarlas antes de volver a usarlas P501: eliminar el contenido/el recipiente en una planta de eliminación de residuos autorizada 55965-84-9 masa de reacción de: 5-cloro-2-metil-4- isotiazolin-3-ona (n.º CE 247-500-7) y 2-metil-2H- isotiazol-3-ona (n.º CE 220-239-6) (3:1) |
* Las etiquetas de seguridad del producto se basan fundamentalmente en la regulación GHS de la UE.
** Sustancia peligrosa.
Tabla 3. cobas® NHP Negative Control Kit
cobas® NHP Negative Control Kit
Almacenar a 2-8 °C
Para uso en el sistema cobas® 5800 (P/N 09051554190)
Para uso en sistemas cobas® 6800/8800 (P/N 07002220190 y P/N 09051554190)
|
Componentes del kit |
Composición del reactivo |
Cantidad por kit |
Símbolo de seguridad y advertencia* |
|
Control negativo para plasma humano normal (NHP-NC) |
Plasma humano normal no reactivo según pruebas autorizadas para anticuerpos del HCV, anticuerpos del HIV-1/2, HBsAg y anticuerpos anti-HBc; ARN de HIV-1, ARN de HIV-2, ARN de HCV y ADN de HBV no detectables mediante métodos de PCR < 0,1% de conservante ProClin® 300** |
16 mL (16 × 1 mL) |
ADVERTENCIA H317: puede provocar una reacción alérgica en la piel P261: evitar respirar el polvo/el humo/el gas/la niebla/los vapores/el aerosol P272: las prendas de trabajo contaminadas no podrán sacarse del lugar de trabajo P280: utilice guantes protectores P333 + P313: en caso de irritación o erupción cutánea: consultar a un médico P362 + P364: quitarse las prendas contaminadas y lavarlas antes de volver a usarlas P501: eliminar el contenido/el recipiente en una planta de eliminación de residuos autorizada 55965-84-9 masa de reacción de: 5-cloro-2-metil- 4-isotiazolin-3-ona (n.º CE 247-500-7) y 2-metil- 2H-isotiazol-3-ona (n.º CE 220-239-6) (3:1) |
* Las etiquetas de seguridad del producto se basan fundamentalmente en la regulación GHS de la UE.
** Sustancia peligrosa.
Reactivos cobas omni para la preparación de muestras:
Tabla 4. Reactivos cobas omni para la preparación de las muestras*
|
Reactivos |
Composición del reactivo |
Cantidad por kit |
Símbolo de seguridad y advertencia** |
|
Cobas omni MGP Reagent (MGP) Almacenar a 2-8 °C (P/N: 06997546190) |
Partículas de vidrio magnéticas, buffer tris, 0,1% de metil-4 hidroxibenzoato, < 0,1% de azida sódica |
480 pruebas |
No aplicable |
|
Cobas omni Specimen Diluent (SPEC DIL) Almacenar a 2-8 °C (P/N: 06997511190) |
Buffer tris, 0,1% de metil- 4 hidroxibenzoato, < 0,1% de azida sódica |
4 × 875 mL |
No aplicable |
|
Cobas omni Lysis Reagent (LYS) Almacenar a 2-8 °C (P/N: 06997538190) |
43% (p/p) de tiocianato de guanidina***, 5% (p/v) de polidocanol***, 2% (p/v) de ditiotreitol, citrato de sodio dihidratado |
4 × 875 mL |
PELIGRO H302 + H332: nocivo en caso de ingestión o inhalación H314: provoca quemaduras graves en la piel y lesiones oculares graves H412: nocivo para los organismos acuáticos, con efectos nocivos duraderos EUH032: en contacto con ácidos libera gases muy tóxicos P261: evitar respirar el polvo/el humo/el gas/la niebla/los vapores/el aerosol P273: evítese su liberación al medio ambiente P280: llevar guantes/prendas/gafas/máscara de protección P303 + P361 + P353: en caso de contacto con la piel (o el pelo): quitar inmediatamente todas las prendas contaminadas. Enjuagar la piel con agua P304 + P340 + P310: en caso de inhalación: transportar a la persona al aire libre y mantenerla en una posición que le facilite la respiración. Llamar inmediatamente a un centro de toxicología/médico P305 + P351 + P338 + P310: en caso de contacto con los ojos: aclarar cuidadosamente con agua durante varios minutos. Quitar las lentes de contacto, si lleva y resulta fácil. Seguir aclarando. Llamar inmediatamente a un centro de toxicología/médico 593-84-0 tiocianato de guanidina 9002-92-0 polidocanol 3483-12-3 (R*,R*)-1,4-dimercaptobutano-2,3-diol |
|
cobas omni Wash Reagent (WASH) Almacenar a 15-30 °C (P/N: 06997503190) |
Citrato de sodio dihidratado, 0,1% de metil- 4-hidroxibenzoato |
4,2 L |
No aplicable |
*Estos reactivos no están incluidos en el kit de la prueba COBAS® HBV. Consulte el listado de material adicional necesario (Tabla 9).
** Las etiquetas de seguridad del producto se basan fundamentalmente en la regulación GHS de la UE.
*** Sustancia peligrosa.
Requisitos de almacenamiento de los reactivos: Los reactivos deben almacenarse y manipularse según las indicaciones de la Tabla 5, la Tabla 6 y la Tabla 7.
Cuando los reactivos no están cargados en los cobas® 5800/6800/8800 Systems, almacénelos a la temperatura correspondiente especificada en la Tabla 5.
Tabla 5. Almacenamiento de reactivos (cuando el reactivo no está cargado en el sistema)
|
Reactivo |
Temperatura de almacenamiento |
|
COBAS® HBV |
2-8 °C |
|
COBAS® HBV/HCV/HIV-1 Control Kit |
2-8 °C |
|
cobas® NHP Negative Control Kit |
2-8 °C |
|
cobas omni Lysis Reagent |
2-8 °C |
|
cobas omni MGP Reagent |
2-8 °C |
|
cobas omni Specimen Diluent |
2-8 °C |
|
cobas omni Wash Reagent |
15-30 °C |
Requisitos para la manipulación de reactivos en el cobas® 5800 system: Los reactivos cargados en el cobas® 5800 System se almacenan a la temperatura correspondiente adecuada y el sistema controla su fecha de caducidad. El sistema solamente permite utilizar los reactivos cuando se cumplen todas las condiciones indicadas en la Tabla 7. El sistema evita automáticamente el uso de reactivos caducados. La Tabla 6 ayuda al usuario a entender las condiciones de manipulación de los reactivos del cobas® 5800 System.
Tabla 6. Condiciones de caducidad de los reactivos del cobas® 5800 System:
|
Reactivo |
Fecha de caducidad del kit |
Estabilidad del kit abierto |
Series en las que se puede utilizar el kit |
Periodo de estabilidad |
|
COBAS® HBV |
No caducado |
90 días desde el primer uso |
Máx. 40 series |
Máx. 36 días* |
|
COBAS® HBV/HCV/HIV-1 Control Kit |
No caducado |
No aplicable1 |
No aplicable |
Máx. 36 días* |
|
cobas® NHP Negative Control Kit |
No caducado |
No aplicable1 |
No aplicable |
Máx. 36 días* |
|
cobas omni Lysis Reagent |
No caducado |
30 días desde la carga* |
No aplicable |
No aplicable |
|
cobas omni MGP Reagent |
No caducado |
30 días desde la carga* |
No aplicable |
No aplicable |
|
cobas omni Specimen Diluent |
No caducado |
30 días desde la carga* |
No aplicable |
No aplicable |
|
cobas omni Wash Reagent |
No caducado |
30 días desde la carga* |
No aplicable |
No aplicable |
1 Reactivos de un solo uso.
* El tiempo se calcula desde la primera vez que se carga el reactivo en el cobas® 5800 System.
Requisitos para la manipulación de reactivos en los cobas® 6800/8800 systems: Los reactivos cargados en los cobas® 6800/8800 Systems se almacenan a la temperatura correspondiente adecuada y el sistema controla su fecha de caducidad. Los cobas® 6800/8800 Systems solamente permiten utilizar los reactivos cuando se cumplen todas las condiciones indicadas en la Tabla 7. El sistema evita automáticamente el uso de reactivos caducados. La Tabla 7 ayuda al usuario a entender las condiciones de manipulación de los reactivos de los cobas® 6800/8800 Systems.
Tabla 7. Condiciones de caducidad de los reactivos de los cobas® 6800/8800 Systems
|
Reactivo |
Fecha de caducidad del kit |
Estabilidad del kit abierto |
Series en las que se puede utilizar el kit |
Periodo de estabilidad (horas acumuladas de carga fuera de la nevera) |
|---|---|---|---|---|
|
COBAS® HBV |
No caducado |
90 días desde el primer uso |
Máx. 40 series |
Máx. 40 horas |
|
COBAS® HBV/HCV/HIV-1 Control Kit |
No caducado |
No aplicablea |
No aplicable |
Máx. 8 horas |
|
cobas® NHP Negative Control Kit |
No caducado |
No aplicablea |
No aplicable |
Máx. 10 horas |
|
cobas omni Lysis Reagent |
No caducado |
30 días desde la carga* |
No aplicable |
No aplicable |
|
cobas omni MGP Reagent |
No caducado |
30 días desde la carga* |
No aplicable |
No aplicable |
|
cobas omni Specimen Diluent |
No caducado |
30 días desde la carga* |
No aplicable |
No aplicable |
|
cobas omni Wash Reagent |
No caducado |
30 días desde la carga* |
No aplicable |
No aplicable |
a Reactivos de un solo uso.
* El tiempo se calcula desde la primera vez que se carga el reactivo en los cobas® 6800/8800 Systems.
Material adicional necesario para el cobas® 5800 system:
Tabla 8. Material y fungibles para el uso en el cobas® 5800 System
|
Material |
P/N |
|
cobas omni Processing Plate 24 |
08413975001 |
|
cobas omni Amplification Plate 24 |
08499853001 |
|
cobas omni Liquid Waste Plate 24 |
08413983001 |
|
Punta CORE TIPS con filtro, 1 mL |
04639642001 |
|
Punta CORE TIPS con filtro, 300 μL |
07345607001 |
|
cobas omni Liquid Waste Container |
07094388001 |
|
cobas omni Lysis Reagent |
06997538190 |
|
cobas omni MGP Reagent |
06997546190 |
|
cobas omni Specimen Diluent |
06997511190 |
|
cobas omni Wash Reagent |
06997503190 |
|
Bolsa para residuos sólidos o Bolsa para residuos sólidos con complemento |
07435967001 o 08030073001 |
Material adicional necesario para los cobas® 6800/8800 systems:
Tabla 9. Materiales y fungibles para el uso en los cobas® 6800/8800 Systems
|
Material |
P/N |
|
cobas omni Processing Plate |
05534917001 |
|
cobas omni Amplification Plate |
05534941001 |
|
cobas omni Pipette Tips |
05534925001 |
|
cobas omni Liquid Waste Container |
07094388001 |
|
cobas omni Lysis Reagent |
06997538190 |
|
cobas omni MGP Reagent |
06997546190 |
|
cobas omni Specimen Diluent |
06997511190 |
|
cobas omni Wash Reagent |
06997503190 |
|
Bolsa para residuos sólidos y recipiente de residuos sólidos o Bolsa para residuos sólidos con complemento y kit del cajón |
07435967001 y 07094361001 o 08030073001 y 08387281001 |
Instrumentos y software necesarios: Es necesario instalar el software cobas® 5800 System y el paquete de análisis COBAS® HBV para el cobas® 5800 System en el instrumento cobas® 5800. El software x800 Data Manager y el PC para el cobas® 5800 System se suministran con el sistema.
Es necesario instalar el software cobas® 6800/8800 Systems y el paquete de análisis COBAS® HBV para los cobas® 6800/8800 Systems en los instrumentos. El IG (instrument gateway) se suministra con el sistema.
Tabla 10. Instrumentos
|
Equipo |
P/N |
|
cobas® 5800 System |
08707464001 |
|
cobas® 6800 System (opción móvil) |
05524245001 y 06379672001 |
|
cobas® 6800 System (fijo) |
05524245001 y 06379664001 |
|
cobas® 8800 System |
05412722001 |
|
Módulo de suministro de muestras |
06301037001 |
Consulte la Asistencia al usuario y/o la Guía del usuario del cobas® 5800 System o los cobas® 6800/8800 Systems para obtener información adicional.
Nota: Póngase en contacto con su representante local de Roche para obtener una lista de pedido detallada para racks de muestras, racks para puntas obstruidas y bandejas de racks compatibles con cada instrumento.
EVALUACIÓN CLÍNICA DEL RENDIMIENTO:
Estudio de reproducibilidad: La reproducibilidad y la variabilidad entre lotes de la prueba COBAS® HBV se evaluaron con plasma conservado en EDTA en el cobas® 6800 System mediante un modelo mixto para estimar la variación total.
Los resultados de la evaluación se resumen de la Tabla 27 a la Tabla 30 que aparecen a continuación.
Variabilidad entre lotes: Se realizaron pruebas de variabilidad entre lotes para los genotipos A y C en un centro de pruebas con tres lotes de reactivo. Dos usuarios del centro analizaron cada lote durante seis días. Se realizaron dos procesos por día.
En la Tabla 27 se muestran los porcentajes atribuibles de la variación total, la desviación estándar (SD) de la precisión total y el coeficiente de variación (CV) de log normal por genotipo y concentración esperada de ADN del HBV en log10 para el cobas® 6800 System.
Tabla 27. Porcentaje atribuible de la variación total, la desviación estándar de la precisión total y el CV (%) en base log normal de la concentración de ADN del HBV (log10 UI/mL) por genotipo y miembro positivo del panel (entre lotes) en el cobas® 6800 System (reproducibilidad)
|
Concentración de ADN del HBV (log10 UI/mL) |
Porcentaje atribuible a la variación total (CV (%) log normal) |
Precisión total |
||||||||
|
Genotipo |
Esperada |
Media observadaa |
N.º de pruebasb |
Lote |
Usuario |
Día |
Serie |
Intra-ensayo |
SDc |
CV (%) log normald |
|
A |
1,48 |
1,50 |
107 |
13% (12,90) |
0% (0,00) |
0% (0,00) |
0% (0,00) |
87% (34,68) |
0,157 |
37,27 |
|
2,70 |
2,72 |
108 |
52% (11,96) |
0% (0,00) |
0% (0,00) |
0% (0,00) |
48% (11,56) |
0,072 |
16,69 |
|
|
3,70 |
3,64 |
108 |
60% (14,29) |
0% (0,00) |
4% (3,55) |
1% (1,57) |
36% (11,01) |
0,080 |
18,53 |
|
|
4,70 |
4,65 |
107 |
47% (13,05) |
0% (0,00) |
3% (3,22) |
1% (2,32) |
49% (13,29) |
0,082 |
19,14 |
|
|
5,70 |
5,67 |
107 |
53% (13,66) |
2% (2,59) |
0% (0,00) |
0% (0,00) |
45% (12,54) |
0,081 |
18,80 |
|
|
6,70 |
6,71 |
105 |
50% (11,66) |
0% (0,00) |
0% (0,00) |
5% (3,82) |
44% (10,92) |
0,071 |
16,48 |
|
|
7,70 |
7,41 |
108 |
55% (13,08) |
0% (0,00) |
0% (0,00) |
4% (3,59) |
40% (11,18) |
0,076 |
17,65 |
|
|
8,70 |
8,41 |
107 |
51% (12,52) |
0% (0,00) |
0% (0,00) |
10% (5,61) |
38% (10,75) |
0,075 |
17,51 |
|
|
C |
1,48 |
1,49 |
107 |
23% (13,62) |
1% (2,83) |
0% (0,00) |
0% (0,00) |
76% (25,26) |
0,124 |
29,05 |
|
2,70 |
2,71 |
105 |
53% (13,92) |
2% (2,63) |
3% (3,48) |
0% (0,00) |
41% (12,27) |
0,082 |
19,16 |
|
|
3,70 |
3,64 |
107 |
61% (11,67) |
0% (0,00) |
0% (0,80) |
0% (0,00) |
39% (9,37) |
0,065 |
15,02 |
|
|
4,70 |
4,65 |
106 |
47% (11,44) |
0% (0,00) |
0% (0,00) |
0% (0,00) |
53% (12,25) |
0,073 |
16,82 |
|
|
5,70 |
5,69 |
107 |
60% (14,76) |
0% (0,00) |
1% (1,51) |
0% (0,00) |
39% (11,86) |
0,082 |
19,08 |
|
|
6,70 |
6,69 |
107 |
48% (11,79) |
0% (0,00) |
2% (2,31) |
0% (0,00) |
50% (12,13) |
0,074 |
17,14 |
|
|
7,70 |
7,38 |
107 |
51% (11,22) |
0% (0,00) |
0% (0,00) |
1% (1,57) |
48% (10,94) |
0,068 |
15,80 |
|
|
8,70 |
8,42 |
106 |
56% (13,92) |
0% (0,00) |
0% (0,00) |
4% (3,54) |
40% (11,72) |
0,080 |
18,62 |
|
Nota: En esta tabla se han incluido los resultados con una carga viral detectable; dentro del rango del ensayo se encuentran los resultados desde 1,0E+01 UI/mL hasta 1,0E+09 UI/mL.
a Calculadas mediante el procedimiento SAS MIXED.
b Número de pruebas válidas con carga viral detectable.
c Cálculo realizado utilizando la variabilidad total del procedimiento SAS MIXED.
d CV (%) log normal = sqrt(10^[SD^2 × ln[10]] - 1) × 100.
CV (%) = porcentaje del coeficiente de variación; ADN = ácido desoxirribonucleico; HBV = virus de la hepatitis B; N.º = número; SD = desviación estándar; sqrt = raíz cuadrada.
En la Tabla 28 a continuación, el porcentaje de concordancia de negativos (PCN) del cobas® 6800 System con pruebas del miembro negativo del panel fue del 100%.
Tabla 28. Porcentaje de concordancia de negativos con el miembro negativo del panel (entre lotes)
|
Concentración de ADN del HBV esperada |
N.º de pruebas válidas |
Resultados positivos |
Resultados negativos |
Porcentaje de concordancia de negativosa |
IC del 95%b |
|
Negativa |
106 |
0 |
106 |
100,00 |
(96,58, 100,00) |
a PCN = (número de resultados negativos ÷ número total de pruebas válidas en el miembro negativo del panel) × 100.
b Calculado mediante el método de intervalo de confianza binomial exacto de Clopper-Pearson.
IC = intervalo de confianza; ADN = ácido desoxirribonucleico; HBV = virus de la hepatitis B; N.º = número; PCN = porcentaje de concordancia de negativos.
Reproducibilidad: Las pruebas de reproducibilidad se realizaron en tres centros para los genotipos A y C utilizando un lote de reactivo. Dos operadores de cada centro realizaron las pruebas durante seis días. Se realizaron dos procesos por día.
En la Tabla 29 se muestran los porcentajes atribuibles de la variación total, la SD de la precisión total y el CV en base log normal por genotipo y concentración esperada de ADN del HBV en log10 para el cobas® 6800 System.
Tabla 29. Porcentaje atribuible de la variación total, la desviación estándar de la precisión total y el CV (%) log normal de la concentración de ADN del HBV (log10 UI/mL) por genotipo y miembro positivo del panel (reproducibilidad)
|
Concentración de ADN del HBV (log10 UI/mL) |
Porcentaje atribuible a la variación total (CV (%) log normal) |
Precisión total |
||||||||
|
Genotipo |
Esperada |
Media observadaa |
N.º de pruebasb |
Centro |
Usuario |
Día |
Serie |
Intra-ensayo |
SDc |
CV (%) log normald |
|
A |
1,48 |
1,48 |
107 |
1% (4,21) |
0% (0,00) |
5% (7,75) |
1% (3,56) |
93% (34,98) |
0,153 |
36,41 |
|
2,70 |
2,66 |
108 |
34% (9,53) |
0% (0,00) |
0% (0,00) |
16% (6,40) |
50% (11,52) |
0,070 |
16,33 |
|
|
3,70 |
3,60 |
108 |
34% (7,49) |
2% (1,90) |
7% (3,42) |
0% (0,00) |
56% (9,58) |
0,055 |
12,80 |
|
|
4,70 |
4,62 |
107 |
13% (5,40) |
0% (0,00) |
0% (0,00) |
12% (5,28) |
75% (13,05) |
0,065 |
15,12 |
|
|
5,70 |
5,63 |
107 |
37% (7,82) |
1% (1,26) |
0% (0,00) |
0% (0,00) |
62% (10,04) |
0,055 |
12,81 |
|
|
6,70 |
6,67 |
106 |
20% (5,99) |
3% (2,16) |
4% (2,57) |
15% (5,16) |
60% (10,48) |
0,059 |
13,59 |
|
|
7,70 |
7,37 |
108 |
3% (2,70) |
2% (2,06) |
0% (0,00) |
0% (0,00) |
95% (15,12) |
0,067 |
15,50 |
|
|
8,70 |
8,36 |
107 |
12% (4,32) |
0% (0,00) |
0% (0,00) |
2% (1,53) |
86% (11,46) |
0,053 |
12,36 |
|
|
C |
1,48 |
1,48 |
107 |
2% (11,79) |
1% (7,06) |
0% (0,00) |
0% (0,00) |
97% (84,30) |
0,324 |
86,20 |
|
2,70 |
2,67 |
105 |
19% (5,94) |
3% (2,22) |
0% (0,00) |
0% (0,00) |
79% (12,27) |
0,060 |
13,84 |
|
|
3,70 |
3,61 |
107 |
14% (4,49) |
0% (0,00) |
7% (3,15) |
0% (0,00) |
78% (10,48) |
0,051 |
11,84 |
|
|
4,70 |
4,62 |
106 |
24% (6,45) |
0% (0,00) |
0% (0,00) |
0% (0,00) |
76% (11,59) |
0,057 |
13,29 |
|
|
5,70 |
5,65 |
107 |
18% (5,96) |
0% (0,00) |
3% (2,29) |
0% (0,00) |
80% (12,68) |
0,061 |
14,22 |
|
|
6,70 |
6,65 |
107 |
23% (6,35) |
6% (3,26) |
0% (0,00) |
1% (1,33) |
70% (11,10) |
0,057 |
13,29 |
|
|
7,70 |
7,34 |
106 |
0% (0,00) |
3% (2,38) |
0% (0,00) |
13% (5,12) |
84% (13,11) |
0,062 |
14,30 |
|
|
8,70 |
8,36 |
107 |
4% (2,24) |
0% (0,00) |
16% (4,35) |
10% (3,46) |
70% (9,09) |
0,047 |
10,91 |
|
Nota: En esta tabla se han incluido los resultados con una carga viral detectable; dentro del rango del ensayo se encuentran los resultados desde 1,0E+01 UI/mL hasta 1,0E+09 UI/mL.
a Calculadas mediante el procedimiento SAS MIXED.
b Número de pruebas válidas con carga viral detectable.
c Cálculo realizado utilizando la variabilidad total del procedimiento SAS MIXED.
d CV (%) log normal = sqrt(10^[SD^2 × ln[10]] - 1) × 100.
CV (%) = porcentaje del coeficiente de variación; HBV = virus de la hepatitis B; ADN = ácido desoxirribonucleico; N.º = número; SD = desviación estándar; sqrt = raíz cuadrada.
El PCN fue del 100% (106/106; IC del 95%: del 96,58% al 100%) con pruebas del miembro negativo del panel en el cobas® 6800 System tal como se presenta en la Tabla 30 a continuación.
Tabla 30. Porcentaje de concordancia de negativos con el miembro negativo del panel (reproducibilidad) en el cobas® 6800 System
|
Concentración de ADN del HBV esperada |
N.º de pruebas |
Resultados positivos |
Resultados negativos |
Porcentaje de concordancia de negativosa |
IC del 95%b |
|
Negativa |
106 |
0 |
106 |
100,00 |
(96,58, 100,00) |
a PCN = (número de resultados negativos ÷ número total de pruebas válidas en el miembro negativo del panel) × 100.
b Calculado mediante el método de intervalo de confianza binomial exacto de Clopper-Pearson.
IC = intervalo de confianza; ADN = ácido desoxirribonucleico; HBV = virus de la hepatitis B; N.º = número; PCN = porcentaje de concordancia de negativos.
Utilidad clínica: El estudio se diseñó para evaluar la capacidad del ensayo para predecir el resultado clínico.
Se analizaron muestras residuales obtenidas de aproximadamente 300 sujetos que recibieron aleatoriamente un tratamiento durante 100 semanas con entecavir y tenofovir, o una monoterapia con entecavir durante un ensayo clínico farmacéutico. También se analizaron muestras de aproximadamente 70 sujetos con infección por HBV crónica HBeAg negativo procedentes de la práctica clínica de rutina que recibieron tratamiento con tenofovir en monoterapia (Tabla 31).
Tabla. 31 Grupos de tratamiento
|
Estudio clínico |
Estado de HBeAg |
Tratamiento |
Brazo del tratamiento |
|
Ensayo clínico farmacéutico21 |
HBeAg (+) |
Entecavir en monoterapia |
Brazo I |
|
Entecavir + tenofovir |
Brazo II |
||
|
HBeAg (-) |
Entecavir en monoterapia |
Brazo III (incluye hasta 17 sujetos de la práctica clínica) |
|
|
Entecavir + tenofovir |
Brazo IV |
||
|
Práctica clínica |
HBeAg (-) |
Tenofovir en monoterapia |
Brazo V |
HBeAg = antígeno e de la hepatitis B.
Los ensayos con la prueba COBAS® HBV se realizaron en tres centros. Cada centro estaba equipado con un cobas® 6800 System. Se utilizaron tres lotes del kit en el estudio y cada muestra se analizó con un lote del kit. En la Tabla 32 se muestran las características demográficas e iniciales de los sujetos cuyas muestras se analizaron en el cobas® 6800 System. En el estudio participaron tanto sujetos con HBeAg (+) como con HBeAg (-), pero los datos de estas poblaciones se analizaron independientemente.
Tabla 32. Características demográficas e iniciales de los sujetos
|
Características |
Estadística |
|---|---|
|
Total, n |
396 |
|
Categoría de edad (años), n (%) |
|
|
< 40 |
186 (47,0%) |
|
≥ 40 |
210 (53,0%) |
|
Edad (años) |
|
|
Media ± SD |
42 ± 15,2 |
|
Mediana |
42 |
|
Rango |
17-81 |
|
Sexo, n (%) |
|
|
Hombres |
276 (69,7%) |
|
Mujeres |
120 (30,3%) |
|
Raza, n (%) |
|
|
Asiático |
204 (51,5%) |
|
Negro/afroamericano |
14 (3,5%) |
|
Blanco/caucásico |
169 (42,7%) |
|
Otros |
9 (2,3%) |
|
Genotipo, n (%) |
|
|
A |
64 (16,2%) |
|
A y G |
1 (0,3%) |
|
B |
62 (15,7%) |
|
C |
74 (18,7%) |
|
D |
105 (26,5%) |
|
E |
4 (1,0%) |
|
F |
10 (2,5%) |
|
Mezclado |
1 (0,3%) |
|
Desconocido |
75 (18,9%) |
|
ALT normal inicial, n (%) |
|
|
Sí |
23 (5,8 %) |
|
No |
361 (91,2 %) |
|
Desconocido |
12 (3,0 %) |
|
ALT inicial (UI/L) |
|
|
Media ± SD |
140 ± 169,9 |
|
Mediana |
96 |
|
Rango |
14-1583 |
|
ADN inicial de HBV (log10 UI/mL) |
|
|
Media ± SD |
6,6 ± 2,38 |
|
Mediana |
7,4 |
|
Rango |
–0,0-10,1 |
|
Categoría de ADN de HBV, n (%) |
|
|
< 2,0 × 103 UI/mL |
41 (10,4%) |
|
De 2,0 × 103 a 2,0 × 104 UI/mL |
13 (3,3%) |
|
> 2,0 × 104 UI/mL |
330 (83,3%) |
|
Desconocido |
12 (3,0%) |
ALT = alanina aminotransferasa; HBV = virus de la hepatitis B; ADN = ácido desoxirribonucleico; SD = desviación estándar.
Predicción sobre la respuesta al tratamiento con antivirales:
Definiciones:
• Respuesta virológica (RV) en la semana 12 = disminución de 2 log10 del ADN de HBV con respecto al valor inicial
• RV en la semana 24 = ADN de HBV < 2.000 UI/mL (HBeAg [+]) o < 50 UI/mL (HBeAg [-])
• RV en la semana 48 = ADN de HBV < 2.000 UI/mL (HBeAg [+]) o < 50 UI/mL (HBeAg [-])
• RV en la semana 96 = ADN de HBV < 50 UI/mL (punto final de la RV)
• Punto final sin RV = ADN de HBV > 50 UI/mL en la semana 96
• Respuesta bioquímica (RB) = normalización de la ALT en comparación con el valor inicial; para ALT en hombres < 30 UI/L y para ALT en mujeres < 19 UI/L
• Pérdida de HBeAg = conversión del estado HBeAg (+) al estado HBeAg (-) durante el tratamiento
Predicción de la respuesta virológica en la semana 96: En este estudio, la concentración inicial de ADN de HBV y la RV en las semanas 12, 24 y 48 del tratamiento se utilizaron para evaluar la capacidad de predecir el resultado (RV, RB o pérdida de HBeAg) en la semana 96 del tratamiento. La RV96 (ADN de HBV < 50 UI/mL) se evaluó con los resultados de ADN de HBV procedentes de una prueba autorizada. Al utilizar la prueba COBAS® HBV para medir el ADN de HBV, una concentración inicial de ADN de HBV < 108 UI/mL y la RV en las semanas 12, 24 y 48 demostraron ser altamente predictivos de la RV96 para todos los brazos del estudio (VPP de 79,6 % a 100 %) (Tabla 33 y Tabla 34 a continuación).
Tabla 33. Probabilidad de obtener una respuesta virológica en la semana 96 a partir de una concentración inicial de ADN de HBV< 108 UI/mL por brazo del tratamiento
|
VPP (%) |
VPN (%) |
OR |
|||||
|
Visita durante el tratamiento |
Brazo del tratamiento |
Sujetos evaluables |
Estimación (IC del 95%) |
n/N |
Estimación (IC del 95%) |
n/N |
Estimación (IC del 95%) |
|
Valor inicial |
Brazo I |
103 |
93,5 (82,5, 97,8) |
43/46 |
31,6 (21,0, 44,5) |
18/57 |
6,62 (1,81, 24,20) |
|
Brazo II |
102 |
96,2 (87,0, 98,9) |
50/52 |
4,0 (1,1, 13,5) |
2/50 |
1,04 (0,14, 7,69) |
|
|
Brazo III |
49 |
100,0 (92,1, 100,0) |
45/45 |
25,0 (4,6, 69,9) |
1/4 |
30,00 (0,83, 1.087,42) |
|
|
Brazo IV |
48 |
97,9 (88,9, 99,6) |
46/47 |
100,0 (20,7, 100,0) |
1/1 |
92,00 (1,81, 4686,43) |
|
|
Brazo V |
30 |
90,0 (74,4, 96,5) |
27/30 |
NC |
0 |
9,00 (0,15, 541,69) |
|
Notas: Valor predictivo positivo (VPP) = PV ÷ (PV + PF) o la probabilidad de obtener un valor para RV96 si el sujeto ha presentado una respuesta virológica en una visita específica.
Valor predictivo negativo (VPN) = NV ÷ (NF + NV) o la probabilidad de no obtener un valor para RV96 si el sujeto no ha presentado una respuesta virológica en una visita específica.
Odds ratio (OR) = (PV × NV) ÷ (PF × NF).
Los IC del 95% para el VPP y el VPN se calculan según el IC del método de puntuación de Wilson.
Se añadió 0,5 a las celdas vacías (PV, NV, PF o NF = 0), antes del cálculo de OR y el IC del 95% correspondiente.
RV en la semana 96 = ADN de HBV < 50 UI/mL (punto final de la RV) con la prueba cobas® Ampliprep/cobas® Taqman® HBV, versión 2. Concentración inicial de ADN de HBV < 1E8 UI/mL determinada en el cobas® 6800 System.
Brazo I: entecavir en monoterapia (HBeAg [+]).
Brazo II: entecavir + tenofovir (HBeAg [+]).
Brazo III: entecavir en monoterapia (HBeAg [-]).
Brazo IV: entecavir + tenofovir (HBeAg [-]).
Brazo V: tenofovir en monoterapia (HBeAg [-]).
IC = intervalo de confianza; ADN = ácido desoxirribonucleico; NF = negativo falso; PF = positivo falso; HBeAg = antígeno e de la hepatitis B; HBV = virus de la hepatitis B; NC = no calculable (puesto que no hubo sujetos sin respuestas virológicas en dicha visita); NV = negativo verdadero; PV = positivo verdadero; RV = respuesta virológica; RV96 = respuesta virológica en la semana 96.
Tabla 34. Probabilidad de obtener una respuesta virológica en la semana 96 a partir de una respuesta virológica determinada en una visita específica del tratamiento por brazo del tratamiento
|
VPP (%) |
VPN (%) |
OR |
|||||
|---|---|---|---|---|---|---|---|
|
Visita durante el tratamiento |
Brazo del tratamiento |
Sujetos elegibles |
Estimación (IC del 95%) |
n/N |
Estimación (IC del 95%) |
n/N |
Estimación (IC del 95 %) |
|
Semana 12 |
Brazo I |
103 |
79,6 (70,8, 86,3) |
82/103 |
NC |
0 |
3,90 (0,08, 202,63) |
|
Brazo II |
100 |
97,0 (91,5, 99,0) |
97/100 |
NC |
0 |
32,33 (0,54, 1921,79) |
|
|
Brazo III |
48 |
97,8 (88,7, 99,6) |
45/46 |
0,0 (0,0, 65,8) |
0/2 |
11,25 (0,28, 445,33) |
|
|
Brazo IV |
48 |
95,8 (86,0, 98,8) |
46/48 |
NC |
0 |
23,00 (0,36, 1485,21) |
|
|
Brazo V |
21 |
85,7 (48,7, 97,4) |
6/7 |
7,1 (1,3, 31,5) |
1/14 |
0,46 (0,02, 8,69) |
|
|
Semana 24 |
Brazo I |
103 |
96,1 (89,2, 98,7) |
74/77 |
69,2 (50,0, 83,5) |
18/26 |
55,50 (13,37, 230,39) |
|
Brazo II |
102 |
96,7 (90,8, 98,9) |
89/92 |
10,0 (1,8, 40,4) |
1/10 |
3,30 (0,31, 35,08) |
|
|
Brazo III |
47 |
100,0 (89,8, 100,0) |
34/34 |
7,7 (1,4, 33,3) |
1/13 |
5,67 (0,18, 179,94) |
|
|
Brazo IV |
49 |
97,7 (87,9, 99,6) |
42/43 |
16,7 (3,0, 56,4) |
1/6 |
8,40 (0,45, 156,19) |
|
|
Brazo V |
20 |
94,1 (73,0, 99,0) |
16/17 |
33,3 (6,1, 79,2) |
1/3 |
8,00 (0,35, 184,38) |
|
|
Semana 48 |
Brazo I |
101 |
89,9 (81,9, 94,6) |
80/89 |
91,7 (64,6, 98,5) |
11/12 |
97,78 (11,28, 847,86) |
|
Brazo II |
97 |
95,9 (89,9, 98,4) |
93/97 |
NC |
0 |
23,25 (0,41, 1328,83) |
|
|
Brazo III |
46 |
100,0 (91,6, 100,0) |
42/42 |
25,0 (4,6, 69,9) |
1/4 |
28,00 (0,77, 1015,78) |
|
|
Brazo IV |
48 |
97,8 (88,4, 99,6) |
44/45 |
33,3 (6,1, 79,2) |
1/3 |
22,00 (0,98, 494,79) |
|
|
Brazo V |
28 |
92,3 (75,9, 97,9) |
24/26 |
50,0 (9,5, 90,5) |
1/2 |
12,00 (0,53, 273,05) |
|
Notas: Valor predictivo positivo (VPP) = PV ÷ (PV + PF) o la probabilidad de obtener un valor para RV96 si el sujeto ha presentado una respuesta virológica en una visita específica.
Valor predictivo negativo (VPN) = NV ÷ (NF + NV) o la probabilidad de no obtener un valor para RV96 si el sujeto no ha presentado una respuesta virológica en una visita específica.
Odds ratio (OR) = (PV × NV) ÷ (PF × NF).
Los IC del 95% para el VPP y el VPN se calculan según el IC del método de puntuación de Wilson.
Se añadió 0,5 a las celdas vacías (PV, NV, PF o NF = 0), antes del cálculo de OR y el IC del 95% correspondiente.
La RV96 se obtiene si el sujeto presenta ADN de HBV < 50 UI/mL con la prueba cobas® TaqMan® HBV para uso con el sistema High Pure en la semana 96.
RV en la semana 12 = ADN de HBV > 2 log10 de disminución con respecto al valor inicial; RV en la semana 24 = ADN de HBV < 2.000 UI/mL (HBeAg [+]) o < 50 UI/mL (HBeAg [-]); RV en la semana 48 = ADN de HBV < 2.000 UI/mL (HBeAg [+]) o < 50 UI/mL (HBeAg [-]).
Brazo I: entecavir en monoterapia (HBeAg [+]).
Brazo II: entecavir + tenofovir (HBeAg [+]).
Brazo III: entecavir en monoterapia (HBeAg [-]).
Brazo IV: entecavir + tenofovir (HBeAg [-]).
Brazo V: tenofovir en monoterapia (HBeAg [-]).
IC = intervalo de confianza; ADN = ácido desoxirribonucleico; NF = negativo falso; PF = positivo falso; HBeAg = antígeno e de la hepatitis B; HBV = virus de la hepatitis B; NC = no calculable (puesto que no hubo sujetos sin respuestas virológicas en dicha visita); NV = negativo verdadero; PV = positivo verdadero; RV = respuesta virológica; RV96 = respuesta virológica en la semana 96.
Predicción de la respuesta bioquímica en la semana 96: La probabilidad de obtener una respuesta bioquímica en la semana 96 siempre que exista una RV durante el tratamiento en la semana 12, la semana 24 o la semana 48 se resume en la Tabla 35.
El valor de la RV en la semana 12, la semana 24 o la semana 48 como indicador de predicción de la RB96 varía según la semana de la RV y el brazo del tratamiento.
Tabla 35. Probabilidad de obtener una respuesta bioquímica en la semana 96 con una respuesta virológica en una semana específica del tratamiento por brazo del tratamiento
|
VPP (%) |
VPN (%) |
OR |
|||||
|---|---|---|---|---|---|---|---|
|
Visita durante el tratamiento |
Brazo del tratamiento |
Sujetos elegibles |
Estimación (IC del 95%) |
n/N |
Estimación (IC del 95%) |
n/N |
Estimación (IC del 95%) |
|
Semana 12 |
Brazo I |
101 |
62,4 (52,6, 71,2) |
63/101 |
NC |
0 |
1,66 (0,03, 85,30) |
|
Brazo II |
100 |
43,0 (33,7, 52,8) |
43/100 |
NC |
0 |
0,75 (0,01, 38,79) |
|
|
Brazo III |
49 |
50,0 (36,1, 63,9) |
23/46 |
66,7 (20,8, 93,9) |
2/3 |
2,00 (0,17, 23,62) |
|
|
Brazo IV |
49 |
32,7 (21,2, 46,6) |
16/49 |
NC |
0 |
0,48 (0,01, 25,57) |
|
|
Brazo V |
21 |
40,0 (16,8, 68,7) |
4/10 |
90,9 (62,3, 98,4) |
10/11 |
6,67 (0,60, 74,51) |
|
|
Semana 24 |
Brazo I |
102 |
66,2 (55,1, 75,8) |
51/77 |
60,0 (40,7, 76,6) |
15/25 |
2,94 (1,16, 7,45) |
|
Brazo II |
103 |
44,6 (34,8, 54,7) |
41/92 |
81,8 (52,3, 94,9) |
9/11 |
3,62 (0,74, 17,68) |
|
|
Brazo III |
51 |
47,2 (32,0, 63,0) |
17/36 |
33,3 (15,2, 58,3) |
5/15 |
0,45 (0,13, 1,57) |
|
|
Brazo IV |
50 |
38,6 (25,7, 53,4) |
17/44 |
100,0 (61,0, 100,0) |
6/6 |
7,56 (0,40, 144,09) |
|
|
Brazo V |
24 |
42,1 (23,1, 63,7) |
8/19 |
80,0 (37,6, 96,4) |
4/5 |
2,91 (0,27, 31,22) |
|
|
Semana 48 |
Brazo I |
100 |
65,2 (54,8, 74,3) |
58/89 |
81,8 (52,3, 94,9) |
9/11 |
8,42 (1,71, 41,41) |
|
Brazo II |
97 |
43,3 (33,9, 53,2) |
42/97 |
NC |
0 |
0,76 (0,01, 39,29) |
|
|
Brazo III |
49 |
52,3 (37,9, 66,2) |
23/44 |
40,0 (11,8, 76,9) |
2/5 |
0,73 (0,11, 4,81) |
|
|
Brazo IV |
49 |
37,0 (24,5, 51,4) |
17/46 |
100,0 (43,9, 100,0) |
3/3 |
3,52 (0,17, 74,51) |
|
|
Brazo V |
28 |
33,3 (18,0, 53,3) |
8/24 |
75,0 (30,1, 95,4) |
3/4 |
1,50 (0,13, 16,82) |
|
Notas: Valor predictivo positivo (VPP) = PV ÷ (PV + PF) o la probabilidad de obtener una RB96 si el sujeto ha presentado una respuesta virológica en una visita específica.
Valor predictivo negativo (VPN) = NV ÷ (NF + NV) o la probabilidad de no obtener una RB96 si el sujeto no ha presentado una respuesta virológica en una visita específica.
Odds ratio (OR) = (PV × NV) ÷ (PF × NF).
Los IC del 95% para el VPP y el VPN se calculan según el IC del método de puntuación de Wilson.
Se añadió 0,5 a las celdas vacías (PV, NV, PF o NF = 0), antes del cálculo de OR y el IC del 95% correspondiente.
Brazo I: entecavir en monoterapia (HBeAg [+]).
Brazo II: entecavir + tenofovir (HBeAg [+]).
Brazo III: entecavir en monoterapia (HBeAg [-]).
Brazo IV: entecavir + tenofovir (HBeAg [-]).
Brazo V: tenofovir en monoterapia (HBeAg [-]).
La respuesta bioquímica se define como la normalización de ALT (ALT < 30 UI/L para hombres y ALT < 19 UI/L para mujeres) en la semana 96 en comparación con el valor inicial para sujetos con una ALT inicial elevada.
RV en la semana 12 = disminución de > 2 log10 del ADN de HBV con respecto al valor inicial. RV en la semana 24 = ADN de HBV < 2.000 UI/mL (HBeAg [+]) o < 50 UI/mL (HBeAg [-]). RV en la semana 48 = ADN de HBV < 2.000 UI/mL (HBeAg [+]) o < 50 UI/mL (HBeAg [-]).
ALT = alanina aminotransferasa; IC = intervalo de confianza; ADN = ácido desoxirribonucleico; NF = negativo falso; PF = positivo falso; HBeAg = antígeno e de la hepatitis B; HBV = virus de la hepatitis B; NC = no calculable (puesto que no hubo sujetos sin respuestas virológicas en esa visita); NV = negativo verdadero; PV = positivo verdadero; RV = respuesta virológica; RB96 = respuesta bioquímica en la semana 96.
Predicción de la pérdida de HBeAg: La pérdida de HBeAg solo pudo evaluarse en sujetos con HBeAg (+) para el valor inicial.
La ausencia de RV en la semana 24 fue altamente predictiva de la persistencia de HBeAg (los VPN fueron ≥ 80,0% para los brazos I y II) mientras que la ausencia de RV en la semana 48 también predijo la persistencia de HBeAg en el brazo I (VNP del 100%) (Tabla 36). Puesto que todos los sujetos del esquema combinado (brazo II) habían conseguido una RV para la semana 48, no fue posible calcular un VPN en este punto temporal para dicho grupo.
Tabla 36. Probabilidad de pérdida de HBeAg en la semana 96 con una respuesta virológica en una visita específica del tratamiento por brazo del tratamiento
|
VPP (%) |
VPN (%) |
O |
|||||
|
Visita durante el tratamiento |
Brazo del tratamiento |
Sujetos elegibles |
Estimación (IC del 95%) |
n/N |
Estimación (IC del 95%) |
n/N |
Estimación (IC del 95 %) |
|
Semana 12 |
Brazo I |
102 |
46,1 (36,7, 55,7) |
47/102 |
NC |
0 |
0,85 (0,02, 43,91) |
|
Brazo II |
101 |
41,6 (32,5, 51,3) |
42/101 |
NC |
0 |
0,71 (0,01, 36,60) |
|
|
Semana 24 |
Brazo I |
103 |
52,6 (41,6, 63,3) |
41/78 |
80,0 (60,9, 91,1) |
20/25 |
4,43 (1,51, 13,00) |
|
Brazo II |
104 |
44,1 (34,4, 54,2) |
41/93 |
81,8 (52,3, 94,9) |
9/11 |
3,55 (0,73, 17,33) |
|
|
Semana 48 |
Brazo I |
101 |
51,1 (41,0, 61,2) |
46/90 |
100,0 (74,1, 100,0) |
11/11 |
23,00 (1,31, 403,28) |
|
Brazo II |
98 |
40,8 (31,6, 50,7) |
40/98 |
NC |
0 |
0,69 (0,01, 35,48) |
|
Nota: Valor predictivo positivo (VPP) = PV ÷ (PV + PF) o la probabilidad de existir pérdida de HBeAg en la semana 96 si el sujeto ha presentado una respuesta virológica en una visita específica.
Valor predictivo negativo (VPN) = NV ÷ (NF + NV) o la probabilidad de no existir una pérdida de HBeAg en la semana 96 si el sujeto no ha presentado una respuesta virológica en una visita específica.
Odds ratio (OR) = (PV × NV) ÷ (PF × NF).
Los IC del 95 % para el VPP y el VPN se calculan según el IC del método de puntuación de Wilson.
Se añadió 0,5 a las celdas vacías (PV, NV, PF o NF = 0), antes del cálculo de OR y el IC del 95% correspondiente.
Brazo I: entecavir en monoterapia (HBeAg [+]).
Brazo II: entecavir + tenofovir (HBeAg [+]).
La pérdida de HBeAg se consigue si se produce una pérdida de HBeAg durante el tratamiento.
RV en la semana 12 = disminución > 2 log10 de ADN de HBV con respecto al valor inicial; RV en la semana 24 = ADN de HBV < 2.000 UI/mL (HBeAg [+]); RV en la semana 48 = ADN de HBV < 2.000 UI/mL (HBeAg [+]).
IC = intervalo de confianza; ADN = ácido desoxirribonucleico; NF = negativo falso; PF = positivo falso; HBeAg = antígeno e de la hepatitis B; HBV = virus de la hepatitis B; NC = no calculable (puesto que no hubo sujetos sin respuestas virológicas en dicha visita); NV = negativo verdadero; PV = positivo verdadero; RV = respuesta virológica; RB96 = respuesta bioquímica en la semana 96.
Los resultados demostraron que la prueba COBAS® HBV resulta útil para la monitorización de la carga viral en sujetos con infección crónica por HBV al inicio de un tratamiento con antivirales o durante el mismo. Este estudio demostró que la medición de la concentración de ADN de HBV en el valor inicial, una disminución de la concentración de ADN de HBV en la semana 12 o concentraciones de ADN de HBV inferiores a umbrales específicos en las semanas 24 o 48 durante el tratamiento son indicadores de predicción de la respuesta al tratamiento; el estudio identificó sujetos que consiguieron una respuesta virológica, una respuesta bioquímica o una pérdida de HBeAg en la semana 96 del tratamiento.
Conclusión:
La prueba COBAS® HBV puede cuantificar el nivel de ADN de HBV para monitorizar y predecir la respuesta a un tratamiento con antivirales. Los resultados de este estudio demuestran la utilidad clínica de esta prueba para determinar la respuesta temprana al tratamiento para el control de los pacientes con infección crónica por HBV.
Equivalencia entre sistemas/comparación de sistemas. La equivalencia entre los cobas® 5800, cobas® 6800 y los cobas® 8800 Systems se demostró a partir de estudios de rendimiento.
Los resultados incluidos en las Instrucciones de uso hacen patente la equivalencia de rendimiento entre todos los sistemas.
EVALUACIÓN NO CLÍNICA DEL RENDIMIENTO:
Características clave de rendimiento de los cobas® 6800/8800 Systems:
Límite de detección (LoD):
Estándar internacional de la OMS: El límite de detección de la prueba COBAS® HBV se determinó mediante el análisis de diluciones en serie del estándar internacional de la OMS para ADN del virus de la hepatitis B en ensayos mediante tecnología de amplificación de ácidos nucleicos (segundo estándar internacional de la OMS) para el genotipo A obtenido del National Institute for Biological Standards and Control (NIBSC), en suero y plasma conservado en EDTA humano negativo al HBV con volúmenes de procesamiento de muestras de 500 μL y 200 μL. Se analizaron paneles con ocho niveles de concentración, más uno negativo, para el volumen de procesamiento de muestras de 500 μL y con nueve niveles de concentración para el volumen de procesamiento de muestras de 200 μL con tres lotes de reactivo de la prueba COBAS® HBV, con múltiples procesos, días, operadores e instrumentos.
Los resultados del suero y del plasma conservado en EDTA correspondientes a los dos volúmenes de procesamiento se detallan desde la Tabla 13 hasta la Tabla 16, respectivamente. El estudio demuestra que la prueba COBAS® HBV es capaz de detectar ADN del HBV en una concentración de 3 UI/mL con una tasa de positividad de ≥ 95% para el volumen de procesamiento de muestras de 500 μL, y en una concentración de 17,5 UI/mL con una tasa de positividad de ≥ 95% para el volumen de procesamiento de muestras de 200 μL en plasma conservado en EDTA. En cuanto a las muestras de suero, el estudio demuestra que la prueba COBAS® HBV es capaz de detectar ADN del HBV en una concentración de 3 UI/mL con una tasa de positividad de ≥ 95% para el volumen de procesamiento de muestras de 500 μL, y en una concentración de 15 UI/mL con una tasa de positividad de ≥ 95% para el volumen de procesamiento de muestras de 200 μL.
Tabla 13. Límite de detección en plasma conservado en EDTA (500 μL)
|
Concentración del título de entrada (ADN del HBV en UI/mL) |
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % |
|
20,0 |
189 |
189 |
100,00 |
|
10,0 |
189 |
189 |
100,00 |
|
8,0 |
189 |
189 |
100,00 |
|
6,0 |
189 |
189 |
100,00 |
|
5,0 |
189 |
188 |
99,47 |
|
4,0 |
189 |
185 |
97,88 |
|
3,0 |
189 |
183 |
96,83 |
|
2,0 |
189 |
166 |
87,83 |
|
LoD según PROBIT con una tasa de positividad del 95% |
2,7 UI/mL Intervalo de confianza del 95%: 2,4-3,1 UI/mL |
||
Tabla 14. Límite de detección en suero (500 μL)
|
Concentración del título de entrada (ADN del HBV en UI/mL) |
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % |
|
20,0 |
189 |
189 |
100,00 |
|
10,0 |
189 |
189 |
100,00 |
|
8,0 |
189 |
189 |
100,00 |
|
6,0 |
189 |
189 |
100,00 |
|
5,0 |
189 |
188 |
99,47 |
|
4,0 |
189 |
186 |
98,41 |
|
3,0 |
189 |
187 |
98,94 |
|
2,0 |
189 |
172 |
91,01 |
|
LoD según PROBIT con una tasa de positividad del 95% |
2,4 UI/mL Intervalo de confianza del 95%: 2,0-2,7 UI/mL |
||
Tabla 15. Límite de detección en plasma conservado en EDTA (200 μL)
|
Concentración del título de entrada (ADN del HBV en UI/mL) |
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % |
|
50,0 |
189 |
189 |
100,00 |
|
30,0 |
189 |
189 |
100,00 |
|
25,0 |
189 |
188 |
99,47 |
|
20,0 |
189 |
189 |
100,00 |
|
17,5 |
189 |
182 |
96,30 |
|
15,0 |
189 |
179 |
94,71 |
|
12,5 |
189 |
170 |
89,95 |
|
10,0 |
189 |
142 |
75,13 |
|
5,0 |
189 |
87 |
46,03 |
|
LoD según PROBIT con una tasa de positividad del 95% |
15,5 UI/mL Intervalo de confianza del 95%: 14,4-16,9 UI/mL |
||
Tabla 16. Límite de detección en suero (200 μL)
|
Concentración del título de entrada (ADN del HBV en UI/mL) |
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % |
|
50,0 |
189 |
189 |
100,00 |
|
30,0 |
189 |
189 |
100,00 |
|
25,0 |
189 |
189 |
100,00 |
|
20,0 |
189 |
187 |
98,94 |
|
17,5 |
189 |
189 |
100,00 |
|
15,0 |
189 |
184 |
97,35 |
|
12,5 |
189 |
174 |
92,06 |
|
10,0 |
189 |
170 |
89,95 |
|
5,0 |
189 |
107 |
56,61 |
|
LoD según PROBIT con una tasa de positividad del 95% |
12,5 UI/mL Intervalo de confianza del 95 %: 11,6-13,8 UI/mL |
||
Intervalo lineal: El estudio de linealidad de la prueba COBAS® HBV se llevó a cabo con una serie de diluciones formadas por un panel de 15 muestras con el que se cubría el intervalo lineal esperado para el genotipo predominante (GT A). Los miembros del panel con título alto se prepararon a partir de un stock de ADN plasmídico de HBV de título elevado, mientras que los miembros del panel con título más bajo se prepararon a partir de una muestra clínica. El panel de linealidad se diseñó para que existiera una superposición de títulos aproximada de 2 log10 entre los dos materiales de origen. El intervalo lineal esperado de la prueba COBAS® HBV cubre desde el LLoQ (10 UI/mL para el volumen de procesamiento de 500 μL y 25 UI/mL para el volumen de procesamiento de 200 μL) hasta el ULoQ (1,00E+09 UI/mL). El diseño del panel de linealidad permitía abarcar desde un concentración inferior al LLoQ (p. ej., 7,5 UI/mL) hasta una concentración superior al ULoQ (p. ej., 2,0E+09 UI/mL), así como incluir puntos de decisiones médicas. Asimismo, el panel de linealidad estaba diseñado para admitir parcialmente pasos de 1,0 log10 a lo largo del intervalo lineal. Para cada miembro del panel se indicó la concentración nominal en UI/mL y el origen del ADN de HBV.
Para el volumen de procesamiento de 500 μL, la prueba COBAS® HBV es lineal para suero y plasma conservado en EDTA desde 10 UI/mL hasta 1,00E+09 UI/mL, y presenta una desviación absoluta respecto al mejor ajuste de la regresión no lineal inferior a ±0,2 log10. A lo largo del intervalo lineal, la exactitud de la prueba fue de ±0,24 log10.
Para el volumen de procesamiento de 200 μL, la prueba COBAS® HBV es lineal para suero y plasma conservado en EDTA desde 25 UI/mL hasta 1,00E+09 UI/mL y presenta una desviación absoluta respecto al mejor ajuste de la regresión no lineal inferior a ±0,2 log10. A lo largo del intervalo lineal, la exactitud de la prueba fue de ±0,24 log10.
Consulte la Ilustración 4 a la Ilustración 7 para conocer los resultados representativos.
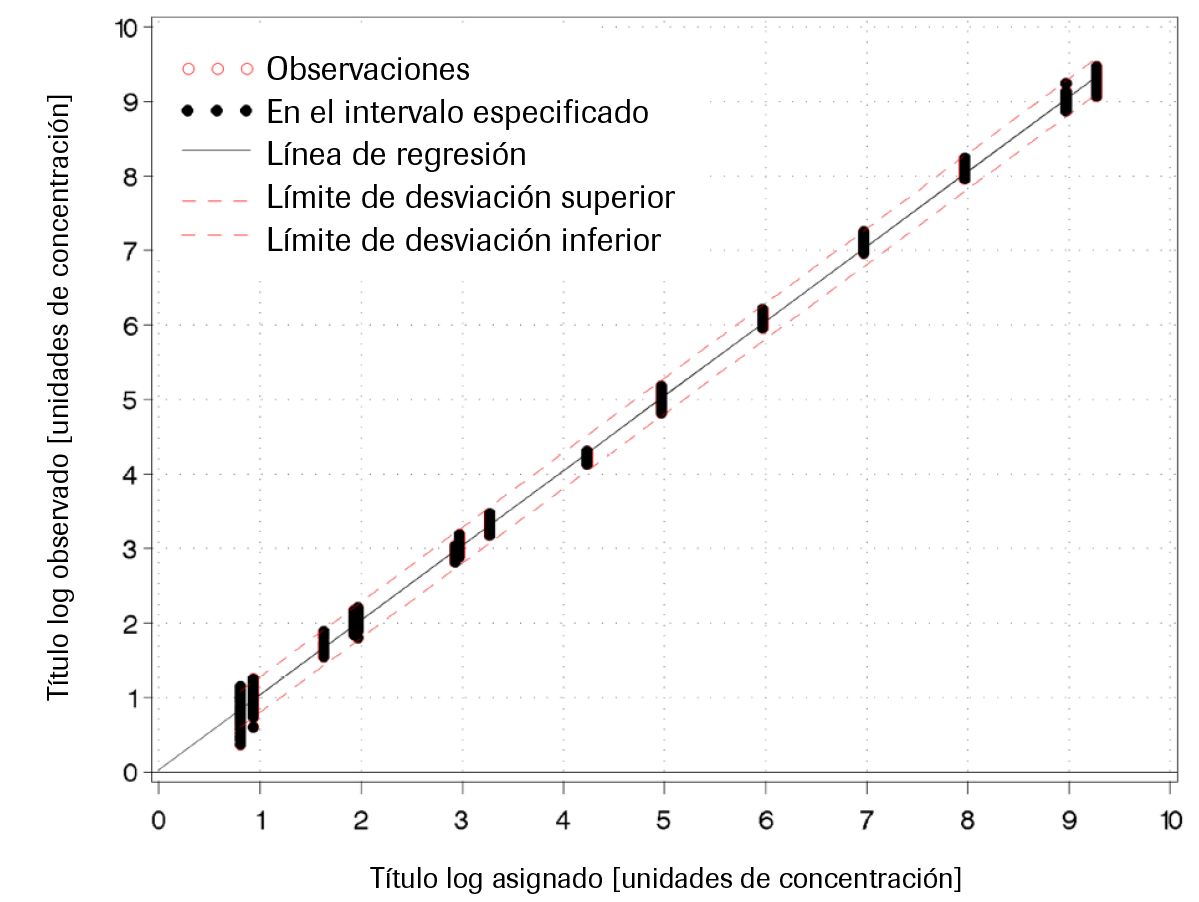
Ilustración 4. Determinación del intervalo lineal en plasma conservado en EDTA (500 μL)

Ilustración 5. Determinación del intervalo lineal en plasma conservado en EDTA (200 μL)

Ilustración 6. Determinación del intervalo lineal en plasma conservado en suero (500 μL)
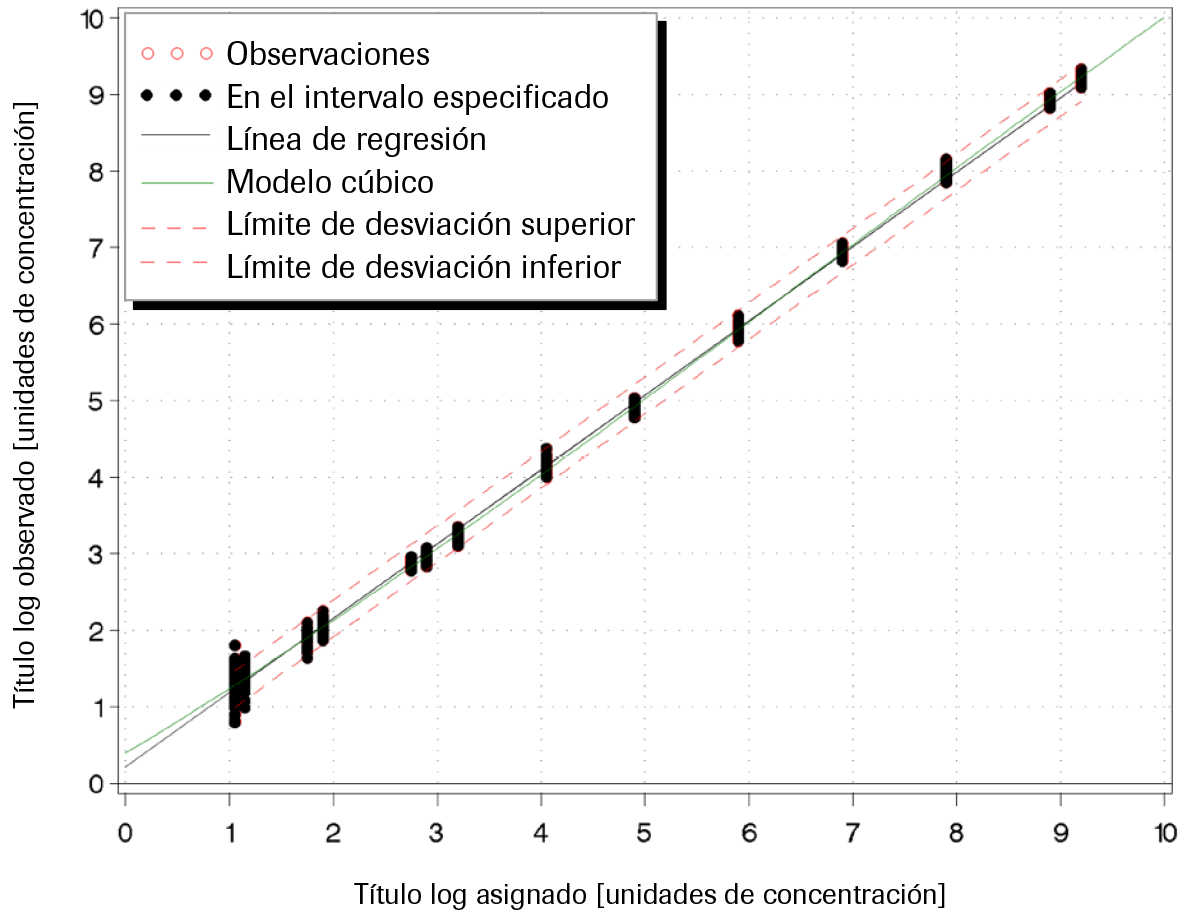
Ilustración 7. Determinación del intervalo lineal en plasma conservado en suero (200 μL)
Precisión (intralaboratorio): La precisión de la prueba COBAS® HBV se determinó mediante el análisis de diluciones en serie de muestras clínicas (MC) de HBV (genotipo A), o de ADN plasmídico de HBV en suero o plasma conservado en EDTA negativos para el HBV. Se analizaron entre 10 y 12 niveles de dilución en 48 réplicas para cada nivel y volumen de procesamiento con los tres lotes de reactivo de la prueba COBAS® HBV en tres instrumentos diferentes y con tres operadores distintos durante 12 días. Cada muestra se sometió al procedimiento completo de la prueba COBAS® HBV en los cobas® 6800/8800 Systems totalmente automatizados. Por lo tanto, la precisión a la que se hace referencia en este documento engloba todas las fases del procedimiento de la prueba. Los resultados se muestran desde la Tabla 17 hasta la Tabla 20.
La prueba COBAS® HBV presentó una alta precisión para los tres lotes de reactivo analizados en un intervalo de concentración comprendido entre 5,00E+01 UI/mL y 1,0E+09 UI/mL con el volumen de procesamiento de muestras de 500 μL, y entre 1,00E+02 UI/mL y 1,0E+08 UI/mL (para plasma conservado en EDTA) y 1,0E+09 UI/mL (para suero) con el volumen de procesamiento de muestras de 200 μL.
Tabla 17. Precisión intralaboratorio de la prueba COBAS® HBV (muestras de plasma conservado en EDTA — volumen de procesamiento de 500 μl)*
|
Concentración nominal (UI/mL) |
Concentración asignada (UI/mL) |
Material de origen |
Plasma conservado en EDTA |
|||
|
Lote 1 |
Lote 2 |
Lote 3 |
Todos los lotes |
|||
|
SD |
SD |
SD |
SD agrupada |
|||
|
1,00E+09 |
9,32E+08 |
ADN plasmídico |
0,04 |
0,07 |
0,09 |
0,07 |
|
1,00E+08 |
9,32E+07 |
ADN plasmídico |
0,04 |
0,08 |
0,05 |
0,06 |
|
1,00E+07 |
9,32E+06 |
ADN plasmídico |
0,06 |
0,05 |
0,04 |
0,05 |
|
1,00E+06 |
9,32E+05 |
ADN plasmídico |
0,06 |
0,07 |
0,04 |
0,06 |
|
1,00E+05 |
9,32E+04 |
ADN plasmídico |
0,06 |
0,06 |
0,07 |
0,06 |
|
2,00E+04 |
1,71E+04 |
Muestra clínica |
0,05 |
0,03 |
0,03 |
0,04 |
|
2,00E+03 |
1,86E+03 |
ADN plasmídico |
0,05 |
0,04 |
0,07 |
0,05 |
|
1,00E+03 |
8,54E+02 |
Muestra clínica |
0,04 |
0,05 |
0,04 |
0,04 |
|
1,00E+03 |
9,32E+02 |
ADN plasmídico |
0,06 |
0,06 |
0,05 |
0,06 |
|
1,00E+02 |
8,54E+01 |
Muestra clínica |
0,07 |
0,08 |
0,07 |
0,07 |
|
1,00E+02 |
9,32E+01 |
ADN plasmídico |
0,10 |
0,08 |
0,09 |
0,09 |
|
5,00E+01 |
4,27E+01 |
Muestra clínica |
0,09 |
0,04 |
0,08 |
0,08 |
* Se considera que los datos de título cuentan con una distribución log-normal y se analizan según la transformación de log10. Las columnas de desviaciones estándar (SD) presentan el total del título log-transformado para cada uno de los tres lotes de reactivo.
Tabla 18. Precisión intralaboratorio de la prueba COBAS® HBV (muestras de suero — volumen de procesamiento de 500 μL)*
|
Concentración nominal (UI/mL) |
Concentración asignada (UI/mL) |
Material de origen |
Suero |
|||
|
Lote 1 |
Lote 2 |
Lote 3 |
Todos los lotes |
|||
|
SD |
SD |
SD |
SD agrupada |
|||
|
1,00E+09 |
5,47E+08 |
ADN plasmídico |
0,05 |
0,06 |
0,03 |
0,05 |
|
1,00E+08 |
5,47E+07 |
ADN plasmídico |
0,03 |
0,04 |
0,03 |
0,04 |
|
1,00E+07 |
5,47E+06 |
ADN plasmídico |
0,05 |
0,05 |
0,03 |
0,05 |
|
1,00E+06 |
5,47E+05 |
ADN plasmídico |
0,04 |
0,06 |
0,06 |
0,05 |
|
1,00E+05 |
5,47E+04 |
ADN plasmídico |
0,04 |
0,03 |
0,03 |
0,04 |
|
2,00E+04 |
1,12E+04 |
Muestra clínica |
0,10 |
0,07 |
0,08 |
0,08 |
|
2,00E+03 |
1,09E+03 |
ADN plasmídico |
0,05 |
0,05 |
0,03 |
0,05 |
|
1,00E+03 |
5,62E+02 |
Muestra clínica |
0,03 |
0,14 |
0,03 |
0,09 |
|
1,00E+03 |
5,47E+02 |
ADN plasmídico |
0,04 |
0,05 |
0,04 |
0,04 |
|
1,00E+02 |
5,62E+01 |
Muestra clínica |
0,09 |
0,06 |
0,07 |
0,07 |
|
1,00E+02 |
5,47E+01 |
ADN plasmídico |
0,05 |
0,07 |
0,04 |
0,06 |
|
5,00E+01 |
2,81E+01 |
Muestra clínica |
0,07 |
0,06 |
0,10 |
0,08 |
* Se considera que los datos de título cuentan con una distribución log-normal y se analizan según la transformación de log10. Las columnas de desviaciones estándar (SD) presentan el total del título log-transformado para cada uno de los tres lotes de reactivo.
Tabla 19. Precisión intralaboratorio de la prueba COBAS® HBV (muestras de plasma conservado en EDTA — volumen de procesamiento de 200 μL)*
|
Concentración nominal (UI/mL) |
Concentración asignada (UI/mL) |
Material de origen |
Plasma conservado en EDTA |
|||
|
Lote 1 |
Lote 2 |
Lote 3 |
Todos los lotes |
|||
|
SD |
SD |
SD |
SD agrupada |
|||
|
1,00E+08 |
1,28E+08 |
ADN plasmídico |
0,04 |
0,05 |
0,03 |
0,04 |
|
1,00E+07 |
1,28E+07 |
ADN plasmídico |
0,06 |
0,04 |
0,02 |
0,04 |
|
1,00E+06 |
1,28E+06 |
ADN plasmídico |
0,03 |
0,04 |
0,04 |
0,03 |
|
1,00E+05 |
1,28E+05 |
ADN plasmídico |
0,02 |
0,06 |
0,05 |
0,05 |
|
2,00E+04 |
1,71E+04 |
Muestra clínica |
0,03 |
0,05 |
0,03 |
0,04 |
|
2,00E+03 |
2,57E+03 |
ADN plasmídico |
0,05 |
0,06 |
0,05 |
0,05 |
|
1,00E+03 |
8,54E+02 |
Muestra clínica |
0,07 |
0,05 |
0,03 |
0,05 |
|
1,00E+03 |
1,28E+03 |
ADN plasmídico |
0,06 |
0,07 |
0,03 |
0,05 |
|
1,00E+02 |
8,54E+01 |
Muestra clínica |
0,09 |
0,09 |
0,07 |
0,09 |
|
1,00E+02 |
1,28E+02 |
ADN plasmídico |
0,06 |
0,09 |
0,11 |
0,09 |
* Se considera que los datos de título cuentan con una distribución log-normal y se analizan según la transformación de log10. Las columnas de desviaciones estándar (SD) presentan el total del título log-transformado para cada uno de los tres lotes de reactivo.
Tabla 20. Precisión intralaboratorio de la prueba COBAS® HBV (muestras de suero — volumen de procesamiento de 200 μL)*
|
Concentración nominal (UI/mL) |
Concentración asignada (UI/mL) |
Material de origen |
Suero |
|||
|
Lote 1 |
Lote 2 |
Lote 3 |
Todos los lotes |
|||
|
SD |
SD |
SD |
SD agrupada |
|||
|
1,00E+09 |
7,92E+08 |
ADN plasmídico |
0,04 |
0,03 |
0,03 |
0,04 |
|
1,00E+08 |
7,92E+07 |
ADN plasmídico |
0,07 |
0,05 |
0,06 |
0,06 |
|
1,00E+07 |
7,92E+06 |
ADN plasmídico |
0,04 |
0,03 |
0,04 |
0,04 |
|
1,00E+06 |
7,92E+05 |
ADN plasmídico |
0,03 |
0,05 |
0,04 |
0,04 |
|
1,00E+05 |
7,92E+04 |
ADN plasmídico |
0,06 |
0,07 |
0,03 |
0,06 |
|
2,00E+04 |
1,12E+04 |
Muestra clínica |
0,16 |
0,08 |
0,03 |
0,11 |
|
2,00E+03 |
1,58E+03 |
ADN plasmídico |
0,05 |
0,04 |
0,05 |
0,05 |
|
1,00E+03 |
5,62E+02 |
Muestra clínica |
0,07 |
0,04 |
0,04 |
0,05 |
|
1,00E+03 |
7,92E+02 |
ADN plasmídico |
0,07 |
0,05 |
0,06 |
0,06 |
|
1,00E+02 |
5,62E+01 |
Muestra clínica |
0,09 |
0,10 |
0,07 |
0,09 |
|
1,00E+02 |
7,92E+01 |
ADN plasmídico |
0,08 |
0,09 |
0,09 |
0,08 |
* Se considera que los datos de título cuentan con una distribución log-normal y se analizan según la transformación de log10. Las columnas de desviaciones estándar (SD) presentan el total del título log-transformado para cada uno de los tres lotes de reactivo.
Determinación y verificación del genotipo: El rendimiento de la prueba COBAS® HBV para los genotipos del HBV se evaluó mediante:
• Determinación del límite de detección para los genotipos B-H y la mutación precore predominante con suero y plasma conservado en EDTA para volúmenes de procesamiento de 500 μL
• Verificación del límite de detección para los genotipos B-H y la mutación precore predominante con suero y plasma conservado en EDTA para volúmenes de procesamiento de 200 μL
• Verificación de la linealidad para los genotipos B-H y la mutación precore predominante
Límite de detección para los genotipos B-H y la mutación precore predominante: El límite de detección de la prueba COBAS® HBV se determinó mediante el análisis de diluciones en serie para siete genotipos distintos (B, C, D, E, F, G, H) y la mutación precore predominante (G1896A; C1858T) en suero y plasma humano conservado en EDTA negativo al HBV con volúmenes de procesamiento de muestras de 500 μL. Se analizaron paneles con ocho niveles de concentración más uno negativo con tres lotes de reactivo de la prueba COBAS® HBV, con múltiples procesos, días, operadores e instrumentos.
Los resultados para suero y plasma conservado en EDTA correspondientes al volumen de procesamiento de 500 μL se detallan en la Tabla 21 y la Tabla 22, respectivamente. El estudio demuestra que la prueba COBAS® HBV es capaz de detectar todos los genotipos del HBV analizados con un LoD similar al del genotipo A del HBV.
Tabla 21. Límite de detección para los genotipos de ADN del HBV en plasma conservado en EDTA (500 μL)
|
Genotipo |
LoD del 95% mediante PROBIT |
Intervalo de confianza del 95% |
|
GT B |
3,45 UI/mL |
2,95 UI/mL-4,32 UI/mL |
|
GT C |
4,13 UI/mL |
3,32 UI/mL-5,82 UI/mL |
|
GT D |
4,52 UI/mL |
3,59 UI/mL-6,49 UI/mL |
|
GT E |
3,21 UI/mL |
2,76 UI/mL-3,98 UI/mL |
|
GT F |
1,87 UI/mL |
1,66 UI/mL-2,24 UI/mL |
|
GT G |
2,49 UI/mL |
2,17 UI/mL-3,02 UI/mL |
|
GT H |
6,55 UI/mL |
5,33 UI/mL-8,77 UI/mL |
|
Mutación precore |
2,38 UI/mL |
2,08 UI/mL-2,90 UI/mL |
Tabla 22. Límite de detección para los genotipos de ADN del HBV en suero (500 μL)
|
Genotipo |
LoD del 95% mediante PROBIT |
Intervalo de confianza del 95% |
|
GT B |
3,30 UI/mL |
2,76 UI/mL-4,30 UI/mL |
|
GT C |
3,34 UI/mL |
2,83 UI/mL-4,23 UI/mL |
|
GT D |
2,59 UI/mL |
2,17 UI/mL-3,42 UI/mL |
|
GT E |
2,67 UI/mL |
2,25 UI/mL-3,49 UI/mL |
|
GT F |
1,98 UI/mL |
1,72 UI/mL-2,45 UI/mL |
|
GT G |
2,07 UI/mL |
1,75 UI/mL-2,66 UI/mL |
|
GT H |
3,48 UI/mL |
2,89 UI/mL-4,60 UI/mL |
|
Mutación precore |
1,65 UI/mL |
1,43 UI/mL-2,03 UI/mL |
Verificación del límite de detección para los genotipos B-H y la mutación precore predominante: Se diluyeron las muestras clínicas de ADN del HBV de todos los genotipos (B, C, D, E, F, G, H) y la mutación precore predominante (G1896A; C1858T) en tres niveles de concentración distintos de suero y plasma conservado en EDTA. La determinación de la tasa de positividad se llevó a cabo con 63 réplicas para cada nivel. El análisis se realizó con tres lotes de reactivos de la prueba COBAS® HBV. En la Tabla 23 y en la Tabla 24 se muestran los resultados obtenidos con el suero y el plasma conservado en EDTA con un volumen de 200 μL. Estos resultados verifican que la prueba COBAS® HBV puede detectar ADN del HBV para los siete genotipos distintos y la mutación precore predominante en concentraciones de 12,50 UI/mL con una tasa de positividad de ≥ 93,65%, y un intervalo de confianza unilateral superior del 95% de 97,80%.
Tabla 23. Verificación del límite de detección de los genotipos de ADN del HBV en plasma conservado en EDTA (200 μL)
|
Genotipo |
6,25 UI/mL |
12,50 UI/mL |
18,75 UI/mL |
||||||
|
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % (IC al 95%*) |
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % (IC al 95%*) |
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % (IC al 95%*) |
|
|
B |
63 |
51 |
80,95 (88,63) |
63 |
63 |
100,00 (100,00) |
63 |
63 |
100,00 (100,00) |
|
C |
63 |
45 |
71,43 (80,65) |
63 |
62 |
98,41 (99,92) |
62 |
62 |
100,00 (100,00) |
|
D |
61 |
49 |
80,33 (88,63) |
63 |
63 |
100,00 (100,00) |
62 |
61 |
98,39 (99,92) |
|
E |
63 |
51 |
80,95 (88,63) |
63 |
63 |
100,00 (100,00) |
63 |
63 |
100,00 (100,00) |
|
F |
63 |
54 |
85,71 (92,34) |
63 |
63 |
100,00 (100,00) |
63 |
63 |
100,00 (100,00) |
|
G |
63 |
46 |
73,02 (82,02) |
63 |
63 |
100,00 (100,00) |
63 |
63 |
100,00 (100,00) |
|
H |
63 |
33 |
52,38 (63,26) |
63 |
59 |
93,65 (97,80) |
63 |
59 |
93,65 (97,80) |
|
Mutación precore |
63 |
54 |
85,71 (92,34) |
63 |
62 |
98,41 (99,92) |
63 |
63 |
100,00 (100,00) |
* Intervalo de confianza unilateral superior del 95%
Tabla 24. Verificación del límite de detección para los genotipos de ADN del HBV en suero (200 μL)
|
Genotipo |
6,25 UI/mL |
12,50 UI/mL |
18,75 UI/mL |
||||||
|---|---|---|---|---|---|---|---|---|---|
|
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % (IC al 95%*) |
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % (IC al 95%*) |
Número de réplicas válidas |
Número de positivos |
Tasa de posit. en % (IC al 95%*) |
|
|
B |
63 |
51 |
80,95 (88,63) |
63 |
62 |
98,41 (99,92) |
63 |
63 |
100,00 (100,00) |
|
C |
63 |
54 |
85,71 (92,34) |
63 |
62 |
98,41 (99,92) |
63 |
63 |
100,00 (100,00) |
|
D |
63 |
53 |
84,13 (91,13) |
63 |
62 |
98,41 (99,92) |
63 |
63 |
100,00 (100,00) |
|
E |
63 |
54 |
85,71 (92,34) |
62 |
62 |
100,00 (100,00) |
63 |
63 |
100,00 (100,00) |
|
F |
63 |
59 |
93,65 (97,80) |
63 |
63 |
100,00 (100,00) |
62 |
62 |
100,00 (100,00) |
|
G |
63 |
59 |
93,65 (97,80) |
62 |
62 |
100,00 (100,00) |
63 |
63 |
100,00 (100,00) |
|
H |
63 |
47 |
74,60 (83,37) |
63 |
61 |
96,83 (99,43) |
63 |
62 |
98,41 (99,92) |
|
Mutación precore |
63 |
60 |
95,24 (98,66) |
63 |
62 |
98,41 (99,92) |
63 |
63 |
100,00 (100,00) |
* Intervalo de confianza unilateral superior del 95%
Linealidad para los genotipos B-H y la mutación precore predominante: La serie de diluciones utilizada para la verificación del estudio de linealidad de los genotipos de la prueba COBAS® HBV consta de un panel de 10 miembros que cubre el intervalo lineal esperado. Los miembros del panel con título alto se prepararon a partir de un stock de ADN plasmídico de título elevado, mientras que los miembros del panel con título más bajo se prepararon a partir de una muestra clínica de título elevado. El panel de linealidad se diseñó para que existiera una superposición de títulos aproximada de 2 log10 entre los dos materiales de origen. El intervalo lineal de la prueba COBAS® HBV abarca desde el LLoQ (10 UI/mL para un volumen de procesamiento de muestras de 500 μL, 25 UI/mL para un volumen de procesamiento de muestras de 200 μL) hasta el ULoQ (1,00E+09 UI/mL) e incluía al menos un punto de decisión médica. Se analizaron 21 réplicas con los tres lotes de reactivo de la prueba COBAS® HBV con cada nivel de suero y plasma conservado en EDTA.
Se verificó la linealidad del intervalo lineal de la prueba COBAS® HBV para los siete genotipos (B, C, D, E, F, G, H) y la mutación precore predominante (G1896A; C1858T). La desviación máxima entre la regresión lineal y el mejor ajuste de la regresión no lineal fue igual o menor que ±0,2 log10.
Especificidad: La especificidad de la prueba COBAS® HBV se determinó mediante el análisis de muestras de suero y plasma conservado en EDTA negativas para el HBV obtenidas de donantes individuales. Se analizaron 300 muestras individuales de plasma conservado en EDTA y 300 muestras individuales de suero (600 resultados totales) con dos lotes de reactivos de la prueba COBAS® HBV. Todas las muestras dieron negativo para ADN del HBV. En el panel de la prueba, la especificidad de la prueba COBAS® HBV fue del 100% (límite de confianza unilateral del 95-99,5%).
Especificidad analítica: La especificidad analítica de la prueba COBAS® HBV se evaluó mediante la dilución de un panel de microorganismos en plasma conservado en EDTA positivo para ADN del HBV y negativo para ADN del HBV. Los microorganismos se añadieron al plasma humano conservado en EDTA negativo al virus y se analizaron con y sin ADN del HBV. Ninguno de los patógenos distintos del HBV interfirió en el rendimiento de la prueba. La prueba COBAS® HBV generó resultados negativos para todas las muestras de microorganismos sin diana del HBV y resultados positivos para todas las muestras de microorganismos con diana del HBV. Además, el título log10 medio de cada una de las muestras positivas para el HBV con organismos de posible reacción cruzada se situó en ±0,3 log10 del título log10 medio del control positivo respectivo añadido.
Tabla 25. Microorganismos analizados para reactividad cruzada
|
Virus |
Bacterias |
Levadura |
|
|---|---|---|---|
|
Adenovirus tipo 5 |
Virus del Nilo Occidental |
Propionibacterium acnes |
Candida albicans |
|
Citomegalovirus |
Virus de la encefalitis de St. Louis |
Staphylococcus aureus |
- |
|
Virus de la hepatitis A |
Virus del dengue tipos 1, 2, 3 y 4 |
- |
- |
|
Virus de la hepatitis C |
Virus FSME (cepa HYPR) |
- |
- |
|
Virus de la hepatitis D |
Virus de la fiebre amarilla |
- |
- |
|
Virus de inmunodeficiencia humana 1 |
Virus del papiloma humano |
- |
- |
|
Virus linfotrópico de células T humanas tipos 1 y 2 |
Virus de la varicela zóster |
- |
- |
|
Virus del herpes humano tipo 6 |
Influenza A |
- |
- |
|
Virus del herpes simple tipos 1 y 2 |
Virus Zika |
- |
- |
Especificidad analítica: sustancias interferentes: Se analizaron niveles elevados de triglicéridos (34,5 g/L), bilirrubina conjugada (0,25 g/L), bilirrubina no conjugada (0,25 g/L), albúmina (58,7 g/L), hemoglobina (2,9 g/L) y ADN humano (2 mg/L) en muestras en presencia y ausencia de ADN del HBV. El análisis de las sustancias interferentes endógenas demostró que no interferían con el rendimiento de la prueba COBAS® HBV.
Asimismo, se analizó la presencia de enfermedades autoinmunes como lupus eritematoso sistémico (LES), artritis reumatoide (AR) y anticuerpos antinucleares (ANA).
También se analizaron los compuestos farmacológicos de la Tabla 26 con una concentración 3 veces superior a la Cmáx, tanto en presencia como en ausencia de ADN del HBV.
Se ha demostrado que ninguna de las posibles sustancias interferentes afecta al rendimiento de la prueba. La prueba COBAS® HBV generó resultados negativos para todas las muestras sin diana del HBV y resultados positivos para todas las muestras con diana del HBV. Además, el título log10 medio de cada una de las muestras positivas para el HBV con sustancias potencialmente interferentes se situó en ±0,5 log10 del título log10 medio del control positivo respectivo añadido.
Tabla 26. Compuestos farmacológicos analizados para la interferencia con la cuantificación de ADN de HBV mediante la prueba COBAS® HBV
|
Clase de fármaco |
Nombre genérico del fármaco |
|
|
Moduladores del sistema inmunológico |
Peginterferón α-2a |
Peginterferón α-2b |
|
Ribavirina |
- |
|
|
Inhibidor de la entrada del HIV |
Maraviroc |
|
|
Inhibidor de la integrasa del HIV |
Elvitegravir/cobicistat |
Raltegravir |
|
Inhibidor de la transcriptasa inversa no nucleósido del HIV |
Efavirenz |
Nevirapina |
|
Etravirina |
Rilpivirina |
|
|
Inhibidor de la proteasa del HIV |
Atazanavir |
Lopinavir |
|
Tipranavir |
Nelfinavir |
|
|
Darunavir |
Ritonavir |
|
|
Fosamprenavir |
Saquinavir |
|
|
Inhibidor de la proteasa del HCV |
Boceprevir |
Telaprevir |
|
Simeprevir |
- |
|
|
Inhibidor de la transcriptasa inversa o de la polimerasa de ADN |
Abacavir |
Tenofovir |
|
Emtricitabina |
Adefovir dipivoxil |
|
|
Entecavir |
Telbivudina |
|
|
Foscarnet |
Zidovudina |
|
|
Cidofovir |
Aciclovir |
|
|
Lamivudina |
Valganciclovir |
|
|
Ganciclovir |
Sofosbuvir |
|
|
Compuestos para el tratamiento de infecciones oportunistas |
Azitromicina |
Pirazinamida |
|
Claritromicina |
Rifabutina |
|
|
Etambutol |
Rifampicina |
|
|
Fluconazol |
Sulfametoxazol |
|
|
Isoniazida |
Trimetoprima |
|
Correlación de métodos:
Evaluación del rendimiento de la prueba COBAS® HBV en comparación con la prueba cobas® AmpliPrep/cobas® TaqMan® HBV, v2.0: El rendimiento de la prueba COBAS® HBV y la prueba cobas® AmpliPrep/cobas® TaqMan® HBV, v2.0 (prueba TaqMan® HBV, v2.0) se comparó mediante el análisis de muestras de suero y plasma conservado en EDTA de pacientes infectados por el HBV. Un total de 103 muestras de plasma conservado en EDTA y 85 muestras de suero de todos los genotipos del HBV, analizadas por duplicado, resultaron válidas y se encontraban dentro del intervalo de cuantificación de ambas pruebas. Se realizó el análisis de la regresión de Deming. La desviación del título medio de las muestras analizadas con las dos pruebas fue de -0,03 log10.
Los resultados de la regresión de Deming se muestran en la Ilustración 8.

Ilustración 8. Comparación del análisis de regresión entre las pruebas COBAS® HBV y TaqMan® HBV, v2.0 en muestras de suero y plasma conservado en EDTA
Equivalencia de matrices: plasma conservado en EDTA frente a suero: Se analizaron 50 muestras de plasma conservado en EDTA y suero emparejadas para determinar la equivalencia de matrices. Las muestras positivas para el HBV cubrían la mayoría de los genotipos con unos títulos comprendidos en todo el intervalo lineal.
La equivalencia de matrices en las muestras analizadas presenta una desviación de título medio de 0,05 log10 (Ilustración 9).

Ilustración 9. Rendimiento de la equivalencia de matrices entre muestras de plasma conservado en EDTA y suero
Fallo de todo el sistema: La tasa de fallo de todo el sistema para la prueba COBAS® HBV se determinó mediante el análisis de 100 réplicas de plasma conservado en EDTA y 100 réplicas de suero a las que se añadió HBV, lo que supone un total de 200 réplicas. Estas muestras se analizaron con una concentración de la diana de aproximadamente 3 × LoD. El estudio se realizó mediante el cobas® 6800 System.
Los resultados del estudio indican que todas las réplicas fueron reactivas para cada diana, lo que representa una tasa de fallo de todo el sistema del 0%. El intervalo de confianza bilateral exacto del 95% fue del 0% para el límite inferior y del 3,62% para el límite superior para cada matriz (0%: 3,62%).
Contaminación por arrastre: La tasa de contaminación por arrastre de la prueba COBAS® HBV se determinó mediante el análisis de 240 réplicas de una muestra de plasma humano normal conservado en EDTA negativa al virus (HIV, HCV y HBV) y de 225 réplicas de una muestra de HBV con un título alto de 1,00E+09 UI/mL. En total, se realizaron cinco series con muestras positivas y negativas utilizando un método de ensayo con configuración de tablero de ajedrez.
Las 240 réplicas de la muestra negativa resultaron no reactivas, por lo que la tasa de contaminación cruzada es del 0%. El intervalo de confianza bilateral exacto del 95% fue del 0% para el límite inferior y del 1,53% para el límite superior (0%: 1,53%).
USO PREVISTO:
COBAS® HBV es una prueba de amplificación de ácidos nucleicos in vitro para la cuantificación del ADN del virus de la hepatitis B (HBV) en plasma humano conservado en EDTA o suero de pacientes infectados con el HBV.
Esta prueba está diseñada para su uso como ayuda en la gestión de los pacientes con una infección crónica por HBV sometidos a una terapia antivírica. La prueba puede utilizarse para cuantificar los niveles de ADN del HBV iniciales y durante el tratamiento para valorar la respuesta al tratamiento. Los resultados de la prueba COBAS® HBV deben interpretarse en el contexto de todos los resultados clínicos y de laboratorio relevantes.
INSTRUCCIONES DE USO:
Notas sobre el procedimiento:
• No utilice los reactivos de la prueba COBAS® HBV, el COBAS® HBV/HCV/HIV-1 Control Kit, el cobas® NHP Negative Control Kit ni los reactivos cobas omni después de la fecha de caducidad.
• No reutilice el material fungible. Son de un solo uso.
• Consulte la Asistencia al usuario o la Guía del usuario del cobas® 5800 System o los cobas® 6800/8800 Systems para obtener información sobre el correcto mantenimiento de los instrumentos.
Ejecución de la prueba COBAS® HBV en el cobas® 5800 System: La prueba COBAS® HBV puede ejecutarse con los volúmenes de muestra obligatorios: 350 μL (para el flujo de trabajo de muestras de 200 μL) y 650 μL (para el flujo de trabajo de muestras de 500 μL). El procedimiento de la prueba se describe con detalle en la Asistencia al usuario o la Guía del usuario del cobas® 5800 System. La Ilustración 2 siguiente resume el procedimiento.
Ilustración 2. Procedimiento de la prueba COBAS® HBV en el cobas® 5800 System
|
1 |
Inicie una sesión en el sistema |
|
2 |
Cargue las muestras en el sistema: • Cargue los racks de muestras en el sistema • El sistema se prepara automáticamente • Solicite las pruebas |
|
3 |
Cargue los reactivos y el material fungible según las indicaciones del sistema: • Cargue el casete de reactivo específico de la prueba • Cargue los mini racks de control • Cargue las puntas de procesamiento • Cargue las puntas de elución • Cargue las placas de procesamiento • Cargue las placas de residuos líquidos • Cargue las placas de amplificación • Cargue el casete de MGP • Cargue el diluyente de muestras • Cargue el reactivo de lisis • Cargue el reactivo de lavado |
|
4 |
Seleccione el botón de inicio de procesamiento en la interfaz de usuario para iniciar la serie analítica. Las series siguientes se iniciarán de forma automática si no se posponen manualmente |
|
5 |
Revise y exporte los resultados |
|
6 |
Retire y tape todos los tubos de muestra que cumplan los requisitos de volumen mínimo para utilizarlos en el futuro, en caso necesario. Limpieza del instrumento: • Descargue los mini racks de control vacíos • Descargue el casete de reactivo específico de la prueba vacío • Vacíe el cajón de placas de amplificación • Vacíe los residuos líquidos • Vacíe los residuos sólidos |
Ejecución de la prueba COBAS® HBV en los cobas® 6800/8800 systems: La prueba COBAS® HBV puede ejecutarse con dos volúmenes de muestra mínimos obligatorios: 350 μL (para el flujo de trabajo de muestras de 200 μL) y 650 μL (para el flujo de trabajo de muestras de 500 μL). El procedimiento de la prueba se describe con detalle en la Asistencia al usuario o la Guía del usuario de los cobas® 6800/8800 Systems. La Ilustración 3 siguiente resume el procedimiento.
Ilustración 3. Procedimiento de la prueba COBAS® HBV en los cobas® 6800/8800 Systems
|
1 |
Inicie una sesión en el sistema Pulse el botón “Iniciar” para preparar el sistema Solicite las pruebas |
|
2 |
Cargue los reactivos y el material fungible según las indicaciones del sistema: • Cargue el casete de reactivo específico de la prueba • Cargue los casetes de control • Cargue las puntas de pipeta • Cargue las placas de procesamiento • Cargue el reactivo MGP • Cargue las placas de amplificación • Cargue el diluyente de muestras • Cargue el reactivo de lisis • Cargue el reactivo de lavado |
|
3 |
Cargue las muestras en el sistema: • Cargue los racks de muestras y los racks para puntas obstruidas en el módulo de suministro de muestras • Confirme que las muestras han sido aceptadas en el módulo de transferencia |
|
4 |
Inicie la serie analítica mediante el botón “Iniciar manualmente” de la interfaz de usuario o ejecute un inicio automático después de 120 minutos o cuando la serie esté llena |
|
5 |
Revise y exporte los resultados |
|
6 |
Retire y tape todos los tubos de muestra que cumplan los requisitos de volumen mínimo para utilizarlos en el futuro, en caso necesario. Limpieza del instrumento: • Descargue los casetes de control vacíos • Vacíe el cajón de placas de amplificación • Vacíe los residuos líquidos • Vacíe los residuos sólidos |
INFORMACIÓN ADICIONAL:
Características principales de la prueba
|
Tipo de muestra |
Plasma conservado en EDTA, suero |
||
|---|---|---|---|
|
Cantidad mínima de muestra necesaria |
650 μL o 350 μL |
||
|
Volumen de procesamiento de muestras |
500 μL o 200 μL |
||
|
Sensibilidad analítica |
500 μL |
200 μL |
|
|
Plasma conservado en EDTA |
2,7 UI/mL |
15,5 UI/mL |
|
|
Suero |
2,4 UI/mL |
12,5 UI/mL |
|
|
Intervalo lineal |
500 μL 10 UI/mL-1,0E+09 UI/mL |
||
|
200 μL: 25 UI/mL-1,0E+09 UI/mL |
|||
|
Especificidad |
100 % (intervalo de confianza unilateral del 95%: 99,5%) |
||
|
Genotipos detectados |
Genotipos A-H del HBV y mutación precore predominante |
||
Símbolos:
Los símbolos siguientes se emplean en el rotulado de todos los productos de diagnóstico por PCR de Roche.
Tabla 37. Símbolos utilizados en las etiquetas de los productos de PCR para diagnóstico de Roche

Bibliografía:
1. Custer B, Sullivan SD, Hazlet TK, et al. Global epidemiology of hepatitis B virus. J Clin Gastroenterol. 2004;38:S158-68. PMID: 15602165.
2. Weinbaum CM, Williams I, Mast EE, et al. Recommendations for identification and public health management of persons with chronic hepatitis B virus infection. MMWR Recomm Rep. 2008;57:1-20. PMID: 18802412.
3. Hu KQ. Hepatitis B virus (HBV) infection in Asian and Pacific Islander Americans (APIAs): how can we do better for this special population? Am J Gastroenterol. 2008;103:1824-33. PMID: 18479498.
4. Dienstag JL. Hepatitis B virus infection. N Engl J Med. 2008;359:1486-500. PMID: 18832247.
5. Liaw YF. Natural history of chronic hepatitis B virus infection and long-term outcome under treatment. Liver Int. 2009;29 Suppl 1:100-7. PMID: 19207972.
6. Fattovich G, Bortolotti F, Donato F. Natural history of chronic hepatitis B: special emphasis on disease progression and prognostic factors. J Hepatol. 2008;48:335-52. PMID: 18096267.
7. But DY, Lai CL, Yuen MF. Natural history of hepatitis-related hepatocellular carcinoma. World J Gastroenterol. 2008;14:1652-6. PMID: 18350595.
8. Kao JH. Diagnosis of hepatitis B virus infection through serological and virological markers. Expert Rev Gastroenterol Hepatol. 2008;2:553-62. PMID: 19072403.
9. Yuen MF, Wong DK, Fung J, et al. HBsAg Seroclearance in chronic hepatitis B in Asian patients: replicative level and risk of hepatocellular carcinoma. Gastroenterology. 2008;135:1192-9. PMID: 18722377.
10. Tong MJ, Hsien C, Song JJ, et al. Factors associated with progression to hepatocellular carcinoma and to death from liver complications in patients with HBsAg-positive cirrhosis. Dig Dis Sci. 2009;54:1337-46. PMID: 19242792.
11. Sorrell MF, Belongia EA, Costa J, et al. National Institutes of Health Consensus Development Conference Statement: management of hepatitis B. Ann Intern Med. 2009;150:104-10. PMID: 19124811.
12. Higuchi R, Dollinger G, Walsh PS, Griffith R. Simultaneous amplification and detection of specific DNA sequences. Biotechnology (N Y). 1992;10:413-7. PMID: 1368485.
13. Heid CA, Stevens J, Livak KJ, Williams PM. Real time quantitative PCR. Genome Res. 1996;6:986-94. PMID: 8908518.
14. Longo MC, Berninger MS, Hartley JL. Use of uracil DNA glycosylase to control carry-over contamination in polymerase chain reactions. Gene. 1990;93:125-8. PMID: 2227421.
15. Pawlotsky JM, Dusheiko G, Hatzakis A, et al. Virologic monitoring of hepatitis B virus therapy in clinical trials and practice: recommendations for a standardized approach. Gastroenterology. 2008;134:405-15. PMID: 18242209.
16. Saldanha J, Gerlich W, Lelie N, et al. An international collaborative study to establish a World Health Organization international standard for hepatitis B virus DNA nucleic acid amplification techniques. Vox Sang. 2001;80:63-71. PMID: 11339072.
17. Savva R, McAuley-Hecht K, Brown T, Pearl L. The structural basis of specific base-excision repair by uracil-DNA glycosylase. Nature. 1995;373:487-93. PMID: 7845459.
18. Mol CD, Arvai AS, Slupphaug G, et al. Crystal structure and mutational analysis of human uracil-DNA glycosylase: structural basis for specificity and catalysis. Cell. 1995;80:869-78. PMID: 7697717.
19. Centers for Disease Control and Prevention. Biosafety in Microbiological and Biomedical Laboratories, 5th ed. https://www.cdc.gov/labs/pdf/CDC-BiosafetyMicrobiologicalBiomedicalLaboratories-2009-P.PDF. Accessed December 2, 2020.
20.Clinical and Laboratory Standards Institute. Protection of laboratory workers from occupationally acquired infections. Approved Guideline-Fourth Edition. https://clsi.org/media/1459/m29a4_sample.pdf. Accessed December 2, 2020.
21. Lok AS, Trinh H, Carosi G, et al. Efficacy of entecavir with or without tenofovir disoproxil fumarate for nucleos(t)ide-naïve patients with chronic hepatitis B. Gastroenterology. 2012;143:619-28.e1. PMID: 22643350
Asistencia técnica:
Para obtener asistencia técnica, póngase en contacto con su filial local: https://www.roche.com/about/business/roche_worldwide.htm
Fabricante e importador
Tabla 38. Fabricante e importador
ROCHE MOLECULAR SYSTEMS, INC.
1080 US Highway 202 South
Branchburg, NJ 08876 USA
Fabricado en los EE. UU.
Roche Diagnostics GmbH
Sandhofer Strasse 116
68305 Mannheim, Germany
Marcas registradas y patentes
Consulte https://diagnostics.roche.com/us/en/about-us/patents
Copyright
©2022 Roche Molecular Systems, Inc.
COBAS® HBV: P/N: 09040820190
Para uso en el sistema cobas® 5800
cobas® HBV/HCV/HIV-1 Control Kit: P/N: 09040773190
cobas® NHP Negative Control Kit: P/N: 09051554190
Para uso en sistemas cobas® 6800/8800
cobas® HBV/HCV/HIV-1 Control Kit:
P/N: 06997767190 o P/N: 09040773190
cobas® NHP Negative Control Kit
P/N: 07002220190 o P/N: 09051554190
RESUMEN Y EXPLICACIÓN DE LA PRUEBA:
Información de referencia: El HBV (virus de la hepatitis B) es uno de los virus causantes de la hepatitis vírica. Más de dos mil millones de personas en todo el mundo han sido infectadas por el HBV y más de 350 millones de estas son portadoras infectadas de forma crónica.1 El HBV es una de las principales causas de enfermedades del hígado en los Estados Unidos (EE. UU.), a pesar del descenso en la incidencia de infecciones agudas asociadas con la vacunación y de las precauciones universales en el uso de jeringas.2 Se estima que la prevalencia global de la infección por HBV en los Estados Unidos oscila entre el 0,3 y el 0,5%, y se calcula que entre un 47 y un 70% de los casos son atribuibles a personas nacidas fuera de los EE. UU.2 Sin embargo, los programas de cribado orientados han demostrado tasas de prevalencia superiores al 15% en determinadas poblaciones de inmigrantes de alto riesgo.3 Los pacientes con infección crónica por HBV presentan un alto riesgo de padecer complicaciones a largo plazo como consecuencia de la infección, incluyendo hepatitis crónica, cirrosis y carcinoma hepatocelular.4-7 Los marcadores serológicos se utilizan normalmente como indicadores diagnósticos o de prognosis de la infección aguda o crónica por el HBV.8 Los centros para el control y la prevención de enfermedades de EE. UU. han ampliado las recomendaciones de cribado rutinario de sujetos de alto riesgo para incluir también poblaciones en las que la prevalencia del antígeno de superficie (HBsAg) del HBV supera el 2%, entre las que figuran personas de regiones endémicas del mundo (como Asia y África), hombres homosexuales y drogadictos que utilizan jeringuillas.2
El marcador más común de la infección por HBV es la presencia de HBsAg.8 A pesar de que los portadores pueden eliminar el HBsAg y desarrollar anticuerpos contra el HBsAg, persiste el riesgo de padecer complicaciones hepáticas importantes en etapas posteriores de la vida.9,10 El antígeno e de HB (HBeAg) se utiliza generalmente como marcador secundario para indicar que el HBV se está replicando activamente y se asocia con la hepatopatía progresiva. La imposibilidad de eliminar el HBeAg parece incrementar el riesgo de padecer hepatopatía terminal.9,10 Distintas cepas de mutaciones precore del HBV pueden perder la capacidad de producir HBeAg incluso en presencia de una infección activa, lo que limita el uso de este marcador para el control de la progresión de la enfermedad.7
Motivos para el uso de la prueba de HBV: El ADN de HBV en suero y plasma conservado en EDTA puede cuantificarse mediante técnicas de amplificación de ácidos nucleicos como la PCR.11-14 Son varias las directrices básicas que recomiendan el uso de la metodología de la PCR a tiempo real para la cuantificación del ADN de HBV, principalmente debido a una mayor sensibilidad y un intervalo lineal más amplio.15, 16
Explicación de la prueba: COBAS® HBV es una prueba cuantitativa realizada en el cobas® 5800 System, el cobas® 6800 System y el cobas® 8800 System. La prueba COBAS® HBV permite detectar y cuantificar el ADN de HBV en suero o plasma conservado en EDTA de pacientes infectados en laboratorios que realizan ensayos clínicos y en la práctica clínica habitual para el tratamiento de pacientes con HBV. La detección y la cuantificación se realizan mediante una única sonda que no discrimina entre los genotipos A-H. La carga viral se cuantifica mediante un estándar de cuantificación de ADN distinto del HBV (DNA-QS) y que se añade a cada una de las muestras durante el proceso de preparación de las muestras. El DNA-QS también permite monitorizar todo el proceso de preparación de las muestras y amplificación mediante PCR. Además, la prueba utiliza tres controles externos: uno positivo de título alto, uno positivo de título bajo y uno negativo. Los controles externos positivo alto y positivo bajo se fabrican mediante dilución a partir de material en stock con un título rastreable al estándar internacional de la ONU para el HBV. Cada lote de kits de amplificación/detección presenta una calibración rastreableal estándar internacional de la ONU para el HBV.
Principios del procedimiento: La prueba COBAS® HBV se basa en la preparación de muestras totalmente automática (extracción y purificación de ácidos nucleicos) seguida de un proceso de amplificación y detección mediante PCR. El cobas® 5800 System se ha diseñado como un único instrumento integrado. Los cobas® 6800/8800 Systems constan del módulo de suministro de muestras, el módulo de transferencia, el módulo de procesamiento y el módulo analítico. La gestión de datos automática se realiza mediante el software cobas® 5800 o cobas® 6800/8800 Systems, que asigna los resultados del análisis a todas las pruebas como diana no detectada, < LLoQ (límite de cuantificación inferior), > ULoQ (límite de cuantificación superior) o ADN de HBV detectado, un valor del intervalo lineal LLoQ < x < ULoQ. Los resultados pueden revisarse directamente en la pantalla del sistema, exportarse o imprimirse como informe.
La extracción de ácidos nucleicos de las muestras de paciente, controles externos y moléculas de ADN de lambda añadido (DNA-QS) se realiza simultáneamente.
Los ácidos nucleicos víricos se liberan al añadir proteinasa y reactivo de lisis a la muestra. Los ácidos nucleicos liberados se unen a la superficie de sílice de las partículas de vidrio magnéticas añadidas. Las sustancias sin unir y las impurezas, como las proteínas desnaturalizadas, los restos celulares y potenciales inhibidores de la PCR se eliminan en los siguientes pasos con el reactivo de lavado, y los ácidos nucleicos purificados se eluyen de las partículas de vidrio magnéticas mediante el buffer de elución a temperatura elevada.
La amplificación selectiva de los ácidos nucleicos de la diana de la muestra se lleva a cabo mediante cebadores que van en un sentido y en sentido contrario específicos del virus para la diana que se seleccionan de regiones altamente conservadas del HBV. La amplificación selectiva de DNA-QS se realiza mediante cebadores que van en un sentido y en sentido contrario específicos de la secuencia que se seleccionan de modo que no presenten homología alguna con el genoma del HBV. Para el proceso de amplificación se utiliza una enzima ADN polimerasa termoestable. El reactivo de Master Mix incluye trifosfato de deoxiuridina (dUTP), en lugar de trifosfato desoxitimidina (dTTP), que se incorpora al ADN recién sintetizado (amplicón).14,17,18 La enzima AmpErase, que se incluye en la mezcla para PCR durante la primera ciclación térmica, elimina los amplicones contaminados de los procesos de PCR anteriores. Sin embargo, los amplicones nuevos no se eliminan porque la enzima AmpErase se inactiva cuando se expone a temperaturas superiores a los 55 °C.
El reactivo de Master Mix de COBAS® HBV contiene sondas de detección específicas para las secuencias de la diana de HBV y los ácidos nucleicos del QS, respectivamente. Cada una de estas sondas de detección específicas para HBV y DNA-QS se marca con uno de los dos marcadores fluorescentes que actúan como emisor. Además, cada sonda dispone de un segundo marcador que actúa como silenciador. Los dos marcadores emisores se miden en longitudes de onda definidas, lo que permite detectar y discriminar simultáneamente la diana amplificada de HBV y el DNA-QS.12,13 Cuando no se une a la secuencia de la diana, la señal fluorescente de la sonda intacta se elimina mediante el marcador silenciador. Durante el paso de amplificación mediante PCR, la hibridación de las sondas con la plantilla específica de ADN monocatenario provoca la escisión de la sonda por la actividad de la exonucleasa 5’ a 3’ de la ADN polimerasa, lo que produce la separación de los marcadores emisor, silenciador y la emisión de una señal fluorescente. Con cada ciclo de PCR, se generan cantidades crecientes de sondas escindidas y la señal acumulada del marcador emisor aumenta concomitante- mente. Como los dos marcadores emisores específicos se miden en longitudes de onda definidas, es posible detectar y discriminar simultáneamente la diana amplificada del HBV y el DNA-QS.