
CINTEC PLUS CYTOLOGY KIT
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
INTERPRETACIÓN DE LAS TINCIONES Y RESULTADOS PREVISTOS:
La tinción con CINTEC PLUS CYTOLOGY KIT da lugar a dos productos de reacción con colores diferentes: un precipitado de color marrón en los sitios del antígeno p16INK4a y un precipitado de color rojo en los sitios del antígeno Ki-67. La tinción de color marrón de las células (citoplasma y/o núcleo) indica una sobreexpresión de p16INK4a. La tinción de color rojo de las células (en los núcleos) indica la presencia de la expresión de Ki-67. Las células que se tiñen con ambos antígenos presentan una tinción citoplasmática marrón con núcleos, por lo general, de color rojo intenso. Antes de interpretar los resultados, un anatomopatólogo o un auxiliar de laboratorio de citología cualificados, con experiencia en procedimientos de inmunocitoquímica y formados en la interpretación de los portaobjetos teñidos con CINTEC PLUS CYTOLOGY KIT, deben evaluar los controles correspondientes.
La interpretación de los resultados de las pruebas solo puede llevarla a cabo un profesional certificado en conjunto con el historial clínico del paciente y las pruebas diagnósticas adicionales que se hayan realizado.
Para llevar a cabo la interpretación de los portaobjetos de citología de cuello de útero teñidos con CINTEC PLUS CYTOLOGY KIT, los portaobjetos se deben evaluar en relación con la presencia de ambas tinciones en las células epiteliales del cuello de útero, la marrón citoplasmática y la roja nuclear, que indican la expresión simultánea de p16INK4a y Ki-67. Además, al igual que ocurre al informar de los resultados de la citología de cuello uterino (prueba de Papanicolau), las muestras deben evaluarse para la idoneidad de las muestras de acuerdo con las Bethesda Guidelines 2015 (o TBS)28 si se trata de resultados de pruebas con el CINTEC PLUS CYTOLOGY KIT.
Resultados positivos: La presencia de una o varias células epiteliales del cuello del útero que contenga tanto la inmunotinción citoplasmática específica marrón como la inmunotinción nuclear específica roja dentro de la misma célula considera que el resultado de la prueba de CINTEC PLUS CYTOLOGY KIT es positivo, independientemente de sus características citomorfológicas.
Resultados negativos: Si no existen células epiteliales del cuello de útero que presenten inmunotinción citoplasmática marrón e inmunotinción nuclear roja de forma simultánea, se considera que el resultado de la prueba de CINTEC PLUS CYTOLOGY KIT es negativo.
La presencia de células epiteliales del cuello de útero que muestran inmunorreactividad solo para uno en lugar de para los dos marcadores (por ejemplo, la tinción marrón solo para p16INK4a o la tinción roja solo para Ki-67) no se considera un resultado positivo a la prueba con el CINTEC PLUS CYTOLOGY KIT.
RESOLUCIÓN DE PROBLEMAS:
1. Si el dispensador del reactivo no dispensa el líquido, compruebe la cámara de cebado o el menisco por si hubiera restos de materiales extraños o partículas, como fibras o precipitados. Si se ha bloqueado el dispensador, no lo utilice y póngase en contacto con el representante local de asistencia técnica de Roche. En caso contrario, vuelva a cebar el dispensador colocándolo sobre el recipiente de residuos, retirando el tapón de la boquilla y presionando hacia abajo la parte superior del dispensador.
2. Es posible que se observe, en ocasiones, una cristalización que se origina en el dispensador de CINtec PLUS Red Naphthol Phosphate. Las investigaciones han demostrado que los cristales no producen interferencias durante la interpretación de los resultados. Si se observan cristales en los portaobjetos, limpie la punta de la boquilla y cebe el dispensador para garantizar que se elimina cualquier resto de la cristalización. Si el cristal no desaparece, deje de usar el dispositivo y póngase en contacto con el representante local de asistencia técnica de Roche para que remplace el dispensador.
3. Si el control positivo presenta una tinción más débil de lo previsto, compruebe que el protocolo que ha seleccionado corresponde con el tipo de muestra específico; por ejemplo, en las preparaciones de citología SurePath es necesario aplicar un periodo de acondicionamiento celular más prolongado que en las preparaciones de portaobjetos ThinPrep o con frotis convencionales. Además, es necesario comprobar que no hay restos de partículas en los cilindros de los dispensadores.
4. Si el control positivo es negativo, debe asegurarse de que el portaobjetos lleva la etiqueta de código de barras correcta. Si el portaobjetos se ha etiquetado correctamente, es necesario comprobar que en los cilindros de los dispensadores no hay restos de partículas.
5. Si se observa una tinción elevada de fondo, reduzca los periodos de incubación en los protocolos de tinción. Además, compruebe que el fluido reaction buffer se ha formulado de forma correcta.
6. Si se observa una tinción débil, aumente los periodos de incubación en los protocolos de tinción. En el caso de los portaobjetos con frotis convencionales, también es posible ajustar el periodo de incubación del acondicionamiento celular.
7. El precipitado de color rojo que sirve para indicar la expresión de la proteína Ki-67 es soluble en alcohol. Si la tinción de Ki-67 es débil o no está presente, compruebe que no se ha utilizado hematoxilina con alcohol y que el procedimiento posterior al procesamiento recomendado se llevó a cabo según las instrucciones de la sección Procedimiento posterior al procesamiento: montaje y colocación de cubreobjetos.
8. Si la muestra se pierde en el portaobjetos, se deben revisar los portaobjetos para comprobar que la muestra se preparó correctamente y siguiendo las indicaciones de la sección de Preparación de muestras, y que se utilizó el tipo de portaobjetos para microscopio recomendado.
9. Si necesita llevar a cabo acciones correctivas, consulte la sección Procedimiento de tinción, el Manual del usuario del instrumento o póngase en contacto con su representante local de asistencia técnica de Roche.
10. Si se pierde un tapón de muestra RCCM o si se producen derrames del vial de muestra, se pueden pedir los tapones de repuesto (sueltos, bolsa de 250, ref. 08037230190, o caja de 8 bandejas de 48, ref. 06913512001).
ALMACENAMIENTO Y ESTABILIDAD:
Tras la recepción y cuando no se utilice, consérvese entre 2 y 8 °C. No lo congele. El usuario debe validar cualquier condición de almacenamiento que no se especifique en la hoja de datos. Este kit de detección se puede utilizar de inmediato tras extraerlo del refrigerador.
Para garantizar una dispensación adecuada del reactivo y su estabilidad, vuelva a poner el tapón del dispensador después de cada uso y almacene inmediatamente el dispensador en la nevera, en posición vertical.
Todos los kits de detección tienen una fecha de caducidad. Si se almacena correctamente, el producto se mantendrá estable hasta la fecha indicada en la etiqueta. No utilice el producto después de la fecha de caducidad del método de conservación prescrito. No existen indicios absolutamente precisos de la inestabilidad de este producto, por tanto, es necesario analizar simultáneamente un control positivo con las muestras desconocidas. Debe ponerse en contacto de inmediato con el representante local de asistencia técnica de Roche si observa el menor indicio de inestabilidad del reactivo.
ADVERTENCIAS Y PRECAUCIONES:
1. Para uso diagnóstico in vitro (IVD).
2. Solo para uso profesional.
3. No utilizar por encima del número especificado de ensayos.
4. No utilice el producto si el embalaje o cualquiera de sus componentes están dañados. Si detecta que el embalaje o los componentes han podido sufrir algún daño o no se encuentran intactos, notifíqueselo a su representante local de asistencia técnica de Roche de inmediato.
5. La solución ProClin 300 se utiliza como conservante en esta solución. Está clasificada como irritante y puede ocasionar sensibilización por contacto con la piel. Adopte precauciones razonables cuando la manipule. Evite el contacto de los reactivos con los ojos, la piel y las membranas mucosas. Utilice guantes y ropa de protección.
6. Los materiales de origen animal o humano deben manipularse como materiales potencialmente biopeligrosos y eliminarse con las precauciones adecuadas. En caso de exposición, deberán seguirse las directivas sanitarias de las autoridades responsables.26,27
7. Adopte las precauciones razonables cuando manipule los reactivos. Evite el contacto de los reactivos con los ojos, la piel y las membranas mucosas. Evite la inhalación de los reactivos. Utilice guantes y póngase el equipo de protección personal cuando vaya a manipular material tóxico y sustancias posiblemente carcinógenas.
8. Si los reactivos entran en contacto con zonas sensibles, lávelas con agua abundante.
9. Evite la contaminación microbiana de los reactivos, dado que podría dar lugar a resultados incorrectos.
10. Para obtener más información sobre el uso de este producto, consulte el Manual del usuario del instrumento BenchMark IHC/ISH y las instrucciones de uso de todos los componentes necesarios que puede encontrar en: navifyportal.roche.com.
11. Consultar a las autoridades locales y/o estatales sobre el método de eliminación recomendado.
12. Cuando se vayan a manipular muestras citológicas o a eliminarlas, incluidas todas las muestras antes y después de la fijación, así como todos los materiales que se encuentran expuestos a ellas, respete las precauciones de seguridad en materia de manipulación de material posiblemente infeccioso, así como los requisitos de eliminación de residuos aplicables.
13. El etiquetado de seguridad de los productos sigue principalmente las directrices del SGA de la UE. Está disponible bajo petición la hoja de datos de seguridad para los usuarios profesionales.
14. Para comunicar la sospecha de incidentes graves relacionados con este dispositivo, póngase en contacto con su representante local de servicio Roche y con las autoridades competentes del estado o país miembro de residencia del usuario.
Este kit de detección contiene componentes clasificados como sigue de acuerdo con la Normativa (CE) n.º 1272/2008:
Tabla 1. Información de riesgos
|
Riesgo |
Código |
Declaración |
|
PELIGRO |
H317 |
Puede provocar una reacción alérgica en la piel |
|
|
H350 |
Puede provocar cáncer |
|
H412 |
Perjudicial para los organismos acuáticos con efectos nocivos duraderos |
|
|
P201 |
Antes de utilizarlo, obtenga cualquier tipo de instrucción especial |
|
|
P261 |
Evite inhalar la niebla o los vapores |
|
|
P273 |
Evitar su emisión al medio ambiente |
|
|
P280 |
Lleve guantes y prendas de protección, así como protección auditiva y para el rostro |
|
|
P308 + P313 |
Si se sufre una exposición importante: consultar a un médico |
|
|
P333 + P 313 |
En caso de irritación o erupción cutánea: consultar a un médico. |
Este producto contiene CAS n.º:
• 868272-85-9: hidrato de tetrahidrocloruro de 3,3"-diaminobencidina.
• 2682-20-4: 2-metil-2H-isotiazol-3-ona.
• 55965-84-9, masa de reacción de: 5-cloro-2-metil-2H-isotiazol-3-ona y 2-metil-2H-isotiazol-3-ona (3:1).
MATERIAL SUMINISTRADO:
CINTEC PLUS CYTOLOGY KIT contiene reactivo suficiente para 100 pruebas:
Un dispensador de 10 mL: De CINtec PLUS Cytology Primary Antibody Cocktail (p16/Ki-67) contiene una combinación del clon del anticuerpo recombinante monoclonal de ratón E6H4 dirigido contra la proteína p16INK4a humana y del clon del anticuerpo primario recombinante de conejo 274-11AC3V1 dirigido contra la proteína Ki-67 humana (< 5 μg/mL) en un tampón con proteína y el conservante ProClin 300.
Un dispensador de 10 mL: De CINtec PLUS Cytology Red anti-Rabbit NP Linker contiene IgG de cabra anticonejo marcado con NP (< 10 μg/mL; NP es un hapteno patentado con unión covalente al anticuerpo de cabra) en un tampón con proteína y el conservante ProClin 300.
Un dispensador de 10 mL: De CINtec PLUS Cytology Red AP Multimer contiene un anticuerpo terciario monoclonal de ratón anti-NP marcado con AP (< 20 μg/mL) en un tampón con proteína y el conservante ProClin 300.
Un dispensador de 10 mL: De CINtec PLUS Cytology Red Naphthol Phosphate contiene naphthol phosphate (< 1%) y el conservante ProClin 300.
Un dispensador de 10 mL: De CINtec PLUS Cytology Fast Red contiene Fast Red (< 1%) en tampón acetato y el conservante ProClin 300.
Un dispensador de 10 mL: De CINtec PLUS Cytology DAB Peroxidase Inhibitor contiene una solución de peróxido de hidrógeno (< 5%).
Un dispensador de 10 mL: De CINtec PLUS Cytology DAB anti-Mouse HQ Linker contiene IgG de cabra antirratón marcado con HQ (< 40 μg/mL; HQ es un hapteno patentado con unión covalente al anticuerpo de cabra) en un tampón con proteína y el conservante ProClin 300.
Un dispensador de 10 mL: De CINtec PLUS Cytology DAB HRP Multimer contiene un anticuerpo terciario monoclonal de ratón anti-HRP marcado con HQ (< 10 μg/mL) en un tampón con proteína y el conservante ProClin 300.
Un dispensador de 10 mL: De CINtec PLUS Cytology DAB contiene tetrahidrocloruro de 3,3"-diaminobencidina (< 1%) en una solución estabilizadora patentada con un conservante también patentado.
Un dispensador de 10 mL: De CINtec PLUS Cytology DAB H2O2 contiene peróxido de hidrógeno (< 1%) en una solución de tampón fosfato.
MATERIALES NECESARIOS PERO NO SUMINISTRADOS:
No se suministran reactivos de tinción, como kits de detección VENTANA, ni componentes auxiliares, incluyendo portaobjetos de control de tejido negativos y positivos.
Puede que no todos los productos que aparecen en la hoja de datos estén disponibles en todos los lugares. Consulte al representante local de asistencia técnica de Roche.
No se suministran los reactivos y materiales siguientes en el kit de detección, pero son necesarios para la tinción:
1. Controles correspondientes (opcional: consulte la sección de Control de calidad).
2. Hematoxylin counterstain (n.º cat. 760-2021/05266726001).
3. Bluing reagent (n.º cat. 760-2037/05266769001).
4. Reaction Buffer Concentrate (10X) (n.º cat. 950-300/05353955001).
5. Cell Conditioning Solution (CC1) (n.º cat. 950-124/05279801001).
6. Cell Conditioning Solution (CC2) (n.º cat. 950-123/05279798001).
7. ULTRA Cell Conditioning Solution (ULTRA CC1) (n.º cat. 950-224/05424569001).
8. ULTRA Cell Conditioning Solution (ULTRA CC2) (n.º cat. 950-223/05424542001).
9. LCS (Predilute) (n.º cat. 650-010/05264839001).
10. ULTRA LCS (Predilute) (n.º cat. 650-210/05424534001).
11. Reagent Grade Ethanol desnaturalizado (pureza ≥ 95%).
12. Instrumento BenchMark IHC/ISH.
13. Se recomienda el uso de portaobjetos de microscopio Superfrost Plus (Thermo Fisher Scientific) en los frotis convencionales.
14. Portaobjetos para microscopio ThinPrep Arcless (Hologic, ref. 70126-002) o portaobjetos para microscopio Superfrost Plus (VWR, ref. 48311-703).
15. Roche Cell Collection Medium (ref. 07994753190).
16. PreservCyt® Solution (Hologic, ref. 234004).
17. Portaobjetos BD SurePath PreCoat (incluidos en el kit GYN SurePath).
18. SurePath™ Preservative Fluid (BD, ref. 490522).
19. Medio de montaje acuoso CC/Mount Roche (ref. 7342098001); Diagnostic BioSystems P/N: K 002; Sigma-Aldrich P/N: C9368.
20. Opcional: horno de secado capaz de mantener una temperatura de 60 °C ± 5 °C.
21. Equipo de laboratorio de uso general.
RECONSTITUCIÓN, MEZCLA, DILUCIÓN, TITULACIÓN:
El CINTEC PLUS CYTOLOGY KIT se ha optimizado para su uso con los instrumentos BenchMark IHC/ISH. No son necesarias la reconstitución, la mezcla, la dilución ni la titulación de los reactivos del kit.
Cualquier diferencia en la forma de llevar a cabo los procedimientos recomendados de fijación o de procesamiento de muestras de citología de cuello de útero puede dar lugar a una variabilidad significativa en los resultados, por lo que es necesario llevar a cabo controles internos de forma periódica.
Para obtener más información sobre los controles, consulte la sección sobre Control de calidad.
CONTROL DE CALIDAD:
Cualquier diferencia en la forma de llevar a cabo los procedimientos recomendados de fijación o de procesamiento de muestras de citología de cuello de útero puede dar lugar a variaciones significativas en los resultados. Cuando el producto no funciona correctamente debido a los problemas de manipulación o a la inestabilidad, no podrá observar indicios claros al respecto. Por lo tanto, los controles correspondientes y las muestras del paciente deben analizarse de forma simultánea.
Control positivo: Las muestras que se hayan procesado de la misma forma que las del paciente deberían utilizarse como controles positivos. Los controles positivos indican que las muestras se han preparado correctamente y que se han aplicado los métodos de tinción adecuados. Se debe incluir un control positivo en cada sesión de tinción.
Los controles positivos conocidos únicamente sirven para monitorizar el comportamiento correcto de los reactivos de la prueba y de las muestras procesadas, y no como ayuda para establecer un diagnóstico específico de las muestras del paciente. Si los controles positivos no muestran una tinción positiva adecuada, los resultados de las muestras de la prueba se deben considerar no válidos.
Control negativo: Como control negativo interno capaz de evaluar la tinción de fondo puede servir una variedad de distintos tipos de células presentes en muestras de citología de cuello de útero representativas que se sabe que son negativas a la expresión de los antígenos p16INK4a y Ki-67 (como las células superficiales).
Verificación del ensayo: Antes de comenzar a utilizar CINTEC PLUS CYTOLOGY KIT en procedimientos diagnósticos, el usuario debe comprobar el rendimiento del kit mediante muestras positivas o negativas con características de rendimiento conocidas.
CARACTERÍSTICAS DE RENDIMIENTO:
Rendimiento de análisis: Se ha evaluado el rendimiento de CINTEC PLUS CYTOLOGY KIT mediante estudios de reproducibilidad analítica y de otros tipos con similar importancia.
Sensibilidad y especificidad analíticas: La sensibilidad y especificidad analíticas de los anticuerpos primarios p16 y Ki-67 se pusieron a prueba mediante los ensayos de Western blotting y de inhibición con péptidos.
En los ensayos de Western blotting se utilizaron lisados de estirpes celulares que representaban una variedad de intensidades de la tinción. El anticuerpo anti-p16INK4a (E6H4) fue capaz de detectar una banda de, aproximadamente, entre 15 y 20 kD en la preparación de proteína p16INK4a recombinante purificada. Además, el anticuerpo se unió específicamente a la proteína p16INK4a recombinante purificada y no a la misma cantidad de proteína recombinante sin relación. El anticuerpo también demostró capacidad de unión a la proteína p16INK4a endógena cuya expresión estaba presente en los lisados a partir de estirpes celulares HeLa, SK Mel 28 y DU145, y no en la estirpe celular MDA MB 231, negativa a p16INK4a. Los niveles relativos de proteína p16INK4a detectados en lisados de las cuatro estirpes celulares mediante la técnica Western blotting se correspondían con los datos de tinción IHC, demostrando la sensibilidad de la detección del anticuerpo anti-p16INK4a (E6H4). La unión del clon anticuerpo Ki-67 (274-11AC3V1) se probó en un ensayo mediante la técnica Western blotting a partir de lisados de célula completa preparados a partir de una línea celular L428 (un linfoma de Hodgkin positivo en el antígeno Ki-67; DSMZ ATCC 197) y una línea celular LNCaP (una línea celular de carcinoma de próstata con una expresión baja de la proteína Ki-67; ATCC CRL-1740). El anticuerpo pudo detectar una proteína Ki-67 endógena en lisados celulares, incluso a niveles de expresión bajos, y la banda se correlacionó intensamente con la tinción IHC para Ki-67 en estas líneas celulares. El anticuerpo primario Ki-67 (274-11AC3V1) de CINTEC PLUS CYTOLOGY KIT se unió a un fragmento de la proteína recombinante Ki-67 purificado y la unión no se produjo en el caso de una cantidad equivalente de una proteína recombinante de control negativa no relacionada. En este ensayo no se detectó unión en la línea celular LNCaP con baja expresión de Ki-67. Los niveles relativos de la proteína Ki-67 detectados en los lisados de estas estirpes celulares mediante la técnica Western blotting coinciden con los datos de la tinción IHC y los datos de expresión de ARNm. Los resultados de la técnica Western blotting muestran que el anticuerpo primario Ki-67 que se utiliza en CINTEC PLUS CYTOLOGY KIT puede detectar la proteína endógena Ki-67 en lisados celulares y el fragmento de proteína recombinante Ki-67 en su forma purificada.
Los ensayos de inhibición de péptidos usaron soluciones con péptidos específicos de p16 o Ki-67. La combinación de anticuerpo primario se diluyó a un volumen 1:1 (una proporción de volumen con soluciones de péptido específico de p16 o Ki-67 de diferentes concentraciones para abarcar una variedad de relaciones molares: un exceso molar del péptido de aproximadamente 1, 10, 100, 1000 y 10000 veces en comparación con la concentración final del anticuerpo en la solución). La combinación del anticuerpo primario con un péptido específico de p16 se utilizó como control no específico para un anticuerpo anti-Ki-67 y un péptido ALK-a no relacionado se usó como control no específico para el anticuerpo anti-p16. Se tiñó un portaobjetos de cada muestra (tres muestras combinadas de citología de cuello de útero y una de células CaSki) con cada una de las soluciones. Los resultados del estudio indicaron que el anticuerpo anti-p16 se une de forma específica a la proteína p16 y que el anticuerpo anti-Ki-67 se une de forma específica a la proteína Ki-67. Tal y como estaba previsto, la intensidad de la tinción de p16 y Ki-67 se redujo en todas las muestras tras la tinción con soluciones que contenían los respectivos péptidos específicos a una concentración de 1 M, y alcanzando una total inhibición con soluciones que contenían concentraciones ≥ 10 M, mientras que no se observaba una reducción de la intensidad de la tinción de p16 tras la tinción con soluciones que contenían un péptido no específico o que no contenían péptido.
Repetibilidad y precisión intermedia: Se llevaron a cabo estudios de precisión de la tinción con CINTEC PLUS CYTOLOGY KIT de muestras ThinPrep de cuello de útero para demostrar lo siguiente:
• Precisión global: se calculó el porcentaje de resultados iguales a la decisión mayoritaria para cada uno de los 12 conjuntos de citologías de cuello de útero (3 conjuntos HSIL/VPH+, 1 LSIL/VPH+, 1 ASC-US/VPH+, 1 NILM/VPH+, 3 NILM/VPH- y LBC, y 3 conjuntos negativos en estirpe celular T24) teñidos con 3 lotes de CINTEC PLUS CYTOLOGY KIT en 5 días no consecutivos, con 2 portaobjetos replicados de cada conjunto y que evaluaron 3 equipos de lectores.
• Precisión entre días: se calculó el porcentaje de resultados iguales a la decisión mayoritaria para cada día (del día 1 al día 5), acumulando los datos de los 12 conjuntos de citologías de cuello de útero (3 conjuntos HSIL/VPH+, 1 LSIL/VPH+, 1 ASC-US/VPH+, 1 NILM/VPH+, 3 NILM/VPH- y LBC, y 3 conjuntos negativos en estirpe celular T24), 3 lotes de CINTEC PLUS CYTOLOGY KIT con 2 portaobjetos replicados de cada conjunto y 3 equipos de lectores.
• Precisión entre lotes: se calculó el porcentaje de resultados iguales a la decisión mayoritaria para cada lote de CINTEC PLUS CYTOLOGY KIT (lotes 1 a 3), acumulando los datos de los 12 conjuntos de citologías de cuello de útero (3 conjuntos HSIL/VPH+, 1 LSIL/VPH+, 1 ASC-US/VPH+, 1 NILM/VPH+, 3 NILM/VPH- y LBC, y 3 conjuntos negativos en estirpe celular T24), 5 días no consecutivos, 2 réplicas y 3 equipos de lectores.
Todos los portaobjetos se enmascararon, se aleatorizaron y se evaluaron según la interpretación de tinción del CINTEC PLUS CYTOLOGY KIT. Tres equipos de lectores, compuestos por un auxiliar de laboratorio citológico y un anatomopatólogo cada uno, evaluaron los portaobjetos. La decisión mayoritaria, o el resultado del modo a nivel de conjunto (positivo o negativo), sirvió como referencia para determinar el porcentaje de resultados iguales a la decisión mayoritaria. El porcentaje de resultados iguales a la decisión mayoritaria es equivalente al PPA cuando la decisión mayoritaria es positiva, y al NPA cuando ésta es negativa. Los resultados se resumen en la Tabla 5, Tabla 6 y Tabla 7. Todos los intervalos de confianza (CI) eran intervalos de confianza del 95% bilaterales. Los datos de CI se calcularon mediante el método bootstrap percentil, salvo en aquellos casos en los que la estimación de punto fue del 100%, en los que se utilizó el método de puntuación de Wilson.
Tabla 5. Estudio de precisión en el mismo laboratorio: precisión global
|
Categoría del conjunto |
Número de evaluaciones |
Modo de resultados de CINTEC PLUS CYTOLOGY KIT (decisión mayoritaria) |
Porcentaje de resultados iguales que la decisión mayoritaria |
Intervalo de confianza del 95% |
|
Estirpe celular T24 |
270 |
Negativa |
100.0% |
(98.6, 100.0) |
|
NILM/VPH- |
270 |
Negativa |
94.1% |
(90.7, 97.0) |
|
NILM/VPH+ |
90 |
Positiva |
61.1% |
(47.2, 74.4) |
|
ASC-US/VPH+ |
90 |
Positiva |
93.3% |
(88.9, 97.8) |
|
LSIL/VPH+ |
90 |
Positiva |
100.0% |
(95.9, 100.0) |
|
HSIL/VPH+ |
270 |
Positiva |
98.9% |
(96.7, 100.0) |
Tabla 6. Estudio de precisión en el mismo laboratorio: precisión entre días
|
Categoría del conjunto |
Número de evaluaciones |
Modo de resultados de CINTEC PLUS CYTOLOGY KIT (decisión mayoritaria) |
Porcentaje de resultados iguales que la decisión mayoritaria |
||||
|
Día 1 |
Día 2 |
Día 3 |
Día 4 |
Día 5 |
|||
|
Estirpe celular T-24 |
270 |
Negativa |
100.0% |
100.0% |
100.0% |
100.0% |
100.0% |
|
NILM/VPH- |
270 |
Negativa |
88.9% |
90.7% |
98.1% |
98.1% |
94.4% |
|
NILM/VPH+ |
90 |
Positiva |
44.4% |
50.0% |
77.8% |
66.7% |
66.7% |
|
ASC-US/VPH+ |
90 |
Positiva |
94.4% |
88.9% |
88.9% |
94.4% |
100.0% |
|
LSIL/VPH+ |
90 |
Positiva |
100.0% |
100.0% |
100.0% |
100.0% |
100.0% |
|
HSIL/VPH+ |
270 |
Positiva |
100.0% |
94.4% |
100.0% |
100.0% |
100.0% |
Tabla 7. Estudio de precisión en el mismo laboratorio: precisión entre lotes
|
Categoría del conjunto |
Número de evaluaciones |
Modo de resultados de CINTEC PLUS CYTOLOGY KIT (decisión mayoritaria) |
Porcentaje de resultados iguales que la decisión mayoritaria |
||
|
Lote 1 |
Lote 2 |
Lote 3 |
|||
|
Estirpe celular T24 |
270 |
Negativa |
100.0% |
100.0% |
100.0% |
|
NILM/VPH- |
270 |
Negativa |
92.2% |
93.3% |
96.7% |
|
NILM/VPH+ |
90 |
Positiva |
46.7% |
70.0% |
66.7% |
|
ASC- US/VPH+ |
90 |
Positiva |
90.0% |
96.7% |
93.3% |
|
LSIL/VPH+ |
90 |
Positiva |
100.0% |
100.0% |
100.0% |
|
HSIL/VPH+ |
270 |
Positiva |
100.0% |
100.0% |
96.7% |
Precisión del lector: Para evaluar la precisión del lector, tres equipos de lectores, compuestos por un auxiliar de laboratorio citológico y un anatomopatólogo cada uno, evaluaron todos los portaobjetos teñidos en los estudios de precisión, incluidos los 2 duplicados de los 12 conjuntos de citologías de cuello de útero (3 conjuntos HSIL/VPH+, 1 LSIL/VPH+, 1 ASC-US/VPH+, 1 NILM/VPH+, 3 NILM/VPH- y LBC, y 3 conjuntos negativos en estirpe celular T24) y 3 lotes de CINTEC PLUS CYTOLOGY KIT en 5 días no consecutivos. El porcentaje de resultados, igual que la decisión mayoritaria, se calculó a partir de los resultados acumulados entre los equipos lectores y se resume en la Tabla 8.
Tabla 8. Estudio de precisión en el mismo laboratorio: precisión entre lectores
|
Categoría del conjunto |
Número de evaluaciones |
Modo de resultados |
Porcentaje de resultados iguales que la decisión mayoritaria |
||
|
Equipo de |
Equipo de |
Equipo de |
|||
|
Estirpe celular T-24 |
270 |
Negativa |
100.0% |
100.0% |
100.0% |
|
NILM/VPH- |
270 |
Negativa |
95.6% |
91.1% |
95.6% |
|
NILM/VPH+ |
90 |
Positiva |
70.0% |
63.3% |
50.0% |
|
ASC-US/VPH+ |
90 |
Positiva |
100.0% |
90.0% |
90.0% |
|
LSIL/VPH+ |
90 |
Positiva |
100.0% |
100.0% |
100.0% |
|
HSIL/VPH+ |
270 |
Positiva |
98.9% |
98.9% |
98.9% |
Reproducibilidad: Se llevaron a cabo estudios de reproducibilidad de CINTEC PLUS CYTOLOGY KIT para demostrar:
• La reproducibilidad entre lotes de CINTEC PLUS CYTOLOGY KIT (Tabla 9).
• La reproducibilidad en una misma sesión (Tabla 10) y entre sesiones (Tabla 11) en los instrumentos BenchMark GX, XT y ULTRA.
• La reproducibilidad en una sola plataforma en los instrumentos BenchMark GX, XT y ULTRA (Tabla 12).
• La reproducibilidad entre plataformas en los instrumentos BenchMark GX, XT y ULTRA (Tabla 13).
Tabla 9. Reproducibilidad entre lotes de CINTEC PLUS CYTOLOGY KIT
|
Tipo de muestra |
Porcentaje de concordancia global |
|
ThinPrep |
100.0 |
|
SurePath |
100.0 |
Tabla 10. Reproducibilidad en la misma sesión de CINTEC PLUS CYTOLOGY KIT
|
Tipo de muestra |
Porcentaje de concordancia global |
||
|
GX |
XT |
ULTRA |
|
|
ThinPrep |
100.0 |
100.0 |
100.0 |
|
SurePath |
93.8 |
96.3 |
92.6 |
Tabla 11. Reproducibilidad entre sesiones de CINTEC PLUS CYTOLOGY KIT
|
Tipo de muestra |
Porcentaje de concordancia global |
||
|
GX |
XT |
ULTRA |
|
|
ThinPrep |
100.0 |
96.2 |
100.0 |
|
SurePath |
100.0 |
92.6 |
100 |
Tabla 12. Reproducibilidad en la misma plataforma de CINTEC PLUS CYTOLOGY KIT.
|
Tipo de muestra |
Porcentaje de concordancia global |
||
|
GX |
XT |
ULTRA |
|
|
ThinPrep |
100.0 |
100.0 |
100.0 |
|
SurePath |
100.0 |
100.0 |
96.3 |
Tabla 13. Reproducibilidad entre plataformas de CINTEC PLUS CYTOLOGY KIT
|
Tipo de muestra |
Porcentaje de concordancia global |
|
ThinPrep |
100.0 |
|
SurePath |
96.3 |
Los estudios se llevaron a cabo con muestras de cuello de útero preparadas tanto con ThinPrep como con SurePath. Todos los estudios cumplieron los criterios de aceptación predeterminados.
Estudios de concordancia: Se evaluó el rendimiento de CINTEC PLUS CYTOLOGY KIT para su uso con los instrumentos BenchMark GX, XT y ULTRA mediante una comparación con CINtec PLUS Kit (dispositivo de referencia, Roche mtm laboratories AG, Mannheim) que había presentado anteriormente una elevada sensibilidad y especificidad en cuanto a la presencia de una enfermedad cancerosa o precancerosa en las muestras de citología de cuello de útero con respecto a la presencia de un resultado de tinción doble positiva en p16INK4a y Ki-67 en las células epiteliales individuales de cuello de útero.7-15,18,20,23,25-28
Se han llevado a cabo estudios de concordancia a partir de muestras de pacientes de la población de uso previsto con resultado NILM (negativo para lesión intraepitelial o malignidad) en la citología de cuello uterino (prueba de Papanicolau), ASC-US, LSIL y HSIL para cada método de preparación de citología de cuello uterino: ThinPrep, BD SurePath y portaobjetos de frotis convencionales. En el caso de las muestras LBC, se prepararon dos portaobjetos de cada muestra de paciente. En el caso de los frotis convencionales, se prepararon dos portaobjetos del mismo paciente y la misma visita, y se dividió el material de la muestra en dos portaobjetos («método de división de la muestra»). Uno de los portaobjetos se analizó con CINTEC PLUS CYTOLOGY KIT en un instrumento BenchMark IHC/ISH y otro portaobjetos se tiñó con el dispositivo homologado anteriormente.
Algoritmo de lectura de las muestras LBC: Dos lectores con formación se encargaron de la lectura de cada portaobjetos. Si estaban de acuerdo en el resultado, este se consideraba el resultado definitivo del portaobjetos. Si no estaban de acuerdo, un tercer lector llevaba a cabo una lectura adicional y el resultado mayoritario se convertía en el resultado definitivo del portaobjetos.
Algoritmo de lectura de los portaobjetos de frotis convencional: Dos lectores con formación se encargaron de la lectura de cada portaobjetos. Si ambos lectores puntuaban el portaobjetos como positivo, se consideraba que el resultado definitivo del portaobjetos era positivo. Si no estaban de acuerdo en el resultado, un panel formado por otros tres lectores llevaba a cabo una revisión por consenso del portaobjetos y su conclusión se convertía en el resultado definitivo del portaobjetos. Si ambos lectores puntuaban el portaobjetos como negativo, un tercer lector llevaba a cabo una lectura adicional para confirmar el resultado negativo. Si el tercer lector confirmaba el resultado negativo, el resultado definitivo del portaobjetos se consideraba negativo. Si el tercer lector puntuaba el portaobjetos como positivo, el portaobjetos se sometía a una revisión por consenso del panel, cuya conclusión se convertía en el resultado definitivo del portaobjetos.
La concordancia entre los resultados de la prueba se notifica como el porcentaje de concordancia positiva (PPA) y el porcentaje de concordancia negativa (NPA) ± el intervalo de confianza (CI) del 95% entre CINTEC PLUS CYTOLOGY KIT para su uso con el instrumento BenchMark IHC/ISH y el dispositivo de referencia.
Tabla 14. Concordancia de los resultados de la prueba entre CINTEC PLUS CYTOLOGY KIT y el dispositivo de referencia en preparaciones de portaobjetos de citología de cuello de útero ThinPrep
|
Dispositivo de referencia |
|||
|
+ |
- |
||
|
CINTEC PLUS CYTOLOGY KIT |
+ |
140 |
25 |
|
- |
17 |
147 |
|
|
Total |
157 |
172 |
|
|
PPA (n/N) (CI del 95%) = 140/157 x 100% = 89.2% (83.3-93.1%) |
|||
|
NPA (n/N) (CI del 95%) = 147/172 x 100% = 85.5% (79.4-90.0%) |
|||
Tabla 15. Concordancia de los resultados de la prueba entre CINTEC PLUS CYTOLOGY KIT y el dispositivo de referencia en preparaciones de portaobjetos de citología de cuello de útero SurePath
|
Dispositivo de referencia |
|||
|
+ |
- |
||
|
CINTEC PLUS CYTOLOGY KIT |
+ |
56 |
3 |
|
- |
9 |
108 |
|
|
Total |
65 |
111 |
|
|
PPA (n/N) (CI del 95%) = 56/65 × 100% = 86.2% (75.7-92.5%) |
|||
|
NPA (n/N) (CI del 95%) = 108/111 × 100% = 97.3% (92.4-99.1%) |
|||
Tabla 16. Concordancia de los resultados de la prueba entre CINTEC PLUS CYTOLOGY KIT y el dispositivo homologado previamente en preparaciones de portaobjetos con citologías de cuello de útero de frotis convencionales
|
Dispositivo de referencia |
|||
|
+ |
- |
||
|
CINTEC PLUS CYTOLOGY KIT |
+ |
98 |
17 |
|
- |
20 |
72 |
|
|
Total |
118 |
89 |
|
|
PPA (n/N) (CI del 95%) = 98/118 × 100% = 83.1% (75.3-88.8%) |
|||
|
NPA (n/N) (CI del 95%) = 72/89 × 100% = 80.9% (71.5-87.7%) |
|||
Estudio de Roche Cell Collection Medium: Se evaluó el rendimiento de Roche Cell Collection Medium en comparación con la solución PreservCyt mediante la tinción de 616 pares de muestras de cuello de útero (casos) con CINTEC PLUS CYTOLOGY KIT. Para cada caso, se preparó un portaobjetos del vial correspondiente de PC o RCCM. La lectura de todos los portaobjetos quedó a cargo de un equipo formado por un auxiliar de laboratorio citológico y un anatomopatólogo, que no conocían la identidad de los portaobjetos. Los resultados de la prueba de CINTEC PLUS CYTOLOGY KIT de comparación entre medios (PC frente a RCCM) se resumen en la Tabla 17. Los porcentajes de positividad se calcularon mediante la división del número de casos positivos entre el número total de casos idóneos en cada medio. Los resultados demuestran una diferencia entre ambos porcentajes de positividad del 2.4% (1.5, 6.3).
Tabla 17. Equivalencia de los porcentajes de positividad de CINTEC PLUS CYTOLOGY KIT de Roche Cell Collection Medium (RCCM) y PreservCyt (PC)
|
Resultado de CINTEC PLUS CYTOLOGY KIT con PC |
|||
|
Resultado de CINTEC PLUS CYTOLOGY KIT con RCCM |
Positiva |
Negativa |
Total |
|
Positiva |
170 |
48 |
218 |
|
Negativa |
37 |
204 |
241 |
|
Total |
207 |
252 |
459 |
|
Porcentaje de positividad con RCCM, n/N (%): |
218/459 (47.5%) |
||
|
Porcentaje de positividad con PC, n/N (%): |
207/459 (45.1%) |
||
|
Diferencia en los porcentajes de positividad, n/N (%): |
11/459 (2.4%; CI del 95%: -1.5, 6.3) |
||
Los resultados de CINTEC PLUS CYTOLOGY KIT en cuanto a la idoneidad celular en la comparación entre PreservCyt y Roche Cell Collection Medium se resumen en la Tabla 18. Los porcentajes de idoneidad de la celularidad se calcularon mediante la división del número de casos con idoneidad de la celularidad entre el número total de casos idóneos en cada medio. Los resultados demuestran una diferencia entre ambos porcentajes de idoneidad celular del 3.2% (-0.0, 6.6).
Tabla 18. Comparación de la idoneidad de la celularidad de CINTEC PLUS CYTOLOGY KIT con Roche Cell Collection Medium (RCCM) y PreservCyt (PC)
|
Idoneidad de la celularidad de CINTEC PLUS CYTOLOGY KIT con PC |
|||
|
Idoneidad de la celularidad de CINTEC PLUS CYTOLOGY KIT con RCCM |
Sí |
No |
Total |
|
Sí |
468 |
63 |
531 |
|
No |
43 |
42 |
85 |
|
Total |
511 |
105 |
616 |
|
Porcentaje de idoneidad de RCCM, n/N (%): |
531/616 (86.2%) |
||
|
Porcentaje de idoneidad con PC, n/N (%): |
511/616 (83.0%) |
||
|
Diferencia en los porcentajes de idoneidad, n/N (%): |
20/616 (3.2%; CI del 95%: -0.0, 6.6) |
||
Estudio de reproducibilidad entre laboratorios en la plataforma de tinción BenchMark ULTRA PLUS: Se llevó a cabo un estudio de reproducibilidad para evaluar la prueba de CINtec PLUS Cytology en el instrumento BenchMark ULTRA PLUS en cuanto a la detección inmunocitoquímica doble de p16INK4a y Ki-67 en muestras de citología. El estudio incluyó 2 cultivos diferentes de células T24 y 10 conjuntos de muestras obtenidas de pacientes (2 conjuntos HSIL/VPH+, 2 LSIL/VPH+, 2 ASC-US/VPH+, 2 NILM/VPH+ y 2 NILM/VPH- y LBC). Los cultivos celulares de T24 se prepararon a partir de un solo banco de células de trabajo. En cada uno de los 3 sitios del estudio se entregaron partes alícuotas de cada conjunto de muestras, cultivo celular de T24 y un conjunto de control con volumen suficiente para llevar a cabo las pruebas planificadas en cada sitio. En cada uno de los cinco días de tinción, los sitios prepararon un portaobjetos de prueba de cada una de las partes alícuotas proporcionadas por RTD mediante un procesador de portaobjetos ThinPrep 2000 o ThinPrep 5000. Después de la preparación de portaobjetos, en cada sitio se tiñó un conjunto de 13 portaobjetos en un instrumento BenchMark ULTRA PLUS. Los 5 días de tinción fueron no consecutivos y abarcaron como mínimo 20 días. En cada sitio, 2 equipos de lectores, compuestos por un auxiliar de laboratorio citológico y un anatomopatólogo cada uno, evaluaron de manera independiente los portaobjetos teñidos en su sitio para detectar la presencia o ausencia de tinción doble, y asignaron al portaobjetos un resultado de la prueba con CINtec PLUS Cytology de positivo, negativo o no satisfactorio. Los equipos de lectores desconocían cualquier determinación anterior del estado de VPH, el estado de la citología Papanicolau, los resultados de la prueba con CINtec PLUS Cytology o cualquier otra información clínica.
Los datos se ingresaron directamente en una base de datos clínica y se analizaron para determinar la reproducibilidad del ensayo en diferentes sitios, días y equipos de lectores. Los índices de aceptabilidad del fondo y la celularidad de todos los casos fueron del 100% en todos los instrumentos. Los resultados se resumen en la Tabla 19 y la Tabla 20.
Tabla 19. Estudio de reproducibilidad entre laboratorios del instrumento BenchMark ULTRA PLUS: reproducibilidad entre sitios
|
Categoría del conjunto |
Número de evaluaciones |
Modo de resultados de CINtec PLUS Cytology (decisión mayoritaria) |
Porcentaje de resultados iguales que la decisión mayoritaria |
||
|
Sitio A |
Sitio B |
Sitio C |
|||
|
Estirpe celular T24 |
60 |
Negativa |
95.0% |
100.0% |
100.0% |
|
NILM/VPH- |
60 |
Negativa |
100.0% |
95.0% |
100.0% |
|
NILM/VPH+ |
60 |
Positiva |
90.0% |
80.0% |
95.0% |
|
ASC-US/VPH+ |
60 |
Positiva |
100.0% |
95.0% |
100.0% |
|
LSIL/VPH+ |
60 |
Positiva |
100.0% |
95.0% |
100.0% |
|
HSIL/VPH+ |
60 |
Positiva |
100.0% |
100.0% |
100.0% |
Tabla 20. Estudio de reproducibilidad entre laboratorios del instrumento BenchMark ULTRA PLUS: precisión global
|
Categoría del conjunto |
Modo de resultados de CINtec PLUS Cytology (decisión mayoritaria) |
Porcentaje de resultados iguales que la decisión mayoritaria |
n/N |
Intervalos de confianza del 95% |
|
Estirpe celular T24 |
Negativa |
98.3% |
59/60 |
(96.7, 100.0) |
|
NILM/VPH- |
Negativa |
98.3% |
59/60 |
(96.7, 100.0) |
|
NILM/VPH+ |
Positiva |
88.3% |
53/60 |
(86.7, 90.0) |
|
ASC-US/VPH+ |
Positiva |
98.3% |
59/60 |
(96.7, 100.0) |
|
LSIL/VPH+ |
Positiva |
98.3% |
59/60 |
(96.7, 100.0) |
|
HSIL/VPH+ |
Positiva |
100.0% |
60/60 |
(94.0, 100.0) |
Concordancia entre los instrumentos BenchMark ULTRA PLUS y BenchMark ULTRA (muestras ThinPrep): Tres laboratorios participaron en un estudio de concordancia entre el instrumento BenchMark ULTRA PLUS y el instrumento BenchMark ULTRA. En este estudio, se utilizaron 220 conjuntos de muestras de cuello de útero LBC ThinPrep no identificadas preparadas en Roche Tissue Diagnostics (RTD) en las siguientes categorías: 88 conjuntos con resultado positivo, 22 con resultado positivo límite, 22 con resultado negativo intermedio y 88 conjuntos con cultivo celular de T24 negativo. Se preparó un conjunto de 4 portaobjetos de cada muestra en RTD mediante el procesador de portaobjetos ThinPrep 2000 o ThinPrep 5000. El primer portaobjetos preparado de cada conjunto se tiñó en un instrumento BenchMark ULTRA en RTD. Uno de los 3 portaobjetos restantes se entregó a cada sitio del estudio para la tinción con la prueba de CINtec PLUS Cytology en el instrumento BenchMark ULTRA PLUS. Se evaluó el portaobjetos teñido en BenchMark ULTRA en RTD para detectar la presencia o ausencia de tinción doble y un equipo de lectores de RTD, compuesto por un auxiliar de laboratorio citológico y un anatomopatólogo, le asignó el resultado de positivo, negativo o no satisfactorio a fin de establecer un índice de referencia. En cada sitio, un equipo de lectores del estudio evaluó de manera independiente los portaobjetos teñidos en el instrumento BenchMark ULTRA para obtener un resultado de la prueba con CINtec PLUS Cytology. El equipo de lectores de dicho sitio evaluó los portaobjetos teñidos en el instrumento BenchMark ULTRA PLUS en cada sitio para obtener un resultado de la prueba con CINtec PLUS Cytology. Por lo tanto, el equipo de lectores de cada sitio evaluó un portaobjetos teñido con BenchMark ULTRA y uno teñido con BenchMark ULTRA PLUS de cada muestra. Las lecturas de los portaobjetos teñidos con BenchMark ULTRA y BenchMark ULTRA PLUS se separaron con un periodo de reposo de dos semanas. Todos los equipos de lectores desconocían cualquier determinación anterior del estado de VPH, el estado de la citología Papanicolau, los resultados de la prueba con CINtec PLUS Cytology o cualquier otra información clínica.
La equivalencia de rendimiento del ensayo CINtec PLUS Cytology se consideraba aceptable en el instrumento BenchMark ULTRA PLUS si los porcentajes de PPA y NPA tenían un límite inferior del intervalo de confianza del 95% bilateral de al menos el 85%. El índice de aceptabilidad del fondo y la celularidad de los portaobjetos de la prueba teñidos con CINtec PLUS Cytology en el instrumento BenchMark ULTRA PLUS debía ser aceptable en ≥ 90% de todos los portaobjetos de la prueba para que se aprobara el estudio. Los índices de aceptabilidad del fondo y la celularidad de todos los portaobjetos de la prueba fueron de 99.7 y 99.4%, respectivamente. En la Tabla 21 que aparece a continuación, se resume el porcentaje de concordancia del estado de CINtec PLUS Cytology entre los instrumentos BenchMark ULTRA y BenchMark ULTRA PLUS.
Tabla 21. Estudio de concordancia entre los instrumentos BenchMark ULTRA y BenchMark ULTRA PLUS: concordancia combinada del estado de CINtec PLUS Cytology entre plataformas (ThinPrep)
|
Estado de CINtec PLUS Cytology |
Concordancia |
|||||
|
BenchMark ULTRA PLUS |
BenchMark ULTRA |
|||||
|
Positiva |
Negativa |
Total |
Tasa |
% (n/N) |
CI del 95% |
|
|
Positiva |
314 |
13 |
327 |
PPA |
95.7 (314/328) |
(92.8, 98.1) |
|
Negativa |
14 |
317 |
331 |
NPA |
96.1 (317/330) |
(93.5, 98.1) |
|
Total |
328 |
330 |
658 |
OPA |
95.9 (631/658) |
(94.1, 97.4) |
Nota: Los porcentajes de concordancia combinada agrupan todas las muestras y equipos de lectores para ULTRA PLUS.
Nota: PPA = porcentaje de concordancia positiva; NPA = porcentaje de concordancia negativa; OPA = porcentaje de concordancia global.
Estudio de reproducibilidad en el mismo laboratorio en la plataforma de tinción BenchMark ULTRA PLUS: Se llevó a cabo un estudio de reproducibilidad en el mismo laboratorio para evaluar la repetibilidad dentro del análisis, la precisión intermedia entre días y la precisión intermedia entre instrumentos de la prueba de CINtec PLUS Cytology en muestras SurePath. El estudio incluyó 2 cultivos diferentes de células T24 y 9 conjuntos de muestras SurePath obtenidas de pacientes (3 CINtec positivo/VPH+, 3 en el límite y 3 CINtec negativo/VPH-). Los portaobjetos de la prueba se prepararon en el instrumento de preparación de portaobjetos BD Totalys en cada uno de los cinco días de tinción, que fueron no consecutivos y abarcaron como mínimo 20 días. Se utilizaron tres instrumentos BenchMark ULTRA PLUS para evaluar la reproducibilidad entre instrumentos. Un equipo de lectores compuesto por un auxiliar de laboratorio citológico y un anatomopatólogo con formación para evaluar el ensayo CINtec PLUS Cytology se encargó de evaluar los portaobjetos de la prueba. La concordancia entre los portaobjetos de la prueba se determinó mediante la comparación del estado de CINtec PLUS Cytology de los portaobjetos de la prueba con el modo a nivel de conjunto (PLM), que se define como el resultado del estado más frecuente entre todas las evaluaciones de un conjunto, acumulando los datos de todos los instrumentos, todos los días y todas las réplicas de ese conjunto. Los índices de aceptabilidad del fondo y la celularidad de todos los portaobjetos de la prueba fueron de 99.4 y 99.7%, respectivamente. Los resultados se resumen en la Tabla 22, la Tabla 23, la Tabla 24 y la Tabla 25 a continuación.
Tabla 22. Estudio de precisión en el mismo laboratorio: precisión global de muestras SurePath con resultado positivo verdadero y negativo verdadero
|
Estado modal a nivel de conjunto |
Concordancia |
|||||
|
Estado de CINtec PLUS |
Positiva |
Negativa |
Total |
Medida |
% (n/N) |
CI del 95% |
|
Positiva |
89 |
0 |
89 |
PPA |
100.0 (89/89) |
(95.9, 100.0) |
|
Negativa |
0 |
90 |
90 |
NPA |
100.0 (90/90) |
(95.9, 100.0) |
|
Total |
89 |
90 |
179 |
OPA |
100.0 (179/179) |
(97.9, 100.0) |
Tabla 23. Estudio de precisión en el mismo laboratorio: precisión intermedia entre días
|
Día |
Mismo resultado con PLM, n (%) |
Resultado diferente de PLM, n (%) |
Total, n (%) |
|
Día 1 |
36 (100.0) |
0 (0.0) |
36 (100.0) |
|
Día 2 |
35 (100.0) |
0 (0.0) |
35 (100.0) |
|
Día 3 |
36 (100.0) |
0 (0.0) |
36 (100.0) |
|
Día 4 |
36 (100.0) |
0 (0.0) |
36 (100.0) |
|
Día 5 |
36 (100.0) |
0 (0.0) |
36 (100.0) |
Tabla 24. Estudio de precisión en el mismo laboratorio: repetibilidad dentro del análisis
|
Réplica |
Mismo resultado con PLM, n (%) |
Resultado diferente de PLM, n (%) |
Total, n (%) |
|
Réplica 1 |
90 (100.0) |
0 (0.0) |
90 (100.0) |
|
Réplica 2 |
89 (100.0) |
0 (0.0) |
89 (100.0) |
Tabla 25. Estudio de precisión en el mismo laboratorio: precisión intermedia entre instrumentos
|
Instrumento |
Mismo resultado con PLM, n (%) |
Resultado diferente de PLM, n (%) |
Total, n (%) |
|
Instrumento 1 |
60 (100.0) |
0 (0.0) |
60 (100.0) |
|
Instrumento 2 |
60 (100.0) |
0 (0.0) |
60 (100.0) |
|
Instrumento 3 |
59 (100.0) |
0 (0.0) |
59 (100.0) |
Concordancia entre las plataformas de tinción BenchMark ULTRA PLUS y BenchMark ULTRA (muestras SurePath): Se llevó a cabo un estudio interno de concordancia para verificar el rendimiento equivalente de la tinción de CINTEC PLUS CYTOLOGY KIT entre las plataformas de tinción BenchMark ULTRA y ULTRA PLUS en muestras SurePath. En el estudio se incluyeron 88 muestras con resultado positivo verdadero, 26 con resultado positivo límite, 26 con resultado negativo intermedio y 88 cultivos con negativo verdadero en estirpe celular T24. Se prepararon dos portaobjetos de la prueba a partir de cada muestra en el instrumento de preparación de portaobjetos BD Totalys y, a continuación, se tiñeron con CINtec PLUS Cytology en el instrumento BenchMark ULTRA o el BenchMark ULTRA PLUS. Un equipo de lectores compuesto por un auxiliar de laboratorio citológico y un anatomopatólogo con formación para evaluar el ensayo CINtec PLUS Cytology se encargó de evaluar los portaobjetos de la prueba. La equivalencia de rendimiento del ensayo CINtec PLUS Cytology se consideraba aceptable en el instrumento BenchMark ULTRA PLUS si los porcentajes de PPA y NPA tenían un límite inferior del intervalo de confianza del 95% bilateral de al menos el 85%. El índice de aceptabilidad del fondo y la celularidad de los portaobjetos de la prueba teñidos con CINtec PLUS Cytology en el instrumento BenchMark ULTRA PLUS debía ser aceptable en ≥ 90% de todos los portaobjetos de la prueba para que se aprobara el estudio. Los índices de aceptabilidad del fondo y la celularidad de todos los portaobjetos de la prueba fueron de 99.6 y 99.1%, respectivamente. Los resultados se resumen en la Tabla 26 a continuación.
Tabla 26. Estudio de concordancia entre los instrumentos BenchMark ULTRA y BenchMark ULTRA PLUS (SurePath)
|
Estado de ULTRA |
Concordancia |
|||||
|
Estado de ULTRA PLUS |
Positiva |
Negativa |
Total |
Medida |
% (n/N) |
CI del 95% |
|
Positiva |
94 |
2 |
96 |
PPA |
92.2 (94/102) |
(85.3, 96.0) |
|
Negativa |
8 |
119 |
127 |
NPA |
98.3 (119/121) |
(94.2, 99.5) |
|
Total |
102 |
121 |
223 |
OPA |
95.5 (213/223) |
(91.9, 97.5) |
RENDIMIENTO CLÍNICO:
Se diseñó un ensayo multicéntrico (IMPACT, IMproved Primary screening And Colposcopy Triage [Triaje mejorado de cribado primario y colposcopia]) para evaluar el rendimiento clínico de CINTEC PLUS CYTOLOGY KIT con el instrumento BenchMark ULTRA y muestras de cuello de útero extraídas en entorno clínico, conservadas en solución PreservCyt® para la detección de una enfermedad de cuello de útero de grado alto. El estudio se diseñó para evaluar el rendimiento de CINTEC PLUS CYTOLOGY KIT como prueba condicionada en mujeres de ≥ 25 años con resultado positivo al VPH en el cobas® 4800 HPV Test o el cobas® 6800/8800 HPV Test. Los datos de este estudio respaldan el uso de CINTEC PLUS CYTOLOGY KIT como ayuda para la identificación de mujeres con lesiones intraepiteliales de cuello de útero de evolución rápida en pacientes con un resultado positivo en las pruebas de VPH de alto riesgo.
Características de rendimiento del CINTEC PLUS CYTOLOGY KIT frente a la citología Papanicolau para mujeres entre 25 y 65 años con cobas® 6800/8800 HPV Test o cobas® 4800 HPV Test, resultados positivos: El rendimiento comparativo de resultados positivos en mujeres con el CINTEC PLUS CYTOLOGY KIT frente a la citología Papanicolau con cobas® 6800/8800 HPV Test y cobas® 4800 HPV Test se representa en las siguientes tablas, que se distribuyen de la siguiente manera: población con alguno de los otros 12 tipos de VPH+ de alto riesgo (Tabla 27), población con VPH16+ (Tabla 28) y población con VPH18+ (Tabla 29). En los tres grupos de genotipo se detectó un aumento de la sensibilidad y una disminución de la especificidad en la detección de enfermedad de cuello de útero de grado alto para CINTEC PLUS CYTOLOGY KIT frente a la citología Papanicolau (Tabla 27, Tabla 28 y Tabla 29).
En las mujeres con resultado positivo, tanto en cobas® 6800/8800 HPV Test como en cobas® 4800 HPV Test, el incremento máximo de la sensibilidad (diferencia = 23.1 y 24.2%, respectivamente) y la disminución mínima de la especificidad (diferencia = 7.9 y 8.7%, respectivamente) respecto a la citología Papanicolau se observó en poblaciones con alguno de los otros 12 tipos de VPH+ de alto riesgo (Tabla 27).
En todos los casos, el uso del CINTEC PLUS CYTOLOGY KIT supuso una reducción sustancial del riesgo de enfermedad en resultados negativos del CINTEC PLUS CYTOLOGY KIT frente a una citología Papanicolau con resultado NILM. Entre las mujeres con resultado positivo en cobas® 6800/8800 HPV Test, el 1-NPV fue un 3.7, 6.1 y 1.2% inferior para ≥ CIN2 y un 0.9, 3.3 y 0.3% inferior para ≥ CIN3 en poblaciones con alguno de los otros 12 tipos de VPH+ de alto riesgo, VPH16+ y VPH18+, respectivamente. Entre las mujeres con resultado positivo en cobas® 4800 HPV Test, el 1-NPV fue un 3.4, 9.1 y 3.3% inferior para ≥ CIN2 y un 0.8, 5.1 y 0.5% inferior para ≥ CIN3 en poblaciones con alguno de los otros 12 tipos de VPH+ de alto riesgo, VPH16+ y VPH18+, respectivamente.
Tabla 27. Rendimiento de CINTEC PLUS CYTOLOGY KIT frente a la citología Papanicolau en mujeres entre 25 y 65 años con alguno de los otros 12 tipos de VPH+ de alto riesgo
|
cobas® 6800/8800 system, con alguno de los otros 12 tipos de VPH+ de alto riesgo |
|||
|
Medición de medida |
Diagnóstico CPR de ≥ CIN2 |
||
|
CINtec PLUS Cytology |
Citología papanicolau |
Diferencia |
|
|
Sensibilidad (%) |
83.0 (254/306) (78.4, 86.8) |
58.8 (180/306) (53.2, 64.2) |
24.2 (18.3, 29.9) |
|
Especificidad (%) |
56.8 (1373/2416) (54.8, 58.8) |
65.5 (1583/2416) (63.6, 67.4) |
-8.7 (-10.9, -6.4) |
|
PPV (%) |
19.6 (254/1297) (18.5, 20.6) |
17.8 (180/1013) (16.2, 19.3) |
1.8 (0.0, 3.3) |
|
1-NPV (%) |
3.6 (52/1425) (2.9, 4.6) |
7.4 (126/1709) (6.5, 8.3) |
-3.7 (-4.5, -2.4) |
|
Prevalencia (%) |
11.2 (306/2722) |
||
|
Medición de medida |
Diagnóstico CPR de ≥ CIN3 |
||
|
CINtec PLUS Cytology |
Citología Papanicolau |
Diferencia |
|
|
Sensibilidad (%) |
86.0 (80/93) (77.5, 91.6) |
66.7 (62/93) (56.6, 75.4) |
19.4 (10.0, 28.7) |
|
Especificidad (%) |
53.7 (1412/2629) (51.8, 55.6) |
63.8 (1678/2629) (62.0, 65.6) |
-10.1 (-12.3, -8.0) |
|
PPV (%) |
6.2 (80/1297) (5.6, 6.6) |
6.1 (62/1013) (5.2, 6.9) |
0.0 (-0.8, 0.8) |
|
1-NPV (%) |
0.9 (13/1425) (0.5, 1.5) |
1.8 (31/1709) (1.3, 2.4) |
-0.9 (-1.4, -0.3) |
|
Prevalencia (%) |
3.4 (93/2722) |
||
|
cobas® 4800 system, con alguno de los otros 12 tipos de VPH+ de alto riesgo |
|||
|
Medición de medida |
Diagnóstico CPR de ≥ CIN2 |
||
|
CINtec PLUS Cytology |
Citología Papanicolau |
Diferencia |
|
|
Sensibilidad (%) |
82.1 (256/312) (77.4, 85.9) |
59.0 (184/312) (53.4, 64.3) |
23.1 (17.3, 28.7) |
|
Especificidad (%) |
58.6 (1520/2594) (56.7, 60.5) |
66.5 (1726/2594) (64.7, 68.3) |
-7.9 (-10.1, -5.8) |
|
PPV (%) |
19.2 (256/1330) (18.1, 20.3) |
17.5 (184/1052) (15.9, 19.0) |
1.8 (0.2, 3.3) |
|
1-NPV (%) |
3.6 (56/1576) (2.8, 4.4) |
6.9 (128/1854) (6.0, 7.8) |
-3.4 (-4.4, -2.3) |
|
Prevalencia (%) |
10.7 (312/2906) |
||
|
Medición de medida |
Diagnóstico CPR de ≥ CIN3 |
||
|
CINtec PLUS Cytology |
Citología Papanicolau |
Diferencia |
|
|
Sensibilidad (%) |
86.2 (81/94) (77.8, 91.7) |
67.0 (63/94) (57.0, 75.7) |
19.1 (9.8, 28.4) |
|
Especificidad (%) |
55.6 (1563/2812) (53.7, 57.4) |
64.8 (1823/2812) (63.0, 66.6) |
-9.2 (-11.3, -7.2) |
|
PPV (%) |
6.1 (81/1330) (5.5, 6.5) |
6.0 (63/1052) (5.1, 6.8) |
0.1 (-0.7, 0.9) |
|
1-NPV (%) |
0.8 (13/1576) (0.5, 1.3) |
1.7 (31/1854) (1.2, 2.2) |
-0.8 (-1.3, -0.3) |
|
Prevalencia (%) |
3.2 (94/2906) |
||
Nota: CPR = revisión anatomopatológica central; PPV = valor predictivo positivo; NPV = valor predictivo negativo; los números que aparecen entre paréntesis son (n/N) e intervalos de confianza del 95% bilaterales.
Tabla 28. Rendimiento de CINTEC PLUS CYTOLOGY KIT frente a la citología Papanicolau en mujeres entre 25 y 65 años con VPH16+
|
cobas® 6800/8800 system, VPH16+ |
|||
|
Medición de medida |
Diagnóstico CPR de ≥ CIN2 |
||
|
CINtec PLUS Cytology |
Citología Papanicolau |
Diferencia |
|
|
Sensibilidad (%) |
92.6 (176/190) (88.0, 95.6) |
75.8 (144/190) (69.2, 81.3) |
16.8 (10.7, 23.2) |
|
Especificidad (%) |
57.2 (349/610) (53.3, 61.1) |
68.5 (418/610) (64.7, 72.1) |
-11.3 (-15.4, -7.2) |
|
PPV (%) |
40.3 (176/437) (37.9, 42.7) |
42.9 (144/336) (39.4, 46.3) |
-2.6 (-5.7, 0.8) |
|
1-NPV (%) |
3.9 (14/363) (2.3, 6.2) |
9.9 (46/464) (7.8, 12.3) |
-6.1 (-7.1, -2.6) |
|
Prevalencia (%) |
23.8 (190/800) |
||
|
Medición de medida |
Diagnóstico CPR de ≥ CIN3 |
||
|
CINtec PLUS Cytology |
Citología Papanicolau |
Diferencia |
|
|
Sensibilidad (%) |
92.5 (111/120) (86.4, 96.0) |
77.5 (93/120) (69.2, 84.1) |
15.0 (7.7, 22.8) |
|
Especificidad (%) |
52.1 (354/680) (48.3, 55.8) |
64.3 (437/680) (60.6, 67.8) |
-12.2 (-16.0, -8.3) |
|
PPV (%) |
25.4 (111/437) (23.6, 27.2) |
27.7 (93/336) (24.8, 30.5) |
-2.3 (-4.7, 0.3) |
|
1-NPV (%) |
2.5 (9/363) (1.3, 4.4) |
5.8 (27/464) (4.2, 7.8) |
-3.3 (-4.7, -1.1) |
|
Prevalencia (%) |
15.0 (120/800) |
||
|
cobas® 4800 system, VPH16+ |
|||
|
Medición de medida |
Diagnóstico CPR de ≥ CIN2 |
||
|
CINtec PLUS Cytology |
Citología Papanicolau |
Diferencia |
|
|
Sensibilidad (%) |
93.6 (176/188) (89.2, 96.3) |
76.6 (144/188) (70.0, 82.1) |
17.0 (10.9, 23.5) |
|
Especificidad (%) |
44.8 (182/406) (40.1, 49.7) |
60.1 (244/406) (55.3, 64.7) |
-15.3 (-20.6, -9.8) |
|
PPV (%) |
44.0 (176/400) (41.7, 46.4) |
47.1 (144/306) (43.5, 50.6) |
-3.1 (-6.6, 0.5) |
|
1-NPV (%) |
6.2 (12/194) (3.6, 10.2) |
15.3 (44/288) (12.0, 19.0) |
-9.1 (-13.4, -4.8) |
|
Prevalencia (%) |
31.6 (188/594) |
||
|
Medición de medida |
Diagnóstico CPR de ≥ CIN3 |
||
|
CINtec PLUS Cytology |
Citología Papanicolau |
Diferencia |
|
|
Sensibilidad (%) |
94.0 (110/117) (88.2, 97.1) |
78.6 (92/117) (70.4, 85.1) |
15.4 (7.9, 23.4) |
|
Especificidad (%) |
39.2 (187/477) (34.9, 43.7) |
55.1 (263/477) (50.6, 59.5) |
-15.9 (-20.7, -11.0) |
|
PPV (%) |
27.5 (110/400) (25.7, 29.2) |
30.1 (92/306) (27.1, 32.9) |
-2.6 (-5.4, 0.2) |
|
1-NPV (%) |
3.6 (7/194) (1.8, 7.0) |
8.7 (25/288) (6.2, 11.8) |
-5.1 (-8.3, -1.7) |
|
Prevalencia (%) |
19.7 (117/594) |
||
Nota: CPR = revisión anatomopatológica central; PPV = valor predictivo positivo; NPV = valor predictivo negativo; los números que aparecen entre paréntesis son (n/N) e intervalos de confianza del 95% bilaterales.
Tabla 29. Rendimiento de CINTEC PLUS CYTOLOGY KIT frente a la citología Papanicolau en mujeres entre 25 y 65 años con VPH18+
|
cobas® 6800/8800 system, VPH18+ |
|||
|
Medición de medida |
Diagnóstico CPR de ≥ CIN2 |
||
|
CINtec PLUS Cytology |
Citología Papanicolau |
Diferencia |
|
|
Sensibilidad (%) |
83.8 (31/37) (68.9, 92.3) |
73.0 (27/37) (57.0, 84.6) |
10.8 (-6.7, 27.8) |
|
Especificidad (%) |
62.7 (205/327) (57.3, 67.8) |
73.1 (239/327) (68.0, 77.6) |
-10.4 (-16.1, -4.6) |
|
PPV (%) |
20.3 (31/153) (16.8, 23.4) |
23.5 (27/115) (18.6, 28.2) |
-3.2 (-8.2, 1.8) |
|
1-NPV (%) |
2.8 (6/211) (1.4, 5.4) |
4.0 (10/249) (2.3, 6.3) |
-1.2 (-3.6, 1.3) |
|
Prevalencia (%) |
10.2 (37/364) |
||
|
Medición de medida |
Diagnóstico CPR de ≥ CIN3 |
||
|
CINtec PLUS Cytology |
Citología Papanicolau |
Diferencia |
|
|
Sensibilidad (%) |
87.5 (14/16) (64.0, 96.5) |
81.3 (13/16) (57.0, 93.4) |
6.3 (-19.6, 31.6) |
|
Especificidad (%) |
60.1 (209/348) (54.8, 65.1) |
70.7 (246/348) (65.7, 75.2) |
-10.6 (-16.1, -5.0) |
|
PPV (%) |
9.2 (14/153) (6.7, 10.8) |
11.3 (13/115) (8.0, 13.9) |
-2.2 (-5.2, 0.8) |
|
1-NPV (%) |
0.9 (2/211) (0.3, 2.7) |
1.2 (3/249) (0.4, 2.7) |
-0.3 (-1.7, 1.1) |
|
Prevalencia (%) |
4.4 (16/364) |
||
|
cobas® 4800 system, VPH18+ |
|||
|
Medición de medida |
Diagnóstico CPR de ≥ CIN2 |
||
|
CINtec PLUS Cytology |
Citología Papanicolau |
Diferencia |
|
|
Sensibilidad (%) |
87.5 (28/32) (71.9, 95.0) |
71.9 (23/32) (54.6, 84.4) |
15.6 (-3.6, 33.9) |
|
Especificidad (%) |
53.4 (102/191) (46.3, 60.3) |
62.3 (119/191) (55.3, 68.9) |
-8.9 (-16.6, -1.0) |
|
PPV (%) |
23.9 (28/117) (19.9, 27.6) |
24.2 (23/95) (18.8, 29.3) |
-0.3 (-5.8, 5.3) |
|
1-NPV (%) |
3.8 (4/106) (1.5, 8.2) |
7.0 (9/128) (4.0, 11.0) |
-3.3 (-8.1, 1.3) |
|
Prevalencia (%) |
14.3 (32/223) |
||
|
Medición de medida |
Diagnóstico CPR de ≥ CIN3 |
||
|
CINtec PLUS Cytology |
Citología Papanicolau |
Diferencia |
|
|
Sensibilidad (%) |
86.7 (13/15) (62.1, 96.3) |
80.0 (12/15) (54.8, 93.0) |
6.7 (-20.5, 33.2) |
|
Especificidad (%) |
50.0 (104/208) (43.3, 56.7) |
60.1 (125/208) (53.3, 66.5) |
-10.1 (-17.5, -2.5) |
|
PPV (%) |
11.1 (13/117) (8.1, 13.2) |
12.6 (12/95) (8.8, 15.6) |
-1.5 (-5.1, 2.0) |
|
1-NPV (%) |
1.9 (2/106) (0.5, 5.2) |
2.3 (3/128) (0.8, 5.2) |
-0.5 (-3.4, 2.3) |
|
Prevalencia (%) |
6.7 (15/223) |
||
Nota: CPR = revisión anatomopatológica central; PPV = valor predictivo positivo; NPV = valor predictivo negativo; los números que aparecen entre paréntesis son (n/N) e intervalos de confianza del 95% bilaterales.
Características de rendimiento en la población mediante cobas® 6800/8800 HPV Test o cobas® 4800 HPV Test, resultados positivos, mujeres entre 30 y 65 años con resultado NILM en la citología Papanicolau: El rendimiento de CINTEC PLUS CYTOLOGY KIT para la detección de ≥ CIN2 y ≥ CIN3 en mujeres con alguno de los otros 12 tipos de VPH+ de alto riesgo y resultado NILM en la citología Papanicolau se refleja en la Tabla 30.
En la población de mujeres con alguno de los otros 12 tipos de VPH+ de alto riesgo según la prueba en cobas® 6800/8800 system y resultado NILM en la citología Papanicolau, la sensibilidad y especificidad en la detección de ≥ CIN2 fueron de 66.7 y 69.7%, respectivamente (y de 62.5 y 67.8%, respectivamente, en la detección de ≥ CIN3). Los valores de PPV de este grupo fueron del 13.0% para ≥ CIN2 y del 2.6% para ≥ CIN3, respectivamente, mientras que, en cuanto al riesgo de padecer la enfermedad, en mujeres con resultados negativos mediante CINTEC PLUS CYTOLOGY KIT (1-NPV), fue del 3.1% para ≥ CIN2 y 0.8% para ≥ CIN3.
En la población de mujeres con alguno de los otros 12 tipos de VPH+ de alto riesgo según la prueba en cobas® 4800 system y resultado NILM en la citología Papanicolau, la sensibilidad y especificidad en la detección de ≥ CIN2 fueron de 64.9 y 71.0%, respectivamente (y de 66.7 y 69.4%, respectivamente, en la detección de ≥ CIN3). Los valores de PPV de este grupo fueron del 12.0% para ≥ CIN2 y del 2.5% para ≥ CIN3, respectivamente, mientras que, en cuanto al riesgo de padecer la enfermedad, en mujeres con resultados negativos mediante CINTEC PLUS CYTOLOGY KIT (1-NPV) fue del 2.9% para ≥ CIN2 y 0.6% para ≥ CIN3.
Tabla 30. Rendimiento de CINTEC PLUS CYTOLOGY KIT en mujeres entre 30 y 65 años con alguno de los otros 12 tipos de VPH+ de alto riesgo y resultado NILM en la citología
|
Medición de rendimiento |
cobas® 6800/8800 system, con alguno de los otros 12 tipos de VPH+ de alto riesgo/NILM |
cobas® 4800 system, con alguno de los otros 12 tipos de VPH+ de alto riesgo/NILM |
||
|
Diagnóstico CPR de ≥ CIN2 |
Diagnóstico CPR de ≥ CIN3 |
Diagnóstico CPR de ≥ CIN2 |
Diagnóstico CPR de ≥ CIN3 |
|
|
Sensibilidad (%) |
66.7 (50/75) (55.4, 76.3) |
62.5 (10/16) (38.6, 81.5) |
64.9 (48/74) (53.5, 74.8) |
66.7 (10/15) (41.7, 84.8) |
|
Especificidad (%) |
69.7 (772/1108) (66.9, 72.3) |
67.8 (791/1167) (65.0, 70.4) |
71.0 (864/1217) (68.4, 73.5) |
69.4 (885/1276) (66.8, 71.8) |
|
Prevalencia (%) |
6.3 (75/1183) |
1.4 (16/1183) |
5.7 (74/1291) |
1.2 (15/1291) |
|
PPV (%) |
13.0 (50/386) (10.8, 14.9) |
2.6 (10/386) (1.6, 3.4) |
12.0 (48/401) (9.9, 13.9) |
2.5 (10/401) (1.6, 3.2) |
|
NPV (%) |
96.9 (772/797) (95.8, 97.8) |
99.2 (791/797) (98.8, 99.6) |
97.1 (864/890) (96.2, 97.9) |
99.4 (885/890) (99.0, 99.7) |
|
1-NPV (%) |
3.1 (25/797) (2.2, 4.2) |
0.8 (6/797) (0.4, 1.2) |
2.9 (26/890) (2.1, 3.8) |
0.6 (5/890) (0.3, 1.0) |
|
PLR |
2.20 (1.79, 2.59) |
1.94 (1.19, 2.58) |
2.24 (1.81, 2.65) |
2.18 (1.35, 2.82) |
|
NLR |
0.48 (0.34, 0.64) |
0.55 (0.27, 0.91) |
0.49 (0.35, 0.66) |
0.48 (0.22, 0.84) |
|
Porcentaje de positividad (%) |
32.6 (386/1183) (30.0, 35.3) |
31.1 (401/1291) (28.6, 33.5) |
||
Nota: CPR = revisión anatomopatológica central; PPV = valor predictivo positivo; NPV = valor predictivo negativo; PLR = cociente de verosimilitudes positivo; NLR = cociente de verosimilitudes negativo; los números que aparecen entre paréntesis son (n/N) e intervalos de confianza del 95% bilaterales.
El rendimiento de CINTEC PLUS CYTOLOGY KIT en la detección de ≥ CIN2 y ≥ CIN3 en mujeres con VPH16+ y resultado NILM en la citología Papanicolau se presenta en la Tabla 31.
En la población de mujeres con VPH16+ según la prueba en cobas® 6800/8800 system y resultado NILM en la citología Papanicolau, la sensibilidad y especificidad fueron de 76.3 y 72.5%, respectivamente, en ≥ CIN2, y de 75.0 y 70.5%, respectivamente, en ≥ CIN3. Los valores de PPV de este grupo fueron de 23.8% para ≥ CIN2 y de 14.8% para ≥ CIN3, respectivamente, mientras que, en cuanto al riesgo de padecer la enfermedad, en mujeres con resultados negativos mediante CINTEC PLUS CYTOLOGY KIT (1-NPV) fue de 3.5% para ≥ CIN2 y 2.4% para ≥ CIN3.
En la población de mujeres con VPH16+ según la prueba en cobas® 4800 system y resultado NILM en la citología Papanicolau, la sensibilidad y especificidad fueron de 80.6 y 61.7%, respectivamente, en ≥ CIN2, y de 81.8 y 59.0%, respectivamente, en ≥ CIN3. Los valores de PPV de este grupo fueron de 27.9% para ≥ CIN2 y de 17.3% para ≥ CIN3, respectivamente, mientras que, en cuanto al riesgo de padecer la enfermedad, en mujeres con resultados negativos mediante CINTEC PLUS CYTOLOGY KIT (1-NPV) fue de 5.5% para ≥ CIN2 y 3.1% para ≥ CIN3.
Tabla 31. Rendimiento de CINTEC PLUS CYTOLOGY KIT en mujeres entre 30 y 65 años con VPH16+ y resultado NILM en la citología
|
Medición de rendimiento |
cobas® 6800/8800 system, VPH16+/NILM |
cobas® 4800 system, VPH16+/NILM |
||
|---|---|---|---|---|
|
Diagnóstico CPR de ≥ CIN2 |
Diagnóstico CPR de ≥ CIN3 |
Diagnóstico CPR de ≥ CIN2 |
Diagnóstico CPR de ≥ CIN3 |
|
|
Sensibilidad (%) |
76.3 (29/38) (60.8, 87.0) |
75.0 (18/24) (55.1, 88.0) |
80.6 (29/36) (65.0, 90.2) |
81.8 (18/22) (61.5, 92.7) |
|
Especificidad (%) |
72.5 (245/338) (67.5, 77.0) |
70.5 (248/352) (65.5, 75.0) |
61.7 (121/196) (54.8, 68.3) |
59.0 (124/210) (52.3, 65.5) |
|
Prevalencia (%) |
10.1 (38/376) |
6.4 (24/376) |
15.5 (36/232) |
9.5 (22/232) |
|
PPV (%) |
23.8 (29/122) (19.1, 28.2) |
14.8 (18/122) (11.0, 18.1) |
27.9 (29/104) (22.8, 32.7) |
17.3 (18/104) (13.2, 20.8) |
|
NPV (%) |
96.5 (245/254) (94.2, 98.0) |
97.6 (248/254) (95.8, 98.9) |
94.5 (121/128) (90.5, 97.2) |
96.9 (124/128) (93.5, 98.7) |
|
1-NPV (%) |
3.5 (9/254) (2.0, 5.8) |
2.4 (6/254) (1.1, 4.2) |
5.5 (7/128) (2.8, 9.5) |
3.1 (4/128) (1.3, 6.5) |
|
PLR |
2.77 (2.10, 3.49) |
2.54 (1.81, 3.24) |
2.11 (1.61, 2.64) |
2.00 (1.45, 2.50) |
|
NLR |
0.33 (0.18, 0.54) |
0.35 (0.17, 0.64) |
0.31 (0.16, 0.57) |
0.31 (0.12, 0.66) |
|
Porcentaje de positividad (%) |
32.4 (122/376) (28.0, 36.9) |
44.8 (104/232) (38.7, 50.9) |
||
Nota: CPR = revisión anatomopatológica central; PPV = valor predictivo positivo; NPV = valor predictivo negativo; PLR = cociente de verosimilitudes positivo; NLR = cociente de verosimilitudes negativo; los números que aparecen entre paréntesis son (n/N) e intervalos de confianza del 95% bilaterales.
El rendimiento de CINTEC PLUS CYTOLOGY KIT en la detección de ≥ CIN2 y ≥ CIN3 en mujeres con VPH18+ y resultado NILM en la citología Papanicolau se presenta en la Tabla 32.
En la población de mujeres con VPH18+ según la prueba en cobas® 6800/8800 system y resultado NILM en la citología Papanicolau, la sensibilidad y especificidad fueron de 75.0 y 73.3%, respectivamente, en ≥ CIN2, y de 66.7 y 72.1%, respectivamente, en ≥ CIN3. Los valores de PPV fueron de 9.7% y de 3.2% en ≥ CIN2 y en ≥ CIN3, respectivamente, mientras que, en cuanto al riesgo de padecer la enfermedad, en mujeres con resultados negativos con el CINTEC PLUS CYTOLOGY KIT (1-NPV) fue de 1.3 y 0.6% para ≥ CIN2 y ≥ CIN3, respectivamente.
En la población de mujeres con VPH18+ según la prueba en cobas® 4800 system y resultado NILM en la citología Papanicolau, la sensibilidad y especificidad fueron de 85.7 y 68.3%, respectivamente, en ≥ CIN2, y de 66.7 y 65.7%, respectivamente, en ≥ CIN3. Los valores de PPV fueron de 15.8% y de 5.3% en ≥ CIN2 y en ≥ CIN3, respectivamente, mientras que, en cuanto al riesgo de padecer la enfermedad, en mujeres con resultados negativos mediante CINTEC PLUS CYTOLOGY KIT (1-NPV) fueron de 1.4% para ambas líneas de corte de la patología.
Tabla 32. Rendimiento de CINTEC PLUS CYTOLOGY KIT en mujeres entre 30 y 65 años con VPH18+ y resultado NILM en la citología
|
Medición de rendimiento |
cobas® 6800/8800 system, VPH18+/NILM |
cobas® 4800 system, VPH18+/NILM |
||
|
Diagnóstico CPR de ≥ CIN2 |
Diagnóstico CPR de ≥ CIN3 |
Diagnóstico CPR de ≥ CIN2 |
Diagnóstico CPR de ≥ CIN3 |
|
|
Sensibilidad (%) |
75.0 (6/8) (40.9, 92.9) |
66.7 (2/3) (20.8, 93.9) |
85.7 (6/7) (48.7, 97.4) |
66.7 (2/3) (20.8, 93.9) |
|
Especificidad (%) |
73.3 (154/210) (67.0, 78.9) |
72.1 (155/215) (65.7, 77.7) |
68.3 (69/101) (58.7, 76.6) |
65.7 (69/105) (56.2, 74.1) |
|
Prevalencia (%) |
3.7 (8/218) |
1.4 (3/218) |
6.5 (7/108) |
2.8 (3/108) |
|
PPV (%) |
9.7 (6/62) (5.4, 13.1) |
3.2 (2/62) (1.0, 5.0) |
15.8 (6/38) (9.2, 21.1) |
5.3 (2/38) (1.7, 8.3) |
|
NPV (%) |
98.7 (154/156) (97.0, 99.6) |
99.4 (155/156) (98.5, 99.9) |
98.6 (69/70) (95.0, 99.7) |
98.6 (69/70) (96.6, 99.7) |
|
1-NPV (%) |
1.3 (2/156) (0.4, 3.0) |
0.6 (1/156) (0.1, 1.5) |
1.4 (1/70) (0.3, 5.0) |
1.4 (1/70) (0.3, 3.4) |
|
PLR |
2.81 (1.49, 3.97) |
2.39 (0.73, 3.74) |
2.71 (1.46, 3.87) |
1.94 (0.59, 3.18) |
|
NLR |
0.34 (0.10, 0.81) |
0.46 (0.09, 1.11) |
0.21 (0.04, 0.76) |
0.51 (0.09, 1.24) |
|
Porcentaje de positividad (%) |
28.4 (62/218) (22.6, 34.3) |
35.2 (38/108) (26.5, 43.8) |
||
Nota: CPR = revisión anatomopatológica central; PPV = valor predictivo positivo; NPV = valor predictivo negativo; PLR = cociente de verosimilitudes positivo; NLR = cociente de verosimilitudes negativo; los números que aparecen entre paréntesis son (n/N) e intervalos de confianza del 95% bilaterales.
USO PREVISTO:
El CINTEC PLUS CYTOLOGY KIT es un ensayo de inmunocitoquímica destinado a su uso en laboratorio para la detección cualitativa simultánea de las proteínas p16INK4a y Ki-67 en preparaciones de citología de cuello uterino teñidas en un instrumento BenchMark IHC/ISH. Se ha concebido como ayuda en la identificación de mujeres con lesiones intraepiteliales de cuello de útero de gran malignidad en los cribados de población y en subgrupos de pacientes cuyos resultados de la citología de cuello uterino (prueba de Papanicolau) muestran la presencia de ASC-US (células escamosas atípicas de importancia no determinada) o LSIL (lesión escamosa intraepitelial de escasa malignidad), y en aquellos pacientes con resultados positivos a la prueba de VPH que indican la existencia de un alto riesgo de contraer la enfermedad.
La interpretación de los resultados de las pruebas solo puede llevarla a cabo un profesional certificado en conjunto con el historial clínico del paciente y las pruebas diagnósticas adicionales que se hayan realizado.
Este producto es para uso diagnóstico in vitro (IVD).

Figura 1. Célula epitelial de cuello uterino positiva en p16INK4a (tinción citoplasmática marrón) y en Ki-67 (tinción nuclear roja).
LIMITACIONES ESPECÍFICAS:
1. Solo para uso profesional. Para llevar a cabo procedimientos de inmunocitoquímica es necesario haber recibido formación especializada.
2. La evaluación con microscopio de los portaobjetos teñidos con CINTEC PLUS CYTOLOGY KIT únicamente debería dejarse en manos de profesionales con certificación que cuenten con formación para interpretar los resultados de la prueba.
3. La interpretación clínica de cualquier tinción positiva o negativa debe llevarse a cabo en el contexto de la presentación clínica y los criterios citológicos correspondientes.
4. La interpretación de los resultados de tinción con CINTEC PLUS CYTOLOGY KIT depende de la intensidad y de la calidad de la contratinción de hematoxilina. El cliente deberá validar cualquier variación con respecto a los reactivos y los periodos de incubación recomendados, dado que una contratinción incompleta o excesiva puede afectar a la correcta interpretación de los resultados.
5. Las muestras de cuello de útero a menudo presentan niveles de sangre total que pueden detectarse a primera vista. Si la concentración de sangre total es superior al 1.0%, será necesario llevar a cabo un lisado de la muestra con ácido acético glacial (GAA), según el protocolo ThinPrep, antes de preparar el portaobjetos.
6. Los portaobjetos con frotis convencionales que se vayan a destinar a la tinción con CINTEC PLUS CYTOLOGY KIT se deben preparar con portaobjetos de vidrio para microscopio Superfrost Plus y Safetex Cytology Fixative (Andwin Scientific), un reactivo de fijación citológico en aerosol que contiene polietilenglicol. El no seguimiento de esta recomendación requiere la validación por parte del cliente.
7. No se recomienda el uso de ThinPrep 3000 Processor para la preparación de muestras con ThinPrep, dado que el procedimiento de fijación en aerosol que se lleva a cabo en el instrumento puede dar lugar a una pérdida significativa de muestra cuando los portaobjetos preparados se tiñen con CINTEC PLUS CYTOLOGY KIT.
8. Se requieren portaobjetos ThinPrep Arcless Microscope o ThinPrep Microscope Slides para el procesamiento especial, o portaobjetos para microscopio Superfrost Plus para la preparación de muestras ThinPrep para la tinción inmunocitoquímica con el CINTEC PLUS CYTOLOGY KIT en instrumentos BenchMark IHC/ISH. Los portaobjetos para microscopio ThinPrep con una zona de cribado grabada pueden generar resultados de tinción incoherentes.
9. El fabricante suministra estos anticuerpos y reactivos con una dilución óptima para que se utilicen, según las instrucciones que se recogen en este documento, en portaobjetos preparados de citología de base líquida (LBC) para pruebas inmunocitoquímicas. Cualquier variación en los procedimientos recomendados de la prueba puede ocasionar la invalidación de los resultados previstos; deben emplearse los controles adecuados y documentarlos. Los usuarios que no sigan los procedimientos recomendados de la prueba deberán hacerse responsables de la interpretación de los resultados del paciente teniendo en cuenta las circunstancias.
10. Es posible que no todos los ensayos estén registrados en todos los instrumentos. Póngase en contacto con el representante local de servicio Roche para obtener más información.
PREPARACIÓN DE MUESTRAS:
Las muestras citológicas se deben manipular de forma adecuada para conservarlas de cara a los procedimientos inmunocitoquímicos. Todas las muestras deben someterse a los métodos estándar de procesamiento celular.
Para evitar que se oculten ciertos elementos, como la sangre y la mucosa, así como para garantizar que la muestra es adecuada de acuerdo con las Bethesda Guidelines28, los médicos deben seguir las técnicas de muestreo recomendadas.
Los siguientes métodos de preparación de portaobjetos son compatibles con el CINTEC PLUS CYTOLOGY KIT:
• Portaobjetos ThinPrep (Hologic Inc.) preparados en ThinPrep 2000 o 5000 Processor (Hologic Inc.) con portaobjetos ThinPrep Arcless Microscope o Superfrost Plus en función de la recomendación del fabricante.
• Portaobjetos BD SurePath (BD Diagnostics) preparados de acuerdo con las recomendaciones del fabricante.
• Portaobjetos preparados de forma manual (portaobjetos de frotis convencionales).
Se recomienda analizar los controles correspondientes y las muestras del paciente de forma simultánea (consulte la sección de Control de calidad para obtener detalles más precisos).
Preparación de muestras con Roche Cell Collection Medium: Las muestras citológicas extraídas por un profesional sanitario y resuspendidas en Roche Cell Collection Medium (RCCM) destinadas a la tinción inmunocitoquímica con CINTEC PLUS CYTOLOGY KIT se pueden conservar a una temperatura de entre 15 y 30 °C durante 6 semanas, y durante otras 12 semanas más si se congelan a una temperatura de entre 2 y 8 °C.
Se requieren portaobjetos ThinPrep Arcless Microscope o Superfrost Plus para la tinción inmunocitoquímica con el CINTEC PLUS CYTOLOGY KIT en instrumentos BenchMark IHC/ISH.
Preparación de portaobjetos con muestras extraídas en Roche Cell Collection Medium mediante ThinPrep 2000 Processor: Los portaobjetos se preparan con muestras extraídas en Roche Cell Collection Medium mediante ThinPrep 2000 Processor. Una vez que haya terminado la secuencia del procesador ThinPrep 2000 Processor el portaobjetos procesado debe asentarse en un vial de fijación con una solución de etanol de grado de reactivo ≥ 95%. Retire el vial del soporte de la solución fijadora de ThinPrep 2000 Processor y traspase el portaobjetos procesado del vial a un recipiente portaobjetos que contenga una solución de etanol de calidad de reactivo a ≥ 95%. Incube el portaobjetos en etanol durante al menos 15 minutos y nunca más de 60 minutos. Remplace la solución de etanol del vial fijador y de la cubeta de portaobjetos después de haber llevado a cabo 20 preparaciones de portaobjetos. Una vez que haya finalizado el periodo de incubación, retire el portaobjetos de la solución de etanol y colóquelo en horizontal sobre una superficie plana para secarlo durante al menos 60 minutos. Los portaobjetos secos se pueden conservar a temperatura ambiente protegidos de la incidencia directa de la luz y se deben teñir con CINTEC PLUS CYTOLOGY KIT en un plazo máximo de 7 días a partir de su preparación.
Preparación de portaobjetos con muestras extraídas en Roche Cell Collection Medium mediante ThinPrep 5000 Processor: Los portaobjetos se preparan con muestras extraídas en Roche Cell Collection Medium mediante ThinPrep 5000 Processor. Cuando finaliza la secuencia de ThinPrep 5000 Processor, los portaobjetos procesados se asientan en una gradilla sumergida en una solución de etanol de calidad de reactivo a ≥ 95% que contiene una solución fijadora. Retire la solución fijadora o la cubeta de portaobjetos de ThinPrep 5000 Processor e incube los portaobjetos durante al menos otros 15 minutos y nunca más de 60 minutos. Remplace la solución de etanol de la cubeta de portaobjetos después de cada sesión. Una vez que haya finalizado el periodo de incubación, retire los portaobjetos de la solución de etanol y colóquelos en horizontal sobre una superficie plana para secarlos durante al menos 60 minutos. Los portaobjetos secos se pueden conservar a temperatura ambiente protegidos de la incidencia directa de la luz y se deben teñir con CINTEC PLUS CYTOLOGY KIT en un plazo máximo de 7 días a partir de su preparación.
Antes de proceder a la tinción inmunocitoquímica con CINTEC PLUS CYTOLOGY KIT, retire la etiqueta original del portaobjetos que se ha utilizado con ThinPrep 5000 Processor.
Preparación de muestras con PreservCyt: La muestra citológica que se encuentra en PreservCyt Solution (PC) destinada a la tinción inmunocitoquímica con CINTEC PLUS CYTOLOGY KIT se puede conservar a una temperatura de entre 15 y 30 °C durante 6 semanas y durante otras 12 semanas más si se congela a una temperatura de entre 2 y 8 °C.
Se requieren portaobjetos ThinPrep Arcless Microscope o Superfrost Plus para la tinción inmunocitoquímica con el CINTEC PLUS CYTOLOGY KIT en instrumentos BenchMark IHC/ISH.
Slide Preparation con muestras extraídas en PreservCyt mediante ThinPrep 2000 Processor: Los portaobjetos se preparan con muestras citológicas extraídas por un profesional sanitario y resuspendidas en PreservCyt mediante ThinPrep 2000 Processor. Una vez que haya terminado la secuencia del procesador ThinPrep 2000 Processor, el portaobjetos procesado debe asentarse en un vial de fijación con una solución de etanol de grado de reactivo ≥ 95%. Retire el vial del soporte de la solución fijadora de ThinPrep 2000 Processor y traspase el portaobjetos procesado del vial a un recipiente portaobjetos que contenga una solución de etanol de calidad de reactivo a ≥ 95%. Incube el portaobjetos en etanol durante al menos 15 minutos y nunca más de 60 minutos. Remplace la solución de etanol del vial fijador y de la cubeta de portaobjetos después de haber llevado a cabo 20 preparaciones de portaobjetos. Una vez que haya finalizado el periodo de incubación, retire el portaobjetos de la solución de etanol y colóquelo en horizontal sobre una superficie plana para secarlo durante al menos 60 minutos. Los portaobjetos secos se pueden conservar a una temperatura de entre 15 y 30 °C protegidos de la incidencia directa de la luz y se deben teñir con CINTEC PLUS CYTOLOGY KIT en un plazo máximo de 7 días a partir de su preparación.
Slide Preparation con muestras extraídas en PreservCyt mediante ThinPrep 5000 Processor: Los portaobjetos se preparan con muestras citológicas extraídas por un profesional sanitario y resuspendidas en PreservCyt mediante ThinPrep 5000 Processor. Cuando finaliza la secuencia de ThinPrep 5000 Processor, los portaobjetos procesados se asientan en una gradilla sumergida en una solución de etanol de calidad de reactivo a ≥ 95% que contiene una solución fijadora. Retire la solución fijadora o la cubeta de portaobjetos de ThinPrep 5000 Processor e incube los portaobjetos durante al menos otros 15 minutos y nunca más de 60 minutos. Remplace la solución de etanol de la cubeta de portaobjetos después de cada sesión. Una vez que haya finalizado el periodo de incubación, retire los portaobjetos de la solución de etanol y colóquelos en horizontal sobre una superficie plana para secarlos durante al menos 60 minutos. Los portaobjetos secos se pueden conservar a temperatura ambiente protegidos de la incidencia directa de la luz y se deben teñir con CINTEC PLUS CYTOLOGY KIT en un plazo máximo de 7 días a partir de su preparación.
Antes de proceder a la tinción inmunocitoquímica con CINTEC PLUS CYTOLOGY KIT, retire la etiqueta original del portaobjetos que se ha utilizado con ThinPrep 5000 Processor.
Preparación de muestras con BD SurePath: Las muestras citológicas extraídas por un profesional sanitario y resuspendidas en SurePath Preservative Fluid destinadas a la tinción inmunocitoquímica con CINTEC PLUS CYTOLOGY KIT se pueden conservar durante un máximo de 4 semanas a una temperatura de entre 15 y 30 °C o durante 6 meses si se almacenan en un refrigerador a una temperatura de entre 2 y 10 °C.
BD SurePath Slide Preparation inmediatamente después del procesamiento de un portaobjetos para la prueba de Papanicolau: Una vez que se ha generado un sedimento celular enriquecido en la preparación de un portaobjetos para una tinción Papanicolau, se puede utilizar de inmediato para la preparación de un segundo portaobjetos que se vaya a teñir con CINTEC PLUS CYTOLOGY KIT. Siga las recomendaciones del fabricante en cuanto al uso de «Slide Preparation» [opción 2] para muestras GYN en el instrumento PrepStain™. El volumen de resuspensión debe pasar a ser 0 mL en la opción de menú «Change Sample/Stain Parameters».
BD SurePath Slide Preparation a partir de un sedimento celular conservado: Los sedimentos celulares enriquecidos se pueden conservar mediante la incorporación de unos 2 mL de SurePath Preservative Fluid y tapando los tubos de muestra para su almacenamiento (consulte las instrucciones del fabricante para obtener información más detallada). Desde la fecha de recogida de la muestra, los sedimentos celulares resuspendidos en líquido conservante se pueden conservar a una temperatura de entre 15 y 30 °C durante un máximo de 4 semanas y durante 6 meses si se almacena en un refrigerador a una temperatura de entre 2 y 10 °C. Para procesar un portaobjetos para el CINTEC PLUS CYTOLOGY KIT, espere 60 minutos a que la muestra esté a temperatura ambiente. Comience por el segundo paso de centrifugación del proceso adicional GYN y lleve a cabo el resto de los pasos previos al procesamiento, como se describe en las instrucciones del fabricante para reprocesar los sedimentos celulares preservados. Siga las recomendaciones del fabricante en cuanto al uso de «Slide Preparation» [opción 2] para muestras GYN del instrumento PrepStain.
En todas las opciones de preparación que se han mencionado anteriormente, retire la gradilla de portaobjetos del instrumento PrepStain cuando haya finalizado el paso de transferencia de la muestra. Gire la gradilla hasta la posición contraria y deje que se vierta el líquido. Pipetee 2 mL de una solución de etanol de calidad de reactivo a ≥ 95% en cada cámara de estabilización y escurra el líquido de forma inmediata. Enjuague con 2 mL de una solución de etanol de calidad de reactivo a ≥ 95% una segunda vez y deje que incube durante 10 minutos. Escurra el líquido por segunda vez volviendo a girar la gradilla hasta la posición contraria. Retire las cámaras de estabilización de todos los portaobjetos y deje que se sequen los portaobjetos en posición horizontal sobre una superficie plana durante al menos 60 minutos. Los portaobjetos secos se pueden conservar a temperatura ambiente protegidos de la incidencia directa de la luz y se deben teñir con CINTEC PLUS CYTOLOGY KIT en un plazo máximo de 7 días a partir de su preparación.
Uso de frotis convencionales: Los frotis convencionales se deben fijar con un reactivo de fijación citológico en aerosol que contenga polietilenglicol (como Safetex Cytology Fixative o Andwin Scientific) de inmediato tras la recogida de la muestra. Los portaobjetos de frotis convencionales fijados con aerosol se pueden conservar a temperatura ambiente protegidos de la incidencia directa de la luz y se deben teñir con CINTEC PLUS CYTOLOGY KIT en un plazo máximo de 7 días a partir de su preparación.
No se requieren más pasos de procesamiento previo antes de colocar los portaobjetos en el instrumento BenchMark IHC/ISH.
PRINCIPIO DEL PROCEDIMIENTO:
El CINTEC PLUS CYTOLOGY KIT contiene un conjunto de reactivos para la detección inmunocitoquímica simultánea de las proteínas p16INK4a y Ki-67 en muestras de citología que se han extraído del cuello uterino. Las proteínas se detectan a partir de una combinación lista para su uso de anticuerpos monoclonales primarios que contiene un anticuerpo recombinante monoclonal de ratón dirigido contra la proteína p16INK4a humana (clon E6H4™) y un anticuerpo primario recombinante de conejo dirigido contra la proteína Ki-67 humana (clon 274-11AC3V1). Tras el acondicionamiento celular, la inhibición de la actividad peroxidasa endógena y la incubación con la combinación de anticuerpos primarios, el ensayo emplea dos sistemas de detección listos para utilizar y optimizados para su uso en las muestras de citología de cuello uterino:
• Un anticuerpo secundario cabra antirratón con unión covalente a haptenos de HQ (hapteno patentado) y un anticuerpo terciario de hapteno anti-HQ conjugado con peroxidasa de rábano (HRP) optimizado para la detección del clon de anticuerpo antirratón monoclonal E6H4.
• Un anticuerpo secundario cabra anticonejo con unión covalente a haptenos de NP (hapteno patentado) y un anticuerpo terciario de hapteno anti-NP conjugado con fosfatasa alcalina (AP) optimizado para la detección del clon de anticuerpo recombinante de conejo 274-11AC3V1.
Las reacciones cromogénicas se basan en la conversión mediada por HRP de tetrahidrocloruro de 3,3"-diaminobencidina (DAB) y la conversión mediada por AP de Fast Red con Naphthol Phosphate, lo que da lugar a un precipitado de color marrón en el sitio del antígeno p16INK4a y un precipitado de color rojo en el sitio del antígeno Ki-67, respectivamente.
Tras la contratinción y el azulado automatizados, se lleva a cabo un procedimiento de montaje en dos pasos. Primero, es preciso montar el portaobjetos con un medio de montaje acuoso. Posteriormente, se coloca un cubreobjetos en el portaobjetos con un medio de montaje permanente. Los resultados de la tinción se deben evaluar mediante inspección de microscopía óptica.
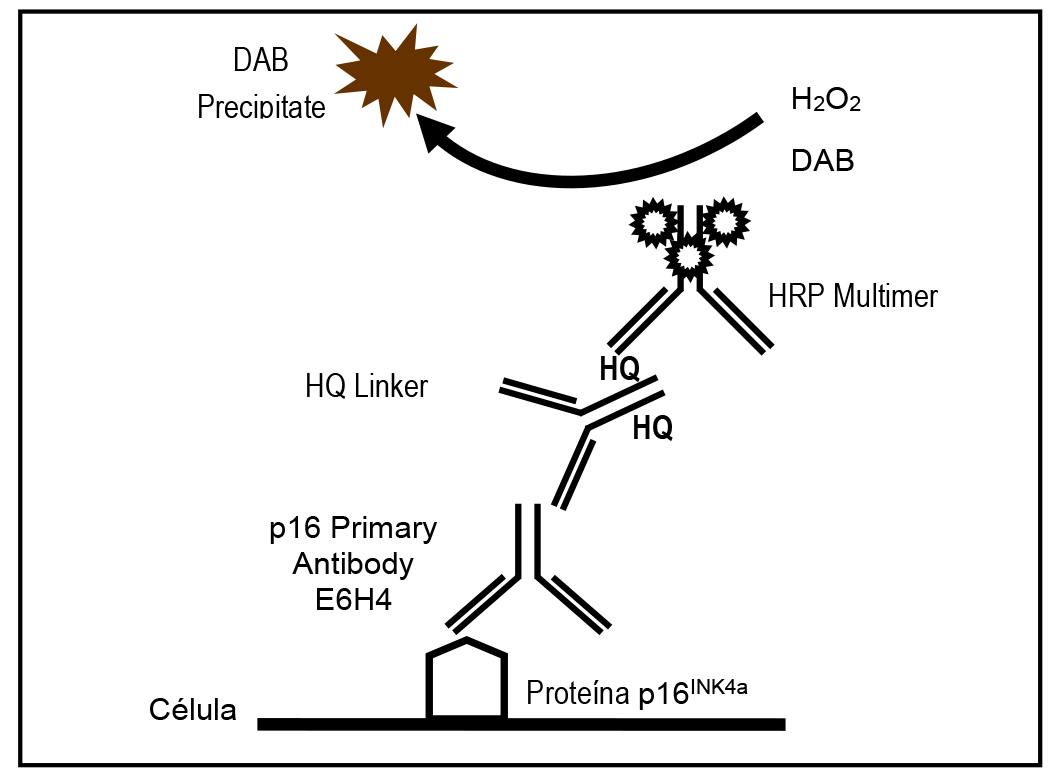
Figura 2. Detección de la proteína p16INK4a humana
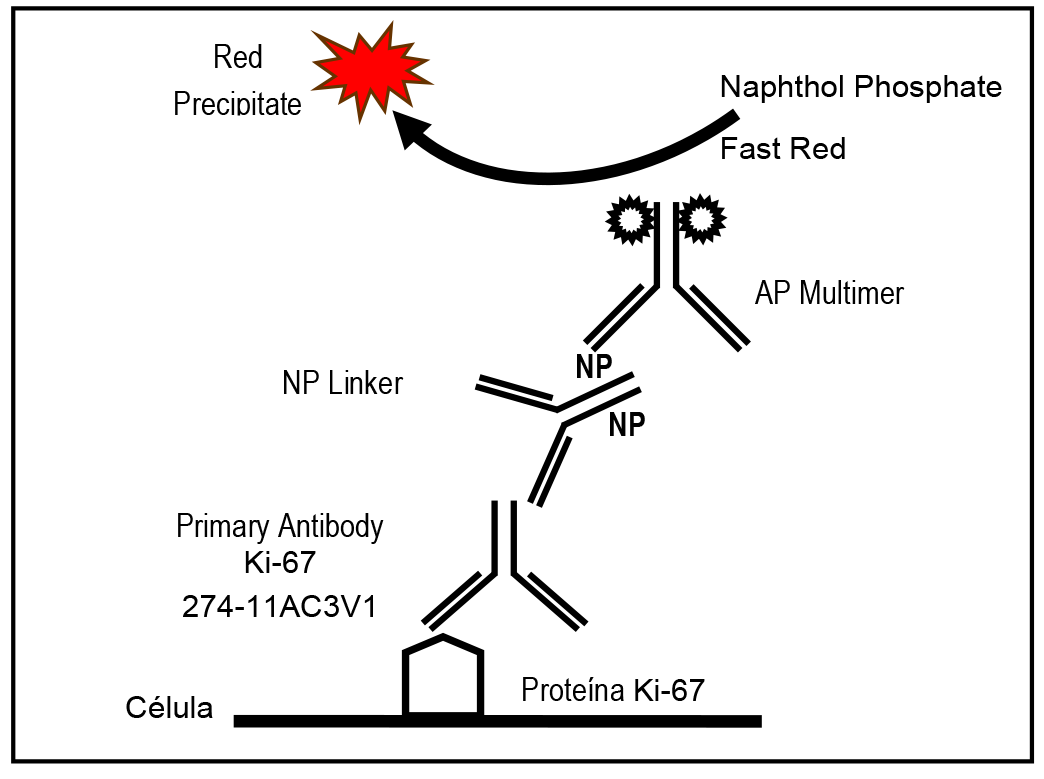
Figura 3. Detección de la proteína Ki-67 humana
PROCEDIMIENTO DE TINCIÓN:
CINTEC PLUS CYTOLOGY KIT se ha creado para su uso con instrumentos BenchMark IHC/ISH junto con los reactivos auxiliares VENTANA y sus accesorios.
CINTEC PLUS CYTOLOGY KIT se ha optimizado a partir de los parámetros que se muestran en las tablas 2, 3 y 4; el usuario debe validar todos los resultados que se obtengan con este kit.
Los parámetros de los protocolos automatizados se pueden visualizar, imprimir y editar según las instrucciones descritas en el Manual del usuario del instrumento.
Tabla 2. Protocolo de tinción recomendado para los portaobjetos preparados con ThinPrep, SurePath y portaobjetos de frotis convencionales en un instrumento BenchMark GX
|
Procedimiento de tinción |
GX CINTEC PLUS CYTOLOGY |
||
|
Opciones que se pueden seleccionar |
Tipo de slide preparation |
||
|
RCCM/ThinPrep |
SurePath |
Convencional |
|
|
ThinPrep |
Seleccionado |
No seleccionado |
No seleccionado |
|
SurePath |
No seleccionado |
Seleccionado |
No seleccionado |
|
Otros |
No seleccionado |
No seleccionado |
Seleccionado |
|
Opción de Cell Conditioning |
No se puede seleccionar |
No se puede seleccionar |
16 minutos |
|
Tiempo de incubación del anticuerpo |
16 minutos |
20 minutos |
16 minutos |
|
Tiempo de incubación en HQ Linker |
12 minutos |
16 minutos |
12 minutos |
|
Tiempo de HRP Multimer Inc |
6 minutos |
8 minutos |
8 minutos |
|
Tiempo de incubación en NP Linker |
8 minutos |
16 minutos |
8 minutos |
|
Tiempo de incubación en AP Multimer |
8 minutos |
8 minutos |
8 minutos |
|
Hematoxylin |
8 minutos |
8 minutos |
8 minutos |
|
Bluing |
4 minutos |
4 minutos |
4 minutos |
Tabla 3. Protocolo de tinción recomendado para los portaobjetos preparados con ThinPrep, SurePath y los frotis convencionales en el instrumento BenchMark XT
|
Procedimiento de tinción |
XT CINTEC PLUS CYTOLOGY |
||
|
Opciones que se pueden seleccionar |
Tipo de slide preparation |
||
|
RCCM/ThinPrep |
SurePath |
Convencional |
|
|
ThinPrep |
Seleccionado |
No seleccionado |
No seleccionado |
|
SurePath |
No seleccionado |
Seleccionado |
No seleccionado |
|
Otros |
No seleccionado |
No seleccionado |
Seleccionado |
|
Opción de Cell Conditioning |
No se puede seleccionar |
No se puede seleccionar |
16 minutos |
|
Tiempo de incubación del anticuerpo |
16 minutos |
20 minutos |
16 minutos |
|
Tiempo de incubación en HQ Linker |
12 minutos |
16 minutos |
12 minutos |
|
Tiempo de HRP Multimer Inc |
8 minutos |
8 minutos |
8 minutos |
|
Tiempo de incubación en NP Linker |
8 minutos |
16 minutos |
8 minutos |
|
Tiempo de incubación en AP Multimer |
8 minutos |
8 minutos |
8 minutos |
|
Hematoxylin |
8 minutos |
8 minutos |
8 minutos |
|
Bluing |
4 minutos |
4 minutos |
4 minutos |
Tabla 4. Protocolo de tinción recomendado para los portaobjetos preparados con ThinPrep, SurePath y los frotis convencionales en los instrumentos BenchMark ULTRA o BenchMark ULTRA PLUS
|
Procedimiento de tinción |
U CINTEC PLUS CYTOLOGY |
||
|
Opciones que se pueden seleccionar |
Tipo de slide preparation |
||
|
RCCM/ThinPrep |
SurePath |
Convencional |
|
|
ThinPrep |
Seleccionado |
No seleccionado |
No seleccionado |
|
SurePath |
No seleccionado |
Seleccionado |
No seleccionado |
|
Otros |
No seleccionado |
No seleccionado |
Seleccionado |
|
Opción de Cell Conditioning |
No se puede seleccionar |
No se puede seleccionar |
16 minutos |
|
Tiempo de incubación del anticuerpo |
16 minutos |
16 minutos |
16 minutos |
|
Tiempo de incubación en HQ Linker |
12 minutos |
16 minutos |
12 minutos |
|
Tiempo de HRP Multimer Inc |
8 minutos |
8 minutos |
8 minutos |
|
Tiempo de incubación en NP Linker |
8 minutos |
16 minutos |
8 minutos |
|
Tiempo de incubación en AP Multimer |
8 minutos |
8 minutos |
8 minutos |
|
Hematoxylin |
8 minutos |
8 minutos |
8 minutos |
|
Bluing |
4 minutos |
4 minutos |
4 minutos |
PROCEDIMIENTO POSTERIOR AL PROCESAMIENTO: MONTAJE Y COLOCACIÓN DE CUBREOBJETOS:
Para que la sensibilidad sea óptima en todo momento y para evitar la desaparición del color de los cromógenos, es necesario llevar a cabo un procedimiento de montaje en dos pasos.
Retire los portaobjetos del instrumento BenchMark IHC/ISH, y agite y enjuague suavemente los portaobjetos con agua del grifo, desionizada o destilada y detergente lavavajillas suave hasta que haya desaparecido por completo la solución LCS de los portaobjetos.
Nota: No deje correr el agua directamente encima de los portaobjetos. Deje correr el agua con la presión mínima.
Los portaobjetos se montan mediante un protocolo de dos pasos y los siguientes pasos han de llevarse a cabo de forma secuencial:
Montaje acuoso:
1. Incube los portaobjetos en agua destilada o desionizada durante al menos 1 minuto.
2. Los portaobjetos en los que no se vaya a colocar cubreobjetos deben permanecer en agua destilada o desionizada durante la aplicación del medio de montaje acuoso CC/Mount al resto de los portaobjetos.
3. Retire un solo portaobjetos del agua destilada o desionizada y seque suavemente la parte posterior con una toallita de papel para eliminar el exceso de agua. No retire el agua ni la seque por la parte frontal del portaobjetos (el lado en el que se encuentra la muestra).
4. Mantenga el portaobjetos ligeramente inclinado y aplique de 4 a 6 gotas de medio de montaje acuoso CC/Mount en cada portaobjetos de ThinPrep o SurePath y 8 gotas en los portaobjetos de frotis convencionales. Evite que se generen burbujas de aire. Para evitar la formación de burbujas es posible descartar la primera gota en una toallita de papel antes de aplicar CC/Mount en el área de preparación de la muestra del portaobjetos.
5. Incline suavemente el portaobjetos de vidrio y gírelo con cuidado para que se genere una fina capa de medio de montaje que cubra completamente el área de preparación de la muestra (de momento no se debe aplicar ningún cubreobjetos, ya sea de vidrio o de lámina); compruebe la distribución del medio de montaje en el portaobjetos mediante una inspección visual.
6. Limpie el exceso de los medios de montaje acuoso CC/Mount de la parte trasera y los extremos del portaobjetos. Si fuera necesario, utilice una toallita de papel.
7. Para secarlos, coloque los portaobjetos preparados en posición horizontal.
• Incube los portaobjetos preparados con ThinPrep o SurePath durante una hora a una temperatura de entre 37 y 60 °C o, de forma opcional, a temperatura ambiente durante toda la noche.
• Incube los portaobjetos de frotis convencionales a una temperatura de 37 °C durante cuatro horas o a 60 °C durante una hora; también puede dejarlos durante toda la noche a temperatura ambiente.
Cubreobjetos de vidrio o película:
1. Una vez que se ha secado por completo el montaje acuoso CC/Mount, deje que los portaobjetos alcancen la temperatura ambiente, siempre que sea necesario. Incube los portaobjetos en xileno durante al menos 1 minuto y un máximo de 20 minutos. A continuación coloque el cubreobjetos en los portaobjetos mediante un método de vidrio o de película con medio de montaje con base de xileno.
Nota: Los portaobjetos no deben deshidratarse mediante una serie de gradientes de soluciones de alcohol antes de aplicar el cubreobjetos de vidrio o de película.
2. Deje que el medio de montaje con base de xileno se seque a temperatura ambiente.
Nota: Para reducir al máximo la desaparición del color, proteja los portaobjetos de la luz y consérvelos a temperatura ambiente.
RESUMEN Y EXPLICACIÓN
En las células eucarióticas, el control de la progresión del ciclo de división celular está regulado por un patrón complejo de expresión controlada y de modificaciones postraducción de las proteínas que regulan el ciclo celular. La proteína p16INK4a desempeña una función esencial en el mecanismo de regulación del ciclo de las células eucariotas. Está implicada en el control inducido por la proteína del retinoblastoma (pRb) de la transición de la fase G1/S y activa la detención del ciclo celular durante los procesos de diferenciación celular. Por tanto, p16INK4a facilita el efecto antiproliferativo durante la evolución del ciclo celular normal.1 En las células epiteliales diferenciadas terminalmente, la expresión de p16INK4a se reduce a niveles que habitualmente no es posible detectar con la inmunocitoquímica (ICC).2
En la displasia cervical, la sobreexpresión de p16 se considera un biomarcador subrogado de infecciones transformantes por VPH, lo que refleja la activación de la proliferación de células generada por la oncoproteína E6/E7 del VPH.2,3,4,5 La detección de p16 en preparaciones de citología de cuello uterino se ha propuesto como un marcador adicional valioso para el triaje de mujeres con resultados anómalos en la citología del cuello uterino (prueba de Papanicolau) y un resultado positivo en las pruebas de VPH.3,4,5 Sin embargo, debido a que puede detectarse la tinción específica de p16 en células metaplásicas o endocervicales en las que el p16 se expresa para ejercer su función celular normal supresora del crecimiento, la interpretación de las preparaciones de citología de cuello uterino de p16 de tinción única requiere la identificación de células inmunorreactivas a p16 y la posterior clasificación de estas células en función de las señales de anomalías morfológicas.2,3,4
La detección simultánea combinada de p16 y el marcador de proliferación Ki-67 dentro de la misma célula mediante inmunocitoquímica (ICC) ha demostrado ser una herramienta valiosa para la identificación de células cervicales displásicas en preparaciones de citología sin necesidad de aplicar técnicas de interpretación morfológica.3,7,8 La Ki-67 es una proteína nuclear y nucleolar estrictamente relacionada con la proliferación de células, imposible de detectar mediante métodos estándares de inmunotinción en células en reposo (G0).6 En condiciones fisiológicas normales, la expresión de la proteína asociada a la proliferación Ki-67 es mutuamente excluyente de la proteína antiproliferativa p16. Por el contrario, las células en las que la secuencia mediada por la proteína del retinoblastoma (pRB) que controla la progresión del ciclo celular está abrogada a fases anteriores a la función supresora del tumor de la p16 (como las células epiteliales que expresan oncoproteínas E6/E7 de alto riesgo de VPH) podrían proliferar y, por tanto, expresar la Ki-67 en presencia de p16 funcional.2,3
Por lo tanto, la detección de células individuales en preparaciones de citología de cuello uterino que coexpresan simultáneamente las proteínas p16 y Ki-67 puede utilizarse como un indicador de células con un ciclo celular desregulado independiente a la morfología. Esta coexpresión de las proteínas p16 y Ki-67 puede utilizarse como un indicador de la presencia de infecciones transformantes por VPH y neoplasia intraepitelial de cuello de útero subyacente.2,3 En el pasado reciente, se han llevado a cabo y publicado numerosos estudios en los que se evalua el valor potencial y la utilidad clínica de la citología de tinción dual p16/Ki-67 para la identificación de mujeres que podrían beneficiarse de una derivación a colposcopia a partir de varios resultados de cribado primario de cáncer de cuello uterino. Estos resultados incluyen el triaje de mujeres con resultados en la citología Papanicolau que muestran la presencia de Atypical Squamous Cells of Undetermined Significance (ASC-US) o Low grade Squamous Intraepithelial Lesion (LSIL), mujeres con resultados positivos en infección por VPH de alto riesgo en un cribado primario de VPH, o mujeres con un resultado Negative for Intraepithelial Lesion or Malignancy (NILM)/positivo en VPH en un centro médico en el que se utiliza la combinación de pruebas de citología de Papanicolau/VPH para un cribado primario.7-25
REFERENCIAS:
1. Kim WY, Sharpless NE. The regulation of INK4/ARF in cancer and aging. Cell. 2006 Oct 20;127(2):265-75.
2. Wentzensen N, von Knebel Doeberitz M. Biomarkers in cervical cancer screening. Dis Markers. 2007;23:315-30.
3. Cuschieri K, Wentzensen N. Human papillomavirus mRNA and p16 detection as biomarkers for the improved diagnosis of cervical neoplasia. Cancer Epidemiol Biomarkers Prev. 2008;17(10):2536-2545.
4. Roelens J, Reuschenbach M, von Knebel Doeberitz M, et al. p16INK4a immunocytochemistry versus human papillomavirus testing for triage of women with minor cytologic abnormalities: a systematic review and meta-analysis. Cancer Cytopathol. 2012;120(5):294–307.
5. Carozzi F, Gillio-Tos A, Confortini M, et al. Risk of high-grade cervical intraepithelial neoplasia during follow-up in HPV-positive women according to baseline p16-INK4a results: a prospective analysis of a nested substudy of the NTCC randomised controlled trial. Lancet Oncol. 2013;14(2):168-76.
6. Scholzen T, Gerdes J. The Ki-67 protein: from the known and the unknown. J Cell Physiol. 2000;182:311-22.
7. Schmidt D, Bergeron C, Denton KJ, et al. p16/Ki-67 Dual-stain cytology in the triage of ASCUS and LSIL Papanicolaou cytology: Results from the European equivocal or mildly abnormal Papanicolaou cytology study. Cancer Cytopathol. 2011;119(3):158- 66.
8. Petry KU, Schmidt D, Scherbring S, et al. Triaging Pap cytology negative, HPV positive cervical cancer screening results with p16/Ki-67 Dual-stained cytology. Gynecol Oncol. 2011;121(3):505-9.
9. Ravarino A, Nemolato S, Macciocu E, et al. CINtec PLUS immunocytochemistry as a tool for the cytologic diagnosis of glandular lesions of the cervix uteri. Am J Clin Pathol. 2012;138(5):652-6.
10. Singh M, Mockler D, Akalin A, et al. Immunocytochemical colocalization of p16(INK4a) and Ki-67 predicts CIN2/3 and AIS/adenocarcinoma. Cancer Cytopathol. 2012;120(1):26-34.
11. Ikenberg H, Bergeron C, Schmidt D, et al. Screening for Cervical Cancer Precursors with p16/Ki-67 Dual-stained Cytology: Results of the PALMS Study. J Natl Cancer Inst. 2013;105(20):1550-7.
12. Wentzensen N, Fetterman B, Castle PE, et al. p16/Ki-67 Dual Stain Cytology for Detection of Cervical Precancer in HPV-Positive Women. J Natl Cancer Inst. 2015 Sep 15;107(12):djv257.
13. Uijterwaal MH, Polman NJ, Witte BI, et al. Triaging HPV-positive women with normal cytology by p16/Ki-67 dual-stained cytology testing: baseline and longitudinal data. Int J Cancer. 2015;136(10):2361-68.
14. Wentzensen N, Schwartz L, Zuna RE, et al. Performance of p16/Ki-67 immunostaining to detect cervical cancer precursors in a colposcopy referral population. Clin Cancer Res. 2012;18(15):4154-62.
15. Bergeron C, Ikenberg H, Sideri M, et al. Prospective evaluation of p16/Ki-67 dual- stained cytology for managing women with abnormal Papanicolaou cytology: PALMS study results. Cancer Cytopathol, 2015. 123(6):373-81.
16. Dona MG, Vocaturo A, Giuliani M, et al. p16/Ki-67 dual staining in cervico-vaginal cytology: Correlation with histology, Human Papillomavirus detection and genotyping in women undergoing colposcopy. Gynecol Oncol. 2012;126(2):198-202.
17. Allia E, Ronco G, Coccia A, et al. Interpretation of p16(INK4a) /Ki-67 dual immunostaining for the triage of human papillomavirus-positive women by experts and nonexperts in cervical cytology. Cancer Cytopathol. 2015;123(4):212-218.
18. Gustinucci D, Giorgi Rossi P, Cesarini E, et al. Use of cytology, E6/E7 mRNA, and p16INK4a-Ki-67 to define the management of human papillomavirus (HPV)-positive women in cervical cancer screening. Am J Clin Pathol, 2016; 145(1):35-45.
19. Rossi P, Borghi L, Ferro R, Mencarelli R. A population of 1136 HPV DNA-HR positive women: expression of p16(INK4a)/Ki67 Dual-Stain Cytology and cytological diagnosis. Histological correlations and cytological follow up. Pathologica. 2015;107(3-4):185-191.
20. Wright TC Jr, Behrens CM, Ranger-Moore J, et al. Triaging HPV-positive women with p16/Ki-67 dual-stained cytology: Results from a sub-study nested into the ATHENA trial. Gynecol Oncol. 2017;144:51-56.
21. Clarke MA, Cheung LC, Castle PE, et al. Five-Year Risk of Cervical Precancer Following p16/Ki-67 Dual-Stain Triage of HPV-Positive Women. JAMA Oncol. 2019;5(2):181-186.
22. Wentzensen N, Clarke MA, Bremer R, et al. Clinical Evaluation of Human Papillomavirus Screening With p16/Ki-67 Dual Stain Triage in a Large Organized Cervical Cancer Screening Program. JAMA Intern Med. 2019;179(7):881-888.
23. Wentzensen N, Fetterman B, Tokugawa D, et al. Interobserver reproducibility and accuracy of p16/Ki-67 dual-stain cytology in cervical cancer screening. Cancer Cytopathol, 2014;122(12):914-20.
24. Arean-Cuns C, Mercado-Gutierrez M, Paniello-Alastruey I, et al. Dual staining for p16/Ki67 is a more specific test than cytology for triage of HPV-positive women. Virchows Arch. 2018;473(5):599-606.
25. Ebisch RMF, van der Horst J, Hermsen M, et al. Evaluation of p16/Ki-67 dual- stained cytology as triage test for high-risk human papillomavirus-positive women. Mod Pathol. 2017;30(7): 1021-1031.
26. Occupational Safety and Health Standards: Occupational exposure to hazardous chemicals in laboratories. (29 CFR Part 1910.1450). Fed. Register.
27. Directive 2000/54/EC of the European Parliament and Council of 24 June 2020 on the protection of workers from risks related to exposure to biological agents at work.
28. Nayar R and Wilbur DC, eds. The Bethesda System for Reporting Cervical Cytology: Definitions, Criteria, and Explanatory Notes. 3rd ed. 2015, Springer International Publishing: Switzerland.
Nota: En este documento se ha usado el punto como separador decimal para marcar el borde entre la parte entera y la parte fraccionaria de los numerales con decimales. No se han usado separadores para las unidades de millar.
El resumen de los aspectos de seguridad y rendimiento se puede ver a continuación: http://ec.europa.edu/tools/eudamed
Símbolos: Ventana usa los siguientes símbolos y signos además de los indicados en la norma ISO 15223-1 (para USA: consulte elabdoc.roche.com/symbols para obtener más información).
Número mundial de artículo comercial
Rx only: Para USA: Precaución: Las normas nacionales restringen la venta de este dispositivo a médicos autorizados o por orden de estos.
Propiedad intelectual:
Ventana, Benchmark, Cintec y Cobas son marcas comerciales de Roche. Todos los demás nombres de productos y marcas comerciales pertenecen a sus respectivos propietarios.
© 2025 Ventana Medical Systems, Inc.
For USA: Rx only
Información de Contacto:
ROCHE DIAGNOSTICS GmbH
Sandhofer Strasse 116
68305, Mannheim, Germany
+800 5505 6606