
CELEBREX
CELECOXIB
Cápsulas
1 Caja, 20 Cápsulas, 100 mg
1 Caja, 10 Cápsulas, 200 mg
1 Caja, 20 Cápsulas, 200 mg
1 Caja, 30 Cápsulas, 200 mg
1 Caja, 1 Cápsulas, 400 mg
1 Caja, 5 Cápsulas, 200 mg
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada CÁPSULA contiene:
Celecoxib 100 mg, 200 mg, 400 mg
Excipiente cbp 1 cápsula
INDICACIONES TERAPÉUTICAS:
Tratamiento sintomático de la osteoartritis (OA) y artritis reumatoide (AR).
Tratamiento de signos y síntomas de la espondilitis anquilosante (EA).
Manejo del dolor agudo.
Tratamiento de la dismenorrea primaria (DM).
Manejo del dolor de espalda baja (DEB).
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacocinéticas:
Absorción: La farmacocinética de celecoxib ha sido evaluada en aproximadamente 1 500 individuos. Cuando se administra en ayuno, celecoxib es bien absorbido en el tracto gastrointestinal alcanzando concentraciones plasmáticas máximas después de aproximadamente 2-3 h. La biodisponibilidad oral de las cápsulas es de aproximadamente 99% comparado con la administración en suspensión (forma farmacéutica oral con disponibilidad óptima). Bajo condiciones de ayuno, tanto los niveles plasmáticos máximos (Cmáx) como el área bajo la curva (ABC) son aproximadamente proporcionales a las dosis de hasta 200 mg dos veces al día. A dosis más altas los aumentos proporcionales en Cmáx y ABC son inferiores.
Distribución: La unión a proteínas plasmáticas, la cual es independiente de la concentración, es de alrededor del 97% a concentraciones plasmáticas terapéuticas y en sangre celecoxib no tiene preferencia de unión a los eritrocitos.
Metabolismo: El metabolismo de celecoxib está mediado primariamente a través del citocromo P450 2C9. Se han identificado tres metabolitos inactivos como inhibidores de la ciclooxigenasa 1 (COX-1) o la ciclooxigenasa 2 (COX-2) en el plasma humano: un alcohol primario, el ácido carboxílico correspondiente y su conjugado glucurónido.
La actividad del citocromo P450 2C9 es baja en personas con polimorfismos genéticos que tienden a reducir la actividad enzimática, tales como los homocigotos para el polimorfismo CYP2C9*3.
En un estudio farmacocinético de celecoxib de 200 mg administrado una vez al día en voluntarios sanos con genotipo CYP2C9*1/*1, CYP2C9*1/*3, CYP2C9*3/*3, la mediana de la Cmáx y ABC0-24 de celecoxib en el día 7 fue aproximadamente de 4 y 7 veces más alta, respectivamente, en sujetos con genotipo CYP2C9*3/*3 en comparación con los otros genotipos. En tres estudios independientes de dosis única que incluyeron un total de 5 sujetos con genotipo CYP2C9*3/*3, el ABC0-24 de la dosis única aumentó aproximadamente 3 veces en comparación con sujetos con metabolismo normal. Se estima que la frecuencia del genotipo homocigótico *3/*3 es 0.3-1.0% entre los diferentes grupos étnicos.
Celecoxib debe administrarse con precaución en pacientes con certeza o sospecha de metabolismo deficiente por CYP2C9 basado en antecedentes o experiencias previas con otros sustratos de CYP2C9. Considere iniciar el tratamiento con la mitad de la dosis más baja recomendada (ver secciones Dosis y vía de administración e Interacciones medicamentosas y de otro género).
Excreción: La eliminación de celecoxib se realiza principalmente por metabolismo hepático con menos del 1% de la dosis excretada sin cambios por la orina. Después de la administración de dosis múltiples, la vida media de eliminación (t½ de eliminación) es de 8-12 h y la velocidad de depuración es de aproximadamente 500 mL/min. Con dosis múltiples se alcanzan las concentraciones plasmáticas en estado estacionario antes del quinto día de administración. La variabilidad de los parámetros farmacocinéticos principales (ABC, Cmáx, t½ de eliminación) entre los pacientes estudiados es de aproximadamente el 30%. La media del volumen de distribución en estado estacionario es de aproximadamente 500 L/70 kg en adultos jóvenes sanos, lo que indica una amplia distribución de celecoxib en los tejidos. Los estudios preclínicos indican que el fármaco atraviesa la barrera hematoencefálica.
Efectos de los alimentos: La administración de celecoxib con alimentos (altos en grasas) retarda su absorción lo que resulta en un tmáx de aproximadamente 4 h e incrementa la biodisponibilidad aproximadamente en un 20% (ver sección Dosis y vía de administración).
En voluntarios sanos, la exposición sistémica generalizada (ABC) de celecoxib fue equivalente cuando se administró como una cápsula intacta o mezclando el contenido de la cápsula en puré de manzana. No se observaron alteraciones significativas en la Cmáx, tmáx o t½ después de la administración del contenido de la cápsula en puré de manzana.
Poblaciones especiales:
Pacientes de edad avanzada: En la población > 65 años hay un aumento de 1.5-2 veces la Cmáx promedio y del ABC de celecoxib. Este aumento está predominantemente relacionado con el peso y no con la edad, siendo los niveles de celecoxib más altos en personas con peso bajo y, por consiguiente, más altos en la población de edad avanzada, quienes generalmente tienen un peso promedio menor que la población más joven. Por lo tanto, las mujeres de edad avanzada tienden a tener concentraciones plasmáticas más altas del fármaco que los hombres de la misma edad. Generalmente no es necesario un ajuste de dosis. Sin embargo, para pacientes de edad avanzada con un peso corporal promedio más bajo (< 50 kg) inicie la terapia a la dosis más baja recomendada.
Raza: Un metaanálisis de estudios farmacocinéticos sugirió un ABC aproximadamente 40% más alto de celecoxib en la población negra comparado con la caucásica. La causa e importancia clínica de este hallazgo es desconocida.
Insuficiencia hepática: Las concentraciones plasmáticas de celecoxib en pacientes con insuficiencia hepática leve (Child-Pugh Clase A) no son significativamente diferentes a las de los controles equiparados en edad y sexo. En pacientes con insuficiencia hepática moderada (Child-Pugh Clase B), las concentraciones plasmáticas de celecoxib son aproximadamente dos veces más altas que las de los controles equiparados (ver sección Dosis y vía de administración).
Insuficiencia renal: En voluntarios de edad avanzada con reducciones en la tasa de filtración glomerular (TFG) relacionadas con la edad (TFG promedio > 65 mL/min/1.73 m2) y en pacientes con insuficiencia renal crónica estable (TFG 35-60 mL/min/1.73 m2), la farmacocinética de celecoxib fue comparable a la observada en pacientes con función renal normal. No se observó una relación significativa entre la creatinina sérica (o depuración de creatinina) y la depuración de celecoxib. No se espera que la insuficiencia renal grave altere la depuración de celecoxib debido a que la principal vía de eliminación es a través de su metabolismo hepático a metabolitos inactivos.
Efectos renales: El papel relativo que desempeñan COX-1 y COX-2 en la fisiología renal no se conoce completamente. Celecoxib disminuye la excreción urinaria de la PGE2 y la 6-ceto-PGF1α (un metabolito de la prostaciclina), pero no afecta al tromboxano sérico B2 (TXB2) ni la excreción urinaria del 11-dehidro-TXB2, un metabolito del tromboxano (ambos productos de COX-1). Estudios específicos han mostrado que celecoxib no produce disminución en la TFG en pacientes de edad avanzada o en aquellos con insuficiencia renal crónica. Estos estudios también han mostrado disminuciones transitorias en la fracción excretada de sodio. En estudios en pacientes con artritis se observó una incidencia de edema periférico comparable a la observada con los inhibidores no específicos de COX (los cuales también poseen una actividad inhibitoria de COX-2). Esto fue más evidente en pacientes que recibieron una terapia diurética concomitante. Sin embargo, no se ha observado aumento en la incidencia de hipertensión ni insuficiencia cardiaca y el edema periférico ha sido leve y autolimitado.
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: M01AH Coxibs.
El mecanismo de acción de celecoxib es mediante la inhibición de la síntesis de prostaglandinas principalmente por la inhibición de COX-2. A concentraciones terapéuticas en humanos celecoxib no inhibe a COX-1. COX-2 se induce en respuesta a estímulos inflamatorios. Esto conduce a la síntesis y acumulación de prostanoides inflamatorios, en particular prostaglandina E2 causando inflamación, edema y dolor. Celecoxib actúa en modelos animales como un agente antiinflamatorio, analgésico y antipirético al bloquear la producción de prostanoides inflamatorios mediante la inhibición de COX-2. En modelos animales de tumor de colon, celecoxib redujo la incidencia y multiplicidad de tumores.
Estudios in vivo y ex vivo muestran que celecoxib tiene una afinidad muy baja por la enzima COX-1 que se expresa en forma constitutiva. Por consiguiente, en dosis terapéuticas, celecoxib no tiene efecto sobre los prostanoides sintetizados por la activación de COX-1 por lo que no interfiere con los procesos fisiológicos normales relacionados con COX-1 en tejidos, especialmente en estómago, intestino y plaquetas.
Estudios clínicos:
Osteoartritis (OA): Celecoxib ha demostrado reducción significativa en el dolor de las articulaciones comparado con placebo. Celecoxib se evaluó para el tratamiento de signos y síntomas de OA de rodilla y cadera en aproximadamente 4 200 pacientes en estudios clínicos con placebo y fármaco controlado con una duración de hasta 12 semanas. En pacientes con OA, el tratamiento con 100 mg de celecoxib dos veces al día o 200 mg una vez al día resultó en una mejoría en el índice de OA Western Ontario and McMaster Universities (WOMAC, por sus siglas en inglés) que es una combinación de mediciones sobre dolor, rigidez y funcionalidad en OA. En tres estudios de 12 semanas acerca del dolor que acompaña a una exacerbación de OA, celecoxib en dosis de 100 mg o 200 mg dos veces al día resultó en una disminución significativa del dolor de 24-48 h después de iniciar la dosis. A dosis de 100 mg o 200 mg dos veces al día, la eficacia de celecoxib demostró ser similar a la de 500 mg de naproxeno dos veces al día. Se ha demostrado que una dosis diaria total de 200 mg es igualmente efectiva tanto si se administran 100 mg dos veces al día como 200 mg una vez al día.
Artritis reumatoide (AR): Celecoxib ha mostrado una disminución significativa en la sensibilidad/dolor e inflamación articular en comparación con el placebo. Celecoxib se evaluó en el tratamiento de signos y síntomas de AR en aproximadamente 2 100 pacientes en estudios clínicos con placebo y fármaco controlado con una duración de hasta 24 semanas. En estos estudios se demostró que celecoxib es superior al placebo utilizando el Índice de Respuesta del American College of Rheumatology 20 (ACR20, por sus siglas en inglés), una combinación de mediciones clínicas, de laboratorio y funcionales en AR. Las dosis de 100 mg y 200 mg dos veces al día de celecoxib fueron similares en eficacia y ambas fueron comparables con 500 mg de naproxeno dos veces al día.
Aunque 100 mg y 200 mg dos veces al día de celecoxib proporcionaron eficacia general similar, algunos pacientes obtuvieron beneficio adicional de la dosis con 200 mg dos veces al día. Dosis de 400 mg dos veces al día no proporcionaron beneficio adicional sobre el observado con 100-200 mg dos veces al día.
Analgesia incluyendo dismenorrea primaria (DM): En modelos de analgesia aguda de dolor poscirugía oral, dolor poscirugía ortopédica y DM, celecoxib alivió el dolor que fue calificado por los pacientes como de moderado a intenso. Dosis únicas de celecoxib proporcionaron alivio del dolor en un plazo de 60 minutos (ver sección Dosis y vía de administración).
Espondilitis anquilosante (EA): Celecoxib fue evaluado en pacientes con EA en dos estudios clínicos con placebo y fármaco (naproxeno o ketoprofeno) controlado de 6 y 12 semanas de duración. Celecoxib a dosis de 100 mg dos veces al día, 200 mg una vez al día y 400 mg una vez al día fue estadísticamente superior al placebo en estos estudios para las tres medidas de eficacia coprimarias valorando la intensidad global del dolor (Escala Visual Análoga), la actividad global de la enfermedad (Escala Visual Análoga) y el deterioro funcional (Índice Funcional de EA de Bath). En el estudio de 12 semanas no hubo diferencia en el grado de mejoría entre las dosis de 200 mg y 400 mg de celecoxib en una comparación del cambio promedio con respecto al estado basal pero hubo un mayor porcentaje de pacientes que respondieron a 400 mg (53%) que a 200 mg (44%) de celecoxib según los criterios de respuesta de la Evaluación de EA (ASAS 20, por sus siglas en inglés). ASAS 20 define como buena respuesta una mejoría de al menos 20% desde el estado basal y una mejoría absoluta de por lo menos 10 mm (en una escala de 0 a 100 mm), por lo menos en tres de los siguientes cuatro campos: evaluación global del paciente, dolor, Índice Funcional de EA de Bath e inflamación. El análisis en la respuesta no demostró cambios en las tasas de respuesta más allá de la sexta semana.
Dolor de espalda baja (DEB): Celecoxib fue utilizado para tratar pacientes que tuvieran dolor no neuropático preexistente de espalda baja con una duración ≥ 12 semanas. En la Tabla 1 mostrada abajo se resumen los resultados de eficacia de 5 estudios clínicos utilizando la Escala Visual Análoga de evaluación de la intensidad del dolor por el paciente (EVA 100 mm) desde la basal hasta el final del tratamiento.
Tabla 1. Resultados de eficacia de 5 estudios clínicos utilizando EVA 100 mm
|
ID de estudio (duración) |
n |
Intensidad del dolor basal |
Cambio en la intensidad |
Valor de p para la diferencia de tratamiento |
|
Tratamiento (dosis total diaria) |
||||
|
Estudio 244 (12 semanas) |
||||
|
Placebo |
177 |
76.6 |
-30.1 |
– |
|
Celecoxib 200 mg |
183 |
73.6 |
-35.9 |
0.0503 |
|
Estudio 245 (12 semanas) |
||||
|
Placebo |
191 |
75.7 |
-26.2 |
– |
|
Celecoxib 200 mg |
183 |
72.8 |
-32.2 |
0.0427 |
|
Estudio 1 165 (6 semanas) |
||||
|
Celecoxib 400 mg |
402 |
65.5 |
-34.6 |
0.008 |
|
Tramadol 200 mg |
389 |
66.1 |
-30.4 |
– |
|
Estudio 1 338 (6 semanas) |
||||
|
Celecoxib 400 g |
386 |
65.9 |
-34.8 |
0.595 |
|
Tramadol 200 mg |
385 |
66.6 |
-34.4 |
– |
|
Estudio 1 174 (4 semanas) |
||||
|
Placebo |
410 |
65.1 |
-26.2 |
– |
|
Celecoxib 400 mg |
410 |
65.0 |
-31.7 |
< 0.001 |
|
Loxoprofeno 180 mg |
407 |
65.6 |
-29.3 |
No evaluado |
Información adicional de los estudios clínicos:
Estudios endoscópicos: Se realizaron evaluaciones endoscópicas programadas del tracto gastrointestinal (GI) superior en más de 4 500 pacientes con artritis que se reclutaron en 5 estudios aleatorios controlados de 12-24 semanas usando comparadores activos, 2 de los cuales también incluyeron controles de placebo. No hubo relación consistente entre la incidencia de úlceras gastroduodenales y la dosis de celecoxib sobre el intervalo estudiado.
La Tabla 2 resume la incidencia de las úlceras endoscópicas en dos estudios de 12 semanas que reclutaron pacientes en quienes las endoscopias basales no revelaron úlceras.
Tabla 2. Incidencia de úlceras gastroduodenales en estudios endoscópicos de pacientes con OA y AR
|
Estudios de 3 meses |
||
|
Estudio 1 (N = 1 108) |
Estudio 2 (N = 1 049) |
|
|
Placebo |
2.3% (5/217) |
2.0% (4/200) |
|
Celecoxib 50 mg dos veces al día |
3.4% (8/233) |
– |
|
Celecoxib 100 mg dos veces al día |
3.1% (7/227) |
4.0% (9/223) |
|
Celecoxib 200 mg dos veces al día |
5.9% (13/221) |
2.7% (6/219) |
|
Celecoxib 400 mg dos veces al día |
– |
4.1% (8/197) |
|
Naproxeno 500 mg dos veces al día |
16.2% (34/210)* |
17.6% (37/210)* |
* p ≤ 0.05 vs. todos los demás tratamientos.
La Tabla 3 resume los datos de dos estudios de 12 semanas que reclutaron pacientes en quienes las endoscopias basales no revelaron úlceras. Los pacientes se sometieron a endoscopias a intervalos de 4 semanas para obtener información sobre el riesgo de ulceración durante el estudio.
Tabla 3. Incidencia de úlceras gastroduodenales en estudios endoscópicos en serie de 3 meses en pacientes con OA y AR
|
Semana 4 |
Semana 8 |
Semana 12 |
Final |
|
|
Estudio 3 (N = 523) |
||||
|
Celecoxib |
4.0% |
2.2% |
1.5% |
7.5% |
|
200 mg dos veces al día |
(10/252)* |
(5/227)* |
(3/196)* |
(20/266)* |
|
Naproxeno |
19.0% |
14.2% |
9.9% |
34.6% |
|
500 mg dos veces al día |
(47/247) |
(26/182) |
(14/141) |
(89/257) |
|
Estudio 4 (N = 1062) |
||||
|
Celecoxib |
3.9% |
2.4% |
1.8% |
7.0% |
|
200 mg dos veces al día |
(13/337)† |
(7/296)† |
(5/274)† |
(25/356)† |
|
Diclofenaco |
5.1% |
3.3% |
2.9% |
9.7% |
|
75 mg dos veces al día |
(18/350) |
(10/306) |
(8/278) |
(36/372) |
|
Ibuprofeno |
13.0% |
6.2% |
9.6% |
23.3% |
|
800 mg tres veces al día |
(42/323) |
(15/241) |
(21/219) |
(78/334) |
* p ≤ 0.05 celecoxib vs. naproxeno basado en los análisis de intervalos y acumulativos.
† p ≤ 0.05 celecoxib vs. ibuprofeno basado en los análisis de intervalos y acumulativos.
Se realizó un estudio aleatorio, doble ciego de 6 meses con 430 pacientes con AR en el que se practicó un examen endoscópico a los 6 meses. La incidencia de úlceras endoscópicas en pacientes que recibieron 200 mg de celecoxib dos veces al día fue de 4% vs. 15% para pacientes que tomaban 75 mg de diclofenaco de liberación prolongada (SR, por sus siglas en inglés) dos veces al día (p < 0.001). En 4 de los 5 estudios endoscópicos, aproximadamente 11% de los pacientes (440/4 000) se dosificaban concomitantemente con ácido acetilsalicílico (≤ 325 mg/día). En los grupos con celecoxib, la tasa de úlcera endoscópica pareció ser más alta entre los usuarios de ácido acetilsalicílico (AAS) que en los que no la usaban. No obstante, el aumento en el porcentaje de úlceras en los usuarios de AAS fue menor al observado en los grupos con comparadores activos, con o sin AAS.
La correlación entre los hallazgos de los estudios endoscópicos y la incidencia relativa de los eventos graves clínicamente significativos del tracto GI superior no ha sido establecida. Se ha observado sangrado del tracto GI superior grave de importancia clínica en pacientes que reciben celecoxib en estudios abiertos y controlados aunque con poca frecuencia (ver sección Precauciones generales-Efectos GI).
Metaanálisis de seguridad GI a partir de estudios de OA y AR: Un análisis de 31 estudios clínicos aleatorios controlados en OA y AR que incluyó a 39 605 pacientes con OA (N = 25 903), AR (N = 3 232) o pacientes con cualquiera de estos trastornos (N = 10 470) comparó la incidencia de eventos adversos GI en los pacientes tratados con celecoxib con la incidencia en pacientes que recibieron placebo o antiinflamatorios no esteroideos (AINEs: naproxeno diclofenaco e ibuprofeno). La incidencia de úlceras clínicas y hemorragias ulcerosas con la dosis total diaria de 200 mg-400 mg de celecoxib fue 0.2% comparada con una incidencia de 0.6% con AINEs (RR = 0.35; 95% IC 0.22-0.56).
Estudio de Seguridad a Largo Plazo con Celecoxib en Artritis (CLASS, por sus siglas en inglés) incluyendo uso de AAS: En un estudio prospectivo de resultados de seguridad a largo plazo realizado posterior a la comercialización en aproximadamente 5 800 pacientes con OA y 2 200 pacientes con AR, se administró a los pacientes 400 mg de celecoxib dos veces al día (4 y 2 veces las dosis recomendadas para OA y AR, respectivamente), 800 mg de ibuprofeno tres veces al día o 75 mg de diclofenaco dos veces al día (dosis terapéuticas frecuentes). La exposición promedio a celecoxib (N = 3 987) y diclofenaco (N = 1 996) fue de 9 meses mientras que para ibuprofeno (N = 1 985) fue de 6 meses. Se presentan las tasas acumulativas de Kaplan-Meier a los 9 meses para todos los análisis. El criterio de valoración principal de este estudio de respuesta fue la incidencia de úlceras complicadas (hemorragia GI, perforación u obstrucción). A los pacientes se les permitió ingerir concomitantemente una dosis baja (≤ 325 mg/día) de AAS para la profilaxis cardiovascular (CV) (subgrupos AAS: celecoxib, N = 882; diclofenaco, N = 445; ibuprofeno, N = 412). Las diferencias en la incidencia de úlceras complicadas entre celecoxib y el grupo combinado de ibuprofeno y diclofenaco no fueron estadísticamente significativas. Aquellos pacientes con tratamiento con celecoxib y una dosis baja concomitante de AAS experimentaron tasas de úlceras complicadas 4 veces mayores comparados con aquellos que no estaban tomando AAS (ver sección Precauciones generales-Efectos GI). Los resultados para celecoxib se muestran en la Tabla 4.
Tabla 4. Efectos de la coadministración de dosis bajas de AAS en las tasas de úlceras complicadas con 400 mg de celecoxib dos veces al día (tasas de Kaplan-Meier a 9 meses [%])
|
Pacientes que no usaron AAS (N = 3 105) |
Usuarios de AAS (N = 882) |
|
|
Úlceras complicadas |
0.32 |
1.12 |
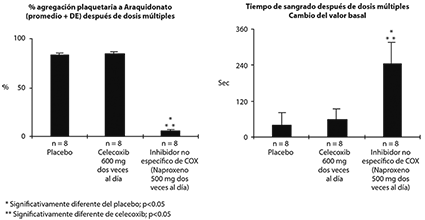
Función plaquetaria: En voluntarios sanos, celecoxib a dosis terapéuticas y a dosis múltiples de 600 mg dos veces al día (una dosis tres veces mayor a la dosis más alta recomendada) no tuvo efecto en la agregación plaquetaria ni en el tiempo de sangrado comparado con placebo. Todos los controles activos (inhibidores no específicos de COX) presentaron disminución significativa de la agregación plaquetaria y prolongación del tiempo de sangrado (ver Figura 1).
Figura 1. Efecto de una dosis alta de celecoxib (600 mg dos veces al día)
en la agregación plaquetaria y el tiempo de sangrado en pacientes sanos
Estudio de Celecoxib vs. Omeprazol y Diclofenaco en pacientes con riesgo de OA y AR (CONDOR, por sus siglas en inglés): En este estudio prospectivo de 24 semanas en pacientes ≥ 60 años o con historia de úlceras gastroduodenales (se excluyeron usuarios de dosis bajas de AAS), el porcentaje de pacientes con eventos GI clínicamente significativos (criterio principal de valoración compuesto) fue menor en pacientes tratados con 200 mg de celecoxib dos veces al día, comparado con pacientes tratados con 75 mg de diclofenaco SR dos veces al día + 20 mg de omeprazol una vez al día.
Esta diferencia fue resultado de la disminución clínicamente significativa en hemoglobina (≥ 2 g/dL) y/o hematocrito (≥ 10%) de origen GI definido o supuesto. Los resultados para los componentes individuales de estos criterios de valoración compuestos se muestran a continuación:
Tabla 5. Resultados del estudio CONDOR
|
Criterios de valoración GI compuestos predefinidos |
200 mg de celecoxib dos veces al día (N = 2 238) |
75 mg de diclofenaco SR dos veces al día + 20 mg de omeprazol una vez al día (N = 2 246) |
|
Componentes |
N (%) de pacientes |
|
|
Hemorragia gastroduodenal |
3 (0.1) |
3 (0.1) |
|
Hemorragia en intestino grueso |
1 (< 0.1) |
1 (< 0.1) |
|
Hemorragia GI aguda de origen desconocido |
1 (< 0.1) |
0 (0.0) |
|
Disminución clínicamente significativa de hemoglobina |
5 (0.2) |
24 (1.1) |
|
Disminución clínicamente significativa de hemoglobina |
10 (0.4) |
53 (2.3) |
|
Total* |
20 (0.9) |
81 (3.6) |
Para los siguientes componentes del criterio de valoración GI compuesto predefinido, no se encontraron ninguno de los siguientes eventos en los grupos tratados: obstrucción de la salida gástrica; perforación gastroduodenal de intestino delgado o grueso; hemorragia del intestino delgado. Todos los eventos que comprenden el criterio de valoración GI compuesto fueron evaluados por un panel de expertos independientes que desconocían las asignaciones aleatorias de tratamiento.
* En un análisis de tiempo hasta un evento utilizando técnicas de tablas de vida, p < 0.0001 para la comparación entre el grupo de tratamiento con celecoxib y el grupo de tratamiento con diclofenaco más omeprazol para este criterio de valoración.
Estudio a largo plazo de seguridad cardiovascular-Estudio de Prevención Antiinflamatoria en la Enfermedad de Alzheimer (ADAPT, por sus siglas en inglés): Los datos del estudio ADAPT no revelaron un riesgo CV significativamente elevado con 200 mg de celecoxib dos veces al día en comparación con placebo. El riesgo relativo en comparación con placebo para un criterio de valoración compuesto similar (muerte CV, infarto al miocardio (IM), accidente cerebrovascular (ACV) fue de 1.14 (IC 95% 0.61-2.15) con 200 mg de celecoxib dos veces al día.
Seguridad cardiovascular-Metaanálisis a partir de estudios con uso crónico: Se realizó un metaanálisis de los datos de seguridad (eventos adversos graves adjudicados y reportados por el investigador) de 39 estudios clínicos con celecoxib finalizados con hasta 65 semanas de duración, incluyendo a 41 077 pacientes 23 030 (56.1%) pacientes expuestos a una dosis diaria total (TDD, por sus siglas en inglés) de 200-800 mg de celecoxib, 13 990 (34.1%) pacientes expuestos a AINEs no selectivos y 4 057 (9.9%) pacientes expuestos a placebo.
En este análisis, la tasa de eventos adjudicados para el criterio de valoración compuesto de muerte CV, IM no mortal y ACV no mortal fue similar entre el tratamiento con celecoxib (N = 19 773; 0.96 eventos/100 años-persona) y AINEs no selectivos (N = 13 990; 1.12 eventos/100 años-persona) (RR = 0.90, 95% IC 0.60-1.33). Este patrón de efecto se mantuvo con o sin el uso de AAS (≤ 325 mg). La tasa de eventos adjudicados de IM no mortal tendió a ser más alta (RR = 1.76, 95% IC 0.93-3.35); sin embargo, el de ACV no mortal tendió a ser menor (RR = 0.51, 95% IC 0.23-1.10) y el de muerte CV fue comparable (RR = 0.57, 95% IC 0.28-1.14) para celecoxib comparado con los AINEs no selectivos combinados.
En este análisis, la tasa de eventos adjudicados para el criterio de valoración compuesto de muerte CV, IM no mortal y ACV no mortal fue 1.42/100 años-paciente para el tratamiento con celecoxib (N = 7 462) y 1.20/100 paciente-año para el placebo (N = 4 057) (RR = 1.11, 95% IC 0.47-2.67). Este patrón de efecto se mantuvo con o sin el uso de AAS (≤ 325 mg). La incidencia de IM no mortal tendió a ser más alta (RR = 1.56, 95% IC 0.21-11.90), al igual que la de muerte CV (RR = 1.26, 95% IC 0.33-4.77); la de ACV no mortal fue similar (RR = 0.80, 95% IC 0.19-3.31) para celecoxib comparado con placebo.
Seguridad cardiovascular: Los resultados de seguridad CV se evaluaron en el estudio CLASS. Las tasas acumulativas de Kaplan-Meier para los eventos adversos tromboembólicos CV serios reportados por el investigador (incluidos IM, embolia pulmonar, trombosis venosa profunda, angina inestable, ataques isquémicos transitorios y ACV isquémicos) no mostraron diferencia entre los grupos terapéuticos con celecoxib, diclofenaco e ibuprofeno. Las tasas acumuladas en todos los pacientes a los nueve meses para celecoxib, diclofenaco e ibuprofeno fueron 1.2%, 1.4% y 1.1%, respectivamente. Las tasas acumuladas en los no usuarios de AAS a los nueve meses de cada uno de los tres grupos terapéuticos fueron menores de 1%. Las tasas acumuladas para IM en los no usuarios de AAS a los nueve meses en cada uno de los tres grupos terapéuticos fueron menores de 0.2%. No hubo grupo placebo en el estudio CLASS, lo cual limita la capacidad para establecer si los tres fármacos evaluados no tuvieron aumento en el riesgo de eventos CV o si todos incrementaron el riesgo en grado similar.
Evaluación Prospectiva Aleatorizada de la Seguridad Integrada de Celecoxib vs. Ibuprofeno o Naproxeno (PRECISION):
Diseño: El estudio PRECISION fue un estudio doble ciego de seguridad CV en pacientes que padecen OA o AR con enfermedad CV o un alto riesgo de desarrollarla que comparó celecoxib (200-400 mg diarios) con naproxeno (750-1 000 mg diarios) e ibuprofeno (1 800-2 400 mg diarios). El criterio de valoración principal compuesto, Colaboración de Ensayistas en Antiplaquetarios (APTC, por sus siglas en inglés), fue adjudicado de forma independiente a muerte CV (incluida la muerte debido a hemorragia), IM o ACV no mortales. El estudio se planificó con una potencia de un 80% para evaluar la ausencia de inferioridad. A todos los pacientes se les prescribió abiertamente esomeprazol (20-40 mg) para protección gástrica. A los pacientes que estaban consumiendo una dosis baja de AAS, se les permitió continuar con el tratamiento.
Otros criterios de valoración secundarios y terciarios adjudicados de forma independiente incluyeron resultados cardiovasculares, gastrointestinales y renales. Además, hubo un subestudio de 4 meses que se enfocó en los efectos de los tres medicamentos sobre la tensión arterial medido a través del monitoreo ambulatorio (ABPM, por sus siglas en inglés).
Resultados:
Tabla 6. Población y dosis de tratamiento
|
Conjunto de análisis |
100-200 mg de celecoxib bid |
600-800 mg de ibuprofeno tid |
375-500 mg de naproxeno bid |
Total |
|
Aleatorizado (IDT) |
8 072 |
8 040 |
7 969 |
24 081 |
|
En tratamiento (mIDT) |
8 030 |
7 990 |
7 933 |
23 953 |
|
Dosis promedio1 (mg/día) |
209 ± 37 |
2 045 ± 246 |
852 ± 103 |
N/A |
1 Dosis promedio dispensada.
IDT: con intención de tratar; todos los sujetos aleatorizados.
mIDT: con intención de tratar modificada: todos los sujetos aleatorizados con al menos una dosis del medicamento del estudio y una visita posterior a la inicial.
bid: dos veces al día.
tid: tres veces al día.
N/A: no aplica.
Criterio de valoración principal: Celecoxib, comparado con naproxeno o ibuprofeno, cumplió con los cuatro requisitos de ausencia de inferioridad previamente especificados (p < 0.001 para la ausencia de inferioridad en ambas comparaciones). La ausencia de inferioridad se estableció cuando el cociente de riesgo (HR, por sus siglas en inglés) es ≤ 1.12 tanto en el análisis de IDT como en el análisis de mIDT, y el IC del 95% superior es ≤ 1.33 para el análisis de IDT y ≤ 1.40 para el análisis de mIDT.
Los análisis primarios de IDT y mIDT se describen a continuación en la Tabla 7.
Tabla 7. Análisis del criterio de valoración principal compuesto de APTC adjudicado
|
Análisis de intención de tratar (IDT, hasta el mes 30) |
|||
|
100-200 mg de celecoxib bid |
600-800 mg de ibuprofeno tid |
375-500 mg de naproxeno bid |
|
|
N |
8 072 |
8 040 |
7 969 |
|
Sujetos con eventos |
188 (2.3%) |
218 (2.7%) |
201 (2.5%) |
|
Comparación de pares |
Celecoxib vs. naproxeno |
Celecoxib vs. ibuprofeno |
Ibuprofeno vs. naproxeno |
|
HR (IC del 95%) |
0.93 (0.76; 1.13) |
0.86 (0.70; 1.04) |
1.08 (0.89; 1.31) |
|
Análisis de intención de tratar modificada (mIDT, en tratamiento hasta el mes 43) |
|||
|
100-200 mg de celecoxib bid |
600-800 mg de ibuprofeno tid |
375-500 mg de naproxeno bid |
|
|
N |
8 030 |
7 990 |
7 933 |
|
Sujetos con eventos |
134 (1.7%) |
155 (1.9%) |
144 (1.8%) |
|
Comparación en pares |
Celecoxib vs. naproxeno |
Celecoxib vs. ibuprofeno |
Ibuprofeno vs. naproxeno |
|
HR (IC del 95%) |
0.90 (0.72; 1.14) |
0.81 (0.64; 1.02) |
1.12 (0.889; 1.40) |
Criterios de valoración secundarios y terciarios clave: El análisis de los Eventos Adversos Cardiovasculares Principales (MACE, por sus siglas en inglés)* para mIDT se describe a continuación en la Tabla 8.
Tabla 8. Eventos adversos CV principales adjudicados en tratamiento
|
100-200 mg de celecoxib bid |
600-800 mg de ibuprofeno tid |
375-500 mg de naproxeno bid |
|
|
N |
8 030 |
7 990 |
7 933 |
|
Cantidad de sujetos con eventos (%) |
|||
|
MACE |
247 (3.1%) |
284 (3.6%) |
253 (3.2%) |
|
Muerte CV |
35 (0.4%) |
51 (0.6%) |
49 (0.6%) |
|
IM no mortal |
58 (0.7%) |
76 (1.0%) |
53 (0.7%) |
|
ACV no mortal |
43 (0.5%) |
32 (0.4%) |
45 (0.6%) |
|
Hospitalización por angina inestable |
46 (0.6%) |
49 (0.6%) |
44 (0.6%) |
|
Revascularización |
132 (1.6%) |
158 (2.0%) |
122 (1.5%) |
|
Hospitalización por AIT |
12 (0.1%) |
21 (0.3%) |
16 (0.2%) |
|
HR por comparación de pares (IC del 95%) |
Celecoxib vs. naproxeno |
Celecoxib vs. ibuprofeno |
Ibuprofeno vs. naproxeno |
|
MACE |
0.95 (0.80; 1.13) |
0.82 (0.69; 0.97) |
1.17 (0.98; 1.38) |
|
Muerte CV |
0.69 (0.45; 1.07) |
0.64 (0.42; 0.99) |
1.08 (0.73; 1.60) |
|
IM no mortal |
1.06 (0.73; 1.54) |
0.72 (0.51; 1.01) |
1.48 (1.04; 2.11) |
|
ACV no mortal |
0.93 (0.61; 1.42) |
1.26 (0.79; 1.98) |
0.74 (0.47; 1.16) |
|
Hospitalización por angina inestable |
1.02 (0.67; 1.54) |
0.89 (0.59; 1.33) |
1.16 (0.77; 1.74) |
|
Revascularización |
1.06 (0.83; 1.35) |
0.78 (0.62. 0.99) |
1.35 (1.07; 1.72) |
|
Hospitalización por AIT |
0.73 (0.35; 1.55) |
0.54 (0.26; 1.09) |
1.38 (0.72; 2.64) |
* MACE: criterio de valoración compuesto de APTC más revascularización coronaria u hospitalización por angina inestable o ataque isquémico transitorio (AIT).
En la población con IDT para el criterio de valoración MACE no hubo diferencias significativas en las comparaciones de pares entre regímenes de tratamiento.
El análisis de eventos GI para mIDT se describe a continuación en la Tabla 9.
Tabla 9. Criterios de valoración GI adjudicados en tratamiento
|
100-200 mg de celecoxib bid |
600-800 mg de ibuprofeno tid |
375-500 mg de naproxeno bid |
|
|
N |
8 030 |
7 990 |
7 933 |
|
Cantidad de sujetos con eventos, n (%) |
|||
|
CSGIE |
27 (0.3%) |
59 (0.7%) |
52 (0.7%) |
|
ADH de origen GI |
27 (0.3%) |
58 (0.7%) |
66 (0.8%) |
|
HR por comparación de pares (IC del 95%) |
Celecoxib vs. naproxeno |
Celecoxib vs. ibuprofeno |
Ibuprofeno vs. naproxeno |
|
CSGIE |
0.51 (0.32; 0.81) |
0.43 (0.27; 0.68) |
1.16 (0.80; 1.69) |
|
ADH de Origen GI |
0.39 (0.25; 0.62) |
0.43 (0.27; 0.68) |
0.91 (0.64; 1.29) |
* CSGIE (eventos GI significativos a nivel clínico): compuestos de lo siguiente: hemorragia gastroduodenal; obstrucción de la salida gástrica; perforación gastroduodenal del intestino delgado o grueso; hemorragia del intestino grueso; hemorragia del intestino delgado; hemorragia GI aguda de origen desconocido, incluida la presunta hemorragia del intestino delgado; úlcera duodenal o gástrica sintomática.
** ADH (anemia por deficiencia de hierro): anemia por deficiencia de hierro significativa a nivel clínico de origen GI o disminución en hematocrito (Hct) y/o hemoglobina (Hgb); definida como Hct > 10 puntos y/o Hgb> 2 g/dL desde el periodo inicial).
En la población con IDT para el criterio de valoración CSGIE no hubo diferencias significativas en las comparaciones de pares entre los regímenes de tratamiento (no se muestran los datos). Con relación al criterio de valoración de ADH de origen GI, se observaron diferencias significativas (celecoxib vs. naproxeno y celecoxib vs. ibuprofeno) y diferencias no significativas (ibuprofeno vs. naproxeno) de forma consistente con los datos presentados anteriormente.
El análisis de eventos renales significativos a nivel clínico*, hospitalización por insuficiencia cardiaca congestiva (ICC) e hipertensión para mIDT se describe a continuación en la Tabla 10.
Tabla 10. Eventos renales adjudicados en tratamiento. Hospitalización por ICC e hipertensión
|
100-200 mg de celecoxib bid |
600-800 mg de ibuprofeno tid |
375-500 mg de naproxeno bid |
|
|
N |
8 030 |
7 990 |
7 933 |
|
Cantidad de sujetos con eventos, n (%) |
|||
|
Eventos renales |
42 (0.5%) |
73 (0.9%) |
62 (0.8%) |
|
Hospitalización por ICC |
28 (0.3%) |
38 (0.5%) |
35 (0.4%) |
|
Hospitalización por hipertensión |
25 (0.3%) |
37 (0.5%) |
32 (0.4%) |
|
Cualquiera de las anteriores |
89 (1.1%) |
139 (1.7%) |
120 (1.5%) |
|
HR comparación de pares (IC del 95%) |
Celecoxib vs. naproxeno |
Celecoxib vs. ibuprofeno |
Ibuprofeno vs. naproxeno |
|
Eventos renales |
0.66 (0.44; 0.97) |
0.54 (0.37; 0.79) |
1.21 (0.86; 1.70) |
|
Hospitalización por ICC |
0.77 (0.47; 1.27) |
0.70 (0.43; 1.13) |
1.12 (0.71; 1.77) |
|
Hospitalización por hipertensión |
0.76 (0.45; 1.28) |
0.64 (0.39; 1.07) |
1.18 (0.74; 1.90) |
|
Cualquiera de las anteriores |
0.72 (0.55; 0.95) |
0.60 (0.46; 0.79) |
1.19 (0.93; 1.52) |
* N.B.: los eventos renales incluyeron un compuesto de aumentos predefinidos en los niveles de creatinina (creatinina sérica verificada de ≥ 2.0 mg/dL [177 μmol/L] y un incremento ≥ 0.7 mg/mL [62 μmol/L]) u hospitalización por insuficiencia renal aguda (definida como la duplicación de la creatinina sérica o la confirmación de hipercalemia con ≥ 50% de elevación en creatinina sérica) o el inicio de hemodiálisis o diálisis peritoneal.
En la población con IDT para el criterio de valoración de eventos renales clínicamente significativos solamente la comparación de pares entre celecoxib e ibuprofeno fue significativa, HR 0.61 (0.44; 0.85), no se observaron diferencias significativas entre los regímenes de tratamiento en la incidencia de hospitalización por ICC y se observó una incidencia significativamente más baja de hospitalización por hipertensión entre celecoxib e ibuprofeno, HR 0.59 (0.36; 0.99).
Mortalidad por cualquier causa: En las poblaciones con mIDT celecoxib, naproxeno e ibuprofeno se asociaron con 53 (0.7%), 79 (1.0%) y 73 (0.9%) muertes, respectivamente. Se observaron diferencias significativas en las comparaciones de pares entre celecoxib y naproxeno HR 0.65 (0.46; 0.92) o entre celecoxib e ibuprofeno HR 0.68 (0.48; 0.97). En la población con IDT celecoxib, naproxeno e ibuprofeno se asociaron con 132 (1.6%), 163 (2.0%) y 142 (1.8%) muertes, respectivamente. No se observaron diferencias significativas en las comparaciones de pares entre los tratamientos.
Subestudio ABPM: En el subestudio PRECISION-ABPM, entre el total de 444 pacientes analizables, en el cuarto mes, los pacientes tratados con celecoxib presentaron el cambio más pequeño en la tensión arterial sistólica (TAS) ambulatoria de 24 h en comparación con ibuprofeno y naproxeno: celecoxib produjo una leve reducción de 0.3 mmHg mientras que ibuprofeno y naproxeno aumentaron la TAS media de 24 h en 3.7 mmHg y 1.6 mmHg, respectivamente. Estos cambios dieron como resultado una diferencia significativa a nivel estadístico y clínico de -3.9 mmHg (p = 0.0009) entre celecoxib e ibuprofeno; una diferencia no significativa de -1.8 mmHg (p = 0.119) entre celecoxib y naproxeno; y una diferencia no significativa de -2.1 mmHg (p = 0.0787) entre naproxeno e ibuprofeno.
CONTRAINDICACIONES:
Celecoxib está contraindicado en:
• Pacientes con antecedentes de hipersensibilidad a celecoxib o a los componentes de la fórmula.
• Pacientes con antecedentes de hipersensibilidad a sulfonamidas.
• Pacientes que hayan padecido asma, urticaria o reacciones de tipo alérgico después de tomar AAS u otros AINEs, incluyendo a otros inhibidores específicos de COX-2.
• El tratamiento del dolor perioperatorio de cirugía de colocación de puente coronario (CABG por sus siglas en inglés) (ver sección Precauciones generales).
• Menores de 18 años.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Uso durante el embarazo: No hay estudios en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva (ver sección Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad). Se desconoce la relevancia de estos datos para humanos.
Celecoxib, al igual que otros fármacos que inhiben la síntesis de prostaglandinas, puede ocasionar inercia uterina y cierre prematuro del conducto arterioso, por lo que debe evitarse su administración durante el tercer trimestre del embarazo.
Celecoxib sólo deberá utilizarse durante el embarazo si, a criterio del médico, el beneficio potencial para la madre es mayor que el riesgo para el feto.
La inhibición de la síntesis de prostaglandina podría afectar negativamente el embarazo. Los datos derivados de estudios epidemiológicos sugieren un aumento de riesgo de aborto espontáneo luego del uso de inhibidores de la síntesis de prostaglandina en las etapas iniciales del embarazo. En animales, la administración de inhibidores de síntesis de prostaglandina ha demostrado generar el aumento de las pérdidas antes y después de la implantación.
Si se usan durante el segundo o tercer trimestre del embarazo, los AINEs pueden causar disfunción renal fetal que puede resultar en la reducción del volumen de líquido amniótico u oligohidramnios en casos severos. Tales efectos pueden ocurrir poco después del inicio del tratamiento y son usualmente reversibles al discontinuar el tratamiento. Las mujeres embarazadas tratadas con celecoxib deben ser monitoreadas de cerca en cuanto al volumen del líquido amniótico.
Uso durante la lactancia: Estudios en ratas demuestran que celecoxib es excretado en la leche en concentraciones similares a las del plasma. La administración de celecoxib a mujeres lactantes muestra muy baja transferencia del fármaco a la leche materna. Debido al potencial de reacciones adversas en lactantes por celecoxib se debe tomar una decisión acerca de abandonar la lactancia o discontinuar el fármaco, considerando el beneficio esperado del fármaco para la madre.
REACCIONES SECUNDARIAS Y ADVERSAS:
Experiencia en estudios clínicos: Las siguientes reacciones adversas al medicamento (RAM) mencionadas en la Tabla 11 fueron identificadas con tasas de incidencia mayores a 0.01% en el grupo de celecoxib y superiores a aquellas reportadas en el grupo de placebo en 12 estudios clínicos controlados con placebo y/o fármaco con duración de hasta 12 semanas y dosis diarias de 100-800 mg en adultos.
Las frecuencias de las RAM en la Tabla 11 se actualizaron con base en una agrupación más reciente de datos de 89 estudios clínicos aleatorizados controlados que representan la exposición clínica en 38 102 pacientes que tomaron celecoxib. Las frecuencias de RAM se definen como: muy común (≥ 10%), común (≥ 1% y < 10%), poco común (≥ 0.1% y < 1%), raro (≥ 0.01% y < 0.1%) y muy raro (< 0.01%). Las RAM se enlistan en la Tabla 11 por sistema orgánico y se ordenan por frecuencia en orden descendente.
Tabla 11. RAM en 12 estudios clínicos controlados con placebo y/o fármaco y frecuencia de RAM de 89 estudios clínicos de dolor e inflamación en adultos, aleatorizados y controlados con dosis diarias de 25-800 mg
|
Clase de sistemas y órganos |
Frecuencia |
Reacciones adversas al medicamento |
|
Infecciones e infestaciones |
Común |
Bronquitis, sinusitis, infección del tracto respiratorio superior, infección del tracto urinario |
|
Poco común |
Faringitis, rinitis |
|
|
Trastornos de la sangre y del sistema linfático |
Poco común |
Anemia |
|
Raro |
Trombocitopenia |
|
|
Trastornos del sistema inmunológico |
Poco común |
Alergia agravada (hipersensibilidad) |
|
Trastornos psiquiátricos |
Común |
Insomnio |
|
Poco común |
Ansiedad |
|
|
Raro |
Estado de confusión |
|
|
Trastornos del sistema nervioso |
Común |
Mareo |
|
Poco común |
Hipertonía, somnolencia |
|
|
Trastornos oculares |
Poco común |
Visión borrosa |
|
Trastornos del oído y del laberinto |
Poco común |
Tinnitus |
|
Trastornos cardiacos |
Poco común |
Palpitaciones |
|
Raro |
Insuficiencia cardiaca congestiva, arritmia, taquicardia |
|
|
Trastornos vasculares |
Común |
Hipertensión (que incluye hipertensión agravada) |
|
Raro |
Enrojecimiento |
|
|
Trastornos respiratorios, torácicos y del mediastino |
Común |
Tos |
|
Trastornos gastrointestinales |
Común |
Vómitos, dolor abdominal, diarrea, dispepsia, flatulencia |
|
Poco común |
Úlcera gástrica, trastorno dental |
|
|
Raro |
Úlcera duodenal, ulceración esofágica |
|
|
Muy raro |
Perforación intestinal, pancreatitis |
|
|
Trastornos hepatobiliares |
Poco común |
Aumento de enzimas hepáticas (incluidos aumento de alanina aminotransferasa y aumento de aspartato aminotransferasa) |
|
Trastornos de la piel y del tejido subcutáneo |
Común |
Prurito (incluido prurito generalizado), erupción cutánea |
|
Poco común |
Urticaria, equimosis |
|
|
Raro |
Angioedema, alopecia |
|
|
Muy raro |
Dermatitis bulosa |
|
|
Trastornos generales y alteraciones en el sitio de administración |
Común |
Edema periférico |
|
Poco común |
Edema facial, enfermedad tipo influenza |
|
|
Lesiones, intoxicación y complicaciones secundarias al procedimiento |
Poco común |
Lesión |
Experiencia posterior a la comercialización: Las reacciones adversas identificadas por la experiencia poscomercialización se proporcionan a continuación. Aunque se identificaron como reacciones a partir de informes poscomercialización, se consultaron los datos de estudios para estimar la frecuencia. Como se mencionó anteriormente, las frecuencias están basadas en un conjunto de estudios que representan la exposición de 38 102 pacientes. Las frecuencias se definen como: muy común (≥ 10%), común (≥ 1% y < 10%), poco común (≥ 0.1% y < 1%), raro (≥ 0.01% y < 0.1%), muy raro (< 0.01%) y desconocido (no puede ser estimado a partir de los datos disponibles).
Trastornos del sistema inmunológico: Muy raro: anafilaxia (reacción anafiláctica).
Trastornos psiquiátricos: Raro: alucinaciones.
Trastornos del sistema nervioso: Muy raro: hemorragia cerebral, meningitis aséptica, ageusia, anosmia.
Trastornos oculares: Poco común: conjuntivitis.
Trastornos vasculares: Muy raro: vasculitis.
Trastornos respiratorios, torácicos y del mediastino: Raro: embolismo pulmonar, neumonitis.
Trastornos gastrointestinales: Raro: hemorragia gastrointestinal.
Trastornos hepatobiliares: Raro: hepatitis; muy raro: insuficiencia hepática, hepatitis fulminante, necrosis hepática (ver sección Precauciones generales-Efectos hepáticos), colestasis, hepatitis colestática, ictericia.
Trastornos de la piel y del tejido subcutáneo: Raro: reacción de fotosensibilidad; muy raro: síndrome de Stevens-Johnson, eritema multiforme, necrólisis epidérmica tóxica, DRESS, pustulosis exantemática aguda generalizada (PEAG), dermatitis exfoliativa.
Trastornos renales y urinarios: Raro: insuficiencia renal aguda (ver sección Precauciones generales-Efectos renales), hiponatremia; muy raro: nefritis tubulointersticial, síndrome nefrótico, glomerulonefritis de lesión mínima.
Trastornos del sistema reproductivo y mamarios: Raro: trastorno menstrual; desconocidos: infertilidad femenina (disminución de la fertilidad femenina) (ver sección Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad).†
Trastornos generales y alteraciones en el sitio de administración: Poco común: dolor en el pecho.
† Mujeres que pretenden quedar embarazadas son excluidas de todos los estudios, por lo tanto, la consulta de la base de datos del estudio para la frecuencia de este evento no era razonable.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Los datos no clínicos de seguridad no revelaron efectos nocivos particulares para humanos basados en estudios convencionales de toxicidad con dosis repetidas, mutagenicidad o carcinogenicidad.
Celecoxib a dosis orales ≥ 150 mg/kg/día (aproximadamente dos veces la exposición en humanos, 200 mg dos veces al día medida por el ABC0-24) ocasionó un aumento en la incidencia de defectos septo ventriculares, un evento raro y alteraciones fetales, como fusión de costillas, esternebras fusionadas y deformes cuando se trataron conejos durante toda la organogénesis. Se observó un aumento dependiente de la dosis en las hernias diafragmáticas cuando se administró celecoxib a dosis orales ≥ 30 mg/kg/día (aproximadamente seis veces la exposición en humanos 200 mg dos veces al día con base en el ABC0-24) a ratas durante toda la organogénesis. Estos efectos se esperan debido a la inhibición de síntesis de prostaglandinas. En ratas, la exposición a celecoxib durante el desarrollo embrionario temprano dio como resultado pérdidas antes y después de la implantación y una supervivencia embrio/fetal reducida.
Toxicología animal: Se observó un incremento en la incidencia de hallazgos de antecedentes de espermatocele con o sin cambios secundarios como hipospermia epididimal así como dilatación mínima a leve de los túbulos seminíferos en ratas jóvenes. Estos hallazgos reproductivos, aunque aparentemente estaban relacionados con el tratamiento, no se incrementaron en cuanto a incidencia ni a severidad con la dosis y pueden indicar una exacerbación de una condición espontánea. No se observaron hallazgos reproductivos similares en estudios de perros jóvenes o adultos o en ratas adultas tratadas con celecoxib. La significancia clínica de esta observación es desconocida.
Fertilidad: Basado en el mecanismo de acción, el uso de AINEs, incluido celecoxib, puede retrasar o prevenir la ruptura de folículos ováricos, lo cual se ha asociado con infertilidad reversible en algunas mujeres. Se debe considerar la discontinuación de AINEs, incluido celecoxib, en mujeres que tienen dificultades para concebir o que son sometidas a una investigación de infertilidad.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
General: El metabolismo de celecoxib está mediado predominantemente por el citocromo P450 (CYP) 2C9 en el hígado. Celecoxib debe usarse con cuidado en los pacientes con certeza o sospecha de metabolismo deficiente por CYP2C9 con base en antecedentes o experiencias previas con otros sustratos de CYP2C9, ya que pueden alcanzar niveles plasmáticos más altos de lo normal por la depuración metabólica reducida. Considere el inicio de tratamiento con la mitad de la dosis más baja recomendada (ver secciones Dosis y vía de administración y Farmacocinética y farmacodinamia).
La administración concomitante de celecoxib con inhibidores del CYP2C9 puede conducir a incrementos en las concentraciones plasmáticas de celecoxib. Por lo tanto, puede ser necesaria una reducción en la dosis de celecoxib cuando es coadministrado con inhibidores del CYP2C9.
La administración concomitante de celecoxib con inductores del CYP2C9, tales como rifampicina, carbamazepina y barbitúricos puede llevar a disminución de las concentraciones plasmáticas de celecoxib. Por lo tanto, puede ser necesario un incremento en la dosis de celecoxib cuando es coadministrado con inductores del CYP2C9.
Un estudio de farmacocinética clínica y estudios in vitro indican que celecoxib, aunque no es un sustrato, es un inhibidor de CYP2D6. Por lo tanto, existe el potencial de una interacción medicamentosa in vivo con los fármacos que son metabolizados por CYP2D6.
Fármacos específicos:
Interacción de celecoxib con warfarina o agentes similares: (ver sección Precauciones generales-Uso con anticoagulantes orales).
Litio: En sujetos sanos, los niveles plasmáticos de litio aumentaron aproximadamente 17% en sujetos que reciben litio junto con celecoxib. Los pacientes con tratamiento de litio deben supervisarse de cerca cuando se inicie o se retire celecoxib.
AAS: Celecoxib no interfiere con el efecto antiplaquetario de AAS a dosis bajas (ver sección Precauciones generales-Efectos GI). Debido a su falta de efectos plaquetarios, celecoxib no es un reemplazo del AAS en el tratamiento profiláctico de la enfermedad CV.
Antihipertensivos incluyendo inhibidores de la enzima convertidora de angiotensina (IECAs), antagonistas de la angiotensina II (también conocidos como bloqueadores del receptor de angiotensina [BRAs]), diuréticos y beta-bloqueadores: La inhibición de prostaglandinas puede disminuir el efecto de antihipertensivos incluyendo IECAs y/o BRAs, diuréticos y beta-bloqueadores. Se debe considerar esta interacción en pacientes que toman concomitantemente celecoxib con IECAs y/o BRAs, diuréticos y beta-bloqueadores.
En pacientes de edad avanzada, con reducción drástica de volumen (incluyendo los pacientes bajo terapia diurética) o con función renal comprometida, la administración concomitante de AINEs, incluyendo inhibidores selectivos de COX-2, con inhibidores de la enzima convertidora de angiotensina (ECA), antagonistas de la angiotensina II o diuréticos, puede resultar en el deterioro de la función renal incluyendo posible insuficiencia renal aguda. Estos efectos usualmente son reversibles. Por lo tanto, la administración concomitante de estos medicamentos se debe realizar con precaución. Los pacientes deben ser hidratados adecuadamente y la necesidad clínica de monitorear la función renal debe ser evaluada al inicio del tratamiento concomitante y a partir de ese momento periódicamente.
Resultados del estudio de lisinopril: En un estudio clínico de 28 días en pacientes con hipertensión en etapa I y II controlada con lisinopril, la administración de 200 mg bid de celecoxib resultó en incrementos clínicamente no significativos en la tensión arterial sistólica o diastólica diaria media determinada utilizando monitoreo ambulatorio de tensión arterial por 24 h cuando se comparó con el tratamiento con placebo. Entre los pacientes a los que se les coadministraron 200 mg bid de celecoxib, 48% fueron considerados sin respuesta a lisinopril en la última visita clínica (definida ya sea como tensión arterial diastólica > 90 mmHg o diastólica con un incremento > 10% comparado con la línea base) comparado con 27% de pacientes a los que se les coadministró con placebo, esta diferencia fue estadísticamente significativa.
Ciclosporina: Debido a su efecto sobre las prostaglandinas renales, los AINEs podrían incrementar el riesgo de nefrotoxicidad con ciclosporina.
Fluconazol y ketoconazol: La administración concomitante de 200 mg de fluconazol una vez al día resultó en un aumento de dos veces la concentración plasmática de celecoxib. Este aumento es debido a la inhibición del metabolismo de celecoxib vía CYP2C9 por fluconazol. Celecoxib debe administrarse a la mitad de la dosis recomendada en pacientes que reciben el inhibidor de CYP2C9 fluconazol (ver sección Dosis y vía de administración). Ketoconazol, un inhibidor de CYP3A4, no mostró una inhibición clínicamente significativa del metabolismo de celecoxib.
Dextrometorfano y metoprolol: La administración concomitante de 200 mg de celecoxib dos veces al día resulta en un incremento de 2.6 y 1.5 veces en las concentraciones plasmáticas de dextrometorfano y metoprolol (sustratos de CYP2D6) respectivamente. Estos incrementos se deben a la inhibición de celecoxib en el metabolismo de los sustratos del CYP2D6 vía CYP2D6. Por lo tanto podría ser necesario reducir la dosis de fármacos como sustratos del CYP2D6 cuando se inicia el tratamiento con celecoxib o incrementarla cuando se termina el tratamiento con celecoxib. (ver sección Precauciones generales-Uso con anticoagulantes orales).
Diuréticos: Estudios clínicos han demostrado que los AINEs, en algunos pacientes, pueden reducir el efecto natriurético de furosemida y tiazidas mediante la inhibición de la síntesis de prostaglandinas renales.
Metotrexato: No se han observado en estudios clínicos interacciones de importancia farmacocinética ni clínica entre celecoxib y metrotexato.
Anticonceptivos orales: En un estudio de interacción, celecoxib no tuvo efectos clínicamente significativos en la farmacocinética de un prototipo combinado de anticonceptivo oral (1 mg de noretindrona/0.035 mg de etinilestradiol).
Otros medicamentos: No se han observado interacciones clínicamente importantes con celecoxib y antiácidos (aluminio y magnesio), omeprazol, glibenclamida (gliburida), fenitoína, o tolbutamida.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Debido a que pueden aparecer úlceras o hemorragia en el tracto GI sin ninguna sintomatología previa, el médico debe monitorear de manera dirigida signos y síntomas de hemorragia GI. Los pacientes manejados a largo plazo con un AINE deben realizarse periódicamente una biometría hemática y una química sanguínea. Si se demostrara que las pruebas de función hepática o renal son anormales o empeoran, el tratamiento con celecoxib debe interrumpirse.
En estudios clínicos controlados, una elevación del nitrógeno ureico en sangre (BUN, por sus siglas en inglés) ocurrió con mayor frecuencia en pacientes que recibieron celecoxib en comparación con placebo. Esta anormalidad en el laboratorio también fue vista en pacientes quienes recibieron un AINE como comparador en estos estudios. La significancia clínica de esta anormalidad no ha sido definida.
PRECAUCIONES GENERALES:
Efectos cardiovasculares: Utilizar con precaución en pacientes con riesgo CV demostrado.
Eventos cardiovasculares trombóticos: Celecoxib puede causar un incremento del riesgo de eventos trombóticos CV graves IM y ACV, los cuales pueden ser mortales. Todos los AINEs pueden tener un riesgo similar. Este riesgo puede aumentar con la dosis y duración de uso. El aumento relativo de este riesgo parece ser similar en aquellos pacientes con o sin enfermedad CV conocida o factores de riesgo CV. Sin embargo, los pacientes con enfermedad CV o factores de riesgo CV pueden tener mayor riesgo en términos de incidencia absoluta debido a su índice aumentado con respecto a la línea basal. Para minimizar el riesgo potencial de eventos CV adversos en pacientes tratados con celecoxib la dosis efectiva más baja debe ser usada por el menor tiempo posible. Los médicos y los pacientes deben permanecer alerta al desarrollo de tales acontecimientos, aun en ausencia de síntomas CV previos. Los pacientes deben ser informados sobre los signos y/o síntomas de toxicidad CV grave y de los pasos a seguir si ésta ocurre (ver sección Propiedades farmacodinámicas).
En dos grandes estudios clínicos controlados de un AINE selectivo a COX-2 para el tratamiento del dolor en los primeros 10-14 días después de un procedimiento CABG se encontró una alta incidencia de IM y ACV (ver sección Contraindicaciones).
Celecoxib no es un sustituto del AAS para la profilaxis de enfermedades tromboembólicas CV debido a la ausencia de efecto sobre la función plaquetaria. Las terapias antiagregantes plaquetarias (p. ej. ASS) no deben ser suspendidas debido a que celecoxib no inhibe la agregación plaquetaria. En pacientes que toman medicamentos antiplaquetarios, estos se deben tomar 2 h antes que celecoxib.
Hipertensión: Como todos los AINEs, celecoxib puede desencadenar el inicio de hipertensión o agravar la hipertensión preexistente, ambas pueden contribuir al aumento en la incidencia de eventos CV. Los AINEs, incluido celecoxib, deben usarse con cuidado en pacientes con hipertensión. La tensión arterial debe vigilarse de cerca al inicio del tratamiento con celecoxib y durante todo el curso terapéutico (ver sección Propiedades farmacodinámicas-Estudios clínicos-Subestudio ABPM).
Retención de líquidos y edema: Como con otros fármacos conocidos que inhiben la síntesis de prostaglandinas, en algunos pacientes que toman celecoxib se ha observado retención de líquidos y edema. Por lo tanto, los pacientes con insuficiencia cardiaca congestiva (ICC) o hipertensión preexistentes deben monitorearse de cerca. Celecoxib debe administrarse con precaución en pacientes con función cardiaca comprometida, edema preexistente u otras condiciones que predispongan a, o que empeoren por, retención de fluidos, incluyendo aquellos que toman diuréticos o que de otra manera están en riesgo de hipovolemia.
Efectos GI: Se han presentado perforaciones, úlceras o hemorragias GI superiores e inferiores en pacientes tratados con celecoxib. Los pacientes con mayor riesgo de desarrollar estos tipos de complicaciones GI con AINEs son los adultos de edad avanzada, pacientes con enfermedad CV, pacientes que usan simultáneamente glucocorticoides, medicamentos antiplaquetarios (como AAS) u otros AINEs, pacientes que beben alcohol, o pacientes con un historial de enfermedad GI activa o previa, tales como ulceración, hemorragia GI o condiciones inflamatorias. La mayoría de los reportes espontáneos de eventos GI mortales han sido con pacientes geriátricos o débiles.
Efectos renales: Los AINEs, incluido celecoxib, pueden causar toxicidad renal. Los estudios clínicos con celecoxib han mostrado efectos renales similares a los observados con AINEs comparativos. Los pacientes con mayor riesgo de toxicidad renal son aquellos con disfunción renal, insuficiencia cardiaca, disfunción hepática y pacientes geriátricos. Estos pacientes deben vigilarse estrechamente durante el tratamiento con celecoxib.
Se debe tener precaución cuando se inicie el tratamiento en pacientes con deshidratación. Es aconsejable rehidratar a los pacientes primero y después de iniciar la terapia con celecoxib.
Enfermedad renal avanzada: La función renal debe monitorearse de cerca en pacientes con enfermedad renal avanzada a quienes se les administra celecoxib (ver sección Dosis y vía de administración).
Reacciones anafilactoides: Al igual que con los AINEs en general, han ocurrido reacciones anafilactoides en pacientes expuestos a celecoxib (ver sección Contraindicaciones).
Reacciones cutáneas graves: Las reacciones graves de la piel, algunas de ellas mortales, incluyendo reacción al medicamento con eosinofilia y síntomas sistémicos (síndrome DRESS, por sus siglas en inglés), dermatitis exfoliativa, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica han sido reportados muy raramente en asociación con el uso de celecoxib. Los pacientes parecen estar en un alto riesgo para estos eventos en el curso temprano de la terapia, el inicio del evento ocurre en la mayoría de los casos dentro del primer mes de tratamiento. Celecoxib debe suspenderse ante la primera aparición de erupción cutánea, lesiones en la mucosa o cualquier otro signo de hipersensibilidad.
Efectos hepáticos: Los pacientes con insuficiencia hepática grave (Child-Pugh Clase C) no han sido estudiados. No se recomienda el uso de celecoxib en pacientes con insuficiencia hepática grave. Celecoxib debe usarse con precaución cuando se trate a pacientes con insuficiencia hepática moderada (Child-Pugh Clase B) e iniciarse con la mitad de la dosis recomendada (ver sección Dosis y vía de administración).
Rara vez han sido reportados casos de reacciones hepáticas graves incluyendo hepatitis fulminante (algunos con desenlace mortal), necrosis e insuficiencia hepática (algunos con desenlace mortal o con la necesidad de un trasplante de hígado) con el uso de celecoxib.
Un paciente con signos y/o síntomas de disfunción hepática o quienes han presentado una prueba de función hepática anormal debe monitorearse cuidadosamente en busca de evidencia del desarrollo de una reacción hepática más severa mientras es tratado con celecoxib.
Uso con anticoagulantes orales: El uso concomitante de AINEs con anticoagulantes orales incrementa el riesgo de hemorragia y deben ser administrados con precaución. Los anticoagulantes orales incluyen warfarina/tipo cumarina y anticoagulantes orales (p. ej. apixabán, dabigatrán y rivaroxabán). En pacientes con tratamiento concomitante con warfarina o agentes similares, se han reportado eventos hemorrágicos graves, algunos de estos mortales. Debido a que se ha reportado incremento en los tiempos de protrombina (INR, por sus siglas en inglés), se debe monitorear la actividad anticoagulante/INR en pacientes que toman anticoagulantes como warfarina/tipo cumarina después de iniciar el tratamiento con celecoxib o al cambiar la dosis (ver sección Interacciones medicamentosas y de otro género).
General: Al reducir la inflamación, celecoxib puede disminuir la utilidad de los signos diagnóstico, tal como fiebre, en la detección de infecciones.
Debe evitarse el uso concomitante de celecoxib y un AINE distinto al AAS.
Inhibición del CYP2D6: Celecoxib ha mostrado ser un inhibidor moderadamente potente del CYP2D6. Para fármacos que son metabolizados por CYP2D6 puede ser necesaria una reducción de dosis durante el inicio del tratamiento con celecoxib o un incremento de dosis hacia el término del tratamiento con celecoxib (ver sección Interacciones medicamentosas y de otro género).
Efectos en la habilidad para conducir y usar maquinaria: No se han estudiado los efectos de celecoxib sobre la capacidad para conducir y usar maquinaria pero de acuerdo con sus propiedades farmacodinámicas y su perfil general de seguridad, es improbable que tenga algún efecto.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Oral.
Celecoxib cápsulas, a dosis de hasta 200 mg dos veces al día puede tomarse con o sin alimentos.
A medida que los riesgos cardiovasculares de celecoxib aumentan en relación con la dosis y duración de la exposición, debe utilizarse la dosis más baja efectiva por día y el menor tiempo posible.
Adultos:
Tratamiento sintomático de OA: La dosis recomendada de celecoxib es 200 mg administrada como dosis única o 100 mg dos veces al día.
Tratamiento sintomático de AR: La dosis recomendada de celecoxib es 100 o 200 mg dos veces al día.
Tratamiento sintomático de EA: La dosis recomendada de celecoxib es 200 mg administrada como dosis única o 100 mg dos veces al día. Algunos pacientes pueden beneficiarse con una dosis diaria total de 400 mg.
Tratamiento de dolor agudo: La dosis inicial recomendada de celecoxib es 400 mg seguida de una dosis adicional de 200 mg en el primer día si es necesario. En los días subsecuentes, si es necesario, la dosis recomendada es 200 mg dos veces al día.
Tratamiento de DM: La dosis inicial recomendada de celecoxib es 400 mg seguida por una dosis adicional de 200 mg después de 12 h, si es necesario en el primer día. En el segundo y tercer día, la dosis recomendada es de 200 mg dos veces al día (cada 12 h). La presentación para este tratamiento contiene 1 cápsula de 400 mg y 5 cápsulas de 200 mg (ver sección Presentaciones).
La cápsula de 400 mg se identifica por una banda verde en el cuerpo con la inscripción “400” en color blanco y en la tapa una banda color verde con la inscripción “7767” en color blanco.
La cápsula de 200 mg se identifica por una banda dorada en el cuerpo con la inscripción “200” en color blanco y en la tapa una banda color dorada con la inscripción “7767” en color blanco.
Dolor de espalda baja: La dosis recomendada de celecoxib es 200 o 400 mg diariamente, administrada como 200 mg dosis única, o como 100 o 200 mg dos veces al día. Algunos pacientes pueden beneficiarse con una dosis diaria total de 400 mg.
Metabolizadores deficientes dependientes de la enzima CYP2C9: Se debe tener precaución cuando se administre celecoxib a pacientes con certeza o sospecha de metabolismo deficiente dependientes de la enzima CYP2C9, según su historia médica/experiencia con otros sustratos de CYP2C9. Considere iniciar el tratamiento con la mitad de la dosis recomendada (ver secciones Interacciones medicamentosas y de otro género y Propiedades farmacocinéticas-Metabolismo).
Pacientes de edad avanzada: Generalmente no es necesario ajustar la dosis. Sin embargo, en pacientes de edad avanzada con peso menor a 50 kg se recomienda iniciar el tratamiento con la dosis más baja recomendada.
Método de administración: Para pacientes que tienen dificultad para tragar las cápsulas, el contenido de una cápsula de celecoxib se puede agregar a puré de manzana, papilla de arroz (avena de arroz), yogur o puré de plátano. Para esto, se debe vaciar cuidadosamente todo el contenido de la cápsula en una cucharita de puré de manzana, papilla de arroz, yogur o puré de plátano frío o a temperatura ambiente y se debe ingerir inmediatamente con un poco de agua. El contenido esparcido de la cápsula sobre el puré de manzana, papilla de arroz o yogur es estable hasta por 6 h bajo refrigeración (2-8 °C). El contenido esparcido de la cápsula sobre puré de plátano no se debe guardar en refrigeración y debe ingerirse inmediatamente.
Insuficiencia hepática: No es necesario ajustar la dosis en pacientes con insuficiencia hepática leve (Child-Pugh Clase A). En pacientes con artritis o dolor con insuficiencia hepática moderada (Child-Pugh Clase B) debe iniciarse el tratamiento con la mitad de la dosis recomendada de celecoxib. Los pacientes con insuficiencia hepática severa (Child-Pugh Clase C) no han sido estudiados (ver sección Precauciones generales-Efectos hepáticos).
Insuficiencia renal: No se requiere de ajuste de dosis en pacientes con insuficiencia renal leve o moderada. No hay experiencia clínica en pacientes con insuficiencia renal grave (ver sección Precauciones generales-Efectos renales).
Coadministración con fluconazol: Celecoxib debe iniciarse con la mitad de la dosis recomendada en pacientes que reciben fluconazol, un inhibidor de CYP2C9. Se aconseja precaución cuando se coadministra celecoxib con otros inhibidores de CYP2C9 (ver sección Interacciones medicamentosas y de otro género).
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: La experiencia clínica con sobredosis es limitada. Se han administrado dosis únicas de hasta 1 200 mg y dosis múltiples de hasta 1 200 mg dos veces al día, en sujetos sanos sin que se presentaran eventos adversos clínicamente significativos. Cuando haya sospecha de sobredosis, se deberá proporcionar atención médica de soporte adecuada. Es poco probable que la diálisis sea un método eficaz para eliminar el fármaco debido a su alto porcentaje de unión a proteínas.
PRESENTACIONES:
Caja con 20 cápsulas con 100 mg.
Caja con 10, 20 o 30 cápsulas con 200 mg.
Caja de cartón con 1 cápsula con 400 mg y 5 cápsulas con 200 mg (presentación indicada para el tratamiento de la dismenorrea primaria).
Todas las presentaciones con instructivo impreso.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a no más de 30°C.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para profesionales de la salud. No se deje al alcance de los niños. No se use en el embarazo y la lactancia ni en menores de 18 años. Su venta requiere receta médica. Este medicamento contiene colorante azul núm. 1 que puede producir reacciones alérgicas (para la presentación con 400 mg).
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx y
MEX.AEReporting@pfizer.com
Pfizer, S.A. de C.V.
Km. 63 Carretera México Toluca,
Zona Industrial, C.P. 50140,
Toluca, México, México.
Reg. Núm. 031M99 SSA IV
®Marca Registrada