
BRILINTA
TICAGRELOR
Tabletas
1 Caja,10 Tabletas,90 mg
1 Caja,20 Tabletas,90 mg
1 Caja,30 Tabletas,90 mg
1 Caja,60 Tabletas,90 mg
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA contiene:
Ticagrelor 90 mg
Excipiente, c.b.p. 1 tableta.
INDICACIONES TERAPÉUTICAS: BRILINTA® está indicado para la prevención de eventos trombóticos (muerte cardiovascular, infarto de miocardio y accidente cerebrovascular) en pacientes con síndrome coronario agudo (SCA), angina inestable, infarto de miocardio sin elevación del segmento ST (NSTEMI) o infarto de miocardio con elevación del segmento ST (STEMI) incluyendo pacientes tratados médicamente o aquellos tratados con intervención coronaria percutánea (PCI) o puentes de derivación aorto-coronarios (CABG).
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacocinéticas:
Generales: Ticagrelor presenta una farmacocinética lineal, y la exposición a BRILINTA® y al metabolito activo (AR-C124910XX) son aproximadamente proporcionales a la dosis.
Absorción: La absorción de ticagrelor es rápida con una mediana de Tmáx. de aproximadamente 1.5 horas. La formación del principal metabolito circulante AR-C124910XX (también activo) es rápida con una mediana de Tmáx. de aproximadamente 2.5 horas. Los valores de Cmáx. (concentración máxima) y AUC (Área Bajo la Curva) de ticagrelor y del metabolito activo aumentaron en forma aproximadamente proporcional con la dosis en el rango estudiado (30-1,260 mg).
La biodisponibilidad media absoluta de ticagrelor se estimó en 36% (rango 25.4 a 64.0%). La ingesta de una comida rica en grasas no tuvo efecto sobre los valores de Cmáx. de ticagrelor o de AUC del metabolito activo, pero produjeron un aumento de 21% en el AUC de ticagrelor y una disminución de 22% en la Cmáx. del metabolito activo. Estos pequeños cambios se consideran de significancia clínica mínima; por lo tanto, BRILINTA® puede administrarse con las comidas o alejado de ellas.
Distribución: El volumen de distribución en estado estacionario de ticagrelor es 87.5 L. Ticagrelor y el metabolito activo se unen ampliamente a las proteínas plasmáticas humanas (> 99.0%).
Metabolismo: La CYP3A es la principal enzima responsable del metabolismo de ticagrelor y de la formación del metabolito activo y sus interacciones con otros sustratos de la CYP3A varían entre la activación y la inhibición. Ticagrelor y el metabolito activo son inhibidores débiles de la glicoproteína P.
El principal metabolito de ticagrelor es AR-C124910XX, que también fue activo cuando se evaluó por la unión in vitro al receptor de ADP plaquetario P2Y12. La exposición sistémica al metabolito activo es de aproximadamente 30-40% de la obtenida para ticagrelor.
Excreción: La vía primaria de eliminación de ticagrelor es el metabolismo hepático. Cuando se administra ticagrelor radiomarcado, la media de recuperación de la radiactividad es de aproximadamente 84% (57.8% en las heces, 26.5% en la orina). La recuperación de ticagrelor y del metabolito activo en la orina fueron ambas menores de 1% de la dosis. La vía primaria de eliminación del metabolito activo es mayormente la excreción biliar. La media de t½ fue de aproximadamente 6.9 horas (rango 4.5-12.8 horas) para ticagrelor y 8.6 horas (rango 6.5-12.8 horas) para el metabolito activo.
Poblaciones especiales:
Pacientes de edad avanzada: Se observó mayor exposición a ticagrelor (aproximadamente 60% tanto para Cmáx. como para AUC [Área Bajo la Curva]) y al metabolito activo (aproximadamente 50% tanto para Cmáx. como para AUC) en sujetos de edad avanzada (³ 65 años) comparados con sujetos más jóvenes. Esta diferencia no se considera clínicamente significativa (véase Dosis y vía de administración).
Pacientes pediátricos: BRILINTA® no se ha evaluado en la población pediátrica (véase Dosis y vía de administración).
Sexo: Se observó una mayor exposición a ticagrelor (aproximadamente 52 y 37% para Cmáx. [distribución] y AUC [Área Bajo la Curva], respectivamente), y al metabolito activo (aproximadamente 50% tanto para Cmáx. como para AUC) en mujeres comparadas con hombres. Estas diferencias no se consideran clínicamente significativas.
Insuficiencia renal: La exposición a ticagrelor fue aproximadamente 20% más baja y la exposición al metabolito activo fue aproximadamente 17% más alta en pacientes con insuficiencia renal severa comparados con sujetos con función renal normal. El efecto IPA (inhibición de la agregación plaquetaria) de ticagrelor fue similar entre los dos grupos; sin embargo, se observó más variabilidad en la respuesta individual de pacientes con insuficiencia renal severa. No es necesario el ajuste de la dosis en pacientes con insuficiencia renal. No se dispone de información respecto del tratamiento de los pacientes en diálisis renal (véase Dosis y vía de administración).
Insuficiencia hepática: Los valores de Cmáx. y AUC de ticagrelor fueron 12 y 23% más altos en pacientes con insuficiencia hepática leve comparados con sujetos sanos respectivamente; sin embargo, el efecto IPA de ticagrelor fue similar entre los dos grupos. No se necesita ajuste de la dosis en pacientes con insuficiencia hepática leve. Ticagrelor no ha sido estudiado en pacientes con insuficiencia hepática moderada o severa (véase Dosis y vía de administración).
Raza: Los pacientes de origen asiático tienen una biodisponibilidad media 39% más alta en comparación con los pacientes caucásicos. Los pacientes de raza negra tuvieron una biodisponibilidad 18% más baja de ticagrelor en comparación con los pacientes caucásicos. En estudios de farmacología clínica, la exposición (Cmáx. y AUC) a ticagrelor en sujetos japoneses fue aproximadamente 40% (20% luego del ajuste por peso corporal) más alta que en los caucásicos.
Propiedades farmacodinámicas:
Mecanismo de acción: BRILINTA® contiene ticagrelor, un miembro de la clase química de las ciclopentiltriazolpirimidinas (CPTP), que es un antagonista selectivo con fijación reversible del receptor de la adenosina difosfato (ADP) que actúa en el receptor P2Y12 del ADP y puede evitar la activación y agregación plaquetarias mediadas por ADP. Ticagrelor es activo por vía oral e interactúa reversiblemente con el receptor plaquetario de ADP P2Y12. Ticagrelor no interactúa con el sitio específico de unión al ADP, sino que su interacción con el receptor plaquetario evita la transducción de la señal del receptor de ADP P2Y12.
Efectos farmacodinámicos:
Comienzo de la acción:
Figura 1: Media del grado de inhibición final (± SE) de la Agregación Plaquetaria (IPA) luego de dosis orales únicas de 180 mg de BRILINTA® o 600 mg de clopidogrel en pacientes con CAD estable.
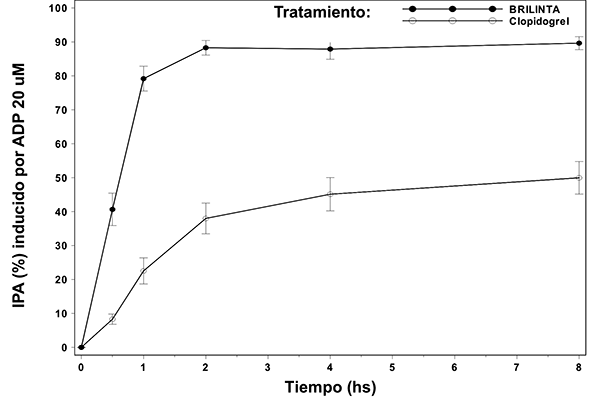
En pacientes con enfermedad arterial coronaria estable tratados con ASA, BRILINTA® demuestra un comienzo rápido del efecto farmacológico a través de la media de la inhibición de la agregación plaquetaria (IPA) a las 0.5 horas después de una dosis de carga de 180 mg de alrededor de 41%, con el máximo de efecto de IPA de 87.9 a 89.6% a las 2-4 horas postdosis. Noventa por ciento de los pacientes tuvieron un grado final de IPA > 70% a las 2 horas postdosis. El efecto alto de IPA de BRILINTA® de entre 87-89% se mantuvo entre 2-8 horas.
Figura 2: Media del grado de inhibición final (± SE) de la agregación plaquetaria (IPA) luego de la última dosis de mantenimiento de 90 mg de BRILINTA® o 75 mg de clopidogrel q.d. o placebo.
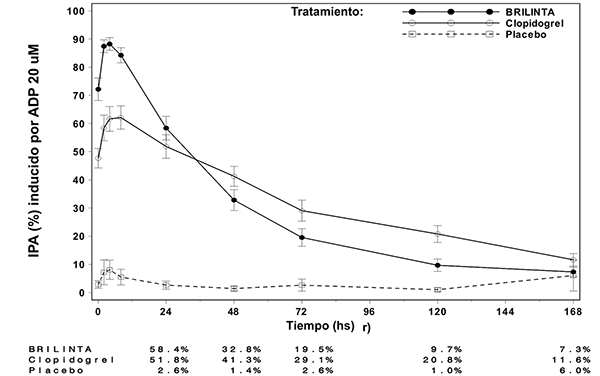
Finalización del efecto: Luego de que las concentraciones de BRILINTA® y del metabolito activo declinan a un nivel menor al requerido para la saturación del receptor, la IPA disminuye gradualmente con la disminución de las concentraciones plasmáticas. Dado que BRILINTA® se une reversiblemente, la recuperación de la función plaquetaria no depende del reemplazo de plaquetas. BRILINTA® tiene un índice de finalización de la IPA más rápido que clopidogrel, determinado por la declinación de la finalización desde las 4-72 horas posteriores a la última dosis (véase Precauciones generales).
La mediana del grado final de IPA medido luego de la última dosis de BRILINTA® es aproximadamente 20-30% mayor con BRILINTA® que con clopidogrel. Sin embargo, a las 24 horas postdosis, el porcentaje de IPA es similar entre BRILINTA® y clopidogrel, y es más bajo para BRILINTA® a partir de las 72 horas hasta los 7 días en comparación a clopidogrel. La media de porcentaje de IPA con BRILINTA® a las 72 horas (día 3) posteriores a la última dosis fue comparable a la de clopidogrel en el día 5, y el porcentaje de IPA con BRILINTA® en el día 5 fue similar al de clopidogrel en el día 7, lo cual no es diferente estadísticamente del placebo.
Respuesta a BRILINTA®: La IPA inducida por BRILINTA® tiene menos variabilidad en las concentraciones plasmáticas máximas de BRILINTA® y del metabolito activo observado con la dosis de 90 mg b.i.d. en comparación con la de clopidogrel. Los pacientes con enfermedad arterial coronaria estable predeterminados para tener una baja respuesta IPA a clopidogrel (no respuesta), y que reciben dosis concomitantes de ASA, mostraron una respuesta IPA media mayor luego de la administración de BRILINTA® en comparación a clopidogrel. En los de no respuesta a clopidogrel se observó una respuesta IPA más alta y consistente con BRILINTA®. El tratamiento con BRILINTA® resultó en una IPA consistentemente más alta en comparación con clopidogrel, y esto fue evidente posterior a la administración, tanto en los que responden como en los que no responden.
Resultados de cambio de medicamento: El cambio de clopidogrel a BRILINTA® resulta en un incremento absoluto de IPA de 26.4%, y el cambio de BRILINTA® a clopidogrel resulta en una disminución absoluta de IPA de 24.5%. Los pacientes pueden cambiar de clopidogrel a BRILINTA® sin interrupción del efecto antiplaquetario.
Eficacia clínica: La evidencia clínica de la eficacia de BRILINTA® se deriva del estudio PLATO [PLATelet Inhibition and Patient Outcomes], una comparación de BRILINTA® con clopidogrel, ambos administrados en combinación con ácido acetilsalicílico (ASA) y otros tratamientos estándares.
El estudio PLATO fue un estudio de 18,624 pacientes aleatorizados, doble ciego, de grupos paralelos, de fase III, de eficacia y seguridad de BRILINTA® comparado con clopidogrel para la prevención de eventos vasculares en pacientes con síndromes coronarios agudos (SICA) (angina inestable, infarto de miocardio sin elevación del ST [NSTEMI] o infarto de miocardio con elevación del ST [STEMI]).
El estudio incluyó pacientes que se presentaban dentro de las 24 horas del inicio del episodio más reciente de dolor torácico o síntomas. Los pacientes fueron aleatorizados para recibir clopidogrel (75 mg una vez por día, con una dosis de carga inicial de 300 mg si no se había administrado tratamiento previo con una tienopiridina. Se permitía una dosis de carga adicional de 300 mg a discreción del investigador), o una dosis de carga de 180 mg de BRILINTA® seguida de una dosis de mantenimiento de 90 mg de BRILINTA® dos veces por día. Los pacientes podían haber sido tratados médicamente, haber sido tratados con intervención coronaria percutánea (PCI) o puentes de derivación aortocoronarios (CABG).
Figura 3: Estimado de riesgo a la primera ocurrencia de cualquier evento en el parámetro de evaluación de eficacia.
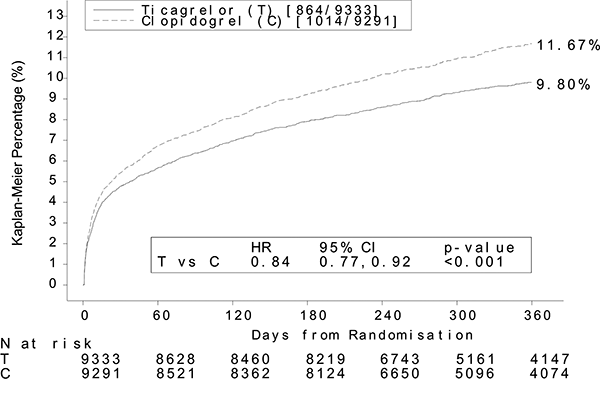
BRILINTA® redujo la aparición del parámetro de evaluación compuesto primario en comparación con clopidogrel tanto en la población UA/NSTEMI como en la STEMI.
Tabla 1. Resultados de eventos en el estudio PLATO
|
Parámetro de evaluación primario |
Pacientes con eventos |
||||
|
BRILINTA® (%) N = 9,333 |
Clopidogrel (%) N = 9,291 |
Reducción del riesgo relativoa (%) |
Índice de riesgo (95% CI) |
Valor p |
|
|
Compuesto de muerte CV/MI (excl. MI silente)/accidente cerebrovascular |
9.3 |
10.9 |
16 |
0.84 (0.77, 0.92) |
p = 0.0003 |
|
Muerte CV |
3.8 |
4.8 |
21 |
0.79 (0.69, 0.91) |
p = 0.0013 |
|
MI (excl. MI silente)a |
5.4 |
6.4 |
16 |
0.84 (0.75, 0.95) |
p = 0.0045 |
|
Accidente cerebrovascular |
1.3 |
1.1 |
-17 |
1.17 (0.91, 1.52) |
p = 0.2249 |
|
Parámetros de evaluación secundarios |
|||||
|
Combinación de muerte CV/MI (excl. MI silente)/accidente cerebrovascular – intento de tratamiento invasivoa |
8.5 |
10.0 |
16 |
0.84 (0.75, 0.94) |
p = 0.0025 |
|
Combinación de mortalidad por cualquier causa/MI (excl. MI silente)/accidente cerebrovascular |
9.7 |
11.5 |
16 |
0.84 (0.77, 0.92) |
p = 0.0001 |
|
Compuesto de muerte CV/MI total/ accidente cerebrovascular/SRI/RI/TIA/otro ATE |
13.8 |
15.7 |
12 |
0.88 (0.81, 0.95) |
p = 0.0006 |
|
Mortalidad por cualquier causa |
4.3 |
5.4 |
22 |
0.78 (0.69, 0.89) |
p = 0.0003** |
a RRR = (1-índice de riesgo) x 100%. Los valores con una reducción de riesgo relativo negativa indican un aumento del riesgo relativo.
** Valor p nominal.
BRILINTA® es superior a clopidogrel en la prevención de eventos trombóticos (RRR 16%, ARR 1.9%, NNT = 54) del parámetro de evaluación compuesto de eficacia (muerte cardiovascular [CV], infarto de miocardio [MI], o accidente cerebrovascular) durante 12 meses. La diferencia entre los tratamientos fue explicada por la muerte cardiovascular y el infarto de miocardio sin diferencias en los accidentes cerebrovasculares. BRILINTA® demostró una reducción estadísticamente significativa del riesgo relativo de 16% (ARR 1.1%) para MI y una reducción del riesgo relativo de 21% (ARR 1.1%) para muerte CV. El tratamiento de 91 pacientes con BRILINTA® en lugar de clopidogrel prevendrá 1 muerte CV.
BRILINTA® mostró superioridad frente a clopidogrel en la prevención del objetivo primario (muerte cardiovascular [CV], infarto de miocardio [MI] o un accidente cerebrovascular). Este resultado apareció tempranamente (reducción del riesgo absoluto [RRA] 0.6% y reducción del riesgo relativo [RRR] de 12% a los 30 días), con un efecto constante en el tratamiento durante un periodo completo de 12 meses, produciendo un RRA 1.9% por año con un RRR de 16%. Esto sugiere que es apropiado para el tratamiento durante al menos 12 meses (véase Dosis y vía de administración).
En el estudio PLATO se llevaron a cabo un gran número de comparaciones de subgrupos para el parámetro de evaluación primaria de eficacia, con el fin de evaluar la robustez y consistencia del beneficio global. El efecto del tratamiento de BRILINTA® sobre clopidogrel parece ser consistente entre los múltiples subgrupos de tratamiento por características demográficas incluyendo peso, sexo, antecedentes médicos, terapia concomitante, y por diagnóstico final del evento [STEMI, NSTEMI, y angina inestable (UA)].
Se observó una débil interacción significativa del tratamiento regionalmente, en que la HR para el parámetro de evaluación primario favorece a BRILINTA® en el resto del mundo, pero favorece a clopidogrel en América del Norte, lo cual representa aproximadamente 10% de la población global estudiada (valor de p para la interacción = 0.045).
Este aparente tratamiento regional-interacción, observado en PLATO posiblemente podría atribuirse a la casualidad, al menos en parte. Análisis adicionales sugieren que la eficacia de clopidogrel en relación con BRILINTA® se asocia con dosis de ASA durante la terapia de mantenimiento. Los datos muestran una mayor eficacia de ticagrelor en comparación con clopridogrel cuando se utiliza con una dosis baja de mantenimiento de ASA (75-150 mg). La eficacia relativa de ticagrelor frente a clopidogrel cuando se utiliza con altas dosis de ASA (>300 mg) es más incierta. Con base en esta relación observada entre la dosis de mantenimiento de ASA y la eficacia relativa de ticagrelor en comparación con clopidogrel, se recomienda que BRILINTA® se utilice con una dosis de mantenimiento baja de ASA 75-150 mg (véase Precauciones generales y Dosis y vía de administración).
Los beneficios asociados con BRILINTA® también fueron independientes del uso de otras terapias cardiovasculares agudas y a largo plazo, incluyendo heparina, heparina de bajo peso molecular (LMWH), inhibidores GpIIb/IIIa intravenosos, fármacos hipolipemiantes, beta bloqueantes, inhibidores de la enzima convertidora de angiotensina (IECA), antagonistas del receptor de la angiotensina II (ARAII), e inhibidores de la bomba de protones (IBP) (véase Interacciones medicamentosas y de otro género).
BRILINTA® demostró una reducción de riesgo relativo (RRR) estadísticamente significativo en el parámetro de evaluación compuesto de muerte cardiovascular (CV), infarto de miocardio (MI) y accidente cerebrovascular en pacientes con SCA programados para someterse a tratamiento invasivo (RRR 16%, ARR 1.7%, p = 0.0025). En un análisis exploratorio, BRILINTA® demostró una reducción del riesgo relativo del parámetro de evaluación primario compuesto en pacientes con SCA programados para someterse a tratamiento médico (RRR 15%, ARR 2.3%, p nominal = 0.0444). En forma consistente con el parámetro de evaluación primario del estudio, el efecto en estos dos grupos fue justificado por muerte CV y MI, sin efecto sobre el accidente cerebrovascular. En los pacientes a los que se les coloca stent, hubo numéricamente menos trombosis definidas por Stent, entre pacientes tratados con ticagrelor en comparación con los tratados con clopidogrel (73 vs. 107, RRR 32%, ARR 0.6%, p nominal = 0.0123).
BRILINTA® demostró una RRR estadísticamente significativa de 16% (ARR 2.1%) para el compuesto de mortalidad de cualquier causa, MI y accidente cerebrovascular comparado con clopidogrel.
Se evaluó el parámetro de evaluación secundario (mortalidad de cualquier causa). BRILINTA® demostró una RRR de 22% para mortalidad por cualquier causa en comparación con clopidogrel a un nivel de significancia nominal de p = 0.0003 y una ARR de 1.4%.
Subestudio Holter: Para estudiar la aparición de pausas ventriculares y otros episodios de arritmias durante el estudio PLATO, los investigadores realizaron un monitoreo con Holter en un subgrupo de casi 3,000 pacientes, de los cuales aproximadamente 2,000 tuvieron registros tanto en la fase aguda de su SCA como después de un mes. La variable primaria de interés fue la aparición de pausas ventriculares ³ 3 segundos.
Más pacientes tuvieron pausas ventriculares con BRILINTA® (6.0%) que con clopidogrel (3.5%) en la fase aguda; y 2.2 y 1.6% respectivamente luego de 1 mes. Más pacientes tuvieron pausas ventriculares con BRILINTA® que con clopidogrel; sin embargo, no hubo consecuencias clínicas adversas asociadas con esta diferencia (incluyendo colocación de marcapasos) en esta población de pacientes.
Ticagrelor es activo por vía oral. A diferencia de clopidogrel, no requiere la actividad de la enzima CYP450 para inhibir la agregación plaquetaria. Los polimorfismos en el gen que codifica la enzima CYP450, 2C19 puede afectar la eficacia de clopidogrel. El polimorfismo en el gen que codifica para el transporte de P-glicoproteína (ABCB1) puede afectar a la eficacia tanto de clopidogrel y ticagrelor.
En el estudio PLATO, 10,285 pacientes proporcionaron muestras genéticas para la determinación del genotipo CPY2C19 y ABCB1 loci. Su análisis proporcionó estas asociaciones de agrupaciones de genotipo sobre la eficacia y seguridad de los resultados del estudio PLATO.
• La superioridad de BRILINTA® sobre clopidogrel no se ve afectada significativamente en los pacientes con el genotipo CYP2C19.
• BRILINTA® reduce los eventos CV mayores en comparación con clopidogrel de forma independiente del genotipo CYP2C19.
• La tasa de eventos para BRILINTA® no varió con el genotipo CYP2C19.
• En el grupo tratado con clopidogrel, los portadores del alelo CYP2C19 Pérdida de Función (LOF), aumentaron las tasas de eventos primarios extremos en comparación con los no portadores.
• Al igual que en el estudio global PLATO, el sangrado mayor total no fue diferente entre BRILINTA® y clopidogrel, independientemente del genotipo CYP2C19, aunque los pacientes con uno o más alelos Ganadores de Función (GOF) en clopidogrel tuvieron la tasa mayor de sangrado.
• Al igual que en el estudio global PLATO, el sangrado no-CABG se incrementó con BRILINTA® en comparación con clopidogrel en pacientes con un alelo CYP2C19 LOF.
• El sangrado no-CABG fue similar con BRILINTA® y clopidogrel en pacientes sin alelo CYP2C19 LOF.
Análisis combinado de eficacia y seguridad: Un análisis combinado de eficacia y seguridad (muerte CV, MI, accidente cerebrovascular, o sangrado mayor total según PLATO) avala el beneficio clínico de ticagrelor comparado con clopidogrel (RRR 8%, ARR 1.4%, HR 0.92; p = 0.0257) durante 12 meses luego de los eventos de SCA.
CONTRAINDICACIONES: BRILINTA® no debe administrarse a pacientes con antecedentes de hipersensibilidad a ticagrelor o a alguno de los excipientes, ni tampoco en casos de sangrado patológico activo, historia de hemorragia intracraneal o insuficiencia hepática grave (véase Reacciones secundarias y adversas).
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: No se han llevado a cabo estudios clínicos en mujeres embarazadas o en mujeres durante la lactancia.
Se dispone de datos clínicos limitados sobre la exposición a BRILINTA® durante el embarazo.
Los estudios en animales no indican efectos perjudiciales directos respecto del embarazo, del desarrollo embrionario/fetal, del parto ni del desarrollo postnatal. Ticagrelor no tuvo efecto sobre la fertilidad masculina ni femenina (véase Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad).
Dado que los estudios de reproducción en animales no siempre son predictivos de la respuesta en humanos, ticagrelor debe utilizarse durante el embarazo solamente cuando el beneficio potencial para la madre justifique algún riesgo potencial para el feto.
Lactancia: No se conoce si este medicamento se excreta en humanos en la leche materna. Los estudios en ratas mostraron que ticagrelor y sus metabolitos activos se excretan en la leche. No se recomienda el uso de BRILINTA® durante la lactancia.
REACCIONES SECUNDARIAS Y ADVERSAS: La seguridad de BRILINTA® en pacientes con síndromes coronarios agudos (UA, NSTEMI y STEMI) fue evaluada en un estudio único fase 3 extenso (estudio PLATO [PLATelet Inhibition and Patient Outcomes]), que comparó pacientes tratados con BRILINTA® (dosis de carga de 180 mg de BRILINTA® y dosis de mantenimiento de 90 mg b.i.d.) en pacientes tratados con clopidogrel (300-600 mg de dosis de carga seguida de una dosis de mantenimiento de 75 mg o.d.) ambos administrados en forma concomitante con ácido acetilsalicílico (ASA) y otros tratamientos estándares.
La mediana de duración del tratamiento con BRILINTA® fue de 277 días (6,762 pacientes fueron tratados por más de 6 meses y 3,138 fueron tratados por más de 12 meses).
Los eventos adversos más comúnmente reportados en pacientes tratados con ticagrelor fueron disnea, cefalea y epistaxis y estos eventos se produjeron con índices superiores que en el grupo de tratamiento con clopidogrel. Durante el periodo de tratamiento, el grupo de BRILINTA® tuvo una mayor incidencia de interrupción debida a eventos adversos que en clopidogrel (7.4% vs. 5.4%).
Sangrado:
En el estudio PLATO se utilizaron las siguientes definiciones de sangrado:
Mayor fatal/potencialmente fatal: Sangrado fatal, o intracraneal, o intrapericárdico con taponamiento cardiaco, o shock hipovolémico o hipotensión severa debida al sangrado y que requirió vasopresores o cirugía, o sangrado aparente manifestado clínicamente asociado con una disminución de la hemoglobina de más de 50 g/L, o transfusión de 4 o más unidades [paquete globular completo (PRBCs)] para el sangrado.
Otros mayores: Significativamente discapacitante (por ejemplo, intraocular con pérdida de la visión permanente), o sangrado clínicamente manifiesto o aparente asociado con una disminución de la hemoglobina de 30 a 50 g/L, o transfusión de 2-3 unidades (sangre entera o PRBCs) para el sangrado.
Menor: Requiere intervención médica para detener o tratar el sangrado (por ejemplo, epistaxis que requiera una visita a un centro de atención médica para taponaje).
Los sangrados mínimos incluyeron todos los demás sangrados; los mismos fueron recabados pero no adjudicados.
Los eventos de sangrado reportados en el estudio PLATO también se interpretaron con la escala TIMI (Thrombolysis in Myocardial Infarction) para facilitar la comparación con otros estudios similares. Mayor TIMI se define como un sangrado clínicamente manifiesto asociado con una caída de la hemoglobina > 5 g/dL, o hemorragia intracraneal, y menor TIMI se define como un sangrado manifiesto asociado con una caída de la hemoglobina de 3 g/dL pero £ 5 g/dL.
El resultado global de los eventos de sangrado en el estudio PLATO se muestra en la figura 4 y tabla 2.
Figura 4: Estimado de Kaplan Meier del tiempo hasta el primer evento de sangrado “mayor total” según la definición del estudio PLATO.
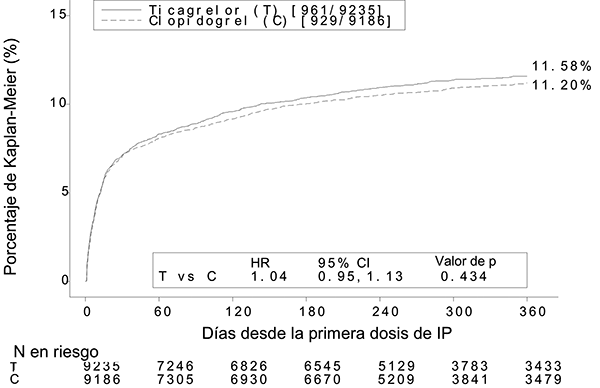
Tabla 2. Análisis de los eventos de sangrado globales
|
BRILINTA® (%) N = 9,235 |
Clopidogrel (%) N = 9,186 |
Valor de p |
|
|
Parámetro de evaluación primario de seguridad |
|||
|
Mayor total |
11.6 |
11.2 |
0.4336 |
|
Parámetros de evaluación secundarios |
|||
|
Fatal/potencialmente fatal |
5.8 |
5.8 |
0.6988 |
|
Sangrados combinados totales mayor + menor |
16.1 |
14.6 |
0.0084 |
|
Mayor no CABG |
4.5 |
3.8 |
0.0264 |
|
Mayor no asociado a procedimiento |
3.1 |
2.3 |
0.0058 |
|
Mayor + menor no asociado a procedimiento |
5.9 |
4.3 |
< 0.0001 |
|
Categoría de sangrado según TIMI |
|||
|
Mayor según TIMI |
7.9 |
7.7 |
0.5669 |
|
Mayor + menor según TIMI |
11.4 |
10.9 |
0.3272 |
En el estudio PLATO, el tiempo hasta el primer sangrado “mayor total” según los criterios de PLATO, con BRILINTA® no difirió significativamente del de clopidogrel. Hubo pocos eventos de sangrado fatal en el estudio, 20 (0.2%) con BRILINTA® y 23 (0.3%) con clopidogrel. Cuando se incluyó el sangrado menor, los eventos combinados de sangrado mayor y menor según los criterios de PLATO fueron significativamente más numerosos con BRILINTA® que con clopidogrel. Los índices globales de eventos de sangrado según los criterios TIMI no difirieron significativamente entre BRILINTA® y clopidogrel.
Sangrado relacionado a CABG: En el estudio PLATO, 1,584 pacientes (12%) fueron sometidos a cirugía de puentes de derivación aortocoronarios (CABG). El sangrado mayor fatal/potencialmente fatal fue de aproximadamente 42% en ambos grupos de tratamiento. No hubo diferencia entre los grupos de tratamiento respecto del riesgo de sangrado mayor fatal/potencialmente fatal con la CABG en relación a la última dosis previa al procedimiento. Los sangrados fatales relacionados a CABG se produjeron raramente, 6 pacientes en cada grupo de tratamiento (0.8 y 0.7% de los pacientes sometidos a CABG con BRILINTA® y clopidogrel, respectivamente).
Sangrados no relacionados a CABG: Cuando se excluyeron del análisis los sangrados relacionados a CABG (véase tabla 3), los índices absolutos de sangrado para todas las categorías fueron más bajos. Los grupos no difirieron en los sangrados mayores fatales/potencialmente fatales según los criterios de PLATO no relacionados con CABG, pero los sangrados mayores totales según los criterios de PLATO, los mayores según los criterios TIMI y los mayores + menores según los criterios TIMI fueron más comunes con BRILINTA®.
Tabla 3. Eventos de sangrado mayores según los criterios PLATO no relacionados con CABG y eventos de sangrado según los criterios TIMI
|
BRILINTA® (%) N = 9,235 |
Clopidogrel (%) N = 9,186 |
Valor de p |
|
|
Categoría de sangrado según PLATO |
|||
|
Sangrado mayor total |
4.5 |
3.8 |
0.0264 |
|
Mayor fatal/potencialmente fatal |
2.1 |
1.9 |
0.2516 |
|
Categoría de sangrado según TIMI |
|||
|
Mayor según TIMI |
2.8 |
2.2 |
0.0246 |
|
Mayor + menor según TIMI |
4.5 |
3.6 |
0.0093 |
Sangrado no relacionado con ningún procedimiento: Como se muestra en la tabla 2, el sangrado mayor y mayor + menor según PLATO no relacionado a procedimientos fue más frecuente con BRILINTA®. La interrupción del tratamiento debido a sangrado no relacionado a procedimientos fue más común con BRILINTA® (2.9%) que con clopidogrel (1.2%; p < 0.001). Las localizaciones clínicamente importantes de sangrado mayor + menor en orden de frecuencia fueron (BRILINTA® vs. clopidogrel): intracraneal (27 vs. 14 eventos), pericárdico (11 vs. 11), retroperitoneal (3 vs. 3), intraocular (2 vs. 4) e intraarticular (2 vs. 1). Otras localizaciones comunes fueron en orden de frecuencia: gastrointestinal (170 vs. 135 eventos), epistaxis (116 vs. 61), urinario (45 vs. 37), subcutáneo/dérmico (43 vs. 38) y hemoptisis (13 vs. 7).
No hubo diferencia entre BRILINTA® y clopidogrel en el sangrado fatal no relacionado con procedimientos. El sangrado gastrointestinal mayor fatal/potencialmente fatal fue el mismo con BRILINTA® y clopidogrel, con más eventos fatales numéricamente con clopidogrel (5) que con BRILINTA® (ninguno). Numéricamente hubo más eventos de sangrado intracraneal no relacionados con procedimientos mayor fatal/potencialmente fatal con BRILINTA® (n = 27 eventos en 26 pacientes, 0.3%) que con clopidogrel (n = 14 eventos, 0,2%), de los cuales 11 eventos de sangrado con BRILINTA® y 1 con clopidogrel fueron fatales.
Se evaluaron las características basales incluyendo edad, sexo, peso, raza, región geográfica, antecedentes médicos, enfermedades concomitantes y terapia concomitante para explorar todo incremento en el riesgo de sangrado con BRILINTA®. No se identificó ningún grupo de riesgo en particular para ningún subgrupo de sangrado.
Disnea: Se produce disnea durante el tratamiento con ticagrelor. Los eventos adversos (EA) de disnea (disnea, disnea en reposo, disnea con el esfuerzo, disnea paroxística nocturna y disnea nocturna), al combinarse, se reportó en 13.8% de los pacientes que tomaban ticagrelor y en 7.8% de los pacientes que tomaban clopidogrel en el estudio PLATO. El estudio no excluyó pacientes con insuficiencia cardiaca congestiva (ICC) de base, enfermedad pulmonar obstructiva crónica (EPOC), ni asma. La mayor parte de los EAs de disnea fueron de intensidad leve a moderada. Se reportaron eventos adversos serios de disnea en 0.7% de los pacientes que tomaron BRILINTA® y en 0.4% de los que tomaban clopidogrel. Más pacientes que tomaban BRILINTA® 0.9% interrumpieron el medicamento de estudio en comparación con la cantidad de pacientes que tomaban clopidogrel 0.1% debido a disnea. La disnea en general se reportó en la fase inicial del tratamiento. Ochenta y siete pacientes que tomaban BRILINTA® reportaron disnea experimentando un único episodio. Aproximadamente 30% de todos los episodios de disnea se resolvieron dentro de los 7 días. Los pacientes que reportaron disnea tendieron a ser mayores y tenían disnea, ICC, EPOC o asma basales con mayor frecuencia. Los datos del estudio PLATO no sugieren que la mayor frecuencia de disnea con BRILINTA® se deba a enfermedad cardiaca o pulmonar de nueva aparición o empeorada (véase Precauciones generales).
En pacientes sometidos a pruebas de función pulmonar en el programa clínico, no hubo indicación de ningún efecto adverso con BRILINTA® sobre la función pulmonar.
Las reacciones adversas se clasifican de acuerdo con la frecuencia y el sistema. Las categorías de frecuencia se definen de acuerdo a las siguientes convenciones: muy común (³ 1/10), común (³ 1/100, <1/10), poco común (³ 1/1,000, <1/100), raro (³ 1/10,000, < 1/1,000).
Luego de los estudios con BRILINTA® se han identificado las siguientes reacciones adversas.
Tabla 4. Reacciones adversas clasificadas por órgano y sistema (SOC por sus siglas en inglés) y la frecuencia de reacciones adversas
|
Clasificación por sistema órgano |
Muy común |
Común |
Poco común |
Raro |
|
Trastornos del metabolismo y de la nutrición |
Hiperuricemiaa |
|||
|
Trastornos psiquiátricos |
Confusión |
|||
|
Trastornos del sistema nervioso central |
Cefalea, mareo |
Hemorragia intracranealb, Parestesias |
||
|
Transtornos oculares |
Hemorragia ocular (intraocular, conjuntival, retinal) |
|||
|
Trastornos del oído y del laberinto |
Vértigo |
|||
|
Trastornos respiratorios, torácicos y mediastinales |
Disneab |
Epistaxis |
Hemoptisis |
|
|
Trastornos gastrointestinales |
Dolor abdominal, constipación, diarrea, dispepsia, hemorragia gastrointestinalb, náuseas, vómito |
Gastritis, hemorragia retroperitonealb |
||
|
Trastornos de la piel y del tejido subcutáneo |
Sangrado subcutáneo o dérmicob, erupción, prurito |
|||
|
Trastornos musculoesqueléticos del tejido conjuntivo y huesos |
Hemartrosis. |
|||
|
Trastornos renales y urinarios |
Sangrado del tracto urinariob |
|||
|
Estudios de laboratorio |
Aumento de la creatinina sanguíneaa |
|||
|
Lesión, envenenamiento y complicación de procedimientos |
Hemorragia posterior al procedimiento |
a Las frecuencias derivadas de observaciones de laboratorio (ácido úrico > 7 y 6.5 mg/dL el LSN en hombres y mujeres, respectivamente, y aumento de creatinina > 50% el valor basal) y sin reporte de frecuencia de eventos adversos (véase Alteraciones en los resultados de pruebas de laboratorio.
b Representa múltiples eventos adversos relacionados con los términos.
Experiencia postcomercialización: Las siguientes reacciones adversas han sido identificadas durante el uso posterior a la aprobación de BRILINTA®. Debido a que estas reacciones son reportadas voluntariamente por una población de tamaño incierto, no siempre es posible estimar su frecuencia de manera confiable.
Trastornos del sistema inmunológico: Reacciones de hipersensibilidad incluyendo angioedema (véase Contraindicaciones).
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Los datos preclínicos de ticagrelor y del metabolito principal no han demostrado un riesgo inaceptable de efectos adversos en humanos en base a los estudios convencionales de farmacología de seguridad, de toxicidad de dosis únicas y repetidas y de potencial genotóxico. Las reacciones adversas no observadas en estudios clínicos, pero vistas en animales a niveles de exposición similares o por encima de los niveles clínicos de exposición con posible relevancia para el uso clínico fueron los siguientes: irritación gastrointestinal.
No se observaron tumores relacionados al compuesto en un estudio de 2 años en ratones a dosis orales de hasta 250 mg/kg/día (> 18 veces la exposición terapéutica humana). No hubo aumento de los tumores en ratas machos con dosis orales de hasta 120 mg/kg/día (> 15 veces la exposición terapéutica humana). Hubo un aumento de los adenocarcinomas uterinos y de los adenomas más adenocarcinomas hepatocelulares y una disminución de los adenomas pituitarios y fibroadenomas mamarios en ratas hembras solamente expuestas a dosis altas (> 25 veces la exposición terapéutica humana). No se observaron cambios en la incidencia de tumores con la dosis de 60 mg/kg/día (> 8 veces de diferencia con la dosis terapéutica humana). Los tumores uterinos vistos solamente en ratas se consideraron resultado de un efecto endocrino no genotóxico de desequilibrio hormonal presente en ratas que recibieron dosis altas de ticagrelor. Los tumores benignos se consideran secundarios a la respuesta hepática a la carga metabólica colocada en el hígado por las altas dosis de ticagrelor.
Ticagrelor se ha estudiado en una variedad de pruebas in vitro e in vivo, y no mostró ser genotóxico.
Ticagrelor no tuvo efecto en la fertilidad de ratas hembras a dosis de hasta 200 mg/kg por día (aproximadamente 20 veces la exposición terapéutica humana) y no tuvo efecto sobre la fertilidad de ratas machos a dosis de hasta 180 mg/kg/día (15.7 veces la exposición terapéutica humana).
Ticagrelor no tuvo efecto sobre el desarrollo fetal a dosis orales de hasta 100 mg/kg por día en ratas (5.1 veces la exposición terapéutica humana) y de hasta 42 mg/kg por día en conejos (equivalente a la exposición terapéutica humana). Ticagrelor no tuvo efectos sobre el parto ni el desarrollo postnatal en ratas con dosis de hasta 60 mg/kg/día (4.6 veces la exposición terapéutica humana).
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones farmacológicas:
Efectos de otros fármacos sobre BRILINTA®:
Medicamentos metabolizados por CYP3A4:
Ketoconazol (inhibidores potentes de CYP3A4): La administración concomitante de ketoconazol con ticagrelor aumentó los valores de Cmáx. y de AUC de ticagrelor a 2.4 y 7.3 veces, respectivamente. Los valores de Cmáx. y AUC del metabolito activo se redujeron 89 y 56%, respectivamente. Se esperaría que otros inhibidores potentes de CYP3A4 (claritromicina, nefazadona, ritonavir y atanazavir) tuvieran efectos similares y no deberían administrarse concomitantemente con BRILINTA® (véase Precauciones generales).
Diltiazem (inhibidores moderados de CYP3A4): La administración concomitante de ticagrelor y diltiazem aumentó los valores de Cmáx. de ticagrelor en 69% y los de AUC en 174% y disminuyó los valores de Cmáx. del metabolito activo en 38% y el AUC del metabolito activo no se modificó. No hubo efecto de ticagrelor sobre los niveles plasmáticos de diltiazem. Otros inhibidores moderados de CYP3A4 (por ejemplo, amprenavir, aprepitant, eritromicina, fluconazol y verapamil) también pueden administrarse concomitantemente con BRILINTA®.
Rifampicina y otros inductores de CYP3A4: La administración concomitante de rifampicina con ticagrelor disminuyó los valores de Cmáx. y AUC de ticagrelor en 73 y 86%, respectivamente. La Cmáx. del metabolito activo no se modificó y el AUC disminuyó en 46% respectivamente. Se esperaría que otros inductores de CYP3A4 (por ejemplo, dexametasona, fenitoína, carbamacepina y fenobarbital) disminuyan también la exposición a ticagrelor y pueden reducir la eficacia de BRILINTA®.
Ciclosporina (PgP e inhibidor CYP3A): La coadministración de ciclosporina (600 mg) con ticagrelor, incrementa la Cmáx. y el AUC en 2.3 y 2.8 veces, respectivamente. El AUC del metabolito activo se incrementó cerca de 32% y la Cmáx. disminuyó cerca de 15% en presencia de ciclosporina. No hubo efecto de ticagrelor en los niveles sanguíneos de ciclosporina.
Otros: Los estudios clínicos de interacción farmacológica mostraron que la administración concomitante de ticagrelor con heparina, enoxaparina y ácido acetilsalicílico no tuvo ningún efecto sobre los niveles plasmáticos de ticagrelor o del metabolito activo. La administración concomitante de ticagrelor y heparina no tuvo efecto sobre la heparina en base a los ensayos de tiempo de tromboplastina parcial activada (aPTT) y tiempo de coagulación activado (ACT). La administración concomitante de ticagrelor y enoxaparina no tuvo efecto sobre la enoxaparina en base al ensayo del factor Xa.
Efectos de BRILINTA® sobre otros fármacos:
Medicamentos metabolizados por CYP3A4:
Simvastatina: La administración concomitante de ticagrelor con simvastatina aumentó los valores de simvastatina de Cmáx. en 81% y de AUC en 56%, y aumentó la Cmáx. de simvastatina ácida en 64% y el AUC en 52% con algunos incrementos individuales de 2 a 3 veces. Debe considerarse el significado clínico de la magnitud y el rango de los cambios sobre la exposición en pacientes que requieren más de 40 mg de simvastatina. No hubo efecto de simvastatina sobre los niveles plasmáticos de ticagrelor. BRILINTA® puede tener efectos similares sobre lovastatina, pero no se espera que tenga efectos clínicamente significativos sobre otras estatinas.
Atorvastatina: La administración concomitante de atorvastatina y ticagrelor aumentó los valores de atorvastatina ácida de Cmáx. en 23% y el AUC en 36%. Se observaron aumentos similares de los valores de AUC y Cmáx. con todos los metabolitos ácidos de atorvastatina. Estos aumentos no se consideran clínicamente significativos.
Medicamentos metabolizados por CYP2C9-tolbutamida: La administración concomitante de ticagrelor con tolbutamida no produjo cambios en los niveles plasmáticos de ninguno de los fármacos, lo que sugiere que ticagrelor no es un inhibidor de CYP2C9 y probablemente no altere el metabolismo mediado por CYP2C9 de fármacos como la warfarina y la tolbutamida.
Anticonceptivos orales: La administración concomitante de ticagrelor con levonorgestrel y etinil estradiol aumentó la exposición a etinilestradiol en aproximadamente 20%, pero no alteró la farmacocinética de levonorgestrel. No se espera tener efectos clínicamente relevantes sobre la eficacia de los anticonceptivos orales cuando se administran concomitantemente levonorgestrel y etinilestradiol con BRILINTA®.
Digoxina (sustrato de la PgP): La administración concomitante de ticagrelor aumentó la Cmáx. de digoxina en 75% y su AUC en 28%. Por lo tanto, se recomienda el monitoreo clínico y/o de laboratorio apropiado cuando se administran fármacos de índice terapéutico estrecho dependientes de la P-gp como la digoxina en forma concomitante con BRILINTA®.
Otros tratamientos concomitantes: En los estudios clínicos, BRILINTA® se administró comúnmente con ácido acetilsalicílico, heparina, heparina de bajo peso molecular, inhibidores intravenosos de la GpIIb/IIIa, inhibidores de la bomba de protones, estatinas, beta bloqueadores, inhibidores de la enzima convertidora de angiotensina y bloqueadores del receptor de la angiotensina, según fuera necesario para las enfermedades concomitantes.
Estos estudios no produjeron ninguna evidencia de interacciones adversas clínicamente significativas.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: En el estudio PLATO, la concentración sérica de ácido úrico aumentó a más del límite superior normal en 22% de los pacientes que recibían BRILINTA® en comparación con 13% de los pacientes que recibían clopidogrel. La media de la concentración sérica de ácido úrico aumentó aproximadamente 15% con BRILINTA® en comparación con aproximadamente 7% con clopidogrel, y se redujo después de suspender el tratamiento. No hubo diferencia en la frecuencia de los eventos adversos clínicos.
En el estudio PLATO, la concentración sérica de creatinina aumentó en > 50% en el 8% de los pacientes que recibían BRILINTA® en comparación con 7% de los pacientes que recibían clopidogrel. Los aumentos típicamente no progresaron con la continuación del tratamiento y a veces disminuyeron durante la terapia. Se observaron signos de reversibilidad con la interrupción aun en aquellos con los aumentos más altos durante el tratamiento. Los grupos de tratamiento de PLATO no difirieron en cuanto a eventos adversos serios relacionados.
PRECAUCIONES GENERALES:
Riesgo de sangrado: Como con otros agentes antiplaquetarios, el uso de BRILINTA® en pacientes con riesgo conocido de aumento de sangrado se debe ponderar contra el beneficio, en términos de prevención de eventos trombóticos. Si está clínicamente indicado, BRILINTA® debe utilizarse con precaución en los siguientes grupos de pacientes considerando lo siguiente:
• Pacientes propensos al sangrado (por ejemplo, debido a traumatismo reciente, cirugía reciente, sangrado gastrointestinal reciente o activo, o insuficiencia hepática moderada). El uso de BRILINTA® está contraindicado en pacientes con sangrado patológico activo y en aquellos con antecedentes de hemorragia intracraneal e insuficiencia hepática grave (véase Contraindicaciones).
• Pacientes con administración concomitante de productos medicinales que puedan aumentar el riesgo de sangrado (por ejemplo, medicamentos antiinflamatorios no esteroideos (AINEs), anticoagulantes orales y/o fibrinolíticos dentro de las 24 horas de la administración de BRILINTA®).
No existen datos con BRILINTA® con respecto al beneficio hemostático de las transfusiones plaquetarias; el ticagrelor circulante puede inhibir las plaquetas transfundidas. Dado que la coadministración de BRILINTA® con desmopresina no disminuyó el patrón del tiempo de sangrado, es improbable que la desmopresina sea efectiva en el manejo de los eventos clínicos de sangrado.
La terapia antifibrinolítica (ácido aminocaproico o ácido tranexámico) y/o el factor VIIa recombinante pueden aumentar la hemostasia. BRILINTA® puede reanudarse luego de haber identificado y controlado la causa del sangrado.
Cirugía:
• Si un paciente requiere cirugía, los médicos deben considerar el perfil clínico de cada paciente, así como los beneficios y riesgos de continuar con la terapia antiplaquetaria al determinar cuándo debe realizarse la interrupción del tratamiento con BRILINTA®.
• Dada la unión reversible de BRILINTA®, la restauración de la agregación plaquetaria se produce más rápido con BRILINTA® en comparación con clopidogrel. En el estudio OFFSET, la media de la Inhibición de la Agregación Plaquetaria (IPA) con BRILINTA® a las 72 horas postdosis fue comparable a la media de IPA con clopidogrel a las 120 horas postdosis. Una recuperación de la acción más rápida puede predecir un riesgo reducido de complicaciones de sangrado, por ejemplo, en situaciones en las que la terapia antiplaquetaria debe interrumpirse temporalmente debido a cirugía o traumatismo.
• En los pacientes del estudio PLATO sometidos a CABG, BRILINTA® tuvo un índice similar de sangrados mayores en comparación con clopidogrel, todos los días después de suspender la terapia excepto en el día 1 en que BRILINTA® tuvo un índice más alto de mayor sangrado.
• Si un paciente se va a someter a cirugía programada y no se desea conservar el efecto antiplaquetario, BRILINTA® debe descontinuarse 5 días antes de la cirugía (véase Propiedades farmacodinámicas).
Pacientes con insuficiencia hepática moderada: Se recomienda precaución en pacientes con insuficiencia hepática moderada, ya que BRILINTA® no se ha estudiado en estos pacientes. El uso de BRILINTA® está contraindicado en pacientes con insuficiencia hepática grave ( véase Contraindicaciones).
Pacientes con riesgo de eventos bradicárdicos: Debido a observaciones de pausas ventriculares principalmente asintomáticas en un estudio clínico temprano, los pacientes con riesgo mayor de eventos bradicárdicos (por ejemplo, pacientes sin marcapasos que tienen síndrome de seno enfermo, bloqueo AV de segundo o de tercer grado o síncope por bradicardia) fueron excluidos del estudio principal que evaluaba la seguridad y eficacia de BRILINTA®. Por lo tanto, debido a la experiencia clínica limitada en estos pacientes, se aconseja tener precaución (véase Propiedades farmacodinámicas).
Disnea: Se reporta disnea en los pacientes tratados con BRILINTA® (aproximadamente 13.8%), generalmente la intensidad es de leve a moderada y con frecuencia se resuelve sin necesidad de interrumpir el tratamiento (véase Reacciones secundarias y adversas). El mecanismo aún no ha sido esclarecido. Si un paciente reporta que presenta disnea reciente, prolongada o empeoramiento, se debe investigar a fondo y si no se tolera el tratamiento con BRILINTA® se debe interrumpir.
Se informó disnea en 13.3% de pacientes tratados con BRILINTA® y en 7.8% de pacientes tratados con clopidogrel. Los investigadores consideraron que sólo en 2.2% de pacientes la disnea tuvo relación causal con el tratamiento de BRILINTA®. Habitualmente ésta fue de intensidad leve a moderada y habitualmente se resolvió sin necesidad de interrumpir el tratamiento. Los pacientes con asma o enfermedad pulmonar obstructiva crónica pueden tener un incremento en el riesgo absoluto para presentar disnea con BRILINTA®. Por tanto, ticagrelor debería ser utilizado con precaución en pacientes con historia de asma o enfermedad pulmonar obstructiva crónica. El mecanismo aún no se ha esclarecido. Si un paciente informa de nuevos episodios de disnea o que ésta se prolongue o empeore, se deberán investigar otras posibles causas, y si el tratamiento con BRILINTA® no es tolerado, éste deberá ser interrumpido.
Otros: Basados en la relación observada en PLATO entre la dosis de mantenimiento de ASA y la eficacia relativa de ticagrelor en comparación con clopidogrel, la administración concomitante de ticagrelor y dosis altas de mantenimiento de ASA (> 300 mg) no se recomiendan (véase Propiedades farmacodinámicas).
La administración concomitante de BRILINTA® con inhibidores potentes de la CYP3A4 (por ejemplo, ketoconazol, claritromicina, nefazadona, ritonavir y atanazavir) debe evitarse, ya que la misma puede producir un aumento sustancial en la exposición a BRILINTA® (véase Interacciones medicamentosas y de otro género).
Interrupción del tratamiento: Los pacientes que requieran interrumpir BRILINTA® tienen un aumento de riesgo de eventos cardiacos. Debe evitarse la interrupción prematura del tratamiento. Si debe interrumpirse BRILINTA® temporalmente debido a un evento adverso, su uso debe reanudarse tan pronto como sea posible cuando los beneficios superen a los riesgos del evento adverso o cuando el evento adverso se haya resuelto (véase Dosis y vía de administración).
Efectos en la habilidad para conducir u operar maquinaria: No se han realizado estudios sobre los efectos de BRILINTA® sobre la capacidad de conducir y utilizar maquinaria. Durante el tratamiento de los síndromes coronarios agudos se han reportado mareos y confusión. Por lo tanto, los pacientes que experimenten estos síntomas deben tener precaución al conducir o utilizar maquinarias.
DOSIS Y VÍA DE ADMINISTRACIÓN: El tratamiento con BRILINTA® debe iniciarse con una dosis única de carga de 180 mg (dos tabletas de 90 mg) y luego continuarse con 90 mg dos veces por día.
Vía de administración: Oral. BRILINTA® puede ingerirse con o sin alimentos.
Los pacientes que toman BRILINTA® deben tomar ASA diariamente, a menos que esté específicamente contraindicada. Después de una dosis inicial de ASA, BRILINTA® se debe administrar con una dosis de mantenimiento de 75-150 mg de ASA (véase Propiedades farmacodinámicas).
Deben evitarse fallas en la terapia. El paciente que omita una dosis de BRILINTA® deberá tomar una tableta de 90 mg (su siguiente dosis) en el horario programado.
Los médicos que deseen cambiar a los pacientes de clopidogrel a BRILINTA® deben administrar la primera dosis de 90 mg de BRILINTA® 24 horas después de la última dosis de clopidogrel (véase Propiedades farmacodinámicas).
Se recomienda el tratamiento durante al menos 12 meses a menos que esté clínicamente indicada la interrupción de BRILINTA® (véase Farmacocinética y farmacodinamia). En pacientes con Síndromes Coronarios Agudos (SCA), la interrupción prematura de cualquier agente antiplaquetario, incluyendo BRILINTA®, podría resultar en aumento del riesgo de muerte cardiovascular, o infarto de miocardio debido a la enfermedad subyacente del paciente (véase Precauciones generales).
Poblaciones especiales:
Pacientes pediátricos: No se ha establecido la seguridad y eficacia en niños menores de 18 años de edad.
Pacientes ancianos: No se requiere ajuste de dosis.
Pacientes con insuficiencia renal: No es necesario el ajuste de dosis en pacientes con insuficiencia renal (véase Propiedades farmacocinéticas). No se dispone de información con respecto al tratamiento de pacientes en diálisis renal.
Pacientes con insuficiencia hepática: No es necesario el ajuste de la dosis en pacientes con insuficiencia hepática leve. BRILINTA® no ha sido estudiada en pacientes con insuficiencia hepática moderada o severa (véase Propiedades farmacocinéticas).
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: Actualmente no se conoce un antídoto para revertir los efectos de BRILINTA® y no se espera que BRILINTA® sea dializable (véase Precauciones generales). El tratamiento de la sobredosis debe seguir los estándares locales de la práctica médica. El efecto esperado de la dosificación excesiva de BRILINTA® prolonga la duración del riesgo de sangrado asociado con la inhibición plaquetaria. Si se presenta sangrado deben tomarse las medidas apropiadas de soporte.
Ticagrelor es bien tolerado en dosis únicas de hasta 900 mg. La toxicidad gastrointestinal fue limitante de la dosis en un estudio de dosis única ascendente. Otros efectos adversos clínicamente significativos que pueden ocurrir con sobredosis incluyen disnea y pausas ventriculares.
En caso de sobredosis se observan efectos adversos potenciales y se considera el monitoreo de ECG.
PRESENTACIONES: Caja con 10, 20, 30 y 60 tabletas de 90 mg.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a temperatura ambiente a no más de 30°C y en lugar seco.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. No se deje al alcance de los niños. El uso en el embarazo y la lactancia queda estrictamente bajo la responsabilidad del médico. Literatura exclusiva para médicos.

ASTRAZENECA, S. A. de C. V.
Súper Avenida Lomas Verdes No. 67
Fracc. Lomas Verdes
C.P. 53120, Naucalpan de Juárez, México
Reg. Núm. 216M2011, SSA IV