ALMETEC TRI
AMLODIPINO, HIDROCLOROTIAZIDA, OLMESARTÁN
Tabletas
1 Caja, 14 Tabletas, 20/5/12.5 mg/mg/mg
1 Caja, 28 Tabletas, 20/5/12.5 mg/mg/mg
1 Caja, 14 Tabletas, 40/5/12.5 mg/mg/mg
1 Caja, 28 Tabletas, 40/5/12.5 mg/mg/mg
1 Caja, 14 Tabletas, 40/5/25 mg/mg/mg
1 Caja, 28 Tabletas, 40/5/25 mg/mg/mg
1 Caja, 14 Tabletas, 40/10/12.5 mg/mg/mg
1 Caja, 28 Tabletas, 40/10/12.5 mg/mg/mg
1 Caja, 14 Tabletas, 40/10/25 mg/mg/mg
1 Caja, 28 Tabletas, 40/10/25 mg/mg/mg
III. FORMA FARMACÉUTICA Y FORMULACIÓN
Tabletas
Química
ALMETEC® TRI es una combinación de dosis fija del antagonista de los receptores de angiotensina II (subtipo AT1) olmesartán medoxomilo, el bloqueador de los canales de calcio amlodipino y el diurético tiazídico hidroclorotiazida.
Olmesartán medoxomilo
Olmesartán medoxomilo se describe químicamente como (5-metil-2-oxo-1,3-dioxolen-4-il)metil 4-(1-hidroxi-1-metiletil)-2-propil-1-{[2’-(1H-tetrazol-5-il)-1,1’-bifenil-4-il]metil}-1H-imidazol-5-carboxilato.
Su fórmula empírica es C29H30N6O6 y su fórmula estructural es:
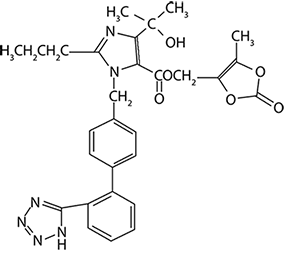
Olmesartán medoxomilo es un producto que se hidroliza durante la absorción del tracto gastrointestinal en el metabolito activo olmesartán (véase V. FARMACOCINÉTICA Y FARMACODINAMIA).
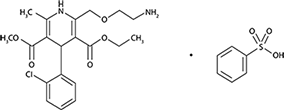
Besilato de amlodipino
Besilato de amlodipino se describe químicamente como 3-Etil-5-metil (±)-2-[(2-aminoetoxi) metil]-4-(2-clorofenil)-1,4-dihidro-6-metil-3,5-piridindicarboxilato, monobenceno sulfonato. Su fórmula empírica es C20H25CIN2O5• C6H6O3S. La fórmula estructural del besilato de amlodipino es:
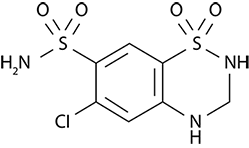
Hidroclorotiazida
Hidroclorotiazida se describe químicamente como 6-cloro-3,4-dihidro-2H-1,2,4-benzotiadiazina-7-sulfonamida 1,1-dióxido.
Su fórmula empírica es C7H8ClN3O4S2 y su fórmula estructural es:
ALMETEC® TRI está disponible como tabletas recubiertas para administración oral en las siguientes concentraciones:
Olmesartán medoxomilo 20 mg más amlodipino (como besilato de amlodipino) 5 mg más hidroclorotiazida 12.5 mg (20/5/12.5 mg), tabletas redondas cubiertas con película blanca naranja y grabado C51 de un lado.
Olmesartán medoxomilo 40 mg más amlodipino (como besilato de amlodipino) 5 mg más hidroclorotiazida 12.5 mg (40/5/12.5 mg), tabletas redondas cubiertas con película amarillo claro y grabado C53 de un lado.
Olmesartán medoxomilo 40 mg más amlodipino (como besilato de amlodipino) 5 mg más hidroclorotiazida 25 mg (40/5/25 mg), tabletas ovaladas cubiertas con película amarillo claro y grabado C54 de un lado.
Olmesartán medoxomilo 40 mg más amlodipino (como besilato de amlodipino) 10 mg más hidroclorotiazida 12.5 mg (40/10/12.5 mg), tabletas redondas cubiertas con película rojo grisáceo y grabado C55 de un lado.
Olmesartán medoxomilo 40 mg más amlodipino (como besilato de amlodipino) 10 mg más hidroclorotiazida 25 mg (40/10/25 mg), tabletas ovales cubiertas con película rojo grisáceo y grabado C57 de un lado.
ALMETEC® TRI contiene los siguientes ingredientes inactivos en el núcleo de la tableta:
• Almidón pregelatinizado
• Celulosa microcristalina silicificada (celulosa microcristalina y dióxido de silicio coloidal)
• Croscarmelosa de sodio
• Estearato de magnesio
• Agua pura (se elimina en el proceso de manufactura)
ALMETEC® TRI contiene los siguientes ingredientes activos en la película de recubrimiento de la tableta:
• Alcohol polivinílico parcialmente hidrolizado
• Polietilenglicol 3350
• Talco
• Dióxido de titanio
• Óxido de hierro (III) amarillo
• Óxido de hierro (III) rojo (únicamente las tabletas recubiertas de 20/5/12.5, 40/10/12.5, 40/10/25)
• Óxido de hierro (III) negro (únicamente las tabletas recubiertas de 20/5/12.5).
XIX. NÚMERO DE REGISTRO DEL MEDICAMENTO ANTE LA SECRETARÍA
Reg. No. 078M2016 SSA IV
Tracer Number: MK8332C-MEX-2016-013358
IV. INDICACIONES TERAPÉUTICAS
ALMETEC® TRI está indicado para el tratamiento de hipertensión arterial primaria estadio 2 en pacientes sin respuesta y que a criterio del médico especialista requieran de la combinación de 3 fármacos para su control en pacientes >18 años de edad y menores de 80 años.
ALMETEC® TRI no está indicado como tratamiento inicial.
V. FARMACOCINÉTICA Y FARMACODINAMIA
FARMACOLOGÍA CLÍNICA
Propiedades farmacodinámicas
Se ha visto que ALMETEC® TRI es eficaz para reducir la presión arterial. Los tres componentes de ALMETEC® TRI (olmesartán medoxomilo, amlodipino e hidroclorotiazida) disminuyen la presión por mecanismos complementarios que operan en sitios diferentes y con diferentes efectos o rutas de bloqueo. A continuación se describe la farmacodinamia de cada componente.
Olmesartán medoxomilo
El componente olmesartán medoxomilo de ALMETEC® TRI es un antagonista selectivo de los receptores de angiotensina II tipo 1 (AT1). El olmesartán medoxomilo se convierte rápidamente en su metabolito farmacológicamente activo olmesartán. La angiotensina II es la principal hormona vasoactiva del sistema renina, angiotensina, aldosterona, y cumple una función importante en la fisiopatología de la hipertensión. Los efectos de la angiotensina II incluyen vasoconstricción, estimulación de la síntesis y liberación de aldosterona, estimulación cardiaca y reabsorción renal de sodio. El olmesartán bloquea los efectos de vasoconstricción y secreción de aldosterona de la angiotensina II al impedir su enlace con el receptor AT1 en los tejidos, incluyendo músculo liso vascular y glándulas suprarrenales. La acción de olmesartán es independiente de la fuente o la vía de síntesis de la angiotensina II. El antagonismo selectivo de olmesartán sobre los receptores de angiotensina II (AT1) da por resultado aumentos en las concentraciones plasmáticas de renina y de angiotensina I y II, así como alguna reducción de las concentraciones plasmáticas de aldosterona.
En hipertensión, olmesartán medoxomilo causa una reducción duradera y dependiente de la dosis en la presión arterial. No hay evidencias de hipotensión con la primera dosis, de taquifilaxia durante el tratamiento a largo plazo ni de rebote de la hipertensión después de una suspensión abrupta de la terapia.
Después de la administración una vez al día a pacientes con hipertensión, olmesartán medoxomilo produce una reducción eficaz y uniforme de la presión arterial durante el intervalo de 24 horas de la dosis. La dosificación una vez al día produjo reducciones semejantes de la presión arterial como la dosificación de dos veces al día a la misma dosis diaria total.
Con el tratamiento continuo, las reducciones máximas de la presión arterial se alcanzan hacia las ocho semanas del inicio del tratamiento, aunque ya se observa una parte sustancial del efecto de reducción de la presión a las dos semanas.
No se conoce el efecto de olmesartán medoxomilo en la morbimortalidad.
Amlodipino
El componente amlodipino de ALMETEC® TRI es un bloqueador de los canales de calcio que inhibe el influjo transmembrana de iones de calcio hacia el corazón por los canales tipo L dependientes de potencial y en músculo liso. Datos experimentales indican que el amlodipino se enlaza en sitios de dihidropiridina y no de dihidropiridina. El amlodipino es relativamente vaso-selectivo, pues tiene un mayor efecto en células de músculo liso vascular que en las células del músculo cardiaco. El efecto antihipertensivo del amlodipino deriva de un efecto relajante directo en el músculo liso arterial, que lleva a una reducción de la resistencia periférica y, por consiguiente, de la presión arterial.
En pacientes hipertensos, el amlodipino causa una reducción prolongada y dependiente de la dosis de la presión arterial. No se tiene evidencia de hipotensión de la primera dosis ni de taquifilaxia en el tratamiento a largo plazo ni hipertensión de rebote después de la suspensión abrupta de la terapia.
Después de la administración de dosis terapéuticas a pacientes con hipertensión, el amlodipino produce una reducción eficaz de la presión arterial en posición supina, sedente y de pie. El uso crónico del amlodipino no se asocia con cambios significativos de la frecuencia cardiaca ni en las concentraciones plasmáticas de catecolaminas. En pacientes hipertensos con función renal normal, las dosis terapéuticas de amlodipino reducen la resistencia vascular renal y aumentan la tasa de filtración glomerular y el flujo plasmático renal eficaz, sin cambiar la fracción de filtración ni la proteinuria.
En estudios epidemiológicos se ha visto que el tratamiento a largo plazo con monoterapia de amlodipino reduce el riesgo de morbilidad y mortalidad cardiovascular.
Hidroclorotiazida
La hidroclorotiazida es un diurético tiazídico. No se conoce completamente el mecanismo de los diuréticos tiazídicos. Las tiazidas afectan el mecanismo tubular renal de reabsorción de electrólitos, lo que aumenta directamente la excreción de sodio y cloro en cantidades aproximadamente iguales. La acción diurética de la hidroclorotiazida reduce el volumen plasmático, aumenta la actividad de la renina plasmática e incrementa la secreción de aldosterona, con incrementos consecuentes en la pérdida urinaria de potasio y bicarbonato, así como disminuciones del potasio sérico. El enlace renina-aldosterona está mediado por la angiotensina II y, por tanto, la coadministración de un antagonista de receptores de angiotensina II tiende a revertir la pérdida de potasio asociada con los diuréticos tiazídicos. Con la hidroclorotiazida, el inicio de la diuresis ocurre en aproximadamente dos horas y el efecto máximo en alrededor de cuatro horas de tomada la dosis, mientras que la acción persiste de seis a 12 horas.
La combinación de olmesartán medoxomilo, amlodipino e hidroclorotiazida produce reducciones aditivas de la presión arterial, lo que generalmente incrementa con la dosis de cada componente.
Propiedades farmacocinéticas
La administración concomitante de olmesartán medoxomilo, amlodipino e hidroclorotiazida no tiene efectos clínicamente relevantes en la farmacocinética de ninguno de los componentes, en sujetos sanos.
Después de la administración de ALMETEC® TRI en adultos sanos normales, la concentración plasmática máxima de olmesartán, amlodipino e hidroclorotiazida se alcanza en aproximadamente 1.5 a 3 horas, 6 a 8 horas, y 1.5 a 2 horas, respectivamente. La velocidad y el grado de absorción de olmesartán medoxomilo, amlodipino e hidroclorotiazida de ALMETEC® TRI son los mismos cuando se administran como formas farmacéuticas separadas. La comida no afecta la biodisponibilidad de ALMETEC® TRI.
Absorción y distribución
Olmesartán medoxomilo
Olmesartán medoxomilo es un profármaco. Se convierte rápidamente en el metabolito farmacológicamente activo, olmesartán, por medio de esterasas de la mucosa intestinal y sangre portal durante la absorción en el tracto gastrointestinal. No se ha detectado olmesartán medoxomilo intacto ni fracción intacta de cadena lateral de medoxomilo en plasma ni en heces. La biodisponibilidad absoluta de olmesartán en la formulación de tableta fue de 25.6%.
La concentración plasmática promedio máxima (Cmáx) de olmesartán se alcanza en aproximadamente dos horas de la toma de la dosis de olmesartán medoxomilo, y las concentraciones plasmáticas de olmesartán aumentan en forma aproximadamente lineal con incrementos en la dosis oral única de hasta 80 mg.
Los alimentos tienen un efecto mínimo en la biodisponibilidad de olmesartán; por tanto, olmesartán medoxomilo puede administrarse con o sin alimentos.
No se han observado diferencias por sexo clínicamente significativas en la farmacocinética de olmesartán.
Olmesartán se enlaza fuertemente con proteínas plasmáticas (99.7%), pero es bajo el potencial de interacciones de desplazamiento clínicamente significativas entre olmesartán y otros compuestos de enlace fuerte co-administrados (como lo confirma la falta de interacción clínicamente significativa entre olmesartán medoxomilo y warfarina). El enlace de olmesartán a células sanguíneas es insignificante. El volumen promedio de distribución después de la dosificación intravenosa es bajo (16 L a 29 L).
En ratas, olmesartán cruza mal la barrera hematoencefálica o no la cruza. Olmesartán cruza la barrera placentaria en ratas y se distribuye al feto. Olmesartán se distribuye en niveles bajos en la leche de ratas.
Amlodipino
Después de la administración oral de dosis terapéuticas, el amlodipino se absorbe lentamente en el aparato digestivo. La absorción de amlodipino no se afecta con la ingesta concomitante de alimentos. La biodisponibilidad absoluta del compuesto sin cambios se calcula en 64% a 80%. Las concentraciones plasmáticas máximas se alcanzan de seis a 12 horas después de la dosis. El volumen de distribución es de alrededor de 20 L/kg. El pKa de amlodipino es de 8.6. El enlace con proteínas plasmáticas in vitro es de aproximadamente 98%.
Hidroclorotiazida
Después de la administración oral de la combinación de olmesartán medoxomilo e hidroclorotiazida, la mediana de tiempo hasta las concentraciones máximas de hidroclorotiazida fue de 1.5 a 2 horas después de la dosificación. La hidroclorotiazida se enlaza 68% a proteínas plasmáticas y su volumen aparente de distribución es de 0.83 – 1.14 L/kg.
Metabolismo y eliminación
Olmesartán medoxomilo
Después de una conversión rápida y completa de olmesartán medoxomilo en olmesartán durante la absorción, prácticamente ya no hay más metabolismo de olmesartán. De 30% a 50% aproximadamente del fármaco absorbido sistémicamente se excreta en orina, mientras que el resto se excreta en las heces (por la bilis).
La eliminación plasmática total de olmesartán fue normalmente de 1.3 L/h (CV, 19%), relativamente baja en comparación con el aporte de sangre al hígado (ca 90 L/h). A partir de la disponibilidad sistémica de 25.6%, puede calcularse que el olmesartán absorbido se elimina por excreción renal y excreción hepatobiliar.
Dependiendo del origen étnico, la vida media de eliminación terminal de olmesartán varió entre 6 y 15 horas. Se alcanzó el estado estable después de las primeras dosis y no se hizo evidente ninguna acumulación posterior con la repetición de la dosis. La eliminación renal fue de aproximadamente 0.5 – 0.7 L/h.
Amlodipino
La vida media de eliminación plasmática (t1/2) varía de 35 a 50 horas. Las concentraciones plasmáticas estables se alcanzan después de siete u ocho días consecutivos. El amlodipino es metabolizado ampliamente en metabolitos inactivos. Alrededor de 60% de la dosis administrada es excretada en la orina, y un 10% de esta cifra en forma de amlodipino intacto.
Hidroclorotiazida
La hidroclorotiazida no se metaboliza en seres humanos y se excreta casi completamente sin cambios como fármaco intacto en orina. Alrededor de 60% de la dosis oral se elimina como fármaco intacto en el plazo de 48 horas. La depuración renal es de alrededor de 250 – 300 mL/min. La vida media de eliminación terminal de hidroclorotiazida es de 10 – 15 horas.
Farmacocinética en poblaciones especiales
Ancianos
En los análisis se indica que la edad no es un factor pronóstico significativo de la eliminación de olmesartán. Como la edad se correlaciona con la depuración de creatinina, todos los cambios observados por la edad en la eliminación del olmesartán pueden atribuirse a cambios en la depuración de la creatinina. En pacientes hipertensos, el área bajo la curva (AUC) de la concentración plasmática de olmesartán aumenta en los ancianos (65 a 75 años) y en los muy ancianos (≥ 75 años) en comparación con el grupo de más jóvenes.
Después de la toma oral de amlodipino, el tiempo hasta la concentración plasmática máxima es equivalente en pacientes jóvenes y mayores. En los ancianos disminuye la eliminación de amlodipino, lo que produce un aumento del AUC de 40% a 60%.
Insuficiencia renal
En pacientes con insuficiencia renal, las concentraciones séricas de olmesartán fueron elevadas en comparación con sujetos con función renal normal. Después de la repetición de la dosis, el AUC se triplicó aproximadamente en pacientes con insuficiencia renal grave (depuración de creatinina <20 mL/min).
No se ha estudiado la farmacocinética de olmesartán medoxomilo en pacientes sometidos a hemodiálisis.
Los cambios en la concentración plasmática de amlodipino no se correlacionaron con el grado de insuficiencia renal. En estos pacientes, el amlodipino puede administrarse en la dosis normal. El amlodipino no se elimina por diálisis.
Insuficiencia hepática
El AUC promedio de olmesartán después de una sola administración oral a pacientes con insuficiencia hepática moderada aumentó alrededor de 48% en comparación con sujeto sanos de control (grupo total) o alrededor de 60% si se compara únicamente con los controles equivalentes.
No se ha evaluado a olmesartán medoxomilo en pacientes con insuficiencia hepática grave.
El amlodipino se metaboliza ampliamente en el hígado. La eliminación de amlodipino disminuye y la t½ se prolonga en pacientes con deterioro de la función hepática, lo que da por resultado un aumento del AUC de aproximadamente 60%.
Pacientes pediátricos
No se tienen datos de farmacocinética de ALMETEC® TRI en pacientes pediátricos (de menos de 18 años).
Interacciones farmacocinéticas de olmesartán
Interacción medicamentosa con el agente secuestrador de ácidos biliares, colesevelam
La administración concomitante de 40 mg de olmesartán medoxomilo y 3,750 mg de clorhidrato de colesevelam en sujetos sanos dio por resultado una reducción de 28% en la Cmáx y una reducción de 39% en el AUC de olmesartán. Efectos menores, como una reducción de 4% y 15% en la Cmáx y el AUC, respectivamente, se observaron al administrar olmesartán medoxomilo cuatro horas antes del clorhidrato de colesevelam (véase X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO).
ESTUDIOS CLÍNICOS
El estudio clínico aleatorizado de Olmesartán y Prevención de la Microalbuminuria por Diabetes (ROADMAP) comprendió 4,447 pacientes con diabetes tipo 2, normoalbuminuria y por lo menos un factor adicional de riesgo cardiovascular. Los pacientes fueron aleatorizados a olmesartán 40 mg diarios o placebo. El estudio alcanzó su punto final primario, la reducción de tiempo para la aparición de microalbuminuria. Para los puntos finales secundarios, que el estudio no fue diseñado para evaluar formalmente, se produjeron eventos cardiovasculares en 96 pacientes (4.3%) con olmesartán y en 94 pacientes (4.2%) con placebo. La incidencia de mortalidad cardiovascular fue mayor con el tratamiento de olmesartán que con placebo (15 pacientes [0.66%] y 3 pacientes [0.14%] [HR=4.94, 95% CI=1.43-17.06]), pero el riesgo de infarto de miocardio no mortal fue menor con olmesartán (HR 0.64, 95% CI 0.35, 1.18).
VI. CONTRAINDICACIONES
ALMETEC® TRI está contraindicado en pacientes hipersensibles a cualquiera de los componentes de la tableta, a los derivados de la dihidropiridina o a otros derivados de la sulfonamida (puesto que la hidroclorotiazida es un derivado de la sulfonamida).
ALMETEC® TRI está contraindicado en pacientes embarazadas. Cuando se diagnostique un embarazo, ALMETEC® TRI debe descontinuarse en cuanto sea posible (véase VIII. RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA).
ALMETEC® TRI está contraindicado en pacientes con anuria por el componente hidroclorotiazida.
No administre conjuntamente aliskiren con ALMETEC® TRI en pacientes con diabetes (véase X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO).
VII. PRECAUCIONES GENERALES
Pacientes con hipovolemia o depleción de sodio
Puede presentarse hipotensión sintomática en pacientes con depleción de volumen o de sodio por una terapia diurética enérgica, restricción de sal en la dieta, diarrea o vómito, especialmente después de la primera dosis. Se recomienda la corrección de esta condición antes de administrar ALMETEC® TRI o una supervisión médica estrecha al inicio del tratamiento.
Otros estados con estimulación del sistema renina, angiotensina, aldosterona
En pacientes cuyo tono vascular y función renal dependen predominantemente de la actividad del sistema renina, angiotensina, aldosterona (por ejemplo, pacientes con insuficiencia cardiaca congestiva grave o enfermedad renal subyacente, incluyendo estenosis de la arteria renal), el tratamiento con otros medicamentos que afectan este sistema, como los antagonistas de los receptores de angiotensina II, se ha asociado con hipotensión aguda, azoemia, oliguria o, en pocos casos, insuficiencia renal aguda.
Hipertensión renovascular
Aumenta el riesgo de hipotensión grave e insuficiencia renal si pacientes con estenosis bilateral de arteria renal o estenosis de la arteria de un solo riñón funcional se tratan con medicamentos que afectan el sistema renina, angiotensina, aldosterona.
Enteropatía por enfermedad celíaca
Se ha reportado diarrea crónica grave con pérdida de peso notable en pacientes que toman olmesartán medoxomilo, meses o años después de iniciar el medicamento. En biopsias intestinales de esos pacientes se muestra atrofia vellosa. Si un paciente desarrolla estos síntomas durante el tratamiento con olmesartán medoxomilo, hay que excluir otras etiologías. Considere descontinuar ALMETEC® TRI en los casos en que no se identifique otra etiología.
Insuficiencia renal y trasplante de riñón
No se cuenta con experiencia sobre la administración de ALMETEC® TRI en pacientes con trasplante reciente de riñón ni en pacientes con insuficiencia renal terminal (es decir, depuración de creatinina <12 mL/min).
No se recomiendan diuréticos tiazídicos en insuficiencia renal grave. En pacientes con enfermedad renal, las tiazidas pueden precipitar azoemia. No se recomienda ALMETEC® TRI en pacientes con insuficiencia renal grave.
Insuficiencia hepática
Alteraciones menores del equilibrio de líquidos o de electrólitos durante una terapia con tiazidas puede precipitar un coma hepático en pacientes con deterioro de la función hepática o hepatopatía progresiva.
Puesto que amlodipino se metaboliza ampliamente en el hígado, la exposición a ALMETEC® TRI aumenta en pacientes con insuficiencia hepática. Debe tenerse cuidado cuando se administra ALMETEC® TRI a pacientes con insuficiencia hepática leve a moderada. No se recomienda ALMETEC® TRI en pacientes con insuficiencia hepática grave.
Miopía Aguda y Glaucoma de Ángulo Estrecho Secundario
La hidroclorotiazida, una sulfonamida, puede ocasionar una reacción idiosincrática, que resulta en miopía aguda transitoria y glaucoma agudo de ángulo estrecho. Los síntomas incluyen inicio agudo de disminución de la agudeza visual o dolor ocular y ocurre típicamente dentro de horas a semanas del inicio del medicamento. Un glaucoma agudo de ángulo estrecho sin tratar puede ocasionar pérdida permanente de la visión. El tratamiento primario es descontinuar la hidroclorotiazida tan pronto como sea posible. Pueden considerarse tratamiento médico o quirúrgico rápido si la presión intraocular permanece sin control. Factores de riesgo para el desarrollo de glaucoma agudo de ángulo estrecho pueden incluir antecedentes de alergia a sulfonamidas o penicilina.
Reacciones de hipersensibilidad
Pueden producirse reacciones de hipersensibilidad a la hidroclorotiazida en pacientes con o sin historial de alergias o de asma, pero son más probables en pacientes con ese historial.
Lupus eritematoso sistémico
Se ha visto que los diuréticos tiazídicos exacerban o activan el lupus eritematoso sistémico.
Litio
No se recomienda el empleo de litio en combinación con diuréticos (véase X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO).
Efectos metabólicos y endocrinos
La terapia con tiazidas puede deteriorar la tolerancia a la glucosa. En pacientes diabéticos, es posible que se requieran ajustes de la insulina o de hipoglucemiantes (véase X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO). Una diabetes mellitus latente puede hacerse manifiesta durante la terapia con tiazida.
Se han relacionado aumentos de las concentraciones de colesterol y triglicéridos con la terapia diurética con tiazidas.
Es posible que se precipite una hiperuricemia o incluso gota en algunos pacientes que siguen una terapia con tiazidas.
Desequilibrio de electrólitos
Al igual que con todos los pacientes que siguen una terapia con diuréticos, a intervalos apropiados deben determinarse las concentraciones de electrólitos.
Las tiazidas, incluyendo la hidroclorotiazida, pueden causar desequilibrio de líquidos o de electrólitos (incluyendo hipokalemia, hiponatremia y alcalosis hipoclorémica). Entre los síntomas o signos de advertencia de desequilibrio de líquidos o electrólitos se cuentan boca seca, sed, debilidad, letargia, somnolencia, inquietud, dolores o calambres musculares, fatiga muscular, hipotensión, oliguria, taquicardia y alteraciones gastrointestinales como náusea o vómito.
Puede producirse hipokalemia con el uso de diuréticos tiazídicos, sobre todo en pacientes con cirrosis hepática, pacientes que sufran diuresis abrupta, pacientes que no toman suficientes electrólitos y pacientes que siguen una terapia concomitante con corticosteroides o con la hormona adrenocorticotrópica (ACTH).
ALMETEC TRI® también contiene olmesartán, un fármaco que inhibe al sistema renina-angiotensina (RAS). Los fármacos que inhiben al RAS pueden ocasionar hiperkalemia. Monitoree periódicamente los electrólitos séricos.
La deficiencia de cloro es por lo regular leve y no requiere tratamiento.
Las tiazidas pueden disminuir la excreción urinaria de calcio y causar una elevación leve e intermitente del calcio sérico en ausencia de trastornos conocidos del metabolismo del calcio. Una hipercalcemia muy notable puede ser evidencia de un hiperparatiroidismo oculto. Deben descontinuarse las tiazidas antes de realizar las pruebas de función paratiroidea.
Se ha visto que las tiazidas aumentan la excreción urinaria de magnesio, lo cual puede dar por resultado hipomagnesemia.
Enfermedad coronaria obstructiva grave
Como con todos los vasodilatadores, se indica tener precauciones especiales en pacientes que sufren estenosis de la válvula mitral o aórtica, o bien cardiomiopatía hipertrófica obstructiva.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR Y USAR MÁQUINAS
No se han realizados estudios sobre los efectos en la capacidad de conducir y usar máquinas con ALMETEC® TRI.
VIII. RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA
Embarazo
ALMETEC® TRI puede causar daño fetal si se administra a una mujer gestante. Como precaución, ALMETEC® TRI no debe usarse durante el primer trimestre del embarazo. La paciente debe cambiar a un medicamento alternativo apropiado antes de un embarazo planeado. Si se produce un embarazo durante la terapia, debe descontinuarse ALMETEC® TRI cuanto antes. No hay experiencia con el uso del ALMETEC® TRI en mujeres gestantes.
Olmesartán medoxomilo está contraindicado en el segundo y tercer trimestres del embarazo. En ese momento, las sustancias que actúan en el sistema renina, angiotensina pueden causar daños (hipotensión, deterioro de la función renal, oliguria o anuria, oligohidramnios, hipoplasia craneal, retraso del crecimiento intrauterino) y muerte en fetos y neonatos. También se han visto casos de hipoplasia pulmonar, anomalías faciales y contracciones de los miembros. En estudios experimentales en animales con olmesartán medoxomilo se ha visto también que puede haber daño renal en la fase fetal final y en la neonatal.
Los datos de un número limitado de embarazos expuestos no indican que amlodipino ni otros antagonistas de los receptores del calcio tengan un efecto perjudicial en la salud del feto; sin embargo, puede haber un riesgo de parto prolongado.
Estudios en los que se administró por vía oral hidroclorotiazida a hembras gestantes de ratón y rata durante su periodo respectivo de mayor organogénesis, a dosis de hasta 3,000 y 1,000 mg/kg, no se encontraron evidencias de daños al feto. De cualquier manera, no hay estudios adecuados y bien controlados en mujeres gestantes. Las tiazidas cruzan la barrera placentaria y aparecen en sangre del cordón umbilical. Pueden causar alteraciones electrolíticas en el feto y posiblemente otras reacciones que han ocurrido en adultos. Se han visto casos de trombocitopenia neonatal o ictericia fetal o neonatal con la terapia materna con tiazidas.
No hay experiencia del uso de olmesartán medoxomilo-hidroclorotiazida en mujeres gestantes. Los estudios en ratas y ratonas con combinaciones de olmesartán medoxomilo e hidroclorotiazida no indican efectos teratogénicos, pero se ha visto fetotoxicidad en ratas.
Si ALMETEC® TRI se usa en el embarazo, o si una paciente se embaraza mientras toma ALMETEC® TRI, la paciente debe ser advertida de los posibles peligros para el feto. Si se produjera una exposición a ALMETEC® TRI del segundo trimestre en adelante, se recomiendan ultrasonidos de la función renal y del cráneo. Los recién nacidos expuestos in utero a antagonistas de la angiotensina II deben ser vigilados estrechamente buscando la ocurrencia de hipotensión, oliguria e hiperkalemia.
Lactancia
No se sabe si dos de los componentes de ALMETEC® TRI (olmesartán medoxomilo o amlodipino) se excretan en la leche humana, pero la tiazida sí aparece ahí. Olmesartán es excretado en concentraciones bajas en leche de ratas lactantes. Dadas las posibilidades de efectos adversos en el lactante, debe tomarse una decisión sobre si suspender la lactancia o descontinuar el fármaco.
IX. REACCIONES SECUNDARIAS Y ADVERSAS
ALMETEC® TRI
Las reacciones adversas más frecuentes, por aparato o sistema orgánico, que ocurrieron en por lo menos 2% de los pacientes tratados con ALMETEC® TRI en un estudio clínico controlado fueron:
Trastornos del sistema nervioso: mareo, cefalea
Infecciones e infestaciones: infección de las vías respiratorias superiores, nasofaringitis
Trastornos renales y urinarios: infección de las vías urinarias
Trastornos generales: edema periférico, fatiga
Trastornos musculoesqueléticos y del tejido conectivo: espasmos musculares, inflamación de las articulaciones
Trastornos gastrointestinales: náusea, diarrea
COMPONENTES INDIVIDUALES
Olmesartán medoxomilo
En estudios clínicos, el tratamiento con olmesartán medoxomilo fue bien tolerado, con una incidencia de eventos adversos semejante a la del placebo. En general, los eventos fueron leves, pasajeros y sin relación con la dosis de olmesartán medoxomilo. La frecuencia general de los eventos adversos no se relacionó con la dosis. El análisis por sexo, edad y raza no mostró diferencias entre los pacientes tratados con olmesartán medoxomilo o con placebo. El mareo es un evento común (incidencia ≥ 1% a <10%) en estudios clínicos con olmesartán medoxomilo.
En la experiencia post-comercialización, las reacciones adversas al medicamento que se han informado muy raramente (<0.01% incidencia) fueron edema periférico, cefalea, tos, dolor abdominal, náusea, vómito, diarrea, enteropatía por enfermedad celíaca, reacción anafiláctica, exantema, prurito, angioedema, insuficiencia renal aguda, aumento de las enzimas hepáticas, aumento de la creatinina en sangre, hiperkalemia, mialgia y condiciones asténicas, como astenia, fatiga, letargo, malestar.
Se han reportado casos únicos de rabdomiólisis con asociación temporal con la toma de bloqueadores del receptor de angiotensina II.
Amlodipino
Casi todas las reacciones adversas reportadas durante la terapia con amlodipino fueron leves o moderadas. Los efectos indeseables más comunes fueron cefalea, edema, mareo, rubor facial y palpitaciones.
En la experiencia post-comercialización se ha observado ginecomastia de manera infrecuente, reportada como reacción adversa con causa incierta. En la experiencia post-comercialización, se ha visto ictericia y elevación de las enzimas hepáticas (consistente principalmente con colestasis o hepatitis), que en algunos casos fueron lo suficientemente graves para requerir hospitalización, asociada con el uso de amlodipino.
Hidroclorotiazida
Los eventos adversos reportados con otras preparaciones de hidroclorotiazida son los siguientes:
Trastornos del aparato digestivo
Irritación gástrica, sialadenitis, pancreatitis.
Trastornos hepatobiliares
Ictericia (ictericia colestática intrahepática).
Trastornos oculares
Xantopsia, visión borrosa pasajera.
Trastornos de la sangre y el sistema linfático
Leucopenia, agranulocitosis, trombocitopenia, anemia aplásica, anemia hemolítica.
Trastornos de la piel y el tejido subcutáneo
Reacciones de fotosensibilidad, urticaria, angeítis necrotizante (vasculitis, vasculitis cutánea), reacciones anafilácticas, necrólisis epidérmica tóxica.
Trastornos generales
Fiebre.
Trastornos del aparato respiratorio
Distrés respiratorio (incluyendo neumonitis y edema pulmonar)
Trastornos renales y urinarios
Disfunción renal, nefritis intersticial
Trastornos musculoesqueléticos
Espasmos musculares, debilidad
Trastornos del sistema nervioso
Inquietud
X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO
ALMETEC® TRI
El efecto reductor de la presión arterial de ALMETEC® TRI puede incrementarse mediante el uso concomitante de medicamentos antihipertensivos (por ejemplo, bloqueadores alfa, diuréticos). No se han realizado estudios de interacción con ALMETEC® TRI y otros medicamentos; sin embargo, se han realizado estudios por separado con los componentes individuales de ALMETEC® TRI olmesartán medoxomilo, amlodipino e hidroclorotiazida, como se describe a continuación.
Olmesartán medoxomilo
Uso con litio
Se han visto aumentos en las concentraciones séricas de litio y la toxicidad por litio con la administración concomitante de litio con antagonistas de los receptores de angiotensina II, incluyendo olmesartán. Vigile las concentraciones séricas de litio durante el uso concomitante.
Bloqueo doble del sistema renina, angiotensina (RAS)
El bloqueo doble del sistema RAS con antagonistas de los receptores de angiotensina, inhibidores de la ECA o aliskiren se ha asociado con un aumento en el riesgo de sufrir hipotensión e hiperkalemia, así como con cambios en la función renal (incluyendo insuficiencia renal aguda), en comparación con la monoterapia. Vigile la presión arterial, función renal y electrólitos en pacientes que toman olmesartán y otros agentes que afectan el RAS.
Uso con aliskiren
No administre aliskiren junto con olmesartán medoxomilo en pacientes con diabetes (véase VI. CONTRAINDICACIONES), puesto que el empleo doble se asocia con un incremento en el riesgo de sufrir hipotensión e hiperkalemia, así como con cambios en la función renal (incluyendo insuficiencia renal aguda), en comparación con la monoterapia.
Anti-inflamatorios no esteroides (AINEs):
Los AINEs y los ARB (Bloqueadores de los receptores de angiotensina) pueden actuar en forma sinérgica y disminuir la filtración glomerular. El uso concomitante de AINEs y ARB puede aumentar el riesgo de que empeore la función renal.
Además, el efecto antihipertensivo de los ARB, incluyendo olmesartán, puede ser atenuado por los AINEs, incluyendo los inhibidores selectivos de cox2.
Uso con clorhidrato de colesevelam
La administración concurrente del secuestrador de ácido biliar clorhidrato de colesevelam reduce la exposición sistémica y la concentración plasmática máxima de olmesartán. La administración de olmesartán por lo menos cuatro horas antes de clorhidrato de colesevelam disminuyó el efecto de la interacción medicamentosa (véase XIV. MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL).
Amlodipino
Uso concomitante que requiere cautela
Inhibidores del CYP3A4 (por ejemplo, ketoconazol, itraconazol, ritonavir):
En un estudio en pacientes ancianos se mostró que diltiazem inhibe el metabolismo del amlodipino, probablemente por medio del CYP3A4, puesto que las concentraciones plasmáticas de amlodipino aumentaron aproximadamente 50% y, por tanto, incrementó su efecto. No puede excluirse la posibilidad de que inhibidores más potentes del CYP3A4 (por ejemplo, ketoconazol, itraconazol, ritonavir) aumenten la concentración plasmática de amlodipino en mayor medida que diltiazem.
Inductores de CYP3A4 (por ejemplo, anticonvulsivos [como carbamazepina, fenobarbital, fenitoína, fosfenitoína, primidona], rifampicina, Hypericum perforatum):
La administración concomitante de un inductor del CYP3A4 puede disminuir la concentración plasmática de amlodipino. Está indicada la vigilancia clínica, con posible ajuste de la dosis de amlodipino durante el tratamiento con el inductor de CYP3A4 y después de haberlo retirado.
Simvastatina
La co-administración de múltiples dosis de 10 mg de amlodipino con 80 mg de simvastatina dio por resultado un incremento de 77% en la exposición a simvastatina, en comparación con la simvastatina sola. Limite la dosis diaria de simvastatina a 20 mg en los pacientes que toman amlodipino.
Tacrolimus
La co-administración de amlodipino con tacrolimus puede incrementar la exposición de tacrolimus. Debido a que ALMETEC TRI® contiene amlodipino, monitoree los niveles sanguíneos de tacrolimus durante el uso concomitante.
Ciclosporina
En un estudio prospectivo en pacientes con trasplante renal, se observó un incremento promedio de 40% en los niveles valle de ciclosporina en presencia de amlodipino. La co-administración de amlodipino con ciclosporina puede incrementar la exposición a ciclosporina. Debido a que ALMETEC TRI® contiene amlodipino, monitoree los niveles valle de ciclosporina durante el uso concomitante.
Hidroclorotiazida
Alcohol, barbitúricos o narcóticos
Puede potenciarse la hipotensión ortostática.
Antidiabéticos (orales e insulina):
Puede ser necesario ajustar la dosis del antidiabético (véase VII. PRECAUCIONES GENERALES).
Colestiramina y resinas de colestipol
Se reduce la absorción de hidroclorotiazida en presencia de resinas de intercambio aniónico.
Corticosteroides y ACTH
Los pacientes que toman corticosteroides o ACTH tienen mayor riesgo de sufrir hipokalemia (véase VII. PRECAUCIONES GENERALES).
Aminas presoras (por ejemplo, noradrenalina = norepinefrina)
Puede disminuir el efecto de las aminas presoras.
Relajantes musculoesqueléticos no despolarizantes (como tubocurarina)
El efecto de los relajantes musculoesqueléticos no despolarizantes puede potenciarse con la hidroclorotiazida.
Litio
Las tiazidas reducen la depuración renal del litio, así que aumenta el riesgo de toxicidad por litio. Por tanto, no se recomienda el uso combinado de ALMETEC® TRI y litio (véase VII. PRECAUCIONES GENERALES). Si se muestra que es necesario emplear la combinación, se recomienda vigilar las concentraciones séricas de litio.
Fármacos anti-inflamatorios no esteroideos
La administración de un antiinflamatorio no esteroide puede reducir los efectos diurético, natriurético y anti-hipertensivo de los diuréticos tiazídicos en algunos pacientes.
XI. ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO
Hiperglucemia, glucosuria, hiperuricemia, desequilibrio de electrólitos (incluyendo hiponatremia e hipokalemia), aumentos del colesterol y los triglicéridos.
XIII. DOSIS Y VÍA DE ADMINISTRACIÓN
Dosis usual para adultos
La dosis recomendada de ALMETEC® TRI es una tableta al día, con o sin alimentos. La dosis puede aumentarse tras dos semanas de terapia. La dosis máxima recomendada de ALMETEC® TRI es 40/10/25 mg.
Por comodidad, los pacientes que toman olmesartán medoxomilo, amlodipino e hidroclorotiazida en tabletas separadas pueden cambiar a las tabletas de ALMETEC® TRI que contienen las mismas dosis de los componentes. Cuando sea clínicamente apropiado, puede pensarse en cambiar de la monoterapia a la combinación fija.
Ancianos
En general, no se necesitan ajustes a la dosis recomendada para pacientes ancianos.
Insuficiencia renal
No se requiere ajustar la dosis recomendada para pacientes con insuficiencia renal leve a moderada. En pacientes con insuficiencia renal grave (depuración de creatinina <30 mL/min) se prefieren los diuréticos de asa antes que las tiazidas; por tanto, no se recomienda el empleo de ALMETEC® TRI (véase VII. PRECAUCIONES GENERALES).
Insuficiencia hepática
No se requiere ajuste de la dosis recomendada para pacientes con insuficiencia hepática leve a moderada. No se recomienda ALMETEC® TRI en pacientes con insuficiencia hepática grave (véase VII. PRECAUCIONES GENERALES).
Niños
ALMETEC® TRI no se recomienda para niños ni adolescentes de menos de 18 años, debido a la falta de información de seguridad y eficacia.
XIV. MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL
Síntomas
La dosis máxima de ALMETEC® TRI es de 40/10/25 mg una vez al día. No hay información de sobredosis con ALMETEC® TRI en seres humanos. El efecto más probable de la sobredosis de ALMETEC® TRI es hipotensión.
Puede esperarse que una sobredosis de amlodipino lleve a una vasodilatación periférica excesiva con hipotensión notable y, posiblemente, taquicardia refleja. Se ha visto hipotensión sistémica marcada y potencialmente prolongada hasta e incluyendo choque con resultados fatales.
La sobredosis con hidroclorotiazida se asocia con depleción de electrólitos (hipokalemia, hipocloremia) y deshidratación por la diuresis excesiva.
Tratamiento
En el caso de sobredosis con ALMETEC® TRI, el tratamiento debe ser de soporte. Como el amlodipino establece una fuerte unión con las proteínas, no es probable que sea benéfica una diálisis. Se desconoce el grado de dialización de olmesartán y de hidroclorotiazida.
XII. PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD
DATOS PRECLÍNICOS DE SEGURIDAD
El modo de la acción antihipertensiva del amlodipino (efecto relajante directo en el músculo liso vascular) varía y es complementario de los efectos de olmesartán medoxomilo (un bloqueador de los receptores de angiotensina de acción prolongada) e hidroclorotiazida (modulación de los mecanismos tubulares renales de reabsorción de electrólitos). A partir de perfiles de toxicidad no clínica de olmesartán medoxomilo/hidroclorotiazida y amlodipino, no se espera que se produzca exacerbación de la toxicidad por la adición de amlodipino a la combinación de olmesartán medoxomilo / hidroclorotiazida, porque el amlodipino tiene otro blanco de toxicidad, a saber, el corazón, mientras que se sabe que olmesartán medoxomilo e hidroclorotiazida se dirigen a los riñones.
En un estudio a tres meses de toxicidad por dosis repetida en ratas, se mostró que la administración combinada de olmesartán medoxomilo, amlodipino e hidroclorotiazida no aumentó ninguna de las toxicidades existentes ya señaladas de los activos por separado, ni indujo toxicidades nuevas, ni se observaron efectos toxicológicamente sinérgicos.
Carcinogenicidad, mutagénesis, deterioro de la fertilidad
No se han realizado estudios adicionales de mutagenicidad, carcinogenicidad ni toxicidad reproductiva con ALMETEC® TRI, dado el perfil de seguridad bien entendido de los compuestos por separado o de las combinaciones dobles.
XVIII. NOMBRE Y DOMICILIO DEL LABORATORIO
SCHERING-PLOUGH, S.A. de C.V.
Av. 16 de Septiembre No. 301, Col. Xaltocan,
C.P. 16090, Deleg. Xochimilco,
Ciudad de México, México.
XV. PRESENTACIÓN
Caja con 14 y 28 tabletas de ALMETEC® TRI 20/5/12.5
(OLMESARTÁN 20 MG / AMLODIPINO 5 MG/ HIDROCLOROTIAZIDA 12.5 MG)
Caja con 14 y 28 tabletas de ALMETEC® TRI 40/5/12.5
(OLMESARTÁN 40 MG / AMLODIPINO 5 MG/ HIDROCLOROTIAZIDA 12.5 MG)
Caja con 14 y 28 tabletas de ALMETEC® TRI 40/5/25
(OLMESARTÁN 40 MG / AMLODIPINO 5 MG/ HIDROCLOROTIAZIDA 25 MG)
Caja con 14 y 28 tabletas de ALMETEC® TRI 40/10/12.5
(OLMESARTÁN 40 MG / AMLODIPINO 10 MG/ HIDROCLOROTIAZIDA 12.5 MG)
Caja con 14 y 28 tabletas de ALMETEC® TRI 40/10/25
(OLMESARTÁN 40 MG / AMLODIPINO 10 MG / HIDROCLOROTIAZIDA 25 MG)
XVI. RECOMENDACIONES SOBRE ALMACENAMIENTO
Consérvese a no más de 30°C.
XVII. LEYENDAS DE PROTECCIÓN
Literatura exclusiva para médicos.
Su venta requiere receta médica.
No se use durante el embarazo o lactancia.
No se deje al alcance de los niños.
No se administre a menores de 18 años.
No se administre a mayores de 80 años.
Reporte las sospechas de reacción adversa a:
farmacovigilancia@cofepris.gob.mx y
dpocmx@merck.com