
ACOEXCEL
PACLITAXEL
Solución inyectable
1 Caja,1 Frasco(s) ámpula,300 mg,
1 Caja , 1 Frasco(s) ámpula , 30/5 mg/ml
1 Caja , 1 Frasco(s) ámpula , 100/16.7 mg/ml
1 Caja , 1 Frasco(s) ámpula , 300/50 mg/ml
FORMA FARMACÉUTICA Y FORMULACIÓN:
El frasco ámpula contiene:
Paclitaxel 30 mg, 100 mg, 300 mg
Excipiente cbp 5 ml, 16.7 ml, 50 ml
INDICACIONES TERAPÉUTICAS: Paclitaxel está indicado en el tratamiento de carcinoma mamario y ovárico avanzados recurrentes o resistentes al tratamiento con otros fármacos citotóxicos. También está indicado para el tratamiento del carcinoma pulmonar de células no pequeñas.
FARMACOCINÉTICA Y FARMACODINAMIA: Paclitaxel pertenece a la clase de medicamentos conocidos como antimicrotúbulos. Posee la característica de estimular y promover la formación de microtúbulos. Se liga a las subunidades β-tubulina de los microtúbulos impidiendo la despolimerización y actúa en la inhibición de la reorganización normal de la red de los microtúbulos, que es esencial para las funciones celulares y como consecuencia el ciclo celular se detiene en la fase G2 y M de la mitosis.
El Paclitaxel produce formaciones o haces anormales de microtúbulos a lo largo del ciclo celular y además de múltiples ésteres de microtúbulos durante la mitosis.
La farmacocinética de Paclitaxel se ha evaluado sobre una amplia variación de dosis de hasta 300 mg/m2 y sobre la base de un programa de infusiones que van de 3 a 24 horas.
La depuración de Paclitaxel es saturable y disminuye al aumentar la dosis o el tiempo y frecuencia de administración.
En pacientes tratados con dosis de 135 y 175 mg/m2 de superficie corporal administrados en infusiones de 3 a 24 horas, el promedio de vida media terminal varía de 5 a 17 horas y la eliminación total en el cuerpo varía de 42 a 162 L/m2, indicando una distribución extravascular extensa y/o unión a los tejidos o ambas.
Después de 3 horas de infusión de 175 mg/m2, el promedio de la vida media terminal se calculó en 9.9 horas, la media de eliminación total en el cuerpo fue de 12.4 L/h/m2. La farmacocinética de Paclitaxel ha mostrado no ser lineal, al incrementar la dosis, existe desproporcionadamente un aumento de Cmáx. y del área bajo la curva (AUC), acompañado de una disminución de la eliminación total del cuerpo aparentemente relacionada a la dosis.
Estos hallazgos son los observados más fácilmente en aquellos pacientes en los que se han alcanzado altas concentraciones plasmáticas de Paclitaxel. El proceso de saturación en la distribución y eliminación-metabolismo podría explicarse con estos hallazgos.
La variabilidad en la exposición sistémica de Paclitaxel, como lo mide el AUC para tratamientos sucesivos, fue mínima; no hubo evidencia de acumulación de Paclitaxel en múltiples tiempos de tratamiento.
En promedio, de 89 a 98% del medicamento se une a las proteínas séricas.
Después de la administración intravenosa, Paclitaxel muestra una disminución bifásica de las concentraciones en el plasma. La disminución inicial rápida representa la distribución en el compartimento periférico y su eliminación, esta última fase se debe en parte al flujo relativamente lento de Paclitaxel al compartimento periférico.
Los metabolitos hidroxilados, que se han encontrado en la bilis, han demostrado ser los metabolitos principales. Aproximadamente 20% de una dosis administrada de Paclitaxel en un paciente se recuperó en la bilis como el compuesto principal y sus metabolitos 24 horas después del tratamiento. El metabolismo hepático y la circulación biliar pueden ser los principales mecanismos para la obtención de Paclitaxel.
El Paclitaxel es metabolizado en el hígado y la excreción biliar es su principal vía de eliminación. Menos de 10% de la dosis administrada es excretada sin cambio en la orina y probablemente no es necesario el ajuste de la dosis en pacientes con la función renal afectada. Se han comunicado rangos extremadamente amplios para el aclaramiento total del Paclitaxel. En estudios de fase I se ha informado de aclaramientos promedio desde 100 hasta 993 ml/minuto/m2 sin que los valores de aclaramiento estuviesen correlacionados con la dosis. No obstante que no se han publicado estudios en humanos para evaluar el metabolismo del Paclitaxel en pacientes con daño hepático, el Paclitaxel deberá administrarse con precaución en estos casos, al igual que en pacientes que reciben fármacos que interfieren en el sistema enzimático del citocromo P-450.
CONTRAINDICACIONES: No se debe administrar este medicamento en pacientes con historia de reacciones de hipersensibilidad al Paclitaxel o a otros fármacos elaborados con aceite de ricino polioxietilado. Paclitaxel no deberá usarse en pacientes con tumores sólidos con un recuento de neutrófilos inferior a 1,500 células/mm3 o en pacientes con sarcoma de Kaposi relacionado al SIDA con un recuento de neutrófilos inferior a 1,000 células/mm3.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: Hasta el momento, no se han realizado estudios bien controlados en mujeres embarazadas. Se recomienda evitar el uso de agentes antineoplásicos, especialmente la quimioterapia de combinación, sobre todo en el primer trimestre del embarazo. Por lo tanto, las mujeres en edad fértil deben utilizar métodos anticonceptivos seguros durante el tratamiento para evitar el embarazo. Aunque se desconoce si el Paclitaxel se distribuye en la leche materna, no se recomienda la lactancia durante el tratamiento con Paclitaxel. Por lo que no se recomienda el uso y administración de este medicamento durante el embarazo y la lactancia.
REACCIONES SECUNDARIAS Y ADVERSAS: La frecuencia y severidad de los eventos adversos, generalmente fueron similares entre los pacientes que recibieron tratamiento con Paclitaxel por cáncer de ovario, cáncer de mama, cáncer de células no pequeñas del pulmón; sin embargo, los pacientes con sarcoma de Kaposi asociado a SIDA pueden tener más severa y frecuentemente toxicidad hematológica, infecciones y neutropenia febril. Estos pacientes requieren de menor intensidad de dosis y de tratamiento de soporte.
Hematológico: La supresión de la médula ósea fue la toxicidad limitante de la dosis de Paclitaxel más importante. La neutropenia, la toxicidad hematológica más importante, fue dependiente de la dosis y del esquema utilizado y generalmente fue rápidamente reversible. Entre los pacientes tratados en el estudio fase III de segunda línea en ovario con 3 horas de infusión, la cuenta de neutrófilos disminuyó por abajo de 500 células/mm3 en 14% de los pacientes tratados con una dosis de 135 mg/m2 comparado con 27% de los pacientes tratados con una dosis de 175 mg/m2 (p = 0.05). En el mismo estudio, la neutropenia severa (< 500 células/mm3) fue más frecuente en la infusión de 24 horas que en la de 3 horas; la duración de la infusión tuvo un mayor impacto que la dosis. La neutropenia no pareció incrementarse con la exposición acumulativa y no pareció ser más frecuente o severa en aquellos pacientes tratados previamente con radioterapia.
La fiebre fue frecuente (12% de todos los cursos de tratamiento). Los episodios infecciosos ocurrieron en 30% de todos los pacientes y en 9% de todos los cursos de tratamiento; estos episodios fueron fatales en 1% de todos los pacientes e incluyeron sepsis, neumonía y peritonitis. Las infecciones del tracto urinario y respiratorio superior fueron las complicaciones infecciosas más frecuentemente reportadas. Se reportó por lo menos una infección oportunista en 61% de la población inmunosuprimida de pacientes con enfermedad de VIH avanzada y sarcoma de Kaposi relacionado a SIDA de bajo riesgo. En los pacientes que presentan neutropenia severa se recomienda tratamiento de soporte, incluyendo factor estimulante de colonias de granulocitos.
Infecciones: En 5% de las administraciones ocurrió neutropenia febril y 30% de todas las administraciones fueron asociados con un episodio de infección. Las infecciones más comunes involucran el sistema respiratorio superior, el sistema urinario y sanguíneo (sepsis).
Neurológico: La neuropatía periférica depende de la dosis, y por lo general se manifiesta como ligera parestesia, ha sido reportado que 60% de los pacientes experimentaron el grado I de la toxicidad, 10% el grado II y 2% el grado III en las dosis recomendadas. En dosis altas se reportó neuropatía en 87% de los pacientes. La incidencia de los síntomas severos (grado III) aumentaron de 4 a 10% de los pacientes, cuando se les administraron dosis altas. Sólo ocasionalmente son experimentados síntomas severos neurológicos, en general, en los pacientes que han recibido dosis altas de Paclitaxel. Por lo general, los síntomas empeoran cuando el paciente es expuesto al Paclitaxel. La suspensión de la terapia de Paclitaxel fue requerida en 2% de los pacientes debido a la neurotoxicidad periférica. Los síntomas sensoriales, por lo general, aumentan o se solucionan en un periodo de algunos meses después de la suspensión del Paclitaxel. El efecto de la terapia de Paclitaxel en las neuropatías ya existentes resulta de las terapias previas que no fueron determinadas. Existe un reporte de convulsiones en los pacientes que han recibido Paclitaxel y que el ataque ocurrió después del tratamiento. Existe un segundo reporte de pacientes con importante daño hepático durante la infusión de Paclitaxel. Otros reportes describen la neuropatía motora con resultados, debilidad distal menor y neuropatía autonómica resultando en íleo paralítico e hipotensión ortostática.
Cardiovascular: La hipotensión y la bradicardia asociadas con la infusión de Paclitaxel han sido reportadas en 25 y 12% de los pacientes respectivamente, a menudo durante la administración actual del medicamento. Sin embargo, no han ocurrido ambos durante el mismo esquema de la terapia. La mayoría de los sucesos cardiacos fueron asintomáticos y manejados sin tratamiento alguno. Sin embargo, reacciones severas de hipotensibilidad han sido asociadas con las reacciones severas de hipersensibilidad y han requerido de intervención. Se ha reportado que incluyen arritmias, taquicardia ventricular asintomática, bigemina, y episodios sincopales y bloqueo atrioventricular.
Hepático: Han sido reportadas más comúnmente elevación en las enzimas del hígado (bilirrubina 18% de los pacientes) fosfatasa alcalina (23%), aspartato transaminasa (AST [SGOTI]); (15%) y alanin transaminasa (ALT [SGPT]; 53%) en los pacientes con función hepática renal basal, los cuales han sido tratados con Paclitaxel. Todos los aumentos, excepto el de ALT, dependen de la dosis. La necrosis hepática y la encefalopatía hepática que dan como resultado la muerte, han sido reportados raras veces.
Artralgia-mialgia: La artralgia o mialgia se observaron en 55% de los pacientes y éstas por lo general se manifestaron como un dolor ligero en las articulaciones de los brazos y piernas. Los síntomas por lo general son de corta duración y aparecen 2 ó 3 días después del tratamiento y se desaparecen en un plazo de pocos días. Estos efectos dependen claramente de la dosis y parece ser que las incidencias más altas son en los pacientes que han sido tratados concurrentemente con filgrastim (factor de estimulación de colonias granulocítica, G-GSP).
Gastrointestinal: Los más comunes son náuseas-vómito (53% de los pacientes), diarrea (26%) y mucositis (26%). Se ha reportado perforación intestinal en varios pacientes que han recibido Paclitaxel. La perforación intestinal debe ser excluida en los pacientes que han recibido Paclitaxel y que presentan dolor abdominal.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: No han sido revisados los estudios del potencial de carcinogenicidad con el Paclitaxel; sin embargo, medicamentos parecidos al Paclitaxel son carcinogénicos. Estudios in vitro (anormalidades de los cromosomas en los linfocitos humanos) e in vivo (pruebas micronucleares realizadas en ratones) pruebas en mamíferos han demostrado que el Paclitaxel es mutagénico. Cuando se probaron las pruebas de AMEs para el Paclitaxel, éstas no produjeron mutagenicidad. Seguida del tratamiento con Paclitaxel por vía intravenosa en una dosis de 1 mg/kg (6 mg/m2), las ratas mostraron disminución en la fertilidad y toxicidad en los fetos. Administrado el Paclitaxel por vía intravenosa a los ratones durante la organogénesis en dosis de 3 mg/kg (33 mg/m2), éste fue tóxico en ambos, en las madres y fetos.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Cisplatino: Cuando Paclitaxel es combinado con un compuesto de platino, debe ser administrado antes que dicho compuesto de platino. En estudios clínicos referentes a la combinación de medicamentos, la mielosupresión fue más profunda y se redujo la eliminación renal de Paclitaxel en aproximadamente 33%, cuando Paclitaxel fue administrado después de cisplatino, comparado cuando Paclitaxel fue administrado antes de cisplatino.
Sustratos, inductores, inhibidores del citocromo P-450 2C8 y 3A4: El metabolismo de Paclitaxel es catalizado por el citocromo P-450, isoenzimas CYP2C8 y CYP3A4. Se debe tener precaución cuando Paclitaxel se administre en forma concomitante con algún sustrato conocido, inductor o inhibidor de las isoenzimas CYP2C8 y CYP3A4 del citocromo P-450.
Doxorubicina: Cuando Paclitaxel y doxorubicina se han combinado administrando Paclitaxel antes de doxorubicina y utilizando periodos de infusión más largos de lo recomendado (Paclitaxel administrado en 24 horas; doxorubicina administrada en 48 horas), se han observado efectos relacionados con la secuencia de aplicación, caracterizados por episodios más profundos de neutropenia y de estomatitis.
Paclitaxel contiene alcohol anhidro. Deberán hacerse consideraciones pertinentes con respecto a posible afectación del SNC u otros efectos del alcohol en todos los pacientes.
Los niños pueden ser más sensibles que los adultos a los efectos del alcohol.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: En algunos pacientes se pueden elevar los niveles de bilirrubinas, de fosfatasa alcalina y de la ASAT (TGO). En algunas ocasiones se ha reportado elevaciones en concentraciones de suero para triglicéridos.
La biometría hemática se altera al modificarse las cifras de neutrófilos y plaquetas. La supresión de la médula ósea es la mayor toxicidad del Paclitaxel y es dosis-dependiente y limitante. La toxicidad hematológica más importante es la neutropenia, que es dosis-dependiente y esquema-dependiente y es, en general, rápidamente reversible. Se presenta en promedio a los 11 días. Paclitaxel no debería ser administrado a pacientes con recuento basal de neutrófilos de menos de 1,500 células/mm3. Durante el tratamiento con Paclitaxel deberá instituirse un frecuente monitoreo del recuento hematológico. Las pacientes no deben ser tratadas con ciclos subsecuentes de Paclitaxel, hasta que los neutrófilos recuperen un nivel > 1,500 células/mm3 y un nivel de plaquetas > 100,000 células/mm3.
PRECAUCIONES GENERALES: La administración de Paclitaxel debe ser bajo la supervisión de personal especializado en el manejo de agentes quimioterapéuticos y en la manipulación como en la eliminación de los antineoplásicos, se han sugerido algunas precauciones que a continuación se indican: utilizar una zona de seguridad biológica como una vitrina durante la reconstitución y dilución del medicamento, para uso parenteral, colocarse guantes y si es posible mascarilla desechable. Eliminar cuidadosa y correctamente las agujas, jeringas, viales, ampolletas y el medicamento no utilizado. Además, se debe contar con lo necesario para el manejo de posibles reacciones anafilácticas, como es epinefrina, líquidos intravenosos, difenhidramina y corticosteroides para tratar las reacciones de hipersensibilidad graves.
Paclitaxel debe ser administrado como una solución diluida. No es recomendable el contacto de Paclitaxel sin diluir con los equipos o dispositivos que contienen PVC (cloruro de polivinilo) y que serán utilizados en la preparación de las infusiones.
A todos los pacientes se les administrará previamente un corticosteroide difenhidramina y un antagonista de los receptores H2 para prevenir las reacciones de hipersensibilidad. Quienes presentan reacciones de hipersensibilidad graves al Paclitaxel no deben recibir de nuevo el medicamento.
Se ha informado sobre efectos tóxicos en el sistema nervioso central en pacientes pediátricos que reciben dosis altas de Paclitaxel en venoclisis durante tres horas. Es posible que ocurra supresión grave de médula ósea (principalmente neutropenia) con la infección consiguiente. En general, los tratamientos con Paclitaxel no deben administrarse ni ser repetidos en enfermos con cuentas de neutrófilos de menos de 1,500 células/mm3 y el recuento de plaquetas sea al menos de 100,000 células/mm3.
Se utilizará Paclitaxel con cautela en pacientes con insuficiencia hepática moderada o grave y se tendrá cuidado de ajustar la dosis de Paclitaxel en enfermos con insuficiencia hepática, neutropenia grave o neuropatía periférica.
Se recomienda el uso de guantes. Si la solución con Paclitaxel tiene contacto con la piel, lávese la zona de contacto de inmediato con abundante agua y jabón. Si Paclitaxel entra en contacto con mucosas, éstas deberán ser enjuagadas abundantemente con agua. Después de la exposición tópica, se ha observado picazón, urencia y eritema.
Al inhalarse, se ha reportado disnea, dolor torácico, urencia ocular, dolor de garganta y náuseas. En vista de que existe la posibilidad de extravasación, es aconsejable monitorear cuidadosamente el sitio de la infusión por posibles infiltraciones durante la administración del medicamento.
No es recomendable el contacto de Paclitaxel sin diluir con los equipos o dispositivos que contienen PVC (cloruro de polivinilo) y que serán utilizados en la preparación de las infusiones.
Para minimizar la exposición del paciente al PVC plastificado con DEHP [di-(2-etilhexil) ftalato] que puede ser extraído de las bolsas o equipos para infusión, las diluciones con Paclitaxel deberán ser preparadas y almacenadas en frascos (vidrio, polietileno o polipropileno) o bolsas de plástico (polietileno, polipropileno) y administradas a través de un equipo para venoclisis de polietileno.
Paclitaxel debe ser administrado a través de un filtro en línea de membrana porosa no mayor de 0.22 micras, con el cual, no se notó pérdida significativa de la potencia después de su administración.
La utilización de equipos con filtros que incorporan tubería de entrada y salida corta, recubierta de PVC, no ha resultado en una extracción significativa del plastificante DEHP.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Intravenosa.
Paclitaxel debe diluirse para obtener una concentración final de 0.3 a 1.2 mg/ml antes de su infusión por venoclisis. Dilúyase a 125 mL con alguno de los siguientes diluyentes: solución cloruro de sodio 0.9% inyectable, solución dextrosa 5% inyectable o solución Lactato Ringer. Al estar preparada, la solución se puede mostrar opalescente, condición atribuida a la formulación del vehículo. Una vez hecha la mezcla, administrar inmediatamente.
En raras ocasiones, se ha reportado precipitación con infusiones de mayor duración a las de 3 horas recomendadas. La vibración, el sacudir o la agitación excesiva pueden inducir precipitación, por lo que deberán evitarse. El equipo de venoclisis deberá purgarse con una solución compatible antes de utilizarse.
Para reducir el riesgo de severas reacciones de hipersensibilidad, todos los pacientes deben ser premedicados antes de administrarles este medicamento. Dicha premedicación puede consistir en 20 mg de dexametasona por vía oral (o su equivalente) aproximadamente 12 y 6 horas antes, difenhidramina (50 mg) o clorfenamina (10 mg) I.V., 30 a 60 minutos antes de cimetidina (300 mg) o ranitidina (50 mg) I.V., 30 a 60 minutos antes de administrar el medicamento.
Limpie la superficie expuesta de los tapones de hule del frasco ámpula, con un antiséptico tal como alcohol. No deje antiséptico excesivo en los tapones.
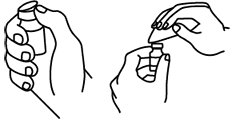
Extraiga con una aguja y jeringa esterilizada el contenido del frasco ámpula.
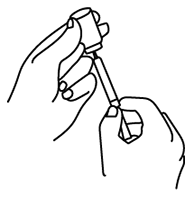
Verifique, observando contra luz, la solución a fin de descartar la presencia de partículas, turbidez o precipitación. Adminístrese de inmediato de acuerdo a las indicaciones del médico.
Este medicamento deberá ser administrado por médicos especialistas en oncología con experiencia en quimioterapia y personal de salud capacitado.
Instrucciones de uso del equipo para administración de soluciones: Usar solamente una vez. No reesterilizar. No se garantiza la esterilidad de este producto en caso de que el empaque primario tenga señales de haber sufrido ruptura previa. No se use si los protectores no están en su lugar. No coloque en campo estéril. No permita que el aire quede atrapado en el equipo. La punción de los componentes del equipo puede causar embolia gaseosa. No regule el flujo con la carretilla reguladora. Coloque el filtro en posición vertical para ventilar el aire. No bloquee la ventilación durante el uso. La presión interna no deberá exceder 45 psi. Este producto contiene goma natural. La superficie de la tubería en contacto con el fluido no contiene DEHP. La superficie exterior de la tubería contiene DEHP. No usarse para infusión por gravedad. Agregue medicamento al envase antes de perforar. La posición del filtro debe estar al nivel o por abajo del nivel del corazón. Cierre la carretilla reguladora por abajo del filtro cuando el equipo no se esté usando. La sangre, emulsiones o medicamentos que no sean totalmente solubles en la solución, no pueden ser administrados a través del filtro. Cuando se administre inyección de bolo antes del filtro, ocluya la tubería entre el filtro y el punto de inyección. Reemplace el equipo cada 24 horas.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: No hay un antídoto conocido para la sobredosificación de Paclitaxel. Las principales complicaciones que en forma primaria pudieran anticiparse con la sobredosis consistirían en supresión de la médula ósea, neurotoxicidad periférica y mucositis. La sobredosificación en pacientes pediátricos puede estar relacionada con toxicidad aguda por alcohol.
PRESENTACIONES:
Caja con 1 frasco ámpula con 30 mg/5 mL con o sin equipo para administración.
Caja con 1 frasco ámpula con 100 mg/16.7 mL con o sin equipo para administración.
Caja con 1 frasco ámpula con 300 mg/50 mL con o sin equipo para administración.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a temperatura ambiente a no más de 30°C en un lugar seco, en su empaque original. Protéjase de la luz.
Si los frascos ámpula sin abrir de Paclitaxel son refrigerados de 2°C a 8°C, se pueden formar pequeños depósitos que una vez alcanzada la temperatura ambiente, se disolverán nuevamente con una pequeña o ninguna agitación. La calidad del producto no se verá afectada. Si la solución continúa turbia o se nota la presencia de un precipitado insoluble, el frasco ámpula deberá ser desechado. El congelamiento no afecta adversamente al producto.
LEYENDAS DE PROTECCIÓN:
Medicamento de alto riesgo. Este medicamento deberá ser administrado únicamente por médicos especialistas en oncología y con experiencia en quimioterapia antineoplásica. No se administre si la solución no es transparente, si contiene partículas en suspensión o sedimentos. No se administre si el cierre ha sido violado. Si no se administra todo el producto, deséchese el sobrante. Su venta requiere receta médica. No se deje al alcance de los niños. No se administre por vía intravenosa directa sin diluir. No se use en el embarazo y la lactancia. 
Literatura exclusiva para el médico.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx y
farmacovigilancia@accordfarma.com.mx
Hecho en India por:
Intas Pharmaceuticals Limited,
Sarkhej-bavla Plot 457/458, Matoda,
Ahmedabad, Gujarat, India-382 210.
Importado y distribuido por:
ACCORD FARMA, S.A. de C.V.
Moctezuma 123, Interior 2,
Col. Aragón La Villa, C.P. 07000,
Alcaldía Gustavo A. Madero,
Ciudad de México, México.
Representante legal:
Accord Farma, S.A. de C.V.
Jaime Balmes No. 11, Torre D, Int. 300,
Col. Los Morales, C.P. 11510,
Alcaldía Miguel Hidalgo,
Ciudad de México, México.
Reg. Núm. 155M2008, SSA IV