
TRAYENTA
LINAGLIPTINA
Tabletas
1 Caja, 10 Tabletas, 5 Miligramos
1 Caja, 30 Tabletas, 5 Miligramos
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA contiene:
Linagliptina 5 mg
Excipiente cbp 1 tableta
INDICACIONES TERAPÉUTICAS: TRAYENTA® (linagliptina) está indicado en pacientes adultos con diabetes mellitus tipo 2 (DMT2) para mejorar el control glucémico junto con la dieta y el ejercicio, como monoterapia o como adyuvante a metformina, sulfonilureas, tiazolidinedionas, insulina (con o sin metformina y/o pioglitazona y/o sulfonilurea) o metformina más sulfonilureas o metformina más inhibidores del SGLT2.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacológicas: Linagliptina es un inhibidor de la enzima DPP-4 (Dipeptidil peptidasa 4, EC 3.4.14.5) una enzima que participa en la inactivación de las hormonas incretinas GLP-1 y GIP (péptido 1 semejante al glucagón, polipéptido insulinotrópico dependiente de la glucosa). Estas hormonas son degradadas rápidamente por la enzima DPP-4. Ambas hormonas incretinas participan en la regulación fisiológica de la homeostasis de la glucosa. Las incretinas son secretadas en una baja concentración basal durante todo el día y los niveles aumentan inmediatamente después de la ingesta de alimentos. Las hormonas GLP-1 y GIP aumentan la biosíntesis y secreción de insulina de las células beta pancreáticas en presencia de concentraciones sanguíneas de glucosa normales y elevadas. Por otra parte, el GLP-1 también reduce la secreción de glucagón de las células alfa pancreáticas, lo cual resulta en una reducción de la producción hepática de glucosa. Linagliptina (TRAYENTA®) se fija muy eficazmente a la DPP-4 de una manera reversible y, de este modo, produce un aumento sostenido y una prolongación de las concentraciones activas de incretinas. TRAYENTA® aumenta, de una manera dependiente de la glucosa, la secreción de insulina y reduce la secreción de glucagón, lo cual resulta en una mejoría global de la homeostasis de la glucosa. Linagliptina se fija selectivamente a la DPP-4 y exhibe una selectividad > 10,000 veces mayor en comparación con la actividad de DPP-8 o DPP-9 in vitro.
Farmacocinética: La farmacocinética de linagliptina ha sido evaluada extensamente en sujetos sanos y en pacientes con diabetes Tipo 2. Después de la administración oral de una dosis de 5 mg a voluntarios sanos y pacientes, linagliptina fue absorbida rápidamente, con concentraciones plasmáticas pico (Tmáx mediano) que se presentaron 1.5 horas después de la dosis.
Las concentraciones plasmáticas de linagliptina declinan de una manera bifásica con una vida media terminal prolongada (vida media terminal de linagliptina de más de 100 horas), que está relacionada principalmente con la fijación saturable y estrecha con la DPP-4 y no contribuye a la acumulación del fármaco. La vida media eficaz para la acumulación de linagliptina, determinada con base en la administración oral de dosis repetidas de 5 mg de linagliptina es de aproximadamente 12 horas. Después de la administración de 5 mg de Linagliptina una vez al día, las concentraciones plasmáticas en estado de equilibrio se alcanzaron con la tercera dosis. El ABC plasmática de linagliptina aumentó aproximadamente 33% después de dosis de 5 mg en estado estable en comparación con la primera dosis. Los coeficientes de variación intra e interindividual del ABC de linagliptina fueron pequeños (12.6% y 28.5%, respectivamente). El ABC plasmática de linagliptina aumentó en una proporción menor que la dosis. La farmacocinética de linagliptina generalmente fue semejante en los sujetos sanos y en los pacientes con diabetes Tipo 2.
Absorción: La biodisponibilidad absoluta de linagliptina es de aproximadamente 30%. Debido a que la administración concomitante de comidas con alto contenido graso y linagliptina no tuvo efectos clínicamente relevantes sobre la farmacocinética, linagliptina puede administrarse con o sin alimentos. Los estudios in vitro indicaron que linagliptina es un sustrato de la glucoproteína P y de la isoenzima CYP3A4. El ritonavir, un potente inhibidor de la glucoproteína P y de la isoenzima CYP3A4, produjo un aumento de dos veces en la exposición (ABC), y la coadministración repetida de linagliptina con rifampicina, un potente inductor de la glucoproteína P (gp-P) y de CYP3A4, resultó en un decremento de aproximadamente 40% del ABC en estado estable, presumiblemente al aumentar/disminuir la biodisponibilidad de linagliptina por inhibición/inducción de la glucoproteína P.
Distribución: Como resultado de la fijación tisular, el volumen de distribución aparente medio en estado estable después de una sola dosis intravenosa de 5 mg de linagliptina a sujetos sanos es de aproximadamente 1110 litros, lo cual indica que linagliptina se distribuye extensamente en los tejidos. La fijación de linagliptina a las proteínas plasmáticas es dependiente de la concentración, disminuyendo de aproximadamente 99% en 1 nmol/L a 75%-89% en ≥ 30 nmol/L, lo cual refleja saturación de la fijación a la DPP-4 con la concentración creciente de linagliptina. En altas concentraciones, donde la DPP-4 está totalmente saturada, 70%-80% de linagliptina se fijó a otras proteínas plasmáticas distintas a la DPP-4; en consecuencia, 20%-30% permaneció sin fijarse al plasma.
Biotransformación/metabolismo: Después de una dosis oral de 10 mg de [14C] linagliptina, aproximadamente el 5% de la radioactividad fue excretado en la orina. El metabolismo desempeña un papel subordinado en la eliminación de linagliptina. Se detectó un metabolito importante con una exposición relativa de 13.3% de linagliptina en estado estable, el cual se encontró que era farmacológicamente inactivo y, por lo tanto, no contribuye a la actividad inhibitoria de la DPP-4 plasmática de linagliptina.
Excreción: Después de la administración de una dosis oral de [14C] linagliptina a sujetos sanos, aproximadamente 85% de la radioactividad administrada fue eliminado en las heces (80%) o la orina (5%) en los 4 primeros días después de la dosis. La depuración renal en estado estable fue de aproximadamente 70 mL/min.
Poblaciones especiales:
Insuficiencia renal: Se llevó a cabo un estudio abierto, con dosis múltiples, para evaluar la farmacocinética de linagliptina (dosis de 5 mg) en pacientes con distintos grados de insuficiencia renal crónica en comparación con sujetos sanos como control. El estudio incluyó pacientes con insuficiencia renal clasificada con base en la depuración de creatinina como leve (50 a < 80 mL/min), moderada (30 a < 50 mL/min) y severa (< 30 mL/min), así como en pacientes con nefropatía en etapa terminal (ESRD) en hemodiálisis. Además, se compararon pacientes con DMT2 e insuficiencia renal severa (< 30 mL/min) contra pacientes con DMT2 con función renal normal. Se determinó la depuración de creatinina en orina de 24 horas o se estimó a partir de la creatinina sérica sobre la base de la fórmula de Cockcroft-Gault:
CrCl = [140 - edad (años)] x peso (kg) {x 0.85 para los pacientes de sexo femenino} [72 x creatinina sérica (mg/dL)].
En condiciones en estado estable, la exposición a linagliptina en los pacientes con deterioro renal leve fue comparable a la de los sujetos sanos. En el deterioro renal moderado, se observó un aumento moderado de la exposición de aproximadamente 1.7 veces en comparación con los controles. La exposición en los pacientes con DMT2 con insuficiencia renal severa aumentó aproximadamente 1.4 veces en comparación con los pacientes con DMT2 con función renal normal. Las predicciones en estado estable del ABC de linagliptina en pacientes con nefropatía en etapa terminal (ESRD) indicaron exposición comparable a la de los pacientes con insuficiencia renal moderada o severa. Además, no se espera que linagliptina sea eliminada en un grado terapéuticamente significativo por hemodiálisis o diálisis peritoneal. Por lo tanto, no se requiere ajuste de la dosis de linagliptina en los pacientes con cualquier grado de insuficiencia renal. Además, la insuficiencia renal leve no tuvo efectos sobre la farmacocinética de linagliptina en pacientes con diabetes mellitus Tipo 2 en la evaluación hecha por medio de análisis de farmacocinética en la población.
Insuficiencia hepática: En los pacientes con insuficiencia hepática leve, moderada y severa (de acuerdo con la clasificación de Child-Pugh), los valores medios del ABC y la Cmáx de linagliptina fueron semejantes a los de controles pareados sanos después de la administración de dosis repetidas de 5 mg de linagliptina. No se requiere ajuste de la dosis de linagliptina en los pacientes con insuficiencia hepática leve, moderada o severa.
Índice de Masa Corporal (IMC): No se requiere ajuste de la dosis con base en el IMC. El índice de masa corporal no tuvo efectos clínicamente relevantes sobre la farmacocinética de linagliptina con base en un análisis de farmacocinética poblacional de los datos de Fase I y Fase II.
Género: No se requiere ajuste de la dosis con base en el género. El género no tuvo efectos clínicamente relevantes sobre la farmacocinética de linagliptina con base en un análisis de farmacocinética poblacional de los datos de Fase I y Fase II.
Pacientes geriátricos: No se requiere ajuste de la dosis con base en la edad, pues la edad no tuvo un impacto clínicamente relevante sobre la farmacocinética de linagliptina basada en un análisis de farmacocinética poblacional de los datos de Fase I y II. Los sujetos de edad avanzada (de 65 a 80 años) tuvieron concentraciones plasmáticas de linagliptina comparables a las de sujetos más jóvenes.
Pacientes pediátricos: Todavía no se han hecho estudios para caracterizar la farmacocinética de la linagliptina en pacientes pediátricos.
Raza: No se requiere ajuste de la dosis con base en la raza. La etnicidad no tuvo efectos manifiestos sobre las concentraciones plasmáticas de linagliptina con base en un análisis combinado de los datos farmacocinéticos disponibles, que incluyeron pacientes de origen caucásico, hispano, afroamericano y asiático. Además, se encontró que las características farmacocinéticas de linagliptina fueron similares en los estudios especiales de Fase I realizados en voluntarios sanos japoneses, chinos y caucásicos y en pacientes afroamericanos con diabetes mellitus tipo 2.
Ensayos clínicos:
Monoterapia con linagliptina: La eficacia y seguridad de la monoterapia con linagliptina fue evaluada en un estudio doble ciego, controlado con placebo, de 24 semanas de duración. El tratamiento con linagliptina una vez al día en dosis de 5 mg proporcionó una disminución significativa de la HbA1c (cambio de -0.69% en comparación con el placebo), en los pacientes con una HbA1c basal de aproximadamente 8%. Linagliptina también demostró disminuciones significativas de la glucosa plasmática en ayunas (GPA), (-23.3 mg/dL/-1.3 mmol/L de cambio comparado con placebo), la glucosa postprandial (GPP) de 2 horas, y un mayor porcentaje de pacientes alcanzaron una HbA1c meta de < 7.0%, en comparación con el placebo.
La disminución de la HbA1c no fue afectada por el género, la edad, la raza, el índice de masa corporal (IMC) basal, la presencia de síndrome metabólico o un índice estándar de resistencia a la insulina (HOMA-IR). El tratamiento con 5 mg de linagliptina al día mejoró significativamente los marcadores indirectos de la función de las células beta, incluyendo la HOMA (Evaluación del Modelo de Homeostasis), la relación proinsulina/insulina y las mediciones de respuesta de las células beta a partir de las frecuentes pruebas de tolerancia a la glucosa. La incidencia observada de hipoglucemia en los pacientes tratados con linagliptina fue semejante a la observada en los tratados con placebo. El peso corporal no difirió significativamente entre los grupos.
Monoterapia con linagliptina en pacientes no aptos para recibir metformina: La eficacia y seguridad de la monoterapia con linagliptina también fue evaluada en pacientes para quienes la terapia con metformina es inapropiada, ya sea por intolerabilidad o contraindicación, en un estudio doble ciego, controlado con placebo, de 18 semanas de duración, seguido por un periodo de extensión de seguridad de 34 semanas (en el que los pacientes que habían recibido placebo fueron tratados con glimepirida). Linagliptina proporcionó disminuciones significativas de la HbA1c (cambio de -0.60% en comparación con el placebo), respecto a una HbA1c basal media de 8.09%. El cambio de HbA1c medio desde el inicio permaneció constante en el grupo tratado con Linagliptina desde la semana 18 a la semana 52. Linagliptina también mostró disminuciones significativas de la glucosa plasmática en ayunas (GPA), (-20.5 mg/dL/-1.1 mmol/L de cambio comparado con placebo) y un mayor porcentaje de pacientes alcanzaron una HbA1c meta de < 7.0%, en comparación con el placebo. La incidencia observada de hipoglucemia en los pacientes tratados con Linagliptina fue similar a la de placebo, y menor que la observada con glimepirida durante el periodo de extensión de seguridad. El peso corporal no difirió significativamente entre los grupos durante el periodo de control con placebo de 18 semanas y los pacientes que recibieron glimepirida aumentaron de peso durante el periodo de extensión de seguridad.
Datos de la monoterapia con linagliptina de 12 semanas en comparación con placebo, y datos de 26 semanas en comparación con un inhibidor de la α-glucosidasa (voglibosa): La eficacia y seguridad de la monoterapia con linagliptina también fueron evaluadas en pacientes japoneses en un estudio doble ciego en comparación con placebo de 12 semanas de duración, y con voglibosa (un inhibidor de la alfa-glucosidasa) de 26 semanas de duración. Linagliptina (5 mg) proporcionó disminuciones significativas de la HbA1c (cambio de -0.87% en comparación con el placebo) después de 12 semanas respecto a una HbA1c basal media de 8.0%. También se demostró que linagliptina (5 mg) proporcionó disminuciones significativamente superiores de la HbA1c en comparación con la voglibosa (cambio de -0.32% en comparación con la voglibosa) después de 26 semanas respecto a una HbA1c basal media de 8.0%. Linagliptina también mostró disminuciones significativas de la glucosa plasmática en ayunas (GPA), (-19.7 mg/dL/-1.1 mmol/L de cambio comparado con placebo, y 6.9 mg/dL/-0.4 mmol/L de cambio comparado con voglibosa) y un mayor porcentaje de pacientes alcanzó una HbA1c meta de < 7.0% en comparación tanto con el placebo como con la voglibosa. La incidencia observada de hipoglucemia en los pacientes tratados con linagliptina fue semejante al observado con el placebo y con la voglibosa. El peso corporal no difirió significativamente entre linagliptina (5 mg) y el placebo después de 12 semanas de tratamiento. Los pacientes tratados con linagliptina (5 mg) exhibieron un pequeño decremento medio del peso corporal respecto a la evaluación basal (-0.16 kg) después de 26 semanas, en comparación con un decremento medio significativamente mayor del peso corporal en los pacientes que recibieron voglibosa (-1.04 kg).
Linagliptina como adyuvante a la terapia con metformina: La eficacia y seguridad de linagliptina en combinación con metformina fueron evaluadas en un estudio doble ciego, controlado con placebo, de 24 semanas de duración. Linagliptina proporcionó disminuciones significativas de la HbA1c (cambio de -0.64% en comparación con el placebo) respecto a una HbA1c basal media de 8.0%.
Linagliptina también mostró disminuciones significativas de la glucosa plasmática en ayunas (GPA), (-21.1 mg/dL/-1.2 mmol/L),la glucosa postprandial (GPP) de 2 horas de -67.1 mg/dL/ (-3.7 mmol/L) comparado con placebo, y un porcentaje mayor de pacientes alcanzaron una HbA1c meta de < 7.0% (-28.3% con linagliptina versus 11.4% con placebo). La incidencia observada de hipoglucemia en los pacientes tratados con linagliptina fue semejante a la observada con el placebo. El peso corporal no difirió significativamente entre los grupos.
La eficacia y seguridad de linagliptina en combinación con metformina se evaluó en un estudio factorial de tratamiento inicial controlado con placebo de 24 semanas de duración. Linagliptina, 2.5 mg dos veces por día, en combinación con metformina (500 mg o 1000 mg dos veces por día) produjo disminuciones significativas en los parámetros de la glucemia en comparación con cualquiera de las dos monoterapias (HbA1c media basal 8.65%). La diferencia media de HbA1c de tratamientos entre el tratamiento combinado de linagliptina y metformina en comparación con la monoterapia con metformina desde el inicio hasta la semana 24 (extrapolación de la última observación [LOCF] fue -0.51% (IC del 95% -0.73, -0.30; p < 0.0001) para el tratamiento con 2.5 mg de linagliptina + 1000 mg de metformina dos veces por día en comparación con 1000 mg de metformina dos veces por día, -0.58% (IC del 95% -0.79; -0.36; p < 0.0001) para el tratamiento con 2.5 mg de linagliptina + 500 mg de metformina dos veces por día en comparación con 500 mg de metformina dos veces por día. La media de cambio de HbA1c corregida por placebo desde el inicio para el tratamiento con 2.5 mg de linagliptina + 1000 mg de metformina dos veces por día fue 1.71% lo que permitió el control de HbA1c (< 7%) en 53.6% de los pacientes (en comparación con 30.7% de los pacientes en monoterapia con 1000 mg de metformina dos veces por día).
La disminución media de HbA1c desde el inicio fue generalmente mayor en los pacientes con valores basales más elevados de HbA1c. El efecto sobre los lípidos plasmáticos generalmente fue neutro. La disminución de peso con la combinación de linagliptina y metformina fue similar a la observada con metformina como monoterapia o con placebo; no hubo cambios desde el inicio para los pacientes que recibieron linagliptina como monoterapia. La incidencia de la hipoglucemia fue similar en todos los grupos de tratamiento (placebo 1.4%; linagliptina 5 mg 0%; metformina 2.1%, y linagliptina 2.5 mg en combinación con metformina dos veces por día 1.4%).
Asimismo, este estudio incluyó pacientes (n = 66) con hiperglucemia más grave (HbA1c basal ≥11%) tratados con linagliptina 2.5 mg y metformina 1000 mg en el estudio abierto, dos veces por día. En este grupo de pacientes, la HbA1c basal media fue 11.8% y la GPA media fue 261.8 mg/dL. Se observó una disminución media desde los valores basales de -3.74% en la HbA1c (n = 48) y de -81.2 mg/dL/-4.5 mmol/L en la GPA (n = 41) en los pacientes que completaron el periodo de estudio de 24 semanas sin terapia de rescate. En el análisis de la última observación llevada a cabo, que incluyó a todos los pacientes con mediciones del criterio de valoración primario (n = 65), en la última observación sin terapia de rescate los cambios desde los valores basales fueron -3.19% para la HbA1c y de -73.6 mg/dL/4.1 mmol/L para la GPA.
La eficacia y seguridad de linagliptina 2.5 mg dos veces por día en comparación con linagliptina 5 mg una vez por día en combinación con metformina en pacientes con control glucémico insuficiente con monoterapia con metformina se evaluó en un estudio doble ciego controlado con placebo de 12 semanas de duración. Linagliptina (2.5 mg dos veces por día y 5 mg una vez por día) combinada con metformina produjo mejoras significativas en los parámetros glucémicos en comparación con placebo. Linagliptina 5 mg una vez por día y 2.5 mg dos veces por día produjo disminuciones significativas y comparables de la HbA1c (IC: -0.07; 0.19) de -0.80% (a partir del valor basal de 7.98%), y de -0.74 (a partir del valor basal de 7.96%) en comparación con placebo. La incidencia de hipoglucemia observada en los pacientes tratados con linagliptina fue similar a la del placebo. El peso corporal no difirió significativamente entre los grupos.
Linagliptina como adyuvante a la terapia con sulfonilurea: La eficacia y seguridad de linagliptina en combinación con sulfonilurea fueron evaluadas en un estudio doble ciego, controlado con placebo, de 18 semanas de duración. Linagliptina proporcionó disminuciones significativas de la HbA1c (cambio de -0.47% en comparación con el placebo) respecto a una HbA1c basal media de 8.6%. Linagliptina también mostró un porcentaje mayor de pacientes que alcanzaron la meta de HbA1c de < 7.0%. El peso corporal no difirió significativamente entre los grupos.
Linagliptina como tratamiento suplementario de insulina: La eficacia y la seguridad de la administración concomitante de lingaliptina 5 mg con el tratamiento con insulina sola o en combinación con metformina o pioglitazona se ha evaluado en un estudio a doble ciego en comparación con placebo de 24 semanas de duración. La diferencia media entre los valores basales y los de la semana 24 (LOCF) de HbA1c para el tratamiento con linagliptina en comparación con placebo fue -0.65% (IC de 95% -0.74; -0.55; p < 0.0001) a partir de un valor basal de HbA1c de 8.3%. Las reducciones promedio a partir de los valores basales de HbA1c en general fueron mayores en los pacientes con valores basales de HbA1c más elevados. Para la linagliptina, el cambio promedio de HbA1c a partir de los valores basales se observó desde la semana 12 hasta la semana 24. La linagliptina también produjo mejoras significativas en los valores de glucosa plasmática en ayunas (FPG) de -11.25 mg/dl/-0.62 mmol/L (IC del 95% -16.14, -6.36; p < 0.0001) en comparación con placebo, y un porcentaje más elevado de pacientes alcanzó el objetivo de HbA1c de < 7.0% en comparación con placebo, lo que se logró con una dosis estable de insulina. Luego de 24 semanas de tratamiento, la dosis diaria promedio de insulina al inicio fue 42 unidades en los pacientes tratados con linagliptina y 40 unidades en los pacientes que recibieron placebo. El cambio promedio en la dosis diaria de insulina desde el inicio hasta la semana 24 fue 1.3 UI en el grupo placebo y 0.6 UI en el grupo linagliptina. No se observaron diferencias significativas entre los grupos en el peso corporal. El efecto sobre los lípidos plasmáticos fue neutral. La incidencia de la hipoglucemia fue similar en ambos grupos de tratamiento (22.2% para linagliptina y 21.2% para placebo). [10] Linagliptina como adyuvante a una terapia de combinación con metformina y sulfonilurea: Se llevó a cabo un estudio controlado con placebo de 24 semanas de duración para evaluar la eficacia y seguridad de 5 mg de linagliptina en comparación con placebo, en pacientes insuficientemente tratados con una combinación de metformina y una sulfonilurea.
Linagliptina proporcionó disminuciones significativas de la HbA1c (cambio de -0.62% en comparación con el placebo) respecto a una HbA1c basal media de 8.14%. La linagliptina también mostró mejoras significativas en pacientes que alcanzaron la meta de HbA1c de < 7.0 y también de glucosa plasmática en ayunas (GPA) (-12.7 mg/dL/-0.7 mmol/L), comparada con placebo. El peso corporal no difirió significativamente entre los grupos.
Linagliptina en adición a una combinación de metformina y empagliflozina: En pacientes que no estaban bien controlados con metformina y empagliflozina [10 mg (n = 247) o 25 mg (n = 217)], el tratamiento de adición de 5 mg de linagliptina durante 24 semanas se redujo la HbA1c media ajustada con respecto a los valores de referencia, respectivamente, en 0.53% (diferencia significativa con respecto a la adición de placebo: 0.32%; IC del 95%: 0.25; 0.13) y 0.58% (diferencia significativa con la adición de placebo: 0.47%; IC del 95%: 0.66; 0.28). Una proporción mayor de pacientes con una HbA1c inicial ≥ 7.0%, tratados con linagliptina 5 mg, alcanzó la meta de ese parámetro (< 7%) en comparación con placebo, lo cual fue estadísticamente significativo.
En subgrupos prespecificados de pacientes con HbA1c inicial de 8.5% o más (metformina más empagliflozina; 10 mg: n = 66; 25 mg: n = 42), la reducción media ajustada de ese valor desde el inicio hasta la semana 24, con la adición de linagliptina 5 mg fue, para ambas dosis de 0.97% (p de la diferencia con la adición de placebo = 0.0875) y 1.16% (p de la diferencia con la adición de placebo = 0.0046), respectivamente.
Linagliptina como terapia de combinación inicial con pioglitazona: En un estudio controlado con placebo de 24 semanas de terapia inicial con 5 mg de linagliptina en combinación con pioglitazona (30 mg), la terapia inicial con linagliptina y pioglitazona proporcionó disminuciones significativas de la HbA1c en comparación con pioglitazona y placebo (-0.51%), respecto a una HbA1c basal media de 8.6%. La combinación inicial de linagliptina y pioglitazona también mostró disminuciones significativas de la glucosa plasmática en ayunas (GPA) (-14.2 mg/dL/-0.8 mmol/L de cambio comparado con placebo), y un porcentaje más alto de pacientes alcanzaron una HbA1c meta (< 7%), y una reducción de la HbA1c de ≥ 0.5%. El peso corporal aumentó significativamente más con la terapia inicial con linagliptina en combinación con pioglitazona, en comparación con pioglitazona y placebo (1.1 kg).
Linagliptina como tratamiento complementario de una combinación de metformina y pioglitazona: Se realizó un estudio comparativo con placebo de 24 semanas de duración para evaluar la eficacia y seguridad de 5 mg de linagliptina en comparación con placebo en pacientes insuficientemente tratados con una combinación de metformina y pioglitazona. La linagliptina proporcionó una mejora significativa de la HbA1c, (-0.57% de cambio comparada con placebo) a partir de una HbA1c media basal de 8.42%.
La linagliptina también mostró mejoras significativas en pacientes que alcanzaron la meta de HbA1c de < 7.0 y también de glucosa plasmática en ayunas (GPA) (-10.4 mg/dL/-0.6 mmol/L), comparada con placebo. El peso corporal no difirió significativamente entre los grupos.
Datos de 24 meses de linagliptina como adyuvante a metformina en comparación con glimepirida: En un estudio que comparó la eficacia y seguridad de la adición de 5 mg de linagliptina o glimepirida (una sulfonilurea) en pacientes con control glucémico inadecuado bajo la monoterapia con metformina, linagliptina fue semejante a la glimepirida en reducir la HbA1c, con una diferencia media entre los tratamientos de la HbA1c entre la evaluación basal y las 104 semanas de +0.20% para linagliptina en comparación con la glimepirida.
En este estudio, la relación proinsulina/insulina, un marcador de la eficiencia de la síntesis y liberación de insulina, mostró una mejoría estadísticamente significativa con linagliptina en comparación con el tratamiento con glimepirida. La incidencia de hipoglucemia en el grupo de linagliptina (7.5%) fue significativamente más baja que en el grupo de glimepirida (36.1%). Los pacientes tratados con linagliptina (5 mg) exhibieron un decremento medio significativo del peso corporal respecto a la evaluación basal en comparación con un aumento de peso significativo en los pacientes que recibieron glimepirida (-1.39 contra + 1.29 kg).
Linagliptina como tratamiento adicional en pacientes con alteraciones renales graves, datos controlados con placebo de 12 semanas (tratamiento de base sin modificaciones) y periodo de extensión controlado con placebo de 40 semanas (tratamiento de base con ajuste de la dosis): También se evaluó la eficacia y seguridad de linagliptina en DMT2 en pacientes con alteraciones renales graves en un estudio a doble ciego comparado con placebo de 12 semanas de duración, durante el cual los tratamientos de base de control glucémico se mantuvieron sin modificaciones. Los pacientes recibían una variedad de tratamientos de base que incluían insulina, sulfonilurea, glinidas y pioglitazona. El estudio incluyó un periodo de seguimiento de 40 semanas durante el cual se permitió el ajuste de las dosis de la terapia antidiabética de base.
Linaglipitna produjo mejoras significativas de la HbA1c (-0.59% de cambio comparado con placebo) a partir de la HbA1c basal media de 8.2%. Una mayor proporción de pacientes alcanzó la meta de HbA1c de < 7.0%, comparado con placebo. La diferencia de HbA1c observada en comparación con placebo fue de -0.72% después de 52 semanas.
El peso corporal no difirió significativamente entre los grupos. La incidencia de hipoglucemia observada en los pacientes tratados con linagliptina fue mayor que la observada con placebo debido a un aumento en los episodios hipoglucémicos asintomáticos. Esto puede atribuirse a las terapias antidiabéticas de base (insulina y sulfonilurea o glinidas). No se observaron diferencias entre los grupos en los episodios hipoglucémicos serios.
Linagliptina como tratamiento suplementario en los pacientes de edad avanzada (edad ≥ 70 años) con diabetes tipo 2: La eficacia y la seguridad de la linagliptina en los pacientes de edad avanzada (edad ≥ 70 años) con diabetes tipo 2 han sido evaluadas en un estudio de diseño doble ciego frente a un placebo a lo largo de un periodo de 24 semanas. Los pacientes recibieron metformina y/o sulfonilurea y/o insulina como tratamiento de base. Las dosis de medicación antidiabética de base se mantuvieron estables durante las primeras 12 semanas, luego de las cuales se permitieron ajustes. La linagliptina permitió lograr mejorías significativas en los valores de HbA1c, de -0.64% (IC del 95% -0.81, -0.48; p < 0.0001) en comparación con el placebo al cabo de 24 semanas, respecto de un valor basal medio de HbA1c de 7.8%. La linagliptina también evidenció mejoras significativas en los valores de glucosa plasmática en ayunas (GPA), de -20.7 mg/dl (IC del 95% -30.2, -11.2; p < 0.0001) en comparación con el placebo (-1.1 mmol/L). El peso corporal no difirió significativamente entre los grupos. Las tasas de hipoglucemia también fueron comparables en una base de insulina con o sin metformina (13 de 35 pacientes, 37.1% tratados con linagliptina y 6 de 15 pacientes, 40% tratados con placebo). Sin embargo, con una base de sulfonilurea con o sin metformina, se reportó hipoglucemia en proporciones más altas de pacientes tratados con linagliptina (24 de 82 pacientes, 29.3%) comparado con placebo (7 de 42 pacientes, 16.7%). No hubo ninguna diferencia entre los grupos en lo que respecta a los eventos de hipoglucemia grave.
Linagliptina como tratamiento suplementario de un tratamiento antidiabético oral preexistente, a lo largo de 52 semanas, en pacientes japoneses con diabetes tipo 2: La seguridad y la eficacia de la linagliptina fueron evaluadas en un estudio de diseño abierto, de grupos paralelos, en sujetos japoneses con DM2 insuficientemente tratados con un antidiabético oral (biguanida, glinida, glitazona, sulfonilurea [SU] o un inhibidor de la α-glucosidasa [A-GI]).
La linagliptina brindó mejoras estadísticamente significativas en la HbA1c y la GPA respecto del nivel basal en la semana 52 para todos los grupos de tratamiento de base, de un valor medio basal previo de HbA1c de 7.98%. Las reducciones se ubicaron en el rango de -0.91% a -0.70%. La mejoría observada fue del -0.88% en el grupo de biguanida y linagliptina; -0.73% en el grupo de glinida y linagliptina, -0.79% en el grupo de glitazona y linagliptina; -0.70% en el grupo de sulfonilurea y linagliptina; y -0.91% en el grupo de inhibidor de α-glucosidasa y linagliptina. Para la GPA, las reducciones se ubicaron en el rango de entre -12.6 mg/dL/-0.7 mmol/L y -6.0 mg/dL/-0.3 mmol/L. La reducción observada fue -12.6 mg/dL/-0.7 mmol/L en el grupo de biguanida y linagliptina; -9.1 mg/dL/-0.5 mmol/L en el grupo de glinida y linagliptina, -9.8 mg/dL/-0.5 mmol/L en el grupo de glitazona y linagliptina; -6.7 mg/dL/-0.4 mmol/L en el grupo de sulfonilurea y linagliptina; y -6.0 mg/dL/-0.3 mmol/L en el grupo de inhibidor de α-glucosidasa y linagliptina. En lo que respecta al peso corporal, los cambios entre el nivel basal y la Semana 52 no difirieron significativamente para ninguno de los grupos de tratamiento de base.
La linagliptina fue similar a la metformina, sumada a un tratamiento de base con una sulfonilurea, en lo que respecta a la reducción de la HbA1c, con un valor medio de diferencia entre los tratamientos en términos de HbA1c entre el nivel basal y las 52 semanas para la linagliptina en comparación con la metformina de + 0.18%.
La linagliptina fue similar a la metformina, sumada a un tratamiento de base con un inhibidor de la α-glucosidasa, en lo que respecta a la reducción de la HbA1c, con un valor medio de diferencia entre los tratamientos en términos de HbA1c entre el nivel basal y las 52 semanas para la linagliptina en comparación con la metformina de + 0.09%.
Los eventos de hipoglucemia fueron informados infrecuentemente en todos los grupos (5.8%) excepto en el caso de los pacientes que recibían tratamiento de base con una sulfonilurea, y en todos los casos fueron de intensidad leve. La incidencia observada de hipoglucemia se observó principalmente cuando la linagliptina se usó con una sulfonilurea (81%); sin embargo, la frecuencia fue comparable a la observada para la metformina sumada a un régimen de base de una sulfonilurea.
La linagliptina y la combinación inicial con metformina y linagliptina en pacientes sin tratamiento previo recientemente diagnosticados con hiperglucemia marcada: La eficacia y seguridad de la combinación inicial de linagliptina 5 mg una vez al día y metformina dos veces al día (aumenta la dosis en las primeras 6 semanas a 1,500 mg o 2000 mg/d) en comparación con linagliptina 5 mg una vez que se ha estudiado en un ensayo de 24 semanas en recientemente pacientes sin tratamiento previo tratamiento diagnosticado con diabetes mellitus tipo 2 e hiperglucemia marcada (HbA1c basal 8.5 a 12.0%).
Después de 24 semanas tanto la monoterapia con linagliptina así como la combinación inicial de linagliptina y metformina redujo significativamente los niveles de HbA1c por -2.0% y -2.8%, respectivamente, de una línea base HbA1c de 9.9% y 9.8%, respectivamente. La diferencia de tratamiento de -0.8% (IC del 95%: -1.1 a -0.5) mostró la superioridad de la combinación inicial sobre la monoterapia (p < 0.0001). En particular, el 40% y el 61% de los pacientes en los grupos de monoterapia y combinación alcanzaron HbA1c < 7.0%.
Estudio de seguridad cardiovascular y renal con linagliptina (CARMELINA): CARMELINA fue un estudio aleatorizado realizado sobre 6,979 pacientes con diabetes tipo 2, con riesgo cardiovascular elevado, evidenciado por la presencia de antecedentes de enfermedad renal o macrovascular establecida, que habían recibido 5 mg de linagliptina (3,494) o placebo (3,485) agregados al tratamiento protocolar regionalmente establecido para lograr los objetivos de HbA1c, para controlar los factores de riesgo cardiovascular y la enfermedad renal. La población del estudio incluyó 1,211 (17.4%) pacientes ≥ 75 años de edad y 4,348 (62.3%) pacientes con insuficiencia renal. Aproximadamente el 19% de la población tenía una TFGe ≥ 45 y < 60 ml/min/1.73 m2, 28% de la población tenía una TFGe ≥ 30 y < 45 ml/min/1.73 m2 y 15% tenía una TFGe < 30 ml/min/1.73 m2.
La HbA1c media al inicio del estudio fue del 8.0%.
El estudio estuvo diseñado para demostrar la no inferioridad en función del criterio de valoración cardiovascular primario, que era un compuesto de la primera aparición de: o bien muerte cardiovascular, o un infarto de miocardio no mortal (IM), o un accidente cerebrovascular no fatal (3P-MACE). El criterio de valoración compuesto renal se definió como muerte renal o enfermedad renal en etapa terminal sostenida, o disminución sostenida del 40% o en la TFGe.
Después de un seguimiento de 2.2 años (mediana), la linagliptina, agregada al tratamiento estándar, no aumentó el riesgo de eventos cardiovasculares graves o eventos de desenlace renal (Tabla 1 y Figura 1). No hubo un aumento en el riesgo de hospitalización por insuficiencia cardiaca, que fue un criterio de valoración adjudicado adicional observado, en comparación con el tratamiento estándar sin linagliptina en pacientes con diabetes tipo 2 (Tabla 2).
Tabla 1. Eventos adversos graves cardiovaculares (MACE) y eventos de desenlace renal estratificados por grupo de tratamiento en el estudio CARMELINA
|
Linagliptina 5 mg |
Placebo |
Razón de riesgos |
|||
|
Cantidad de sujetos |
Tasa de incidencia por cada 1000 años-paciente* |
Cantidad de sujetos (%) |
Tasa de incidencia por cada 1000 años-paciente* |
(IC del 95%) |
|
|
3494 |
3485 |
||||
|
Compuesto cardiovascular primario (muerte cardiovascular, infarto de miocardio no mortal, accidente cerebrovascular no mortal) |
434 (12.4) |
57.7 |
420 (12.1) |
56.3 |
1.02 (0.89, 1.17)** |
|
Compuesto renal secundario (muerte renal, enfermedad renal terminal, disminución sostenida del 40% de la TFGe) |
327 (9.4) |
48.9 |
306 (8.8) |
46.6 |
1.04 (0.89, 1.22) |
* PY = años-paciente.
** Prueba de no inferioridad para demostrar que el límite superior del IC del 95% para la razón de riesgos instantáneos es menor a 1.3.
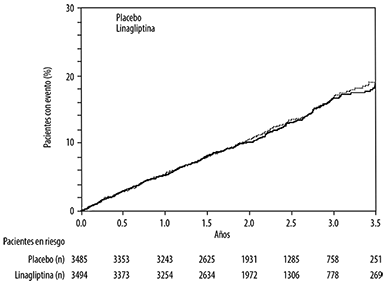
Tabla 2. Hospitalización por insuficiencia cardiaca y mortalidad estratificados por grupo de tratamiento, en el estudio CARMELINA
|
Linagliptina 5 mg |
Placebo |
Razón de riesgos |
|||
|
Cantidad de sujetos (%) |
Tasa de incidencia por cada 1000 años-paciente* |
Cantidad de sujetos (%) |
Tasa de incidencia por cada 1000 años-paciente* |
(IC del 95%) |
|
|
Cantidad de pacientes |
3,494 |
3,485 |
|||
|
Mortalidad por todas las causas |
367 (10.5) |
46.9 |
373 (10.7) |
48.0 |
0.98 (0.84, 1.13) |
|
Muerte cardiovascular |
255 (7.3) |
32.6 |
264 (7.6) |
34 |
0.96 (0.81, 1.14) |
|
Hospitalización por insuficiencia cardiaca |
209 (6.0) |
27.7 |
226 (6.5) |
30.4 |
0.90 (0.74, 1.08) |
* PY = años-paciente.
En los análisis de progresión de la albuminuria (cambio de normoalbuminuria a micro o macroalbuminuria, o de microalbuminuria a macroalbuminuria), la razón de riesgos instantáneos estimada para la linagliptina, en comparación con placebo, fue 0.86 (IC del 95%: 0.78 a 0.95). El criterio de valoración microvascular se definió como el compuesto de muerte renal, enfermedad renal crónica sostenida, reducción sostenida ≥ 50% de la TFGe, progresión de la albuminuria, tratamiento de la retinopatía diabética con fotocoagulación retineana o inyecciones intravítreas de inhibidores del factor de crecimiento endotelial vascular, hemorragia vítrea o ceguera provocada por la diabetes. La razón de riesgos estimada para el tiempo transcurrido hasta la primera aparición del criterio de valoración microvascular compuesto fue 0.86 (IC del 95%: 0.78; 0.95) para la linagliptina, comparada con el placebo, y se debió principalmente a la progresión de la albuminuria.
Estudio de seguridad cardiovascular con linagliptina (CAROLINA): CAROLINA fue un estudio aleatorizado realizado con 6,033 pacientes con diabetes tipo 2 incipiente y con riesgo cardiovascular elevado o complicaciones establecidas, que habían recibido 5 mg de linagliptina (3023) o glimepirida 1-4 mg (3010) agregados al tratamiento estándar (que incluyó un tratamiento de base con metformina en el 83% de los pacientes) establecido regionalmente para lograr los objetivos de HbA1c y los factores de riesgo CV. La edad media de la población del estudio era 64 años e incluyó 2030 (34%) pacientes ≥ 70 años de edad. La población del estudio incluyó 2089 (35%) pacientes con enfermedad cardiovascular y 1130 (19%) pacientes con insuficiencia renal con una TFGe basal < 60 ml/min/1.73 m2. La HbA1c media basal fue del 7.15%.
El estudio estuvo diseñado para demostrar la no inferioridad en función del criterio de valoración cardiovascular primario, que era un compuesto de la primera aparición de muerte por evento cardiovascular, un infarto de miocardio no mortal (IM), o un accidente cerebrovascular no fatal (3P-MACE).
Después de un seguimiento de 6.25 años (mediana), la linagliptina no aumentó el riesgo de eventos cardiovasculares graves (Tabla 3) comparada con la glimepirida. Los resultados fueron consistentes para los pacientes tratados con o sin metformina.
Tabla 3. Eventos adversos cardiovasculares primarios (MACE) y mortalidad por grupo de tratamiento en el estudio CAROLINA
|
Linagliptina 5 mg |
Glimepirida (1-4 mg) |
Razón de riesgos |
|||
|
Cantidad de sujetos (%) |
Tasa de incidencia por cada 1000 PY* |
Cantidad de sujetos (%) |
Tasa de incidencia por cada 1000 PY* |
(IC del 95%) |
|
|
Cantidad de pacientes |
3023 |
3010 |
|||
|
Compuesto CV primario (muerte por evento cardiovascular, IM no mortal, accidente cerebrovascular no mortal) |
356 (11.8) |
20.7 |
362 (12.0) |
21.2 |
0.98 (0.84, 1.14)** |
* PY = años-aciente.
** Prueba de no inferioridad para demostrar que el límite superior del IC del 95% para la razón de riesgos instantáneos es menor a 1.3.
El compuesto de viabilidad del tratamiento, un criterio de valoración secundario, se definió como la proporción de pacientes sometidos al tratamiento del estudio luego del periodo de ajuste inicial (16 semanas) que mantienen el control glucémico (HbA1c ≤ 7.0%) en la visita final sin necesidad de tratamiento adicional con fármacos antidiabéticos (medicación de rescate), sin ningún episodio de hipoglucemia moderado (sintomático con un valor de glucosa ≤ 70 mg/dl) o grave (que requiere asistencia) y sin un incremento de peso de > 2%. Una cantidad más elevada de pacientes en tratamiento con linagliptina (481; 16%) alcanzó este criterio de valoración secundario en comparación con glimepirida (305; 10.2%).
Para todo el periodo de tratamiento (mediana de tiempo en tratamiento de 5.9 años), la tasa de pacientes con hipoglucemia moderada o grave fue de 6.5% con linagliptina frente a 30.9% con glimepirida, el 0.3% de los pacientes experimentó hipoglucemia grave con linagliptina versus el 2.2% con glimepirida.
CONTRAINDICACIONES: Hipersensibilidad al ingrediente activo o a cualquiera de los excipientes.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: Hay información limitada sobre el uso de la linagliptina en mujeres embarazadas. Los estudios realizados en animales no indican efectos dañinos directos e indirectos en lo que respecta a la toxicidad reproductiva.
Como medida de precaución, es preferible evitar el uso de TRAYENTA® durante el embarazo.
Lactancia: Los datos farmacodinámicos/toxicológicos disponibles en animales han mostrado excreción de linagliptina/metabolitos en la leche. Se desconoce si linagliptina se excreta en la leche humana. Se deberá tener precaución cuando se administra TRAYENTA® a madres lactando.
REACCIONES SECUNDARIAS Y ADVERSAS: La seguridad de TRAYENTA® ha sido evaluada en pacientes con DMT2 los cuales en la mayoría de los casos recibieron la dosis diaria de 5 mg.
En el análisis combinado de los estudios controlados con placebo, la frecuencia global de eventos adversos (EA) en los pacientes tratados con placebo fue semejante a la de los tratados con 5 mg de linagliptina (63.4 contra 59.1%).
La descontinuación del tratamiento por EA en los pacientes que recibieron placebo fue más alta en comparación con la de los que recibieron 5 mg de linagliptina (4.3% contra 3.4%).
Debido al impacto de la terapia de trasfondo sobre los eventos adversos (por ejemplo, sobre las hipoglucemias), los eventos adversos fueron analizados con base en los respectivos regímenes de tratamiento (monoterapia, adyuvante a metformina, adyuvante a tiazolidinediona [ligando del PPAR?], adyuvante a sulfonilurea, adyuvante a metformina más sulfonilurea, adyuvante a la insulina y adyuvante a la metformina e inhibidores del SGLT2).
Los estudios controlados con placebo incluyeron 28 estudios donde la linagliptina fue administrada ya fuese como:
- Monoterapia a corto plazo de hasta 4 semanas.
- Monoterapia con duración de ≥ 12 semanas de duración.
- Adicional a metformina.
- Terapia de combinación inicial con pioglitazona.
- Adicional a sulfonilurea.
- Adicional a metformina + sulfonilurea.
- Adicional a insulina (con o sin metformina y/o pioglitazona y/o + sulfonilurea).
- Adicional a metformina y empagliflozina.
El efecto adverso informado con mayor frecuencia fue la hipoglucemia observada con la combinación triple de linagliptina más metformina más sulfonilurea, 22.9% vs. 14.8% con placebo.
En los estudios comparativos con placebo (10.9%; N = 471), las hipoglucemias fueron de intensidad leve (80%; N = 384), moderada (16.6%; N = 78) o grave (1.9%; N = 9). Las reacciones adversas clasificadas de acuerdo con los términos preferidos SOC (Clasificación de los Sistemas Orgánicos) y MedDRA reportados en los pacientes que recibieron 5 mg de TRAYENTA® en los estudios doble ciegos como monoterapia, terapia de combinación inicial o tratamiento adicional en los estudios clínicos y las reacciones adversas identificadas de la experiencia post-comercialización se presentan en la siguiente tabla (ver Tabla 4).
Tabla 4. Reacciones adversas notificadas en pacientes tratados con 5 mg diarios de TRAYENTA®, como monoterapia o tratamiento adicional en estudios clínicos y reacciones adversas identificadas en la experiencia post-comercialización)
|
Terminología según la clasificación por sistema y órganos del MedDRA |
Reacciones adversas a la linagliptina |
|
Infecciones e infestaciones |
Nasofaringitis |
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
|
Angioedema1 |
|
|
Urticaria1 |
|
|
Trastornos del metabolismo y la nutrición |
Hipoglucemia (cuando se usa en combinación con metformina más sulfonilurea) |
|
Hipertrigliceridemia (cuando se usa en combinación con sulfonilurea) |
|
|
Hiperlipidemia (cuando se usa en combinación con pioglitazona) |
|
|
Trastornos respiratorios, torácicos y del mediastino |
Tos |
|
Trastornos gastrointestinales |
Pancreatitis |
|
Estreñimiento (cuando se usa en combinación con insulina) |
|
|
Úlceras bucales1 |
|
|
Enfermedades de piel y tejido subcutáneo |
Exantema1 |
|
Penfigoide ampolloso1,4 |
|
|
Otras exploraciones |
Aumento de peso (cuando se usa en combinación con pioglitazona) |
|
Aumento de la lipasa2 |
|
|
Aumento de la amilasa3 |
1 RMA (reacción adversa medicamentosa) identificada a partir de la experiencia post-comercialización.
2 Basado en los aumentos de lipasa > 3 veces el LSN (límite superior de la normalidad) observado en estudios clínicos.
3 En el estudio CAROLINA que comparó la linagliptina con el fármaco comparador del activo glimepirida (ver la sección Estudios clínicos), el análisis de laboratorio de amilasa presentó aumentos de hasta > 3 veces el LSN en el 0.99% de los pacientes tratados con linagliptina y en el 0.54% de los pacientes tratados con glimepirida.
4 Ver también el estudio de seguridad cardiovascular y renal de linagliptina (CARMELINA) más adelante.
Estudio de seguridad cardiovascular y renal con linagliptina (CARMELINA): En el estudio CARMELINA, se evaluó la seguridad cardiovascular y renal de linagliptina comparada con un placebo en pacientes con diabetes tipo 2 y con un aumento del riesgo cardiovascular evidenciado por la presencia de antecedentes de enfermedad renal o macrovascular establecida (ver la sección Estudios clínicos). Se incluyeron en el estudio 3494 pacientes tratados con linagliptina (5 mg) y 3485 pacientes tratados con placebo. Ambos tratamientos se agregaron al tratamiento estándar empleado para alcanzar la meta de HbA1c, según los criterios regionales, y controlar los factores de riesgo cardiovascular. Al inicio del estudio, 57% de los pacientes recibían insulina, 54% metformina y 32%, una sulfonilurea. La incidencia global de eventos adversos y eventos adversos graves en pacientes que recibieron linagliptina fue similar a la de los pacientes que recibieron placebo. Los datos de seguridad de este estudio estaban en línea con el perfil de seguridad conocido anterior de linagliptina.
En la población tratada, se informaron eventos hipoglucémicos graves (que requirieron asistencia) en 3.0% de los pacientes tratados con linagliptina y en 3.1% de los pacientes tratados con placebo. Entre los pacientes que estaban recibiendo, una paciente que estaba recibiendo insulina al inicio del estudio, la incidencia de la hipoglucemia grave fue 4.4% con linagliptina y 4.9% con placebo.
En el periodo de observación total del estudio, se notificaron eventos adjudicados como pancreatitis aguda en 0.3% de los pacientes tratados con linagliptina y en 0.1% de los pacientes tratados con placebo.
En el estudio CARMELINA, se informó penfigoide ampolloso en 0.2% de los pacientes tratados con linagliptina y en ningún paciente tratado con placebo.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Carcinogenicidad: Se llevó a cabo un estudio de carcinogenicidad de dos años en ratas machos y hembras que recibieron dosis orales de linagliptina de 6, 18 y 60 mg/kg/día. Con las dosis de hasta 60 mg/kg/día no hubo aumentos en la frecuencia de tumores en ningún órgano. Esta dosis resulta en exposiciones de aproximadamente 418 veces la exposición humana con la máxima dosis humana adulta diaria recomendada (MDAR) de 5 mg/día con base en las comparaciones del ABC. Se llevó a cabo un estudio de carcinogenicidad de dos años en ratones machos y hembras que recibieron dosis orales de 8, 25 y 80 mg/kg/día. No hubo evidencia de potencial carcinogénico con las dosis de hasta 80 mg/kg/día, que corresponde a aproximadamente 242 veces la exposición humana con la MDAR.
Genotoxicidad: Linagliptina no causó mutagénesis ni clastogénesis con o sin activación metabólica en el ensayo de mutagénesis bacteriana de Ames, una prueba de aberraciones cromosómicas en linfocitos humanos y un ensayo de micronúcleos in vivo.
Toxicidad reproductiva: En los estudios de fertilidad en ratas con dosis administradas por intubación oral forzada de 10, 30 y 240 mg/kg/día, los machos fueron tratados durante 4 semanas antes del apareamiento y durante el apareamiento; las hembras fueron tratadas durante 2 semanas antes del apareamiento hasta el día 6 de la gestación, inclusive. No se observaron efectos adversos sobre el desarrollo embrionario inicial, el apareamiento, la fertilidad y la parturición de crías vivas con las dosis de hasta 240 mg/kg/día (aproximadamente 943 veces la exposición humana recomendada para los seres humanos adultos según las ABC comparativas.
En los estudios sobre el desarrollo embriofetal en ratas y conejos, se demostró que linagliptina no fue teratogénica en dosis de hasta 240 mg/kg/día inclusive (943 veces la MDAR) en la rata y 150 mg/kg/día (1,943 veces la MDAR) en el conejo.
Se observaron concentraciones sin efectos adversos observados (CSEAO) correspondientes a dosis de 30 mg/kg/día (49 veces la MDAR) y 25 mg/kg (78 veces la MDAR) en lo que respecta a la toxicidad embriofetal en la rata y el conejo, respectivamente.
Fertilidad: No se han hecho estudios de los efectos de TRAYENTA® sobre la fertilidad humana. No se observaron efectos adversos sobre la fertilidad en animales tratados con dosis tan altas como de 240 mg/kg/día (aproximadamente 943 veces la exposición humana basada en las comparaciones del ABC).
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones farmacocinéticas:
Evaluaciones in vitro de las interacciones medicamentosas: Linagliptina es un inhibidor competitivo débil a moderado de la isoenzima del CYP CYP3A4, pero no inhibe otras isoenzimas del CYP. No es un inductor de isoenzimas del CYP.
Linagliptina es un sustrato de la glucoproteína P (P-gp) e inhibe el transporte de digoxina mediado por la glucoproteína P con baja potencia. Con base en estos resultados y los estudios de interacción medicamentosa in vivo, se considera improbable que linagliptina cause interacciones con otros sustratos de la P-gp.
Evaluación in vivo de las interacciones medicamentosas: Los datos clínicos descritos a continuación sugieren que el riesgo de interacciones clínicamente significativas con los productos medicinales coadministrados es bajo. No se observaron interacciones clínicamente significativas que requirieran ajuste de la dosis. La linagliptina no tuvo efectos clínicamente relevantes sobre la farmacocinética de la metformina, glibenclamida, simvastatina, pioglitazona, warfarina, digoxina o anticonceptivos orales, lo cual proporciona evidencia in vivo de una baja propensión a causar interacciones medicamentosas con sustratos de CYP3A4, CYP2C9, CYP2C8, glucoproteína P y el transportador catiónico orgánico (TCO).
Metformina: La coadministración de dosis repetidas tres veces al día de 850 mg de metformina con una dosis supraterapéutica de 10 mg de linagliptina una vez al día no alteró de manera clínicamente significativa la farmacocinética de la linagliptina o la metformina en voluntarios sanos. Por lo tanto, la linagliptina no es un inhibidor del transporte mediado por el TCO.
Sulfonilureas: Los parámetros farmacocinéticos en estado estable de 5 mg de linagliptina no fueron alterados por la coadministración de una sola dosis de 1.75 mg de glibenclamida (gliburida) y dosis orales repetidas de 5 mg de linagliptina. Sin embargo, hubo una reducción clínicamente no relevante de 14% tanto en el área bajo la curva (ABC) como en la concentración máxima (Cmáx) de la glibenclamida. Como la glibenclamida es metabolizada principalmente por CYP2C9, estos datos también apoyan la conclusión de que la linagliptina no es un inhibidor de CYP2C9. No se esperarían interacciones clínicamente significativas con otras sulfonilureas (por ejemplo, glipizida, tolbutamida y glimepirida) las cuales, igual que la glibenclamida, son eliminadas principalmente por la isoenzima CYP2C9.
Tiazolidinedionas: La coadministración de dosis diarias repetidas de 10 mg de linagliptina (supraterapéuticas) con dosis diarias repetidas de 45 mg de pioglitazona, un sustrato de CYP2C8 y CYP3A4, no tuvo efectos clínicamente relevantes sobre la farmacocinética ya fuese de la linagliptina o la pioglitazona ni sobre los metabolitos activos de la pioglitazona, lo cual indica que linagliptina no es un inhibidor del metabolismo mediado por la isoenzima CYP2C8 in vivo y respalda la conclusión de que la inhibición in vivo de CYP3A4 por la linagliptina es insignificante.
Ritonavir: Se llevó a cabo un estudio para evaluar el efecto del ritonavir, un potente inhibidor de la glucoproteína P y la isoenzima CYP3A4, sobre la farmacocinética de la linagliptina. La coadministración de una sola dosis oral de 5 mg de linagliptina y dosis orales repetidas de 200 mg de ritonavir aumentaron el ABC y la Cmáx. de la linagliptina aproximadamente dos y tres veces, respectivamente. Las simulaciones de las concentraciones plasmáticas en estado estable de linagliptina con y sin ritonavir indicaron que el aumento de la exposición no estará asociado con un aumento de la acumulación. Estos cambios en la farmacocinética de la linagliptina no se consideraron clínicamente relevantes. Por lo tanto, no se esperarían interacciones clínicamente relevantes con otros inhibidores de la glucoproteína P/CYP3A4 y no se requiere ajuste de la dosis.
Rifampicina: Se llevó a cabo un estudio para evaluar el efecto de la rifampicina, un potente inductor de la glucoproteína P y de CYP3A4, sobre la farmacocinética de 5 mg de linagliptina. La coadministración repetida de linagliptina con rifampicina resultó en decrementos de 39.6% y 43.8% del ABC y la Cmáx en estado estable de linagliptina y un decremento de aproximadamente 30% de la inhibición de la dipeptidil peptidasa 4 (DPP-4) en concentraciones basales. Por lo tanto, se espera que linagliptina en combinación con inductores potentes de la P-gp sea clínicamente eficaz, aunque podría no lograrse la eficacia completa.
Digoxina: La coadministración de dosis diarias repetidas de 5 mg de linagliptina con dosis repetidas de 0.25 mg de digoxina no tuvo efectos sobre la farmacocinética de la digoxina en voluntarios sanos. Por lo tanto, linagliptina no es un inhibidor del transporte mediado por la glucoproteína P in vivo.
Warfarina: Las dosis diarias repetidas de 5 mg de linagliptina no alteraron la farmacocinética de la S-warfarina y la R-warfarina, un sustrato de CYP2C9, lo cual demuestra que linagliptina no es un inhibidor de la isoenzima CYP2C9.
Simvastatina: Las dosis diarias repetidas de 10 mg de linagliptina (supraterapéuticas) tuvieron un efecto mínimo sobre la farmacocinética en estado estable de la simvastatina, un sustrato sensible de la isoenzima CYP3A4, en voluntarios sanos. Después de la administración de 10 mg de linagliptina concomitantemente con 40 mg de simvastatina diariamente durante 6 días, el ABC plasmática de la simvastatina aumentó en 34%, y la Cmáx plasmática aumentó en 10%. Por lo tanto, se considera que linagliptina es un inhibidor débil del metabolismo mediado por la isoenzima CYP3A4, y se considera innecesario el ajuste de la dosis de las sustancias administradas concomitantemente metabolizados por la isoenzima CYP3A4.
Anticonceptivos orales: La coadministración con 5 mg de linagliptina no alteró la farmacocinética en estado estable del levonorgestrel o el etinilestradiol.
La biodisponibilidad absoluta de linagliptina es de aproximadamente 30%. Debido a que la coadministración de una comida con alto contenido de grasa con linagliptina no tuvo efectos clínicamente relevantes sobre la farmacocinética, linagliptina puede administrarse con o sin alimentos.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: No se han reportado cambios clínicamente significativos en los parámetros de laboratorio y de ECG.
PRECAUCIONES GENERALES:
Generales: TRAYENTA® no debe usarse en pacientes con diabetes Tipo 1 o para el tratamiento de la cetoacidosis diabética.
Pancreatitis: Se ha observado pancreatitis aguda en pacientes que estaban tomando linagliptina. Ante la sospecha de pancreatitis debe suspenderse la administración de TRAYENTA®.
Hipoglucemia: Linagliptina como monoterapia mostró una incidencia de hipoglucemia comparable a la del placebo.
En los estudios clínicos de linagliptina como parte de una terapia de combinación con agentes no conocidos como causantes de hipoglucemia (metformina, tiazolidinedionas) las tasas de hipoglucemia reportadas con linagliptina fueron semejantes a las tasas en los pacientes que tomaban placebo.
Se sabe que las sulfonilureas causan hipoglucemia. Por lo tanto, se recomienda precaución cuando se use linagliptina en combinación con una sulfonilurea. Puede ser necesario considerar una reducción de la dosis de la sulfonilurea.
Penfigoide ampolloso: Se ha observado casos penfigoide ampolloso en pacientes que toman linagliptina. Si se sospecha de penfigoide ampolloso, el tratamiento con TRAYENTA® debe interrumpirse.
Efectos sobre la capacidad de conducir y utilizar maquinarias: No se han estudiado los efectos sobre la capacidad para conducir vehículos y operar maquinaria.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Oral.
Adultos: La dosis recomendada es de 5 mg una vez al día. TRAYENTA® puede tomarse con o sin alimentos en cualquier hora del día.
Cuando la linagliptina se añade a metformina debe mantenerse la dosis de metformina y administrar linagliptina de forma concomitante.
Cuando linagliptina se usa en combinación con sulfonilureas o insulina puede considerarse la dosis más baja de sulfonilureas o insulina para reducir el riesgo de hipoglucemia.
Deterioro renal: No se requiere ajuste de la dosis para los pacientes con alteraciones renales.
Deterioro hepático: No se requiere ajuste de la dosis para los pacientes con alteraciones hepáticas.
Pacientes de edad avanzada: No se requiere ajuste de la dosis.
Niños y adolescentes: TRAYENTA® no se recomienda para uso en niños menores de 18 años de edad debido a la falta de datos sobre su seguridad y eficacia.
Dosis omitida: Si se omite una dosis, debe tomarse tan pronto como lo recuerde el paciente. No debe tomarse una dosis doble el mismo día.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Síntomas: Durante los estudios clínicos controlados en personas sanas, las dosis únicas de hasta 600 mg de linagliptina (equivalentes a 120 veces la dosis recomendada) fueron bien toleradas. No hay experiencia con las dosis de más de 600 mg en los humanos.
Tratamiento: En caso de una sobredosis, es razonable emplear las medidas habituales de apoyo, por ejemplo, eliminar el material no absorbido del tracto gastrointestinal, emplear monitoreo clínico e instituir las medidas clínicas que sean necesarias.
PRESENTACIONES: Caja con 10 o 30 tabletas de 5 mg.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a no más de 25 °C.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Su venta requiere receta médica. No se deje al alcance de los niños. No se use durante el embarazo o lactancia. No se use en diabetes tipo 1. No se recomienda su uso en menores de 18 años.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx y
farmacovigilancia.mex@boehringer-ingelheim.com
BOEHRINGER INGELHEIM PROMECO, S.A. de C.V.
Calle del Maíz No. 49, Col. Barrio Xaltocan,
C.P. 16090, Xochimilco, Ciudad de México, México.
Reg. Núm. 159M2011 SSA
®Marca registrada