
KOMBIGLYZE XR
METFORMINA, SAXAGLIPTINA
Tabletas
1 Caja,14 Tabletas,5/500 mg/mg
1 Caja,28 Tabletas,5/500 mg/mg
1 Caja,56 Tabletas,5/500 mg/mg
1 Caja,14 Tabletas,5/1000 mg/mg
1 Caja,28 Tabletas,5/1000 mg/mg
1 Caja,56 Tabletas,5/1000 mg/mg
1 Caja,28 Tabletas,2.5/1000 mg/mg
1 Caja,56 Tabletas,2.5/1000 mg/mg
FORMA FARMACÉUTICA Y FORMULACIÓN:
Clorhidrato de metformina de liberación prolongada.
Cada TABLETA contiene:
|
Clorhidrato de saxagliptina equivalente a de saxagliptina |
2.5 mg |
5.0 mg |
5.0 mg |
|
Clorhidrato de metformina |
1,000.0 mg |
1,000.0 mg |
500.0 mg |
|
Excipiente, c.b.p. |
1 tableta |
1 tableta |
1 tableta |
INDICACIONES TERAPÉUTICAS: KOMBIGLYZE® XR está indicado como terapia complementaria a la dieta y el ejercicio para mejorar el control glucémico en pacientes con diabetes mellitus tipo 2, cuando la terapia con saxagliptina y metformina es apropiada.
FARMACOCINÉTICA Y FARMACODINAMIA:
Mecanismo de acción: KOMBIGLYZE® XR combina dos agentes antihiperglucémicos con mecanismos de acción complementaria para mejorar tanto la glucosa plasmática en ayuno (GPA) como la glucosa plasmática postprandial (GPP) en pacientes con diabetes tipo 2: saxagliptina, un inhibidor DPP4 y clorhidrato de metformina, un miembro de la clase de las biguanidas.
Saxagliptina: Saxagliptina es un inhibidor de la enzima dipeptidilpeptidasa 4 (DPP-4) muy potente, selectivo, reversible y competitivo. Saxagliptina demuestra ser selectiva para DPP4 versus otras enzimas DPP, incluyendo DPP8 y DPP9. Saxagliptina tiene una unión extendida al sitio activo de la DPP4 que prolonga la inhibición de la DPP4.
Saxagliptina ejerce su acción en pacientes con diabetes tipo 2, reduciendo la inactivación de las hormonas incretinas, incluyendo el péptido-1 similar al glucagón (GLP-1) y el polipéptido insulinotrópico dependiente de glucosa (GIP). Las concentraciones de estas hormonas incretinas activas intactas aumentan con saxagliptina, por lo tanto, aumentan y prolongan la acción de estas hormonas.
Las hormonas incretinas son liberadas por el intestino a lo largo del día y sus concentraciones aumentan en respuesta a los alimentos. Estas hormonas son inactivadas rápidamente por la enzima DPP4. Las incretinas son parte de un sistema endógeno involucrado en la regulación fisiológica de la homeostasis de la glucosa. Cuando las concentraciones de glucosa sanguínea están elevadas, GLP-1 y GIP aumentan la síntesis y la liberación de insulina a partir de las células beta del páncreas. GLP-1 también disminuye la secreción de glucagón de las células alfa del páncreas, provocando la reducción en la producción de la glucosa hepática.
Las concentraciones de GLP-1 están reducidas en los pacientes con diabetes tipo 2, pero saxagliptina incrementa GLP-1 y GIP activos, potencializando estos mecanismos. Al aumentar y prolongar las concentraciones de las incretinas activas, saxagliptina aumenta la liberación de insulina y disminuye las concentraciones de glucagón en la circulación de una manera dependiente de la glucosa.
Saxagliptina mejora el control glucémico reduciendo las concentraciones de glucosa durante el ayuno y postprandial en pacientes con diabetes tipo 2 al mejorar la función de las células alfa y beta como se refleja por las acciones descritas más adelante.
– Secreción de insulina en ayuno dependiente de la glucosa: Saxagliptina aumenta la respuesta de las células beta del páncreas a la glucosa durante el ayuno y provoca un aumento en la secreción de insulina y la eliminación de la glucosa en presencia de concentraciones elevadas de glucosa.
– Secreción de insulina postprandial dependiente de glucosa: Saxagliptina aumenta la respuesta de las células beta del páncreas a la glucosa durante el estado postprandial y provoca una mayor secreción de insulina y mejora la disposición de glucosa.
– Secreción postprandial de glucagón: En la diabetes tipo 2, los incrementos paradójicos en la secreción del glucagón a partir de las células alfa después de los alimentos estimula la producción de glucosa hepática y contribuye al desequilibrio glucémico. Saxagliptina modera la secreción de glucagón y disminuye las concentraciones postprandiales de glucagón.
Clorhidrato de metformina: Metformina es un agente antihiperglucémico que mejora la tolerancia a la glucosa en pacientes con diabetes tipo 2, disminuyendo la glucosa plasmática basal y postprandial. Metformina disminuye la producción de la glucosa hepática, disminuye la absorción intestinal de la glucosa y mejora la sensibilidad a la insulina, aumentando la captación de glucosa periférica y su utilización. A diferencia de las sulfonilureas, metformina no produce hipoglucemia ni en pacientes con diabetes tipo 2 o sujetos normales (excepto en circunstancias especiales, véase Precauciones generales) y no produce hiperinsulinemia. Con el tratamiento con metformina, la secreción de insulina permanece sin cambios, mientras que los niveles de insulina en ayuno y la respuesta a la insulina durante el día pueden estar disminuidos.
Farmacodinamia:
Mejora en el control glucémico:
Saxagliptina: En los pacientes con diabetes tipo 2, la administración de saxagliptina produce una inhibición de la actividad enzimática DPP4 durante un periodo de 24 horas. Después de una carga de glucosa oral o un alimento, se provoca una inhibición de la DPP4 que resulta en un aumento de 2 a 3 veces los niveles circulantes del GLP-1 y de GIP activos, disminuyendo las concentraciones de glucagón y aumentando la respuesta de las células beta dependientes de glucosa, lo cual resulta en una mayor concentración de insulina y del péptido-C. El aumento en la insulina y la disminución del glucagón estuvieron asociadas con una reducción en las concentraciones de glucosa en ayuno y una reducción en la excursión de glucosa posterior a una carga oral de glucosa o de la ingesta de un alimento.
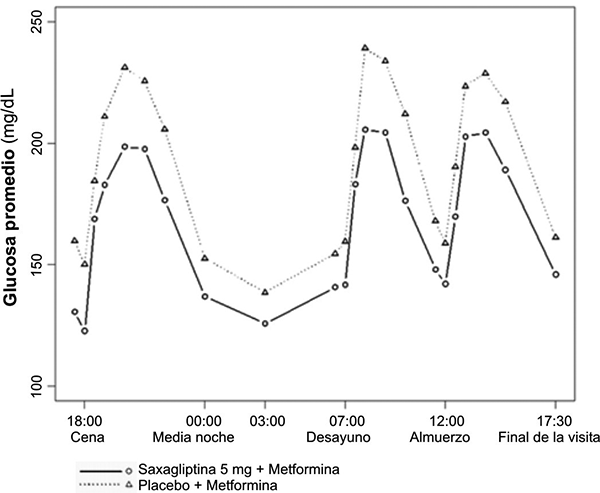
El tratamiento con saxagliptina 5 mg y metformina de liberación prolongada administrados una vez al día, junto con los alimentos vespertinos durante 4 semanas, produce reducciones significativas en la concentración promedio de glucosa durante 24 horas (definido como un Área Bajo la Curva de glucosa por 24 horas dividida en 24 horas) al compararse con placebo más metformina de liberación prolongada (reducción promedio de placebo-corregido de -16.8 mg/dL; p = 0.0001) con mejoría consistente en los valores de glucosa plasmática medidos a través de un intervalo de dosificación de 24 horas (figuras 1 y 2). Se observaron reducciones importantes en la glucosa postprandial de 2 horas y en las concentraciones plasmáticas de glucosa en ayuno en un promedio de 2 días (promedio de reducciones corregidas de placebo de -35.4 mg/dL; p = 0.0010 y -15.3 mg/dL; p = 0.0002, respectivamente).
Figura 1. Perfil de glucosa durante 24 horas-valor basal
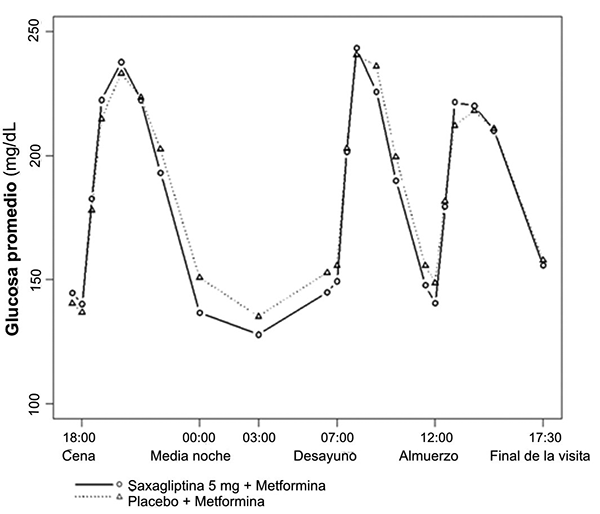
Figura 2. Perfil de glucosa durante 24 horas-semana 4
Electrofisiología cardiaca:
Saxagliptina: En un estudio clínico diseñado para estudiar el efecto de saxagliptina en el intervalo QTc, la administración de saxagliptina a dosis hasta de 40 mg (8 veces la dosis recomendada para uso en humanos [RHD]) no estuvo relacionada con la prolongación clínicamente importante del intervalo QTc ni con la frecuencia cardiaca . En un estudio aleatorizado, doble ciego, controlado con placebo, cruzado de cuatro vías, con comparador activo, se administró a 40 sujetos sanos dosis de saxagliptina hasta 40 mg, placebo una vez al día durante cuatro días, o una dosis única de moxifloxacina 400 mg como control positivo. Después de la dosis de 40 mg, el aumento máximo con placebo en el promedio de los cambios corregidos en el intervalo QTc y la frecuencia cardiaca inicial fue de 2.4 msec a 24 horas después de la dosis y de 4.5 latidos por minuto a las 4 horas después de la dosis, respectivamente.
Farmacocinética: Los resultados de los estudios de bioequivalencia en sujetos sanos demostraron que KOMBIGLYZE® XR Tabletas combinadas, son bioequivalentes a la coadministración de las dosis correspondientes de las tabletas individuales de saxagliptina (Onglyza®) y de clorhidrato de metformina de liberación prolongada.
Saxagliptina: La farmacocinética de saxagliptina ha sido caracterizada ampliamente en sujetos sanos y pacientes con diabetes tipo 2. Saxagliptina se absorbe rápidamente después de la administración oral con concentraciones plasmáticas máximas de saxagliptina (Cmáx.) que se logran generalmente dentro de las dos horas siguientes a la administración en ayuno. La Cmáx. y los valores del AUC (Área Bajo la Curva) aumentan proporcionalmente al incrementar la dosis de saxagliptina. Después de una dosis oral única de 5 mg de saxagliptina en sujetos sanos, los valores plasmáticos promedio del AUC(INF) (Área Bajo la Curva de concentración tiempo desde el tiempo cero hasta el infinito) para saxagliptina y su principal metabolito fueron 78 ng•h/mL y 214 ng•h/mL, respectivamente. Los valores plasmáticos correspondientes a la Cmáx. plasmática fueron de 24 ng/mL y 47 ng/mL, respectivamente. Los coeficientes de variación intrasujetos para la Cmáx. y el AUC de saxagliptina fueron menores de 12%.
Después de una dosis oral única de 5 mg de saxagliptina a sujetos sanos, el promedio plasmático de la vida media terminal (t½) para saxagliptina fue de 2.5 horas y el valor promedio t½ para la inhibición plasmática de la DPP4 fue de 27 horas. La inhibición de la actividad plasmática de DPP4 para saxagliptina durante por lo menos 24 horas después de la administración oral de saxagliptina se debe a la elevada potencia, gran afinidad y extensa unión al sitio activo. No se observó acumulación considerable con la dosis repetida una vez al día en cualquier nivel de dosis. No se observó dependencia de la dosis ni del tiempo en la depuración de saxagliptina y su principal metabolito en los 14 días de administración una vez al día de saxagliptina a dosis que variaron de 2.5 mg a 400 mg. Los resultados de la población basados en el modelo de exposición sugieren que la farmacocinética de saxagliptina y su principal metabolito fueron similares en sujetos sanos y en pacientes con diabetes tipo 2.
Clorhidrato de metformina: La Cmáx. de metformina de liberación prolongada es alcanzada con un valor medio de 7 horas. El grado de absorción de metformina de la tableta de liberación prolongada se ve aumentada en aproximadamente 50% cuando se administra con los alimentos. En el estado de equilibrio, el AUC y la Cmáx. son menores que la dosis proporcional para metformina de liberación prolongada dentro de un rango de 500 a 2,000 mg. Después de la administración repetida de metformina de liberación prolongada, metformina no se acumula en el plasma. Metformina se excreta sin cambios por la orina y no sufre metabolismo hepático.
Absorción:
Saxagliptina: Saxagliptina puede administrarse con o sin alimentos. La cantidad de saxagliptina absorbida después de una dosis oral es por lo menos de 75%. Los alimentos tienen efectos relativamente discretos sobre la farmacocinética de saxagliptina en sujetos sanos. La administración con alimentos elevados en grasa no produce cambios en la Cmáx. de saxagliptina y un incremento de 27% en el AUC comparativamente con el estado en ayuno. El tiempo necesario para que saxagliptina alcance una Cmáx. (Tmáx.) aumentó en aproximadamente 0.5 horas con alimentos en comparación con el ayuno. Estos cambios no se consideraron clínicamente significativos.
Clorhidrato de metformina: Después de una dosis oral única de metformina de liberación prolongada, la Cmáx. se alcanza con un valor medio de 7 horas y en un rango de 4 a 8 horas. En el estado estable, el AUC y la Cmáx. son menores que la dosis proporcional de metformina de liberación prolongada dentro del rango de 500 a 2,000 mg administrados una vez al día. Los máximos niveles plasmáticos son aproximadamente de 0.6, 1.1, 1.4, y 1.8 µg/mL para dosis de 500, 1,000, 1,500 y 2,000 mg una vez al día, respectivamente. A pesar de que el grado de absorción de metformina es importante (como demostró el AUC) a partir de la tableta con metformina de liberación prolongada, ésta aumenta en aproximadamente 50% cuando se administra con alimentos; no hay efectos de los alimentos sobre la Cmáx. y Tmáx. de metformina. Tanto los alimentos con alto o bajo contenido de grasa tienen el mismo efecto sobre la farmacocinética de metformina de liberación prolongada.
Después de la dosis oral de metformina, el Tmáx. es alcanzado en 2.5 horas. La biodisponibilidad absoluta de metformina tabletas de 500 mg administradas en condiciones de ayuno es aproximadamente de 50 a 60%. Los estudios empleando una dosis oral única de metformina de 500 a 1,500 mg y de 850 a 2,550 mg, indican que no existe proporcionalidad de la dosis con el incremento de la dosificación, lo cual se debe a la absorción disminuida más que a una alteración en la eliminación. Los alimentos disminuyen el grado y retrasan ligeramente la absorción de metformina, como se muestra en aproximadamente 40% del promedio inferior de la Cmáx., 25% inferior a la concentración plasmática del Área Bajo la Curva versus el tiempo (AUC) y una prolongación de 35 minutos del tiempo de la concentración plasmática máxima, seguida de la administración de una sola tableta de 850 mg de metformina con alimentos, en comparación con la misma concentración de tabletas administradas en ayuno. Se desconoce la importancia clínica de estas disminuciones.
Distribución:
Saxagliptina: La unión a proteínas in vitro de saxagliptina y su principal metabolito en el suero humano es inferior a los niveles detectables. Así que, no es de esperarse que los cambios en los niveles sanguíneos de proteínas en varios estadios de la enfermedad (insuficiencia renal o hepática) alteren la disposición de saxagliptina.
Clorhidrato de metformina: No se han hecho estudios de distribución con metformina de liberación prolongada; sin embargo, el volumen aparente de distribución (V/F) después de dosis orales únicas de metformina de liberación inmediata de 850 mg promediadas 654 ± 358 L, metformina se une de forma insignificante a las proteínas plasmáticas, en contraste con las sulfonilureas, que se unen a las proteínas en más de 90%. Metformina se distribuye dentro de los eritrocitos, muy probablemente en función del tiempo.
Metabolismo:
Saxagliptina: El metabolismo de saxagliptina está mediado principalmente por el citocromo P-450 3A4/5 (CYP3A4/5). El principal metabolito de saxagliptina también es un inhibidor selectivo de la DPP4, reversible y competitivo, la mitad de potente que saxagliptina.
Clorhidrato de metformina: Los estudios a dosis única por vía intravenosa en sujetos normales demostraron que metformina es excretada sin cambios en la orina y que no sufre metabolismo hepático (no se han identificado metabolitos en humanos) ni se excreta por la bilis. No se han realizado estudios del metabolismo con tabletas de metformina de liberación prolongada.
Excreción:
Saxagliptina: Saxagliptina es eliminada tanto por vía renal como hepática. Después de una dosis única de 50 mg de 14C saxagliptina, 24, 36 y 75% de la dosis fue excretada en la orina como saxagliptina, su principal metabolito y la radiactividad total, respectivamente. La depuración renal promedio de saxagliptina (~230 mL/min) fue mayor que el promedio estimado de la tasa de filtración glomerular (~120 mL/min), sugiriendo alguna excreción renal activa. Para el metabolito principal, los valores de depuración renal fueron comparables con la tasa de filtración glomerular estimada. Un total de 22% de la radiactividad administrada se recuperó en las heces representando la fracción de la dosis de saxagliptina excretada en la bilis y/o medicamento no absorbido por el tracto gastrointestinal.
Clorhidrato de metformina: La depuración renal es aproximadamente 3.5 veces mayor que la depuración de creatinina, lo que indica que la secreción tubular es la principal vía de eliminación de metformina. Después de la administración oral, aproximadamente 90% del medicamento absorbido se elimina a través de la vía renal dentro de las primeras 24 horas, con una vida media de eliminación plasmática de aproximadamente 6.2 horas. La vida media de eliminación en sangre es de aproximadamente 17.6 horas, sugiriendo que la masa eritrocitaria puede ser un compartimiento en la distribución.
Farmacocinética del metabolito principal:
Saxagliptina: Los valores de Cmáx. y AUC del metabolito principal de saxagliptina aumentaron proporcionalmente al incrementar la dosis de saxagliptina. Después de las dosis orales únicas de 2.5 mg a 400 mg de saxagliptina con los alimentos o en ayuno, los valores promedio de AUC del metabolito principal variaron desde 2 y 7 veces más que las exposiciones originales de saxagliptina sobre base molar. Después de una dosis oral única de 10 mg de saxagliptina en estado de ayuno, la vida media terminal promedio (t½) para el metabolito principal fue de 3.1 horas y no se observó una acumulación importante hasta la nueva administración una vez al día de cualquier dosis.
Poblaciones especiales:
Insuficiencia renal: KOMBIGLYZE® XR no debe administrarse a pacientes con insuficiencia renal (véase Contraindicaciones y Precauciones generales).
– Saxagliptina: Se realizó un estudio de dosis única, abierto, para evaluar la farmacocinética de saxagliptina (dosis 10 mg) en sujetos con diverso grado de enfermedad renal crónica (ERC) en comparación con sujetos con función renal normal.
El grado de ERC no afectó la Cmáx. de saxagliptina ni de su principal metabolito. En sujetos con ERC moderada, los valores del AUC de saxagliptina y su principal metabolito fueron 1.2 y 1.7 veces mayores, respectivamente, que los valores de AUC en sujetos con función renal normal.
Debido a que los incrementos de esta magnitud no son clínicamente relevantes, el ajuste de la dosis en pacientes con ERC leve no es recomendado. Saxagliptina se elimina mediante hemodiálisis.
– Clorhidrato de metformina: En los pacientes con disminución de la función renal (basados en las mediciones de depuración de creatinina), la vida media de metformina plasmática y hemática se prolonga y la depuración renal está disminuida en proporción a la disminución en la depuración de creatinina.
Insuficiencia hepática:
– Saxagliptina: No hubo diferencias clínicamente significativas en la farmacocinética de los sujetos con daño hepático leve, moderado o severo, por lo tanto, no se recomienda ajustar la dosis de saxagliptina en pacientes con insuficiencia hepática. En sujetos con insuficiencia hepática (clasificación Child-Pugh A, B, y C), la Cmáx. promedio y el AUC de saxagliptina fueron hasta de 8 y 77% mayores, respectivamente, comparados con controles sanos pareados después de la administración de una sola dosis de 10 mg de saxagliptina. La Cmáx. y el AUC correspondientes al principal metabolito fueron hasta 59 y 33% menores, respectivamente, comparados con los controles sanos. Estas diferencias no se consideraron clínicamente relevantes.
– Clorhidrato de metformina: No se han realizado estudios farmacocinéticos de metformina en pacientes con insuficiencia hepática.
Índice de masa corporal:
– Saxagliptina: No se recomienda ajustar la dosis basándose en el índice de masa corporal (IMC). El IMC no ha sido identificado como una covarianza significativa sobre la aparente depuración de saxagliptina o su principal metabolito en un análisis modelo de exposición.
Pacientes geriátricos:
– Saxagliptina: No se recomienda ajustar la dosis de saxagliptina basándose solamente en la edad. Los sujetos de edad avanzada (65-80 años) tuvieron valores 23 y 59% más altos de la media geométrica de la Cmáx. y del AUC, respectivamente, que los originales con saxagliptina en sujetos más jóvenes (18-40 años). Las diferencias farmacocinéticas del metabolito principal entre sujetos de edad avanzada y jóvenes generalmente reflejan las diferencias observadas en la farmacocinética original de saxagliptina. La diferencia entre la farmacocinética de saxagliptina y el metabolito principal en sujetos jóvenes y de edad avanzada, parece deberse a múltiples factores incluyendo la declinación del funcionamiento renal y la capacidad metabólica con el aumento de edad. La edad no fue identificada como una covarianza significativa sobre la depuración aparente de saxagliptina y su principal metabolito durante el análisis del modelo de exposición.
– Clorhidrato de metformina: Los limitados datos de estudios farmacocinéticos controlados de metformina en sujetos de edad avanzada sanos sugieren que la depuración plasmática total de metformina está disminuida, la vida media se prolonga y existe aumento en la Cmáx., comparativamente con sujetos jóvenes sanos. De estos datos, parece ser que el cambio en la farmacocinética de metformina con el envejecimiento acontece principalmente por los cambios en el funcionamiento renal.
Pacientes pediátricos y adolescentes:
– Saxagliptina: No ha sido estudiada la farmacocinética de la población pediátrica.
– Clorhidrato de metformina: Después de la administración oral única de metformina tabletas de 500 mg con los alimentos, la media geométrica de la Cmáx. y el AUC de metformina difirió menos de 5% entre los pacientes pediátricos con diabetes tipo 2 (12-16 años de edad) y adultos sanos de mismo sexo y peso (20-45 años de edad), todos con función renal normal.
Sexo:
– Saxagliptina: No se recomienda ajustar la dosis en base al sexo. No se observaron diferencias en la farmacocinética de saxagliptina entre hombres y mujeres. Comparativamente con los hombres, las mujeres tuvieron valores de exposición 25% mayor aproximadamente para el metabolito principal que los varones, pero esta diferencia no se considera de relevancia clínica. El sexo no fue identificado como una covariante importante sobre la depuración aparente de saxagliptina y su principal metabolito en el análisis de un modelo de exposición.
– Clorhidrato de metformina: Los parámetros farmacocinéticos de metformina no difieren significativamente entre los sujetos normales y los pacientes con diabetes tipo 2 cuando se analizan de acuerdo al sexo (hombres = 19, mujeres = 16). Similarmente, en estudios clínicos controlados en pacientes con diabetes tipo 2, los efectos antihiperglucémicos de metformina fueron comparables en hombres y mujeres.
Raza:
– Saxagliptina: No se recomiendan ajustes de dosis basados en la raza. Un análisis del modelo de exposición comparó la farmacocinética de saxagliptina y su principal metabolito en 309 sujetos blancos contra 105 sujetos no blancos (consistentes de 6 grupos raciales). No fue detectada ninguna diferencia significativa en la farmacocinética de saxagliptina y su principal metabolito entre estas dos poblaciones.
Clorhidrato de metformina: No se han realizado estudios de los parámetros farmacocinéticos de metformina según la raza. En estudios clínicos controlados con metformina en pacientes con diabetes tipo 2, el efecto antihiperglucémico fue comparable en blancos (n = 249), negros (n = 51), e hispanos (n = 24).
Información de estudios clínicos:
Mejora en el control glucémico: La coadministración de saxagliptina y metformina ha sido estudiada en pacientes con diabetes tipo 2, inadecuadamente controlados con metformina sola, en el tratamiento de pacientes vírgenes al tratamiento inadecuadamente controlados solamente con dieta y ejercicio, en comparación con sulfonilurea en combinación con metformina, en pacientes con control glucémico inadecuado con metformina sola y estudiados en un subgrupo de pacientes inadecuadamente controlados con insulina más metformina. La coadministración de saxagliptina y metformina también ha sido estudiada en pacientes con diabetes tipo 2 controlados inadecuadamente con metformina más una sulfonilurea. El tratamiento con saxagliptina más metformina con todas las dosis produjo mejoría clínicamente relevante y estadísticamente significativa en las cifras de hemoglobina A1c (HbA1c), glucosa plasmática en ayuno (GPA) y glucosa postprandial a las 2 horas (GPP) después de una prueba de tolerancia a la glucosa oral (OGTT), comparado con placebo combinado con metformina (terapia inicial o de adición). Se observaron reducciones en la HbA1c entre los subgrupos incluyendo sexo, edad, raza, e IMC basal.
En los estudios de combinación inicial y de adición con metformina, la disminución en el peso corporal en los grupos de tratamiento a los que se administró saxagliptina en combinación con metformina fue similar a la observada en los grupos a los que se administró metformina sola. Saxagliptina más metformina no se relacionaron con cambios significativos en los niveles de lípidos séricos en ayuno, comparados con metformina sola.
No se han realizado estudios clínicos de eficacia con KOMBIGLYZE® XR; sin embargo, ha sido demostrada la bioequivalencia de la coadministración de tabletas de saxagliptina y clorhidrato de metformina de liberación prolongada.
Adición de saxagliptina a metformina: Un total de 743 pacientes con diabetes tipo 2 participaron en este estudio aleatorizado, doble ciego, controlado con placebo de 24 semanas de duración, para evaluar la eficacia y seguridad de saxagliptina en combinación con metformina en pacientes con control glucémico inadecuado (HbA1c ³ 7% y £ 10%) con metformina sola. Los pacientes necesitaban ser sometidos a una dosis estable de metformina (1,500 mg a 2,550 mg diariamente) durante al menos 8 semanas para ser reclutados en este estudio.
Los pacientes que cumplieron los criterios de elección fueron incluidos en un periodo ciego simple, inducido con placebo, de dos semanas, con dieta y ejercicio, durante el cual los pacientes recibieron metformina en su dosis preestudio hasta 2,500 mg al día, durante todo el estudio. Seguido del periodo de inducción, los pacientes elegibles fueron aleatorizados a 2.5 mg, 5 mg o 10 mg de saxagliptina o placebo, adicionalmente a su dosis actual en fase abierta de metformina. Los pacientes que no cumplieron las metas glucémicas específicas durante el estudio fueron tratadas con pioglitazona como tratamiento de rescate, adicionalmente a placebo o saxagliptina más metformina. En este estudio, no se permitió titulación de las dosis de saxagliptina y metformina.
En combinación con metformina, saxagliptina 5 mg produjo mejoras significativas en HbA1c, GPA, y GPP comparativamente con el grupo de placebo más metformina (tabla 1). Se observaron reducciones en HbA1c en la semana 4 (figura 3) y GPA en la semana 2 en los grupos de tratamiento con saxagliptina 5 mg más metformina comparativamente con el grupo de placebo más metformina, en los puntos de evaluación más tempranos. La proporción de los pacientes que lograron HbA1c < 7% (independientemente de los valores iniciales) fue significantemente mayor en los grupos de tratamiento con saxagliptina 5 mg más metformina comparativamente con el grupo de placebo más metformina. Se observaron reducciones importantes en el nivel de GPP a las 2 horas después de una prueba estándar de tolerancia a la glucosa oral en el grupo de tratamiento de saxagliptina 5 mg más metformina (-58 mg/dL) comparativamente con -18 mg/dL en el grupo con placebo más metformina. La proporción de los pacientes que fueron retirados por falta de control glucémico o que fueron rescatados al cumplir con los criterios glucémicos preespecificados fue mayor en el grupo de placebo más metformina (27%) que en el grupo que recibió saxagliptina 5 mg más metformina (13%). Valores basales más altos de HbA1c estuvieron asociados con un cambio mayor en el promedio ajustado de HbA1c inicial con saxagliptina 5 mg. El efecto de saxagliptina sobre los puntos de valoración de los lípidos en este estudio fue similar al placebo. Se observaron reducciones similares en el peso corporal en los pacientes que recibieron tratamiento con saxagliptina y placebo (-0.9 kg y -0.9 kg, respectivamente).
Tabla 1. Parámetros glucémicos en la semana 24 en un estudio controlado con placebo de saxagliptina en combinación con metformina*
|
Parámetros de eficacia |
Saxagliptina 5 mg + metformina |
Placebo + metformina |
|
Hemoglobina HbA1c (%) |
N = 186 |
N = 175 |
|
Inicial (promedio) |
8.1 |
8.1 |
|
Cambios desde el valor basal (media ajustada†) |
-0.7 |
0.1 |
|
Diferencia con placebo (media ajustada†) |
-0.8‡ |
|
|
95% intervalo de confianza |
(-1.0, 0.6) |
|
|
Porcentaje de los pacientes que alcanzaron HbA1c < 7% |
44%‡ (81/186) |
17% (29/175) |
|
Glucosa plasmática de ayuno GPA (mg/dL) |
N = 187 |
N = 176 |
|
Valor basal (media) |
179 |
175 |
|
Cambios desde la basal (media ajustada†) |
-22 |
1 |
|
Diferencia con placebo (media ajustada†) |
-23‡ |
|
|
95% intervalo de confianza |
(-30, -16) |
|
|
3-horas GPP AUC (mg·min/dL) |
N = 146 |
N = 131 |
|
Valor basal (media ajustada) |
49,021 |
47,407 |
|
Cambio desde el valor basal (media ajustada†) |
-9,586 |
-3,291 |
|
Diferencia con placebo (media ajustada†) |
-6,294‡ |
|
|
95% intervalo de confianza |
(-8,606, -3,983) |
* Población de intención de tratamiento empleando la última observación en el estudio, antes del tratamiento de rescate con pioglitazona.
† Mínimos cuadrados promedio ajustados para valores basales.
‡ Valor-p < 0.0001 comparados con placebo + metformina.
Figura 3. Cambio medio a partir del valor basal en HbA1c en un estudio controlado con placebo, de saxagliptina en combinación con metformina*
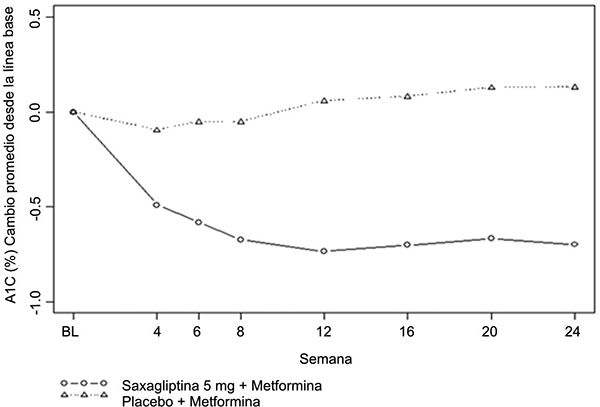
* Población con intención de tratamiento empleando la última observación en el estudio antes del tratamiento de rescate con pioglitazona. Promedio cambios desde el inicio (LOCF).
Extensión del estudio controlado a largo plazo: Los pacientes que fueron rescatados (basados en niveles de glucosa predefinidos) durante un periodo inicial de estudio de 24 semanas, así como todos aquellos que completaron todas las visitas durante el periodo de estudio inicial de 24 semanas sin necesidad de tratamiento de rescate, fueron elegibles para entrar a una extensión del estudio controlado a largo plazo. Los pacientes que recibieron saxagliptina en el estudio inicial de 24 semanas mantuvieron la misma dosis de saxagliptina en la extensión a largo plazo. Todos los resultados de eficacia reflejan los datos previos a la terapia de rescate. El tratamiento con saxagliptina 5 mg más metformina estuvo asociado con una mayor reducción de HbA1c que en el grupo de placebo más metformina, y el efecto relativo del placebo se sostuvo hasta la semana 102. Los cambios de HbA1c con saxagliptina 5 mg más metformina, comparativamente con placebo más metformina, fueron -0.8% en la semana 102.
Coadministración de saxagliptina con metformina en el tratamiento de pacientes vírgenes al tratamiento: Un total de 1,306 pacientes con diabetes tipo 2 vírgenes al tratamiento participaron en este estudio aleatorizado, doble ciego, controlado con activo, durante 24 semanas, para evaluar la eficacia y seguridad de saxagliptina como tratamiento inicial combinado con metformina en pacientes con control glucémico inadecuado (HbA1c ³ 8% a £ 12%) solamente con dieta y ejercicio. Los pacientes incluidos en este estudio necesariamente debían ser vírgenes al tratamiento.
Los pacientes que cumplieron los criterios de elección fueron incluidos en un periodo ciego simple, de una semana, con un periodo de inducción con placebo, dieta y ejercicio. Los pacientes fueron aleatorizados en uno de los cuatro brazos de tratamiento: saxagliptina 5 mg + metformina 500 mg, saxagliptina 10 mg + metformina 500 mg, saxagliptina 10 mg + placebo, o metformina 500 mg + placebo. Saxagliptina fue administrada una vez al día. Durante la semana 1 a 5, en los grupos con saxagliptina 5 mg y saxagliptina 10 mg más metformina y metformina sola, metformina fue titulada de manera ascendente en base a los niveles de GPA con incrementos de 500 mg al día según la tolerancia hasta un máximo de 2,000 mg al día. Los pacientes que fallaron para cumplir las metas glucémicas específicas durante los estudios, fueron tratados con pioglitazona como tratamiento de rescate de adición.
El tratamiento inicial con la combinación de saxagliptina 5 mg más metformina produjo mejoras significativas en HbA1c, GPA, y GPP comparativamente con metformina sola (tabla 2). Las reducciones en HbA1c en la semana 4 y la GPA en la semana 2 fueron observadas en el grupo de tratamiento de saxagliptina 5 mg más metformina en comparación con metformina sola, los puntos más tempranos de evaluación. La proporción de los pacientes que alcanzaron HbA1c < 7% (independientemente del valor inicial) fue significativamente mayor en el grupo de tratamiento de saxagliptina 5 mg más metformina comparativamente con metformina sola. Se observaron reducciones importantes en el nivel de PPG a las 2 horas, después de una prueba estándar de tolerancia a la glucosa en el grupo con saxagliptina 5 mg más metformina (-138 mg/dL) comparativamente con el grupo con metformina sola (-97 mg/dL). Se observaron también mejoras significativas en HbA1c, GPA, y PPG en el grupo con saxagliptina 5 mg más metformina comparativamente con el grupo con saxagliptina sola. La reducción en HbA1c fue -2.5% en el grupo de saxagliptina 5 mg más metformina versus -1.7% en el grupo con saxagliptina 10 mg. El valor basal más elevado de HbA1c estuvo asociado con un cambio medio mayor ajustado de la basal en HbA1c en todos los grupos de tratamiento. En todos los grupos de tratamiento, se observaron efectos similares sobre los parámetros lipídicos. Se observaron reducciones similares en el peso corporal en los grupos con saxagliptina 5 mg más metformina y en el grupo con metformina sola (-1.8 kg y -1.6 kg, respectivamente) con una reducción menor observada en el grupo con saxagliptina 10 mg.
Tabla 2. Parámetros glucémicos en la semana 24 en un estudio con control activo de saxagliptina en combinación con metformina como tratamiento inicial y metformina sola*
|
Parámetros de eficacia |
Saxagliptina 5 mg + metformina |
metformina |
|
Hemoglobina HbA1c (%) |
N = 306 |
N = 313 |
|
Valor basal (medio) |
9.4 |
9.4 |
|
Cambios desde la basal (media ajustada†) |
-2.5 |
-2.0 |
|
Diferencia de metformina (media ajustada† |
-0.5‡ |
|
|
95% intervalo de confianza |
(-0.7, -0.4) |
|
|
Porcentaje de los pacientes que alcanzaron HbA1c <7% |
60%‡ (185/307) |
41% (129/314) |
|
Glucosa plasmática de ayuno GPA (mg/dL) |
N = 315 |
N = 320 |
|
Valor basal (medio) |
199 |
199 |
|
Cambios desde la basal (media ajustada†) |
-60 |
-47 |
|
Diferencia con metformina (media ajustada†) |
-13§ |
|
|
95% intervalo de confianza |
(-19, -6) |
|
|
3-hora GPP AUC (mg·min/dL) |
N = 142 |
N = 135 |
|
Valor basal (medio) |
55,531 |
57,937 |
|
Cambios desde la basal (media ajustada†) |
-2,108 |
-15,005 |
|
Diferencia con metformina (media ajustada†) |
-6,075‡ |
|
|
95% intervalo de confianza |
(-8,429, -3,721) |
* Población con intención de tratamiento utilizando la última observación en el estudio antes de la terapia de rescate con pioglitazona.
† Mínimos cuadrados promedio ajustados al valor basal.
‡ Valor-p < 0.0001 comparado con metformina.
§ Valor-p = 0.0002 comparado con metformina.
Extensión del estudio controlado a largo plazo: Los pacientes rescatados (basados en niveles de glucosa pre-definidos) durante el periodo de estudio inicial a las 24 semanas, así como aquellos que completaron todas las visitas durante el periodo de estudio inicial a las 24 semanas sin necesidad de tratamiento de rescate, fueron elegibles para ingresar a la extensión del estudio controlado.
Los pacientes que recibieron saxagliptina en el periodo inicial de estudio de 24 semanas mantuvieron la misma dosis de saxagliptina en la extensión a largo plazo. Todos los datos de eficacia muestran los datos anteriores al tratamiento de rescate.
El tratamiento con saxagliptina 5 mg más metformina estuvo asociado con una mayor reducción en HbA1c que en el grupo de monoterapia con metformina, y el efecto relativo al control se mantuvo hasta la semana 76.
El cambio en HbA1c con saxagliptina 5 mg más metformina comparativamente con metformina como monoterapia fue de -0.5% en la semana 76.
Terapia de adición de saxagliptina combinada con metformina versus terapia de adición de glipizida combinada con metformina: Un total de 858 pacientes con diabetes tipo 2 participaron en este estudio aleatorizado, doble ciego, controlado con activo de 52 semanas de duración, para evaluar la eficacia y seguridad de saxagliptina en combinación con metformina comparada con sulfonilurea en combinación con metformina en pacientes con un inadecuado control glucémico (HbA1c > 6.5% y £ 10%) con metformina sola. Para ser incluidos en este estudio, los pacientes necesitaban tener una dosis estable de metformina (al menos 1,500 mg al día) durante por lo menos 8 semanas.
Los pacientes que cumplieron con los criterios de selección fueron incluidos en un periodo simple ciego de dos semanas con dieta y ejercicio e inducción con placebo, durante el cual los pacientes recibieron metformina (1,500 mg a 3,000 mg basados en su dosis preestudio) durante la duración del estudio. Después del periodo de inducción, los pacientes elegidos fueron aleatorizados a 5 mg de saxagliptina o 5 mg de glipizida adicionalmente a su dosis actual de metformina en fase abierta. Los pacientes en el grupo de glipizida más metformina fueron titulados hasta el efecto óptimo (GPA £ 6.1 mmol/L, £ 110 mg/dL) o la mayor dosis tolerable durante las primeras 18 semanas empleando una técnica de doble-simulación a un máximo de 20 mg por día (dosis promedio 15 mg).
Saxagliptina 5 mg adicionada a metformina no fue inferior a glipizida adicionada a metformina en la reducción de HbA1c según el análisis primario del conjunto de análisis por protocolo (tabla 3). El análisis de intención de tratamiento mostró resultados consistentes.
Saxagliptina 5 mg tuvo una considerable menor proporción de eventos hipoglucémicos: 3% (19 eventos en 13 pacientes) versus 36.3% (750 eventos en 156 pacientes) con glipizida.
Los pacientes tratados con saxagliptina mostraron una disminución importante del peso corporal inicial comparativamente al aumento de peso en los pacientes tratados con glipizida (-1.1 kg versus +1.1 kg, p < 0.0001).
Tabla 3. HbA1c en la semana 52 en un estudio con control activo de saxagliptina en combinación con metformina*
|
Parámetro de eficacia |
Saxagliptina 5 mg + metformina |
Glipizida + metformina |
|
Hemoglobina HbA1c (%) |
N = 293 |
N = 293 |
|
Valor basal (media) |
7.5 |
7.5 |
|
Cambio desde el valor basal (media ajustada†) |
-0.7 |
-0.8 |
|
Diferencias vs. glipizida + metformina (media ajustada†) |
0.1 |
|
|
Intervalo de confianza de 95% |
(-0.1, 0.2)‡ |
* Población por protocolo.
† Mínimos cuadrados promedio ajustados para valores basales.
‡ Saxagliptina + metformina se considera como no-inferior a glipizida + metformina si el límite superior de confianza estimada es < 0.35%.
Estudio de extensión controlado a largo plazo: Los pacientes que completaron el periodo inicial de 52 semanas del estudio fueron elegibles para entrar en el estudio de extensión controlado a largo plazo de 52 semanas. Los pacientes mantuvieron la misma dosis de saxagliptina 5 mg o glipizida en la extensión a largo plazo. Los cambios en los valores basales de HbA1c fueron -0.4% para saxagliptina 5 mg (n = 184) adicionada a metformina y -0.3% para glipizida (n = 160) adicionada a metformina a la semana 104.
El tratamiento con saxagliptina 5 mg más metformina resultó en una menor proporción de pacientes con eventos hipoglucémicos, 3.5% (24 eventos en 15 pacientes) versus 38.4% (896 eventos para 165 pacientes) para el tratamiento con glipizida más metformina. El tratamiento con saxagliptina 5 mg más metformina produjo una reducción en el peso corporal promedio en comparación con los valores basales (-1.5 kg) mientras que el tratamiento con glipizida más metformina produjo un incremento en el peso corporal promedio comparado con los valores basales (+1.3 kg) a la semana 104. El perfil de seguridad total de saxagliptina 5 mg versus glipizida en el periodo del tratamiento a largo plazo fue consistente con la observada previamente en el periodo inicial del tratamiento de 52 semanas.
Terapia de adición de saxagliptina combinada con insulina (con o sin metformina): Un total de 455 pacientes con diabetes tipo 2 participaron en el estudio controlado con placebo, doble ciego, distribuidos aleatoriamente, de 24 semanas de duración, para evaluar eficacia y seguridad de saxagliptina en combinación con insulina en pacientes con control glucémico inadecuado (HbA1c ³ 7.5% y £ 11%), con insulina sola (N = 141) o insulina en combinación con una dosis estable de metformina (N = 314). Se requirió que los pacientes estuvieran con una dosis estable de insulina (³ 30 a £ 150 unidades, diariamente) con una variación £ 20% en la dosis total diaria durante ³ 8 semanas previo a la selección con o sin metformina.
Los pacientes estuvieron con insulina de acción intermedia o prolongada (basal) o insulina premezclada.
Los pacientes que utilizaban insulina de acción corta fueron excluidos a menos que ésta fuera administrada como parte de una insulina premezclada.
Los pacientes que cumplieron con los criterios de elegibilidad fueron enrolados en un periodo de inducción con placebo, ciego simple, de cuatro semanas, con dieta y ejercicio durante el cual los pacientes recibieron insulina (y metformina, si aplicaba) en la dosis preestudio. Después del periodo de inducción, los pacientes seleccionados fueron aleatorizados con 5 mg de saxagliptina o placebo en adición para continuar con su dosis habitual de insulina (y metformina, si aplica). Los pacientes mantuvieron una dosis estable de insulina cuando fue posible.
Los pacientes que fallaron el cumplimiento de las metas glucémicas o quienes incrementaron su dosis de insulina por > 20%, fueron rescatados y posteriormente cambiados a un régimen de dosis de insulina más flexible. En este estudio, no se permitió la titulación de la dosis de saxagliptina y metformina.
Saxagliptina 5 mg adicionada a insulina, con o sin metformina, proporciona mejoras significativas en HbA1c y GPP en comparación con placebo adicionado a insulina, con o sin metformina (tabla 4).
Se alcanzaron reducciones de HbA1c similares contra placebo, en pacientes que utilizan saxagliptina 5 mg adicionada a insulina sola y saxagliptina adicionada a insulina en combinación con metformina (-0.4 y -0.4%, respectivamente). La proporción de pacientes que fueron suspendidos por falta de control glucémico o rescatados fue de 23% en el grupo de saxagliptina 5 mg adicionada a insulina y 32% en el grupo de placebo adicionado a insulina.
Tabla 4. Parámetros glucémicos en la semana 24 en un estudio placebo-controlado de saxagliptina en terapia de adición combinada con insulina*
|
Parámetro de eficacia |
Saxagliptina 5 mg + insulina (+/- metformina) N = 304 |
Placebo + insulina (+/- metformina) N = 151 |
|
Hemoglobina HbA1c (%) |
N = 300 |
N = 149 |
|
Valor basal (media) |
8.7 |
8.7 |
|
Cambio desde el valor basal (media ajustada†) |
-0.7 |
-0.3 |
|
Diferencia del placebo (media ajustada†) |
-0.4‡ |
|
|
Intervalo de confianza de 95% |
(-0.6, -0.2) |
|
|
Porcentaje de pacientes que logran HbA1c < 7% |
17%§ (52/300) |
7% (10/149) |
|
Glucosa posprandial 2 horas (mg/dL) |
N = 262 |
N = 129 |
|
Valor basal (media) |
251 |
255 |
|
Cambio desde el valor basal (media ajustada†) |
-27 |
-4 |
|
Diferencia del placebo (media ajustada†) |
-23¶ |
|
|
Intervalo de confianza de 95% |
(-37, -9) |
|
|
Glucosa plasmática de ayuno GPA (mg/dL) |
N = 300 |
N = 149 |
|
Valor basal (media) |
173 |
173 |
|
Cambio desde el valor basal (media ajustada†) |
-10 |
-6 |
|
Diferencia de placebo (media ajustada†) |
-4# |
|
|
Intervalo de confianza de 95% |
(-13, 5) |
|
|
Media total de la dosis diaria de insulina (unidades) |
N = 299 |
N = 151 |
|
Valor basal (media) |
53 |
55 |
|
Cambio desde el valor basal (media ajustada†) |
2 |
5 |
|
Diferencia de placebo (media ajustada†) |
-3§ |
|
|
Intervalo de confianza de 95% |
(-6, -1) |
* Población con intención de tratamiento utilizando la última observación en el estudio antes de la terapia de rescate con insulina en pacientes que necesitan rescate: población con intención de tratamiento empleando la última observación en el estudio.
† Media de mínimos cuadrados ajustada para el valor basal y metformina usada en el valor basal.
‡ Valor p < 0.0001 en comparación a placebo + insulina.
§ Significancia no analizada.
¶ Valor p = 0.0016 en comparación a placebo + insulina.
# No estadísticamente significativo.
Estudio de extensión controlado a largo plazo: Los pacientes que completaron todas las visitas durante el periodo inicial de 24 semanas del estudio fueron elegibles para entrar al estudio de extensión controlado a largo plazo. Los pacientes que recibieron saxagliptina en el periodo inicial de 24 semanas mantuvieron la misma dosis de saxagliptina en la extensión a largo plazo, pero los pacientes que completaron el periodo de 24 semanas del estudio con una dosis estable de insulina cambiaron a un régimen de dosis flexible de insulina durante el periodo de extensión. Todos los análisis de eficacia se basaron en los datos independientemente de la dosis de insulina. El tratamiento con saxagliptina 5 mg adicionada a insulina con o sin metformina se asoció a una mayor reducción de HbA1c que el uso de placebo adicionado a insulina con o sin metformina y el efecto relacionado al placebo fue sostenido hasta la semana 52. El cambio de HbA1c para saxagliptina 5 mg más insulina (n = 244) en comparación con el placebo más insulina (n = 124) fue -0.4% a la semana 52.
Saxagliptina adicionada a la terapia combinada con metformina más sulfonilurea: Un total de 257 pacientes con diabetes tipo 2 participaron en el estudio placebo-controlado, doble ciego, con distribución aleatorizada de 24 semanas, para evaluar la eficacia y seguridad de saxagliptina adicionada a la terapia de combinación con metformina más sulfonilurea en pacientes con control glucémico inadecuado (HbA1c ³ 7% y £ 10%). Se requirió que los pacientes estuvieran con una dosis combinada estable de metformina de liberación prolongada o de liberación inmediata (en dosis máxima tolerada, con una dosis mínima para ser enrolados de 1,500 mg) y sulfonilurea (en dosis máxima tolerada, con dosis mínima para ser enrolados ³ 50% de la dosis máxima recomendada) por al menos 8 semanas antes del reclutamiento.
Los pacientes que cumplieron con los criterios de elegibilidad fueron incluidos en un periodo de inducción de 2 semanas para permitir la evaluación de los criterios de inclusión/exclusión. Después del periodo de inducción de 2 semanas, los pacientes seleccionados fueron aleatorizados a doble ciego con saxagliptina (5 mg una vez al día) o doble ciego con placebo durante 24 semanas. Durante el periodo de tratamiento de 24 semanas, los pacientes debían recibir metformina y sulfonilurea a la misma dosis constante observada en el momento de reclutamiento. La sulfonilurea podría ser titulada una vez a la baja en el caso de un evento hipoglucémico o eventos recurrentes hipoglucémicos menores. Durante el periodo del tratamiento no se permitió la titulación (a la alza o a la baja) de los medicamentos.
Saxagliptina en combinación con metformina más sulfonilurea proporcionó mejoras significativas en los niveles de HbA1c y GPP en comparación con placebo en combinación con metformina más una sulfonilurea (tabla 5).
Tabla 5. Parámetros glucémicos en la semana 24 en un estudio placebo-controlado con saxagliptina en terapia combinada de adición a metformina más sulfonilurea*
|
Parámetro de eficacia |
Saxagliptina 5 mg + metformina + sulfonilurea |
Placebo + metformina + sulfonilurea |
|
Hemoglobina HbA1c (%) |
N = 127 |
N = 127 |
|
Valor basal (media) |
8.4 |
8.2 |
|
Cambio desde el valor basal (media ajustada†) |
-0.7 |
-0.1 |
|
Diferencia del placebo (media ajustada†) |
-0.7‡ |
|
|
Intervalo de confianza de 95% |
(-0.9, -0.5) |
|
|
Porcentaje de pacientes que logran HbA1c < 7% |
31%§ (39/127) |
9% (12/127) |
|
Glucosa postprandial 2 horas (mg/dL) |
N = 115 |
N = 113 |
|
Valor basal (media) |
268 |
262 |
|
Cambio desde el valor basal (media ajustada†) |
-12 |
5 |
|
Diferencia del placebo (media ajustada†) |
-17¶ |
|
|
Intervalo de confianza de 95% |
(-32, -2) |
|
|
Glucosa plasmática de ayuno GPA (mg/dL) |
N = 121 |
N = 123 |
|
Valor basal (media) |
162 |
155 |
|
Cambio desde el valor basal (media ajustada†) |
-5 |
3 |
|
Diferencia de placebo (media ajustada†) |
-8# |
|
|
Intervalo de confianza de 95% |
(-17, 1) |
* Población con intención de tratamiento utilizando la última observación antes de interrumpir.
† Media de mínimos cuadrados ajustada para el valor basal.
‡ Valor p < 0.0001 en comparación a placebo + metformina + sulfonilurea.
§ Significancia no analizada.
¶ Valor p = 0.0301 en comparación a placebo + metformina + sulfonilurea.
# No estadísticamente significativo.
Seguridad cardiovascular: En el estudio de evaluación de desenlaces cardiovasculares de saxagliptina registrados en pacientes con diabetes mellitus-trombólisis en infarto de miocardio (Saxagliptin Assesment of Vascular Outcomes Recorder in Patients with Diabetes Mellitus-thrombolysis in Miocardial Infarction, SAVOR por sus siglas en inglés) se evaluó el efecto de saxagliptina en la incidencia de eventos cardiovasculares (ECV) en 16,492 pacientes adultos con diabetes tipo 2 quienes ya tenían ECV o presentaban múltiples factores de riesgo para enfermedad vascular, incluyendo a pacientes con insuficiencia renal moderada o grave. Se reclutaron pacientes > 40 años de edad, diagnosticados con diabetes tipo 2 y con HbA1C > 6.5%, y con ECV declarada o múltiples factores de riesgo CV.
Los pacientes fueron asignados aleatoriamente al grupo de placebo (n = 8,212) o de saxagliptina (5 o 2.5 mg para pacientes con insuficiencia renal moderada o grave) una vez al día (n = 8,280). La asignación aleatoria a los grupos de saxagliptina y placebo se estratificó por riesgo CV con 3,533 pacientes (21.4%) únicamente con factores de riesgo CV y 12,959 pacientes (78.6%) con ECV declarada y por insuficiencia renal que incluyó 13,916 pacientes (84.4%), con función renal normal o insuficiencia leve, 2,240 pacientes (13.6%) con insuficiencia moderada y 336 pacientes (2.0%) con insuficiencia renal grave. Los pacientes con ECV declarada se definieron por medio de antecedentes de cardiopatía isquémica, enfermedad vascular periférica o accidente vascular cerebral isquémico. Para los pacientes con factores de riesgo CV sólo se tomó la edad (hombres ³ 55 años y mujeres ³ 60 años) como factor de riesgo y al menos un factor de riesgo adicional de dislipidemia, hipertensión o tabaquismo actual.
Las características demográficas y basales en los pacientes fueron equilibradas entre los grupos de saxagliptina y placebo. La población del estudio comprendió 67% de hombres y 33% de mujeres con una edad promedio de 65 años en la aleatorización. De los 16,492 pacientes asignados al azar, 8,561 pacientes (52%) tenía 65 años o más y 2,330 (14%) tenía 75 años o más.
Todos los pacientes del estudio tenían DMT2 con una duración promedio de 12 años (mediana = 10.3) y un nivel de HbA1C promedio de 8.0% (mediana = 7.6%). En general, 25% de los pacientes tenía niveles iniciales de HbA1C< 7%. Se les dio seguimiento a los pacientes durante un promedio de 2 años (mediana = 2.0).
El uso de medicamentos concomitantes fue similar para los dos grupos de tratamiento. En general, el uso de medicamentos para tratar la diabetes concordó con la práctica local de tratamiento y el programa clínico de saxagliptina (metformina 69%, insulina 41%, sulfonilureas 40% y TZD 6%). El uso de medicamentos para la ECV también concordó con la práctica local de tratamiento (inhibidores de la ECA o BRA 79%, estatinas 78%, ácido acetilsalicílico 75%, betabloqueadores 62% y medicamentos antiplaquetarios diferentes al ácido acetilsalicílico 24%). Se trató aproximadamente a 6% de los pacientes únicamente con dieta y ejercicio al inicio. Los medicamentos concomitantes se administraron durante el estudio conforme a los objetivos de los lineamientos locales para control glucémico y reducción de riesgo CV para minimizar las diferencias entre los dos grupos de tratamiento, especialmente para control glucémico.
El punto final primario de seguridad y eficacia fue un punto final compuesto, conformado por el tiempo hasta la primera incidencia de cualquiera de los siguientes eventos adversos CV graves (MACE, por sus siglas en inglés): muerte CV, infarto de miocardio no letal o accidente vascular cerebral isquémico no letal.
El objetivo final primario de seguridad de este estudio fue establecer que el límite superior del IC a 95% bilateral para la relación de riesgo calculada, que compara la incidencia del punto final compuesto de muerte CV, IM no letal o accidente vascular cerebral isquémico no letal observado con saxagliptina en comparación con el observado en el grupo de placebo que fue de < 1.3.
El objetivo final primario de eficacia fue determinar, como una evaluación de superioridad, si el tratamiento con saxagliptina, en comparación con placebo cuando se añadió a la terapia de base actual, resultaba en una reducción significativa en el punto final primario de MACE.
El primer punto final secundario de eficacia fue un punto final compuesto conformado por el tiempo hasta la incidencia de MACE más hospitalización por insuficiencia cardiaca, hospitalización por angina de pecho inestable u hospitalización por revascularización coronaria (MACE plus). El siguiente punto final secundario de eficacia fue determinar si el tratamiento con saxagliptina en comparación con placebo cuando se añadió a la terapia de base actual en pacientes con DMT2 provocaría una reducción de mortalidad por cualquier causa.
Se evaluó la seguridad cardiovascular de saxagliptina en el estudio SAVOR, donde se estableció que saxagliptina no incrementó el riesgo de ECV (muerte CV, infarto de miocardio no letal o accidente vascular cerebral isquémico no letal) en pacientes con DMT2 en comparación con placebo cuando se añadió a la terapia de base actual (RR 1.00; IC a 95%: 0.89, 1.12; P < 0.001 para no inferioridad).
El punto final primario de eficacia no demostró una diferencia estadísticamente significativa en eventos adversos coronarios graves para saxagliptina en comparación con placebo cuando se añadió a la terapia de base actual en pacientes con DMT2.
Tabla 6. Puntos finales clínicos primarios y secundarios por grupo de tratamiento en el estudio SAVOR*
|
Punto final |
Saxagliptina® (N = 8,280) |
Placebo (N = 8,212) |
Relación de riesgo (IC a 95 %)† |
||
|
Pacientes con eventos n (%) |
Índice de eventos por 100 años-paciente |
Pacientes con eventos |
Índice de eventos por 100 años-paciente |
||
|
Punto final compuesto primario: MACE |
613 |
3.76 |
609 |
3.77 |
1.00 |
|
Punto final compuesto secundario: MACE plus |
1,059 |
6.72 |
1,034 |
6.60 |
1.02 |
|
Mortalidad por cualquier causa |
420 |
2.50 |
378 |
2.26 |
1.11 |
* Población con intención de tratar.
† Relación de riesgo ajustada para la categoría de función renal inicial y la categoría de riesgo de ECV inicial.
‡ Valor P < 0.001 para no inferioridad (con base en RR < 1.3) en comparación con placebo.
§ Valor P = 0.99 para superioridad (con base en RR < 1.0) en comparación con placebo.
¶ Significancia no evaluada.
Figura 4. Porcentaje acumulativo del tiempo hasta el primer evento CV para el punto final compuesto primario*
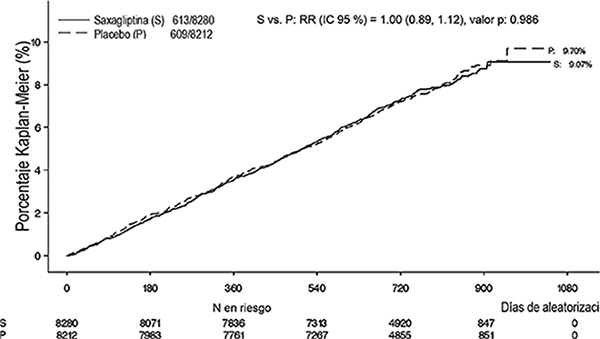
* Población con intención de tratar.
Los eventos se acumularon continuamente con el paso del tiempo, y las tasas de eventos para saxagliptina y placebo no discrepan de forma notable con el paso del tiempo.
Un componente del punto final compuesto secundario, hospitalización por insuficiencia cardiaca, presentó mayor incidencia en el grupo de saxagliptina (3.5%) en comparación con el grupo de placebo (2.8%) con una significancia estadística nominal (es decir, sin ajuste para pruebas o puntos finales múltiples) que favorece al grupo de placebo (RR = 1.27; [IC a 95% 1.07, 1.51]; P = 0.007). Definitivamente no se pudieron identificar los factores clínicamente relevantes predictivos del incremento de riesgo relativo en el tratamiento con saxagliptina. Los pacientes con mayor riesgo de hospitalización por insuficiencia cardiaca, independientemente del tratamiento asignado, se pudieron identificar por medio de factores de riesgo conocidos para insuficiencia cardiaca como antecedentes iniciales de insuficiencia cardiaca o disfunción renal. Sin embargo, los pacientes en tratamiento con saxagliptina, con antecedentes de insuficiencia cardiaca o disfunción renal al inicio, no tuvieron incremento de riesgo relativo a la administración de placebo para los puntos finales compuestos primarios o secundarios o mortalidad por cualquier causa.
No se observó riesgo incrementado para el punto final primario entre saxagliptina y placebo en ninguno de los siguientes subgrupos: ECV, múltiples factores de riesgo por ECV, insuficiencia renal leve, moderada o grave, edad, sexo, raza, región, duración de la diabetes tipo 2, antecedentes de insuficiencia cardiaca, HbA1C inicial, proporción de albúmina/creatinina, medicamento antidiabético al inicio, o uso al inicio de estatinas, ácido acetilsalicílico, inhibidores de la ECA, BRA, betabloqueadores, o medicamentos antiplaquetarios.
A pesar de la administración activa de la terapia antidiabética concomitante en ambos grupos de estudio, los niveles promedio de HbA1C fueron menores en el grupo de saxagliptina en comparación con el grupo de placebo en el año 1 (7.6% frente a 7.9%, diferencia de -0.35% [IC a 95%: -0.38, - 0.31]) y al año 2 (7.6% frente a 7.9%, diferencia de -0.30% [IC a 95%: -0.34, -0.26]). Las proporciones de pacientes con HbA1C < 7% en el grupo de saxagliptina en comparación con el grupo de placebo fueron de 38% frente a 27% en el año 1 y 38% frente a 29% en el año 2.
En comparación con placebo, saxagliptina resultó en una necesidad menor de iniciar con un nuevo medicamento oral para la diabetes, insulina o incrementar la dosis actual. La mejoría en HbA1C y la proporción de pacientes que alcanzaron las metas de HbA1C, entre los pacientes tratados con saxagliptina, fueron obtenidas a pesar de las menores tasas de ajustes ascendentes en medicamentos contra la diabetes o el inicio de nuevos medicamentos contra la diabetes o insulina, en comparación con placebo.
CONTRAINDICACIONES:
KOMBIGLYZE® XR está contraindicado en pacientes con:
• Enfermedad renal o insuficiencia renal (sugerido por niveles de creatinina sérica ³ 1.5 mg/dL [varones], ³ 1.4 mg/dL [mujeres] o depuración anormal de creatinina) que también pueden ser el resultado de otras alteraciones como: colapso cardiovascular (shock), infarto agudo al miocardio, y septicemia.
• Acidosis metabólica aguda o crónica, incluyendo cetoacidosis diabética, con o sin coma. La cetoacidosis diabética deberá tratarse con insulina.
• Antecedentes de cualquier reacción seria de hipersensibilidad, como: anafilaxia o angioedema a cualquier inhibidor DPP4 o hipersensibilidad conocida a clorhidrato de metformina.
KOMBIGLYZE® XR deberá suspenderse temporalmente en pacientes sometidos a estudios radiológicos que involucren la administración intravascular de materiales de contraste yodados debido a que el uso de dichos productos puede provocar alteraciones agudas del funcionamiento renal (véase Precauciones generales).
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: No existen estudios adecuados y bien controlados con KOMBIGLYZE® XR o sus componentes individuales en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre predicen la respuesta en humanos, KOMBIGLYZE® XR, así como otros medicamentos antidiabéticos, deberán ser usados durante el embarazo solamente si son claramente indispensables.
Saxagliptina: Saxagliptina atraviesa la placenta hacia el feto después de la administración en ratas preñadas. Saxagliptina se secreta en la leche de ratas lactando.
Metformina: La determinación de concentraciones fetales demostró una barrera placentaria parcial a la metformina. No se han realizado estudios con la combinación de los componentes de KOMBIGLYZE® XR en animales lactando. En estudios realizados con los componentes individuales, tanto saxagliptina como metformina son secretadas en la leche de ratas lactando. Se desconoce si saxagliptina o metformina son secretadas en la leche humana. Debido a que muchos medicamentos son secretados en la leche humana, se deberá tener precaución cuando se administre la KOMBIGLYZE® XR a mujeres amamantando.
REACCIONES SECUNDARIAS Y ADVERSAS:
Experiencia clínica: Debido a que los estudios clínicos se realizan bajo diferentes condiciones, los índices de reacciones adversas observadas en los estudios clínicos de un medicamento no pueden compararse directamente con los índices en los estudios clínicos de otros medicamentos y pueden no reflejar los índices observados durante la práctica.
Más de 17,000 pacientes con diabetes tipo 2 han sido tratados con saxagliptina en estudios clínicos aleatorizados, controlados y doble ciego.
Reacciones adversas relacionadas con saxagliptina en el estudio SAVOR: El estudio SAVOR incluyó a 8,240 pacientes tratados con saxagliptina 5 o 2.5 mg una vez al día y a 8,173 pacientes con placebo. La duración promedio de exposición a saxagliptina independientemente de las interrupciones, fue de 1.8 años. Un total de 3,698 pacientes (45%) fueron tratados con saxagliptina durante 2 y 3 años.
La incidencia total de eventos adversos en pacientes tratados con saxagliptina en este estudio fue similar con placebo (72.5% frente a 72.2%, respectivamente). La suspensión de la terapia debido a eventos adversos fue similar entre los dos grupos de tratamiento (4.9% en el grupo de saxagliptina y 5.0% en el grupo de placebo).
Se evaluó la seguridad cardiovascular de saxagliptina en el estudio SAVOR, donde se estableció que saxagliptina no incrementó el riesgo cardiovascular (muerte CV, IM no letal o accidente vascular cerebral isquémico no letal) en pacientes con diabetes mellitus tipo 2 (DMT2) en comparación con placebo, cuando se adicionó a la terapia basal actual (relación de riesgo [RR] 1.00; intervalo de confianza de 95% [IC]: 0.89, 1.12; P < 0.001 para no inferioridad) (véase Estudios clínicos).
En el estudio SAVOR, la incidencia de eventos de pancreatitis relacionados fue de 0.3% tanto en los pacientes tratados con saxagliptina como en los pacientes tratados con placebo en la población con intención de tratamiento.
La incidencia de reacciones de hipersensibilidad fue de 1.1% tanto en los pacientes tratados con saxagliptina como en los pacientes tratados con placebo.
Hipoglucemia: En el estudio SAVOR, la incidencia total reportada de hipoglucemia (registrada en el diario del paciente) fue de 17.1% en los pacientes tratados con saxagliptina y 14.8% en los pacientes tratados con placebo.
El porcentaje de pacientes con eventos hipoglucémicos graves reportados durante el tratamiento (definido como un evento que requirió la ayuda de otra persona) fue mayor en el grupo de saxagliptina que en el grupo de placebo (2.1 y 1.6%, respectivamente).
El riesgo incrementado de hipoglucemia total y grave observado en el grupo tratado con saxagliptina ocurrió principalmente en pacientes tratados con una sulfonilurea al inicio y no en pacientes tratados con insulina o monoterapia de metformina al inicio.
El riesgo incrementado de hipoglucemia total y grave se observó principalmente en pacientes con HbA1c < 7% al inicio.
Monoterapia y tratamiento combinado de adición de saxagliptina en estudios de control glucémico: En dos estudios con monoterapia, controlado con placebo, con una duración de 24 semanas, los pacientes fueron tratados con saxagliptina 2.5 mg diariamente, saxagliptina 5 mg diariamente, saxagliptina 10 mg diariamente (en uno de estos dos estudios) y placebo. También se realizaron tres estudios a 24 semanas, controlados con placebo, con terapia de adición en combinación, uno con metformina, otro con una tiazolidinediona [TZD] (pioglitazona o rosiglitazona) y uno con glibenclamida. En estos tres estudios, a los pacientes cuya diabetes no estaba controlada adecuadamente con una dosis estable de metformina, TZD o sulfonilurea, se les administró saxagliptina 2.5 mg diariamente, saxagliptina 5 mg diariamente y, en el estudio combinado con metformina sola, se administró saxagliptina 10 mg diariamente o placebo. En un análisis grupal preespecificado de los datos de 24 semanas de los dos estudios con monoterapia, el estudio de adición con metformina, el estudio de adición con TZD y el estudio de adición con glibenclamida, la incidencia global de eventos adversos en los pacientes tratados con saxagliptina 5 mg, fue similar al placebo (72.2% versus 70.6%). La descontinuación del tratamiento por eventos adversos fue mayor en los pacientes que recibieron saxagliptina 5 mg versus placebo (3.3% versus 1.8%). Las reacciones adversas reportadas en el análisis grupal (independientemente de la valoración de causalidad por el investigador) fueron ³ 5% en los pacientes tratados con saxagliptina 5 mg y más frecuentemente que en los pacientes tratados con placebo, son mostrados en la siguiente tabla.
Tabla 7. Reacciones adversas (independientemente de la valoración de causalidad por el investigador) en los estudios controlados con placebo* reportados en ³ 5% de los pacientes tratados con saxagliptina 5 mg y más frecuentemente que en los pacientes tratados con placebo
|
Número (%) de pacientes |
||
|
Saxagliptina 5 mg N = 882 |
Placebo N = 799 |
|
|
Infecciones de las vías aéreas superiores |
68 (7.7) |
61 (7.6) |
|
Infecciones del tracto urinario |
60 (6.8) |
49 (6.1) |
|
Cefaleas |
57 (6.5) |
47 (5.9) |
* Los 5 estudios controlados con placebo incluyeron dos estudios con monoterapia y un estudio de tratamiento combinado de adición con cada uno de los siguientes: metformina, tiazolidinediona, o glibenclamida.
En este análisis grupal, las reacciones adversas menos comunes que se reportaron en ³ 2% de los pacientes tratados con saxagliptina 5 mg y ³ 1% más frecuentes en comparación con placebo incluyendo lo siguiente: sinusitis (2.6% versus 1.6%), gastroenteritis (2.3% versus 0.9%) y vómito (2.3% versus 1.3%).
Hipoglucemia:
Saxagliptina: Las reacciones adversas de hipoglucemia se basaron en todos los reportes de hipoglucemia, no fue necesaria la medición concurrente de glucosa. La incidencia de hipoglucemia reportada con saxagliptina 5 mg versus placebo administrada como monoterapia fue de 5.6% versus 4.1%, respectivamente, y 5.8% versus 5% cuando se administró como terapia de adición a metformina. La incidencia reportada de hipoglucemia fue de 3.4% durante el tratamiento de pacientes vírgenes al tratamiento a quienes se administró saxagliptina 5 mg mas metformina y 4.0% en pacientes a quienes se administró metformina sola. En el estudio de saxagliptina de adición a insulina, la incidencia total de hipoglucemia reportada fue de 18.4% para saxagliptina 5 mg y de 19.9% para placebo. La incidencia de hipoglucemia confirmada para saxagliptina 5 mg fue 5.3% versus 3.3% para placebo.
En el estudio de saxagliptina adicionada a la combinación de metformina más SU, la incidencia total de hipoglucemia reportada fue de 10.1% para saxagliptina 5 mg y de 6.3% para placebo. La hipoglucemia confirmada fue reportada en 1.6% de los pacientes tratados con saxagliptina y ninguna para pacientes tratados con placebo.
Reacciones de hipersensibilidad:
Saxagliptina: Un conjunto de eventos relacionados con hipersensibilidad, en el análisis grupal de 5 estudios hasta la semana 24, mostró una incidencia de 1.5 y 0.4% en pacientes que recibieron saxagliptina 5 mg y placebo, respectivamente. Ninguno de estos eventos necesitó hospitalización ni tampoco hubo reporte del investigador de que estuviera en riesgo la vida de pacientes que recibieron saxagliptina.
Reacciones adversas asociadas con saxagliptina co-administrada con metformina en el tratamiento de pacientes con diabetes tipo 2 vírgenes al tratamiento para control glucémico: En un estudio adicional de 24 semanas, controlado con activo, de tratamiento inicial con saxagliptina combinada con metformina, las reacciones adversas reportadas (independientemente de la valoración de causalidad por el investigador) en ³ 5% de los pacientes, se muestran en la siguiente tabla.
Tabla 8. Tratamiento inicial con la combinación de saxagliptina y metformina: Reacciones adversas reportadas (independientemente de la valoración de causalidad por el investigador) en ³ 5% de los pacientes tratados con la terapia combinada de saxagliptina 5 mg más metformina (y mayor que en pacientes tratados con saxagliptina 10 mg sola y metformina sola)
|
Número de pacientes (%) |
|||
|
Saxagliptina 5 mg + metformina* N = 320 |
Saxagliptina 10 mg N = 335 |
metformina* N = 328 |
|
|
Cefalea |
24 (7.5) |
21 (6.3) |
17 (5.2) |
|
Nasofaringitis |
22 (6.9) |
14 (4.2) |
13 (4.0) |
* Metformina administrada con una dosis inicial de 500 mg diariamente y titulada hasta un máximo de 2,000 mg diariamente.
No fueron observados cambios clínicamente importantes en los signos vitales en los pacientes tratados con saxagliptina 5 mg.
Monoterapia-clorhidrato de metformina: Las reacciones adversas más comunes en los estudios clínicos controlados con placebo fueron reportadas en > 5% de los pacientes tratados con clorhidrato de metformina de liberación prolongada y más comúnmente que entre los pacientes tratados con placebo, incluyendo diarrea, náuseas/vómito.
Experiencia postcomercialización:
Saxagliptina: Durante la experiencia postcomercialización, los siguientes eventos adversos se han reportado con el uso de saxagliptina: pancreatitis aguda y reacciones de hipersensibilidad, incluyendo anafilaxis, angioedema, rash y urticaria. Debido a que estas reacciones son reportadas voluntariamente de una población de tamaño incierto, no es posible estimar de manera confiable su frecuencia.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Carcinogénesis, mutagénesis, alteraciones en la fertilidad: No se han realizado estudios en animales con la combinación en KOMBIGLYZE® XR para evaluar carcinogénesis, mutagénesis o alteraciones en la fertilidad. Los siguientes datos están basados en los hallazgos en los estudios con saxagliptina y metformina de manera individual.
Saxagliptina: Se hicieron estudios a dos años en ratones y ratas con dosis por vía oral de 50, 250, y 600 mg/kg/día y con 25, 75, 150, y 300 mg/kg/día, respectivamente. Saxagliptina no indujo tumores ni en ratones ni en ratas con las dosis más altas evaluadas. Las mayores dosis evaluadas en los ratones fueron equivalentes a aproximadamente 900 (machos) y 1,210 (hembras) veces la exposición en humanos a la dosis recomendada para uso humano (RHD) de 5 mg/día. En las ratas, las exposiciones fueron aproximadamente 370 (machos) y 2,300 (hembras) veces la RHD.
Se valoró el potencial mutagénico y clastogénico de saxagliptina con altas concentraciones y exposición en batería de estudios de toxicidad genética incluyendo un ensayo bacteriano de Ames in vitro, un ensayo citogenético in vitro en linfocitos primarios humanos, un ensayo en ratas in vivo de micronúcleo oral, un estudio in vivo de reparación oral DNA en ratas y un estudio citogenético oral in vivo/in vitro en linfocitos de sangre periférica en ratas. Saxagliptina no fue mutagénico ni clastogénico en base a los resultados combinados de estos estudios. El metabolito principal no fue mutagénico en un estudio bacteriano de Ames in vitro.
En un estudio de fertilidad en ratas, los machos fueron tratados con dosis de 100, 200, y 400 mg/kg/día por sonda oral durante dos semanas antes del apareamiento, durante el apareamiento y hasta el término programado (aproximadamente cuatro semanas en total), y las hembras fueron tratadas por sonda oral con dosis de 125, 300, y 750 mg/kg/día por dos semanas previas al apareamiento hasta el día 7 de la gestación. No se observaron eventos adversos sobre la fertilidad con dosis de 200 mg/kg/día (machos) o 125 mg/kg/día (hembras) como resultado de las exposiciones respectivas (AUC) de aproximadamente 630 (machos) y 805 (hembras) veces la exposición humana de la RHD. Con las dosis tóxicas maternas más altas (300 y 750 mg/kg/día), se observó una mayor resorción fetal (aproximadamente 2,150 y 6,375 veces la RHD). Se observaron efectos adicionales sobre el ciclo estrogénico, fertilidad, ovulación e implantación a dosis de 750 mg/kg (aproximadamente 6,375 veces la RHD).
Clorhidrato de metformina: Se han realizado estudios de carcinogenicidad a largo plazo en ratas (duración de la dosis de 104 semanas) y ratones (duración de la dosis de 91 semanas) con dosis hasta e incluyendo 900 mg/kg/día y 1,500 mg/kg/día, respectivamente. Ambas dosis son aproximadamente 4 veces la máxima dosis diaria recomendada en humanos de 2,000 mg en base a comparaciones de la superficie corporal. No se encontró evidencia de carcinogenicidad con metformina en ratones macho o hembra. Similarmente, no se observó potencial tumorígeno con metformina en ratas macho. Hubo, sin embargo, aumento en la incidencia de pólipos del estroma uterino de tipo benigno en ratas hembra tratadas con 900 mg/kg/día.
No hubo evidencia de potencial mutagénico con metformina en las siguientes pruebas in vitro: Prueba de Ames (S. typhimurium), prueba de mutación genética (células de linfoma de ratón) o prueba de aberraciones cromosómicas (linfocitos humanos). Los resultados de las pruebas in vivo de micronúcleo en ratones también fueron negativas.
La fertilidad de ratas macho o hembra permaneció inalterada cuando metformina fue administrada a dosis tan altas como 600 mg/kg/día, que es aproximadamente 3 veces la dosis diaria máxima recomendada en humanos en base a comparaciones con el área superficial corporal.
Teratogenicidad y alteraciones en el desarrollo fetal: La coadministración de saxagliptina y metformina a ratas y conejas preñadas durante el periodo de organogénesis, no fue ni embrioletal ni teratogénico en ninguna de las especies cuando se probaron a dosis que produjeran exposiciones sistémicas (AUC) superiores a 100 y 10 veces las dosis máximas recomendadas en humanos (DHMR) (saxagliptina 5 mg y metformina 2,000 mg), respectivamente, en ratas; y 249 y 1.1 veces las DHMR´s en conejos. En las ratas, la menor toxicidad del desarrollo se limitó a un aumento en la incidencia de osificación retrasada de las costillas, asociada con la toxicidad materna estuvo limitada a disminución ponderal de 5 a 6% en el curso de los días 13 a 18 de la gestación y reducción relacionada en el consumo materno de alimento. En los conejos, la coadministración fue poco tolerada y en un subgrupo de madres (12 de 30), se produjeron muertes, agonía o abortos. Sin embargo, entre las madres sobrevivientes con camadas evaluables, la toxicidad materna se limitó a reducciones marginales en el peso corporal durante el curso de la gestación los días 21 a 29; y la asociación con toxicidad del desarrollo en estas crías estuvo limitada a disminución en el peso corporal de 7%, y una baja incidencia de retraso en la osificación del hueso hioides fetal.
Saxagliptina: Saxagliptina no fue teratogénica a ninguna de las dosis evaluadas en ratas o conejos. A altas dosis en ratas, saxagliptina produjo un discreto y reversible retraso en el desarrollo en la osificación de la pelvis fetal a ³ 240 mg/kg/día (³ 1,560 veces la exposición humana [AUC] de la RHD). Se observó toxicidad materna y reducción del peso corporal fetal con 900 mg/kg/día (8,290 veces la RHD). En los conejos, los efectos de saxagliptina se limitaron a variaciones esqueléticas menores observadas solamente con dosis tóxica materna (200 mg/kg/día, exposiciones 1,420 veces la RHD).
Saxagliptina administrada a ratas hembra del día 6 de gestación al día 20 de lactancia, produjo una disminución en el peso corporal en las crías macho y hembra solamente con dosis tóxica materna (³ 250 mg/kg/día, exposiciones ³ 1,690 veces la RHD). No se observó toxicidad funcional o conductual en las crías de las ratas a las que se administró cualquier dosis de saxagliptina.
Clorhidrato de metformina: Metformina no fue teratogénico en ratas y conejos a dosis de hasta 600 mg/kg/día. Esto representa una exposición de aproximadamente 2 a 6 veces la dosis humana máxima recomendada de 2,000 mg en base a comparaciones del área de superficie corporal para ratas y conejos respectivamente. La determinación de concentraciones fetales demostró una barrera placentaria parcial a metformina.
Toxicología animal: Se realizó un estudio en perros a 3 meses con la combinación de saxagliptina y metformina. No se observó toxicidad a exposiciones AUC de 68 y 1.5 veces la DHMR para saxagliptina y metformina, respectivamente.
Saxagliptina: Saxagliptina produjo cambios cutáneos (escaras y/o úlceras) en las extremidades (cola, garras, escroto y/o nariz) y cambios microscópicos multiorgánicos con infiltración celular mononuclear e inflamación en monos macacos a dosis ³ 2 mg/kg/día por uno a tres meses (³ 7 veces la exposición humana a RHD). En un estudio a tres meses, con 3 mg/kg/día (³ 20 veces la exposición a la RHD) se observó mejoría cutánea durante el periodo de administración, con recuperación completa tanto de la piel como de los cambios microscópicos seguidos de un periodo de recuperación libre de medicamento. Los infiltrados celulares mononucleares o la inflamación son consideradas como una exacerbación de cambios anteriores comúnmente observados en los monos. El nivel de no efecto para la piel y los cambios microscópicos es de 0.3 mg/kg/día (uno [hembras] a tres [machos] veces RHD). No se observaron lesiones cutáneas similares en ratones, ratas o perros con exposiciones hasta 1,210, 2,300 o 55 veces la exposición humana a RHD, respectivamente. Las correlaciones clínicas de las lesiones cutáneas en los monos no han sido observadas en estudios clínicos en humanos con saxagliptina.
Saxagliptina produjo heces sanguinolentas/mucoides en perros (a exposiciones ³ 19 veces RHD) con un nivel de no efecto 4 veces RHD.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Saxagliptina: El metabolismo de saxagliptina está mediado principalmente por el citocromo P-450 3A4/5 (CYP3A4/5).
En los estudios in vitro, saxagliptina y su principal metabolito no inhibieron a ninguna de CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 o 3A4, ni indujeron a CYP1A2, 2B6, 2C9, o 3A4. Por lo tanto, no es de esperarse que saxagliptina altere la depuración metabólica de medicamentos coadministrados que sean metabolizados por estas enzimas. Saxagliptina tampoco es un inhibidor importante de P-glicoproteína (P-gp) ni un inductor de P-gp.
La unión in vitro de proteínas de saxagliptina y su principal metabolito en el suero humano es menor a los niveles detectables. De esta forma, la unión a proteínas no deberá tener una influencia importante sobre la farmacocinética de saxagliptina o de otros medicamentos.
Efecto de otros medicamentos sobre saxagliptina: En los estudios realizados en sujetos sanos, como se describe más adelante, la farmacocinética de saxagliptina, su principal metabolito, o la exposición a todos los componentes activos de saxagliptina (original + metabolito) no se alteró de manera importante por metformina, glibenclamida, pioglitazona, digoxina, simvastatina, diltiazem, ketoconazol, rifampicina, omeprazol, hidróxido de aluminio+ hidróxido de magnesio+ combinación de simeticona, o famotidina.
Metformina: La coadministración de una dosis única de saxagliptina (100 mg) y metformina (1,000 mg), un sustrato hOCT-1 y hOCT-2, disminuyeron la Cmáx. de saxagliptina en 21%; sin embargo, el AUC no cambió. Por lo tanto, las principales interacciones de KOMBIGLYZE® XR con otros sustratos hOCT-1 y hOCT-2 no es de esperarse.
Glibenclamida: La coadministración de una dosis única de saxagliptina (10 mg) y glibenclamida (5 mg), un sustrato CYP2C9, aumentaron la Cmáx. de saxagliptina en 8%; sin embargo, el AUC de saxagliptina no cambió. De esta forma, no son de esperarse interacciones importantes de KOMBIGLYZE® XR con otros sustratos CYP2C9.
Pioglitazona: La coadministración de múltiples dosis una vez al día de saxagliptina (10 mg) y pioglitazona (45 mg), sustratos CYP2C8 (mayor) y CYP3A4 (menor), no alteraron la farmacocinética de saxagliptina. Por lo tanto, no se esperan interacciones importantes entre KOMBIGLYZE® XR con otros sustratos CYP2C8.
Digoxina: La coadministración de múltiples dosis una vez al día de saxagliptina (10 mg) y digoxina (0.25 mg), un sustrato P-gp, no alteraron la farmacocinética de saxagliptina. Por lo tanto, no se esperan interacciones importantes de KOMBIGLYZE® XR con otros sustratos P-gp.
Simvastatina: La coadministración de múltiples dosis una vez al día de saxagliptina (10 mg) y simvastatina (40 mg), un sustrato CYP3A4/5, aumentaron la Cmáx. de saxagliptina en 21%; sin embargo, el AUC de saxagliptina no cambió. Por lo tanto, no se esperarían interacciones importantes de KOMBIGLYZE® XR con otros substratos de CYP3A4/5.
Diltiazem: La coadministración de una dosis única de saxagliptina (10 mg) y diltiazem (360 mg, formulación de larga acción en estado estable), un inhibidor moderado de CYP3A4/5, aumentaron la Cmáx. de saxagliptina en 63% y el AUC para todos los componentes activos de saxagliptina en 21%. Por lo tanto, no se esperan interacciones importantes de KOMBIGLYZE® XR con otros inhibidores moderados de la CYP3A4/5.
Ketoconazol: La coadministración de una dosis única de saxagliptina (100 mg) y ketoconazol (200 mg cada 12 horas en estado estable), un potente inhibidor de CYP3A4/5 y de P-gp, aumentaron la Cmáx. de saxagliptina en 62% y el AUC para todos los componentes activos de saxagliptina en 13%. Por lo tanto, no se esperan interacciones importantes de KOMBIGLYZE® XR con otros potentes inhibidores de CYP3A4/5 y P-gp.
Rifampicina: La coadministración de una dosis única de saxagliptina (5 mg) y rifampicina (600 mg una vez al día en estado de equilibrio), un potente inductor de CYP3A4/5 y P-gp, disminuyeron la Cmáx. de saxagliptina en 53% y el AUC para todos los componentes activos de saxagliptina en 26%. La inhibición de la actividad plasmática de DPP4 por KOMBIGLYZE® XR en un intervalo de dosis (24 h) no se vio alterada de manera importante por la coadministración de rifampicina.
Omeprazol: La coadministración de múltiples dosis una vez al día de saxagliptina (10 mg) y omeprazol (40 mg), los substratos CYP2C19 (mayor) y CYP3A4, un inhibidor de CYP2C19, y un inductor de MRP-3, no modificaron la farmacocinética de saxagliptina. Por lo tanto, no son de esperarse interacciones importantes de KOMBIGLYZE® XR con otros inhibidores de la CYP2C19 o inductores de MRP-3.
Hidróxido de aluminio+ hidróxido de magnesio+ simeticona: La coadministración de una dosis única de saxagliptina (10 mg) y un líquido conteniendo hidróxido de aluminio (2,400 mg), hidróxido de magnesio (2,400 mg) y simeticona (240 mg) disminuyeron la Cmáx. de saxagliptina en 26%; sin embargo, el AUC de saxagliptina no cambió. Por lo tanto, no se esperan interacciones importantes de KOMBIGLYZE® XR con formulaciones antiácidas y antiflatulentas.
Famotidina: La administración de una dosis única de saxagliptina (10 mg) tres horas después de una dosis única de famotidina (40 mg), un inhibidor de hOCT-1, hOCT-2, y hOCT-3, aumentaron la Cmáx. de saxagliptina en 14%; sin embargo, el AUC de saxagliptina no cambió. Por lo tanto, no se esperan interacciones importantes de KOMBIGLYZE® XR con otros inhibidores de hOCT 1, hOCT-2, y hOCT-3.
Efecto de saxagliptina sobre otros medicamentos: En estudios realizados en sujetos sanos, como se describe adelante, saxagliptina no altera de manera importante la farmacocinética de metformina, glibenclamida, pioglitazona, digoxina, simvastatina, diltiazem, ketoconazol, o anticonceptivos orales combinados con estrógeno/progestina.
Metformina: La coadministración de una dosis única de saxagliptina (100 mg) y metformina (1000 mg), los sustratos hOCT-1 y hOCT-2, no modificaron la farmacocinética de metformina en sujetos sanos. Por lo tanto, saxagliptina no es un inhibidor del transporte mediado por hOCT-1 y hOCT-2.
Glibenclamida: La coadministración de una dosis única de saxagliptina (10 mg) y glibenclamida (5 mg), un sustrato CYP2C9, aumentaron la Cmáx. plasmática de glibenclamida en 16%; sin embargo, el AUC de glibenclamida no cambió. Por lo tanto, saxagliptina no inhibe de forma importante el metabolismo mediado por CYP2C9.
Pioglitazona: La coadministración de múltiples dosis una vez al día de saxagliptina (10 mg) y pioglitazona (45 mg), un sustrato CYP2C8, aumentaron la Cmáx. plasmática de pioglitazona en 14%; sin embargo, el AUC de pioglitazona no cambió. Por lo tanto, saxagliptina no inhibe ni induce de manera importante el metabolismo mediado por CYP2C8.
Digoxina: La coadministración de múltiples dosis una vez al día de saxagliptina (10 mg) y digoxina (0.25 mg), un sustrato P-gp, no modificaron la farmacocinética de digoxina. Por lo tanto, saxagliptina no es un inhibidor o inductor del transporte mediado por P-gp.
Simvastatina: La coadministración de múltiples dosis una vez al día de saxagliptina (10 mg) y simvastatina (40 mg), un sustrato CP3A4/5, no modificaron la farmacocinética de simvastatina. Por lo tanto, saxagliptina no es un inhibidor o inductor del metabolismo mediado por CYP3A4/5.
Diltiazem: La coadministración de múltiples dosis una vez al día de saxagliptina (10 mg) y diltiazem (360 mg, formulación de larga acción en estado de equilibrio), un inhibidor moderado de CYP3A4/5, aumentaron la Cmáx. plasmática de diltiazem en 16%; sin embargo, el AUC de diltiazem no cambió. Por lo tanto, KOMBIGLYZE® XR no altera de manera importante la farmacocinética de los inhibidores moderados de CYP3A4/5.
Ketoconazol: La coadministración de una dosis única de saxagliptina (100 mg) y dosis múltiples de ketoconazol (200 mg cada 12 horas en estado de equilibrio), un potente inhibidor de CYP3A4/5 y P-gp, disminuyó la Cmáx. plasmática y el AUC de ketoconazol en 16 y 13%, respectivamente. Por lo tanto, saxagliptina no alteraría de forma importante la farmacocinética de potentes inhibidores de CYP3A4/5 y P-gp.
Anticonceptivos orales: La coadministración de múltiples dosis una vez al día de saxagliptina (5 mg) y Ortho Cyclen® (0.035 mg etinil estradiol/0.250 mg norgestimato), un anticonceptivo oral durante 21 días, no modificaron la farmacocinética en estado de equilibrio del principal componente estrogénico activo, etinil estradiol, o el principal componente progestágeno activo, norelgestromina. Cuando saxagliptina fue coadministrada con Ortho Cyclen®, el AUC plasmática de norgestrel, un metabolito activo de norelgestromina, aumentó en 13% y la Cmáx. plasmática de norgestrel aumentó 17%. Estos cambios de poca magnitud en el AUC y la Cmáx. de norgestrel no es considerada clínicamente importante. Basados en estos hallazgos, no se espera que saxagliptina altere de forma importante la farmacocinética de un anticonceptivo oral combinado de estrógeno/progestina.
Medicamentos catiónicos:
Clorhidrato de metformina: Medicamentos catiónicos (por ejemplo, amilorida, digoxina, morfina, procainamida, quinidina, quinina, ranitidina, triamtereno, trimetoprima, o vancomicina) son eliminados por secreción tubular renal; teóricamente tienen un potencial de interacción con metformina por competencia de los sistemas de transporte renal tubular. Dicha interacción entre metformina y cimetidina oral ha sido observada en voluntarios sanos normales tanto con la dosis única como dosis múltiple, estudio de interacción con metformina-cimetidina, con 60% de aumento en la concentración plasmática máxima de metformina y en las concentraciones en sangre total y un aumento de 40% en el AUC de metformina plasmática y en sangre total. No hubo cambios en la vida media de eliminación en el estudio con dosis única. Metformina no tuvo efectos sobre la farmacocinética de cimetidina. Sin embargo, aunque dichas interacciones permanecen teóricas (a excepción de cimetidina), se recomienda monitorear cuidadosamente al paciente y ajustar la dosis de metformina y/o de los medicamentos que interfieran en pacientes que estén tomando medicamentos catiónicos que sean excretados por el sistema secretorio renal del túbulo proximal.
Glibenclamida:
Clorhidrato de metformina: En un estudio de interacción con dosis única en pacientes con diabetes tipo 2, la coadministración de metformina y glibenclamida no ocasionó ningún cambio en la farmacocinética ni en la farmacodinamia de metformina. Se observaron disminuciones en el AUC de glibenclamida y en la concentración máxima (Cmáx.), pero de forma altamente variable. La naturaleza de la dosis única en este estudio y la falta de correlación entre los niveles sanguíneos de glibenclamida y los efectos farmacodinámicos, hacen que la importancia clínica de esta interacción se considere incierta.
Furosemida:
Clorhidrato de metformina: En un estudio de interacción medicamentosa de metformina-furosemida, con sujetos sanos y dosis única, se demostró que los parámetros farmacocinéticos de ambos compuestos se vieron afectados con la coadministración. Furosemida aumentó la concentración plasmática de metformina y la Cmáx. en 22% y el AUC sanguínea en 15%, sin ningún cambio importante en la depuración renal de metformina. Cuando furosemida fue administrada con metformina, la Cmáx. y el AUC de furosemida fueron 31 y 12% menores, respectivamente, que cuando se administraron solas, y la vida media terminal disminuyó en 32%, sin ningún cambio significativo en la depuración renal de furosemida. No existe información disponible sobre la interacción de metformina y furosemida cuando son coadministradas de manera crónica.
Nifedipino:
Clorhidrato de metformina: En un estudio de interacción medicamentosa en voluntarios sanos, con dosis única de metformina-nifedipino, se demostró que la coadministración de nifedipina aumentó la Cmáx. de metformina y el AUC en 20 y 9%, respectivamente, y aumentó la cantidad excretada por la orina. La Tmáx. y la vida media permanecieron inalteradas. Nifedipino aparentemente aumenta la absorción de metformina. Metformina tuvo efectos mínimos sobre nifedipino.
Uso con otros medicamentos:
Clorhidrato de metformina: Algunos medicamentos tienden a producir hiperglucemia y pueden provocar una pérdida del control glucémico. Estos medicamentos incluyen las tiazidas y otros diuréticos, corticosteroides, fenotiazinas, productos tiroideos, estrógenos, anticonceptivos orales, fenitoína, ácido nicotínico, simpaticomiméticos, bloqueadores de los canales de calcio, e isoniazida. Cuando dichos medicamentos son administrados a un paciente que recibe metformina, el paciente deberá ser observado muy de cerca por la pérdida del control de glucosa sanguínea. Cuando dichos medicamentos son interrumpidos en un paciente que recibe metformina, el paciente deberá ser observado cuidadosamente por el riesgo de desarrollar hipoglucemia.
En voluntarios sanos, la farmacocinética de metformina y propranolol y de metformina e ibuprofeno, no se ve afectada cuando se coadministran en estudios de interacción con dosis única.
Metformina se une de manera insignificante a las proteínas plasmáticas y, por lo tanto, es poco probable que interactúe con medicamentos que se unen de forma importante a las proteínas plasmáticas como los salicilatos, sulfonamidas, cloranfenicol y probenecida, comparativamente con las sulfonilureas que se unen fuertemente a las proteínas séricas.
Otras interacciones: Los efectos del tabaquismo, la dieta, los productos herbolarios y el uso del alcohol sobre la farmacocinética de KOMBIGLYZE® XR no han sido estudiados específicamente.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Cuenta absoluta de linfocitos:
Saxagliptina: Entre estudios clínicos, la incidencia de los eventos adversos de laboratorio fue similar en pacientes tratados con saxagliptina 5 mg en comparación con los pacientes tratados con placebo. Se ha observado una pequeña disminución en la cuenta absoluta de linfocitos. A partir de un valor basal de la cuenta absoluta de linfocitos de aproximadamente 2,200 células/microL, se observó una disminución promedio de aproximadamente 100 células/microL comparado con placebo, en un análisis combinado de cinco estudios clínicos controlados con placebo. Los promedios de cuentas absolutas de linfocitos permanecieron estables y dentro de los límites normales con una dosificación diaria de hasta 102 semanas de duración. La disminución en la cuenta de linfocitos no se asoció con las reacciones adversas clínicamente relevantes. No se conoce la significancia clínica de esta disminución en la cuenta de linfocitos en comparación con el placebo.
En el estudio SAVOR, se reportó reducción del recuento de linfocitos en 0.5% de los pacientes tratados con saxagliptina y 0.4% en los pacientes tratados con placebo.
Niveles de vitamina B12:
Clorhidrato de metformina: En estudios clínicos controlados con metformina con una duración de 29 semanas, se observó una disminución a niveles subnormales de los niveles séricos previamente normales de vitamina B12, sin manifestaciones clínicas en aproximadamente 7% de los pacientes. Dicha disminución, probablemente secundaria a la interferencia en la absorción de vitamina B12 del complejo del factor intrínseco de vitamina B12, está muy raramente asociada con anemia y aparentemente parece ser rápidamente reversible con la suspensión de metformina o suplementos de vitamina B12 (véase Precauciones generales).
PRECAUCIONES GENERALES:
Acidosis láctica:
Clorhidrato de metformina: La acidosis láctica es una complicación metabólica rara, pero grave, que puede presentarse por la acumulación de metformina durante el tratamiento con KOMBIGLYZE® XR; cuando se presenta, es fatal en aproximadamente 50% de los casos. La acidosis láctica también puede presentarse asociada con un número de condiciones fisiopatológicas, incluyendo diabetes mellitus, y cuando exista hipoperfusión e hipoxemia tisular significativas. La acidosis láctica está caracterizada por niveles elevados de lactato sanguíneo (> 5 mmol/L), disminución del pH sanguíneo, alteraciones electrolíticas con aumento de la brecha aniónica, y aumento del índice lactato/piruvato. Cuando metformina está implicada como la causa de acidosis láctica, generalmente se encuentran niveles plasmáticos de metformina > 5 µg/mL.
La incidencia reportada de acidosis láctica en pacientes en tratamiento con clorhidrato de metformina es muy baja (aproximadamente 0.03 casos/1,000 pacientes-año, con aproximadamente 0.015 casos fatales/1,000 pacientes-año). En más de 20,000 pacientes-año de exposición a metformina en estudios clínicos, no hubo reportes de acidosis láctica. Los casos reportados se presentaron principalmente en pacientes diabéticos con insuficiencia renal significativa, incluyendo tanto enfermedad renal intrínseca e hipoperfusión renal, frecuentemente en el contexto de múltiples problemas médicos/quirúrgicos concomitantes y múltiples medicamentos concomitantes. Los pacientes con insuficiencia cardiaca congestiva que necesitan tratamiento farmacológico, particularmente aquéllos con insuficiencia cardiaca congestiva aguda o inestable que están en riesgo de hipoperfusión e hipoxemia, se encuentran en mayor riesgo de acidosis láctica. El riesgo de acidosis láctica aumenta con el grado de mal funcionamiento renal y la edad del paciente. El riesgo de acidosis láctica puede, por lo tanto, disminuir significativamente por el monitoreo frecuente de la función renal en pacientes que toman metformina y por el uso de una dosis efectiva mínima de metformina. En particular, el tratamiento en pacientes de edad avanzada deberá acompañarse con un monitoreo cuidadoso del funcionamiento renal. El tratamiento con metformina no deberá ser iniciado en pacientes ³ 80 años de edad, a menos que las mediciones de depuración de creatinina demuestren que no existe disminución del funcionamiento renal, debido a que estos pacientes son más susceptibles para desarrollar acidosis láctica. Además, metformina deberá ser retirada inmediatamente ante la presencia de cualquier condición relacionada con hipoxemia, deshidratación o sepsis. Debido a que el daño de funcionamiento hepático puede limitar de manera importante la capacidad de depurar el lactato, metformina deberá generalmente ser evitada en pacientes con evidencia clínica o de laboratorio de enfermedad hepática. Los pacientes deberán ser alertados contra el consumo excesivo de alcohol, tanto agudo como crónico, cuando estén bajo tratamiento con metformina ya que el alcohol potencializa los efectos del clorhidrato de metformina sobre el metabolismo de lactato. Adicionalmente, metformina deberá ser suspendida temporalmente antes de cualquier estudio con radiocontraste intravascular y durante cualquier procedimiento quirúrgico.
El inicio de acidosis láctica generalmente es sutil y se acompaña de síntomas inespecíficos como malestar, mialgias, insuficiencia respiratoria, somnolencia acentuada, y malestar abdominal inespecífico. Puede estar asociado con hipotermia, hipotensión y bradiarritmias resistentes con acidosis más acentuada. El paciente y el médico del paciente deberán estar alertas de la posible importancia de dichos síntomas y el paciente deberá ser instruido para notificar inmediatamente a su médico si éstos se presentan (véase Precauciones generales). Metformina deberá ser interrumpida hasta aclarar la situación. Pueden ser útiles los electrólitos séricos, cetonas, glucosa sanguínea, y si está indicado, pH sanguíneo, niveles de lactato, y aún más, los niveles sanguíneos de metformina. Una vez que el paciente se estabiliza con cualquier dosis de metformina, los síntomas gastrointestinales, que son comunes al inicio del tratamiento, es poco probable que estén relacionados con el medicamento. La presencia tardía de síntomas gastrointestinales podría deberse a acidosis láctica u otra enfermedad grave.
Los niveles plasmáticos en ayuno del lactato venoso por arriba del límite superior normal, pero menos de 5 mmol/L, en pacientes tomando metformina, no necesariamente indican acidosis láctica inminente y pueden ser explicados por otros mecanismos, como una diabetes pobremente controlada u obesidad, actividad física intensa o problemas técnicos en el manejo de la muestra.
La acidosis láctica deberá sospecharse en cualquier paciente diabético con acidosis metabólica con ausencia de evidencia de cetoacidosis (cetonuria y cetonemia). La acidosis láctica es una urgencia médica que deberá ser tratada en el medio hospitalario. En un paciente con acidosis láctica que esté tomando metformina, el medicamento deberá suspenderse inmediatamente y se deberán instalar inmediatamente medidas de apoyo general. Debido a que el clorhidrato de metformina es dializable (con una depuración por arriba de los 170 mL/min bajo buenas condiciones hemodinámicas), la hemodiálisis rápida está recomendada para corregir la acidosis y eliminar la metformina acumulada. Dicho manejo generalmente produce una rápida remisión de síntomas y recuperación (véase Contraindicaciones).
Evaluación de la función renal:
Clorhidrato de metformina: Se sabe que metformina se excreta principalmente por los riñones y que el riesgo de acumulación de metformina y de acidosis láctica aumenta con el grado de daño del funcionamiento renal. Así que los pacientes con niveles séricos de creatinina por arriba del límite superior normal para su edad, no deberán recibir KOMBIGLYZE® XR. En pacientes de edad avanzada, KOMBIGLYZE® XR deberá ser titulada cuidadosamente para establecer la dosis mínima para el efecto glucémico adecuado porque el envejecimiento está asociado con disminución de la función renal. En pacientes de edad avanzada, principalmente aquéllos mayores de 80 de edad, el funcionamiento renal deberá monitorearse frecuentemente y generalmente, KOMBIGLYZE® XR no deberá ser titulada a la dosis máxima de metformina.
Antes de iniciar el tratamiento con KOMBIGLYZE® XR, y posteriormente al menos una vez al año, se deberá valorar el funcionamiento renal y verificar su normalidad. En pacientes en quienes se anticipe el desarrollo de un mal funcionamiento renal, deberá valorarse con mayor frecuencia la función renal y suspenderse KOMBIGLYZE® XR ante la evidencia presente de daño renal (véase Dosis y vía de administración).
Insuficiencia hepática:
Clorhidrato de metformina: Debido a que el daño en la función hepática ha sido asociado con algunos casos de acidosis láctica, KOMBIGLYZE® XR generalmente, deberá evitarse en pacientes con evidencia clínica o de laboratorio de enfermedad hepática.
Niveles de vitamina B12:
Clorhidrato de metformina: En estudios clínicos controlados con metformina durante 29 semanas, se observó en aproximadamente 7% de los pacientes una disminución hacia niveles subnormales de los niveles séricos previamente normales de vitamina B12, sin manifestaciones clínicas. Dicha disminución, posiblemente debida a una interferencia entre la absorción de vitamina B12 del complejo intrínseco del factor B12, es, por lo tanto, una asociación muy rara con anemia y parece ser rápidamente reversible al suspender metformina o los suplementos de vitamina B12. Se sugieren mediciones anuales de los parámetros hematológicos en pacientes bajo tratamiento con KOMBIGLYZE® XR, y cualquier anormalidad aparente deberá ser investigada y manejada adecuadamente.
Algunos individuos (aquéllos con ingesta u absorción inadecuada de vitamina B12 o calcio) parecen estar predispuestos a desarrollar niveles subnormales de vitamina B12. En estos pacientes, puede ser muy útil la medición rutinaria de vitamina B12 en suero a intervalos de 2 a 3 años.
Consumo de alcohol:
Clorhidrato de metformina: Se sabe que el alcohol potencializa el efecto de metformina sobre el metabolismo de lactato. Los pacientes, por lo tanto, deben ser advertidos contra el consumo excesivo de alcohol, agudo o crónico, mientras estén recibiendo KOMBIGLYZE® XR.
Procedimientos quirúrgicos:
Clorhidrato de metformina: El empleo de KOMBIGLYZE® XR deberá ser interrumpido temporalmente por cualquier procedimiento quirúrgico (a excepción de procedimientos menores no asociados con la restricción de la ingesta de alimentos o líquidos) y no deberá reiniciarse hasta que la ingesta oral del paciente haya sido restablecida y la función renal se haya valorado como normal.
Cambios en el estado clínico de pacientes con diabetes tipo 2 previamente controlada:
Clorhidrato de metformina: Un paciente con diabetes tipo 2 bien controlado previamente con KOMBIGLYZE® XR, que desarrolle alteraciones de laboratorio o enfermedad clínica (enfermedad especialmente vaga y poco definida) deberá ser valorado inmediatamente para evidenciar cetoacidosis o acidosis láctica. La evaluación deberá incluir los niveles de electrólitos séricos y cetonas, glucosa sanguínea y, si está indicado, pH sanguíneo, lactato, piruvato y niveles de metformina. Si se presenta acidosis de cualquier índole, se deberá interrumpir KOMBIGLYZE® XR inmediatamente y se iniciaran otras medidas correctivas apropiadas.
Uso con medicamentos que se conoce provocan hipoglucemia: Se sabe que los agentes antihiperglucémicos de la clase de la sulfonilurea y la insulina provocan hipoglucemia. Por lo tanto, puede ser requerida una dosis menor de sulfonilurea o insulina para reducir el riesgo de hipoglucemia cuando se utiliza en combinación con KOMBIGLYZE® XR (véase Reacciones secundarias y adversas).
Medicamentos concomitantes que afectan el funcionamiento renal o la disposición de metformina:
Clorhidrato de metformina: Los medicamentos concomitantes que pueden alterar el funcionamiento renal o producir cambios hemodinámicos importantes, o que puedan interferir con la disposición de metformina como los medicamentos catiónicos que son eliminados por secreción tubular renal (véase Interacciones medicamentosas y de otro género), deberán administrarse con precaución.
Estudios radiológicos con administración intravascular de materiales de contraste yodados:
Clorhidrato de metformina: Los estudios intravasculares con medios de contraste yodados pueden provocar alteración aguda del funcionamiento renal y han sido relacionados con acidosis láctica en pacientes en tratamiento con metformina (véase Contraindicaciones). Por lo tanto, pacientes en quienes se planea hacer este estudio, KOMBIGLYZE® XR deberá suspenderse temporalmente en el momento o antes del procedimiento y mantenerse durante 48 horas posteriores al procedimiento y reiniciarse solamente cuando la función renal haya sido revalorada y se haya encontrado normal.
Estados hipóxicos:
Clorhidrato de metformina: El colapso cardiovascular (shock) de cualquier causa, insuficiencia cardiaca congestiva aguda, infarto agudo al miocardio y otras condiciones caracterizadas por hipoxemia se han relacionado con acidosis láctica y también pueden provocar uremia prerrenal. Cuando estos eventos se presentan durante el tratamiento con KOMBIGLYZE® XR, el medicamento deberá suspenderse inmediatamente.
Pérdida del control de la glucosa sanguínea:
Clorhidrato de metformina: Cuando un paciente estabilizado con cualquier régimen diabético es expuesto a estrés como fiebre, trauma, infecciones o cirugía, puede presentarse una pérdida temporal del control glucémico. Como algunas veces, puede ser necesario interrumpir la administración de KOMBIGLYZE® XR y administrar insulina temporalmente, KOMBIGLYZE® XR puede reiniciarse después de que se resuelva el episodio agudo.
Reacciones de hipersensibilidad:
Saxagliptina: Durante la experiencia postcomercialización, los siguientes eventos adversos se han reportado con el uso de saxagliptina: reacciones graves de hipersensibilidad, incluyendo anafilaxis y angioedema. Debido a que estas reacciones se informan voluntariamente en una población de tamaño incierto, no es posible estimar de manera confiable su frecuencia. Si se sospecha de una reacción grave de hipersensibilidad a saxagliptina, suspéndase el uso de KOMBIGLYZE® XR, evalúe otras potenciales causas del acontecimiento y establezca un tratamiento alternativo para la diabetes (véase Contraindicaciones y Reacciones secundarias y adversas).
Pancreatitis:
Saxagliptina: Durante la experiencia postcomercialización, se han recibido reportes de eventos adversos espontáneos de pancreatitis aguda. Los pacientes deben ser informados de los síntomas característicos de la pancreatitis aguda: dolor abdominal severo y persistente. Si se sospecha de pancreatitis, el uso de KOMBIGLYZE® XR debe ser suspendido (véase Reacciones secundarias y adversas).
En la evaluación de resultados vasculares registrados en pacientes con diabetes mellitus-trombólisis en infarto de miocardio, estudio SAVOR, por sus siglas en inglés (Saxagliptin Assesment of Vascular Outcomes Recorder), la incidencia de eventos de pancreatitis relacionados fue de 0.3%, tanto en pacientes tratados con saxagliptina como en pacientes tratados con placebo en la población con intención de tratamiento (véase Reacciones secundarias y adversas).
Uso pediátrico: No se ha establecido la seguridad y eficacia de KOMBIGLYZE® XR en pacientes pediátricos.
Uso geriátrico: Debido a que saxagliptina y metformina son parcialmente eliminados por el riñón y debido a que los pacientes de edad avanzada son más proclives a tener una disminución del funcionamiento renal, KOMBIGLYZE® XR deberá emplearse con precaución al aumentar la edad (véase Dosis y vía de administración).
Saxagliptina: De los 16,492 pacientes distribuidos aleatoriamente en el estudio SAVOR, 8,561 pacientes (51.9%) tenían 65 años o más y 2,330 (14.1%) tenían 75 años o más. El número de pacientes de 65 años o más tratados con saxagliptina en el estudio SAVOR fue de 4,290, mientras que el número de pacientes mayores de 75 años fue de 1,169.
Del número total de sujetos (N = 4,148) en seis estudios doble ciego, controlados, de seguridad clínica y eficacia de saxagliptina, 634 (15.3%) pacientes tenían 65 años de edad o más, de los cuales 59 (1.4%) pacientes tenían 75 años y más. No se observaron diferencias globales en la seguridad o eficacia entre los sujetos mayores de 65 y 75 años y entre sujetos más jóvenes.
Clorhidrato de metformina: Los estudios clínicos controlados con metformina no incluyeron un número suficiente de pacientes de edad avanzada para determinar si su respuesta era distinta a la de pacientes más jóvenes; sin embargo, otros estudios clínicos reportados no identificaron diferencias en las respuestas entre los pacientes de edad avanzada y jóvenes. Se sabe que metformina es excretada sustancialmente por los riñones, y debido al riesgo de reacciones adversas graves al medicamento es mayor en pacientes con funcionamiento renal alterado, por lo que metformina solamente deberá ser empleada en pacientes con función renal normal. La dosis inicial y de mantenimiento de metformina deberá ser conservadora en pacientes con edad avanzada, por su potencial para disminuir la función renal en esta población. Cualquier ajuste en la dosis deberá basarse en una evaluación cuidadosa de la función renal (véase Contraindicaciones, Precauciones generales y Farmacocinética y farmacodinamia).
Efectos sobre la habilidad para conducir y usar maquinaria: No se han realizado estudios con KOMBIGLYZE® XR sobre los efectos en la habilidad para conducir y utilizar maquinaria. Sin embargo, saxagliptina o metformina pueden tener una influencia significativa en la capacidad para conducir y usar maquinaria. Hay que tener en cuenta que se han reportado mareos con el uso de saxagliptina.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Dosis recomendada: La dosis de tratamiento antihiperglucémico de KOMBIGLYZE® XR debe individualizarse en base al régimen actual del paciente, la eficacia y la tolerabilidad, mientras no exceda la dosis máxima recomendada de saxagliptina 5 mg y metformina de liberación prolongada de 2,000 mg.
KOMBIGLYZE® XR generalmente deberá administrarse una vez al día con los alimentos vespertinos, con una titulación gradual de la dosis para reducir los efectos secundarios gastrointestinales asociados con metformina. Están disponibles las siguientes formas de administración:
• KOMBIGLYZE® XR (saxagliptina/HCL de metformina liberación prolongada) tabletas 5 mg/500 mg.
• KOMBIGLYZE® XR (saxagliptina/HCL de metformina liberación prolongada) tabletas 5 mg/1,000 mg.
• KOMBIGLYZE® XR (saxagliptina/HCL de metformina liberación prolongada) tabletas 2.5 mg/1,000 mg.
Si el tratamiento con una tableta combinada que contiene saxagliptina y metformina se considera adecuado, la dosis recomendada de saxagliptina es de 5 mg una vez al día. La dosis inicial recomendada de metformina de liberación prolongada es de 500 mg una vez al día, que puede titularse hasta 2,000 mg una vez al día. La dosis máxima de KOMBIGLYZE® XR es saxagliptina 5 mg/metformina liberación prolongada 2,000 mg, administrada como dos tabletas de 2.5 mg/1,000 mg una vez al día.
No se han realizado estudios que examinen específicamente la seguridad y la eficacia de KOMBIGLYZE® XR en pacientes tratados previamente con otros medicamentos antihiperglucémicos y que cambian a KOMBIGLYZE® XR. Cualquier cambio en el tratamiento de la diabetes tipo 2 deberá realizarse con cuidado y con el monitoreo adecuado ya que pueden presentarse cambios en el control glucémico.
Los pacientes deberán ser informados de que las tabletas de KOMBIGLYZE® XR deben ingerirse completas y nunca triturarlas, cortarlas ni masticarlas. Ocasionalmente, los ingredientes inactivos de KOMBIGLYZE® XR serán eliminados en las heces como una masa suave, hidratada, que puede semejar a la tableta original.
Insuficiencia renal: KOMBIGLYZE® XR está contraindicado en pacientes con insuficiencia renal (véase Contraindicaciones).
Insuficiencia hepática: Debido a que el daño del funcionamiento hepático ha sido relacionado con algunos casos de acidosis láctica en pacientes tratados con metformina, generalmente deberá evitarse el uso de KOMBIGLYZE® XR en pacientes con evidencia clínica o de laboratorio de daño hepático (véase Precauciones generales).
Pediatría y adolescencia: No han sido comprobadas la seguridad y eficacia de KOMBIGLYZE® XR en pacientes pediátricos y adolescentes.
Geriatría: Como saxagliptina y metformina son eliminadas parcialmente por los riñones, y debido a que los pacientes de edad avanzada son más proclives a tener una función renal disminuida, KOMBIGLYZE® XR deberá emplearse con precaución conforme aumenta la edad (véase Precauciones generales).
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Saxagliptina: Saxagliptina administrada una vez al día por vía oral, ha demostrado ser segura y bien tolerada, sin efecto clínicamente significativo sobre el intervalo QTc o el ritmo cardiaco a dosis hasta de 400 mg diariamente durante dos semanas (80 veces la dosis recomendada para humanos de 5 mg/día).
En el caso de una sobredosis, se deberá iniciar un tratamiento de apoyo adecuado de acuerdo con el estado clínico del paciente. Saxagliptina y su principal metabolito se eliminan con hemodiálisis (23% de la dosis en cuatro horas).
Clorhidrato de metformina: La alta sobredosis o los riesgos concomitantes de metformina pueden provocar acidosis láctica. La acidosis láctica es una emergencia médica y debe ser tratada en el hospital. El método más efectivo de eliminar el lactato y la metformina es la hemodiálisis. Se han reportado casos de hipoglucemia con sobredosificación de metformina, a pesar de que la asociación causal no ha sido establecida.
PRESENTACIONES:
Caja con 14, 28 y 56 tabletas con 5 mg de saxagliptina/500 mg de clorhidrato de metformina de liberación prolongada.
Caja con 14, 28 y 56 tabletas con 5 mg de saxagliptina/1,000 mg de clorhidrato de metformina de liberación prolongada.
Caja con 28 y 56 tabletas con 2.5 mg de saxagliptina/1,000 mg de clorhidrato de metformina de liberación prolongada.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a no más de 30°C y en lugar seco. Consérvese la caja bien cerrada.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. No debe ser utilizado durante el embarazo ni la lactancia. No se deje al alcance de los niños. Literatura exclusiva para médicos.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx y
patientsafety.mexico@astrazeneca.com

AstraZeneca S. A. de C. V.
Súper Avenida Lomas Verdes No. 67
Fracc. Lomas Verdes, C.P. 53120
Naucalpan de Juárez, México
Reg. Núm. 138M2012, SSA IV
153300001T0015/RM2015