
EFFIENT
PRASUGREL
Tabletas recubiertas
1 Caja,14 Tabletas recubiertas,10 mg
1 Caja,14 Tabletas recubiertas,5 mg
1 Caja,28 Tabletas recubiertas,10 mg
1 Caja,28 Tabletas recubiertas,5 mg
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA recubierta contiene:
Clorhidrato de prasugrel equivalente a 5 o 10 mg de prasugrel
Excipiente, c.b.p. 1 tableta.
El clorhidrato de prasugrel es un nuevo miembro de la clase de las tienopiridinas, agentes antiplaquetarios, que inhiben la activación y la agregación plaquetarias mediante la unión irreversible de su metabolito activo a los receptores del tipo P2Y12 de difosfato de adenosina (ADP) de las plaquetas. La estructura química del clorhidrato de prasugrel se muestra en la siguiente figura.
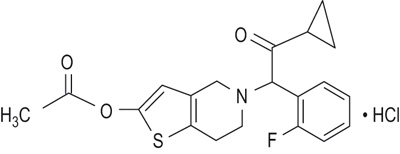
El clorhidrato de prasugrel tiene la fórmula molecular C20H20FNO3S•HCl con un peso molecular de 409.90 y existe como un sólido de color blanco a café claro.
EFFIENT® está disponible en tabletas recubiertas que contienen 5 o 10 mg de clorhidrato de prasugrel. Los ingredientes inactivos son monohidrato de lactosa; celulosa microcristalina, manitol, croscarmelosa de sodio, hipromelosa, estearato de magnesio, dióxido de titanio, triacetina, óxido de hierro rojo, óxido de hierro amarillo y talco.
INDICACIONES TERAPÉUTICAS: EFFIENT® está indicado para reducir la incidencia de eventos trombóticos cardiovasculares en síndromes coronarios agudos en:
• Pacientes con angina inestable (UA) o infarto miocárdico sin elevación del segmento ST (NSTEMI) que son manejados con intervención coronaria percutánea (PCI).
• Pacientes con infarto miocárdico con elevación del segmento ST (STEMI), que son manejados con intervención coronaria percutánea (PCI) primaria o electiva.
EFFIENT® está indicado para la reducción de trombosis del stent en síndromes coronarios agudos.
EFFIENT® ha demostrado reducir la frecuencia del parámetro final combinado, compuesto por muerte cardiovascular, infarto miocárdico no mortal y accidente vascular cerebral no mortal comparado con clopidogrel.
Debido a que la gran mayoría de los casos de síndrome coronario agudo son manejados sin cirugía de revascularización coronaria, se puede considerar el tratamiento antes de determinar la anatomía coronaria, si la necesidad de cirugía de revascularización coronaria se considera poco probable. Las ventajas del tratamiento temprano con prasugrel deben ser balanceadas con el incremento en el riesgo de sangrado en pacientes que requieran ser sometidos a cirugía de revascularización coronaria de urgencia.
FARMACOCINÉTICA Y FARMACODINAMIA:
Farmacodinamia: El clorhidrato de prasugrel es un inhibidor de la agregación y activación plaquetarias que actúa mediante la unión específica e irreversible de su metabolito activo al receptor plaquetario de ADP del tipo P2Y12 y como consecuencia inhibe numerosas actividades plaquetarias mediadas por ADP.
Debido a que las plaquetas participan en el inicio y/o en la evolución de las complicaciones trombóticas de la enfermedad ateroesclerótica, la inhibición de la función plaquetaria puede producir una reducción de la tasa de eventos cardiovasculares tales como muerte, infarto miocárdico o accidente vascular cerebral.
Después de una dosis de carga de clorhidrato de prasugrel de 60 mg, la inhibición de la agregación plaquetaria inducida por ADP ocurrió a los 15 minutos con 5 µM de ADP y a los 30 minutos con 20 µM de ADP. La inhibición máxima de la agregación plaquetaria inducida por ADP producida por clorhidrato de prasugrel es de un 83% con 5 µM de ADP y de 79% con 20 µM de ADP, logrando al menos un 50% de inhibición de la agregación plaquetaria después de 1 hora en un 89% de sujetos sanos y pacientes con ateroesclerosis estable con ambas concentraciones de ADP. La inhibición de la agregación plaquetaria mediada por clorhidrato de prasugrel mostró una variabilidad baja (9%) entre sujetos y dentro del sujeto (12%) con ambas concentraciones (5 µM y 20 µM) de ADP.
La inhibición promedio en estado estable de la agregación plaquetaria fue del 74 y 69% respectivamente, para 5 µM y 20 µM de ADP, y se alcanzó después de 3 a 5 días de una dosis de mantenimiento de 10 mg de clorhidrato de prasugrel precedida por una dosis de carga de 60 mg. Más del 98 % de los sujetos presentaron una inhibición de la agregación plaquetaria ³ 20% durante la dosis de mantenimiento.
La agregación plaquetaria volvió gradualmente a los valores basales después del tratamiento, entre 7 y 9 días posteriores a la administración de una dosis única de carga de 60 mg de clorhidrato de prasugrel y en 5 días después de interrumpir la dosis de mantenimiento en estado estable.
Clopidogrel: Después de la administración diaria de 75 mg de clopidogrel durante 10 días, 40 sujetos sanos fueron cambiados a 10 mg diarios de clorhidrato de prasugrel con o sin una dosis de carga de 60 mg. Se observó una inhibición de la agregación plaquetaria similar o mayor con clorhidrato de prasugrel. El cambiar directamente a una dosis de carga de 60 mg de clorhidrato de prasugrel produjo un inicio de acción más rápido y una mayor inhibición plaquetaria. Después de la administración de una dosis de carga de 900 mg de clopidogrel (con ácido acetilsalicílico), 56 sujetos con síndrome coronario agudo (SCA) fueron tratados por 14 días con 10 mg diarios de clorhidrato de prasugrel o con 150 mg diarios de clopidogrel, y posteriormente cambiados a 150 mg de clopidogrel o 10 mg de clorhidrato de prasugrel durante otros 14 días. Se observó una mayor inhibición de la agregación plaquetaria en pacientes a los que se les cambió a 10 mg de clorhidrato de prasugrel comparados con aquellos tratados con 150 mg de clopidogrel. No existen datos disponibles del cambio directo de una dosis de carga de clopidogrel a una dosis de carga de clorhidrato de prasugrel.
Eficacia y seguridad en el síndrome coronario agudo (SCA): En el estudio TRITON-TIMI 38 de Fase 3 (Trial to Assess Improvement in Therapeutic Outcomes by Optimizing Platelet InhibitioN with Prasugrel) se comparó EFFIENT® (clorhidrato de prasugrel) con clopidogrel, ambos coadministrados con ácido acetilsalicílico y con otros tratamientos estándar. El estudio TRITON-TIMI 38 fue de grupos paralelos, doble ciego, con asignación aleatoria, internacional y multicéntrico; que incluyó a 13,608 pacientes. Los pacientes presentaban SCA con angina inestable (UA) de riesgo moderado a alto, infarto miocárdico sin elevación del segmento ST (NSTEMI) o infarto miocárdico con elevación del segmento ST (STEMI) y fueron tratados con intervención coronaria percutánea (PCI).
Los pacientes con UA/NSTEMI con síntomas dentro de las primeras 72 horas o con STEMI con síntomas entre las 12 horas y los 14 días, fueron asignados de manera aleatoria a tratamiento después de conocer la anatomía coronaria. Los pacientes con STEMI con síntomas dentro de las primeras 12 horas y que tenían planeada la realización de una intervención coronaria percutánea (PCI) primaria, podían ser asignados de manera aleatoria sin conocer la anatomía coronaria. En todos los pacientes, la dosis de carga podía administrarse en cualquier momento a partir de la asignación aleatoria y hasta 1 hora después de que el paciente abandonara la sala de cateterismo.
Los pacientes asignados de manera aleatoria a recibir clorhidrato de prasugrel (dosis de carga de 60 mg seguido de 10 mg una vez al día) o clopidogrel (dosis de carga de 300 mg seguido de 75 mg una vez al día) fueron tratados por una mediana de 14.5 meses (máximo de 15 meses con un mínimo de 6 meses de seguimiento). Los pacientes también recibieron ácido acetilsalicílico (75 mg a 325 mg una vez al día).
El uso de cualquier tienopiridina dentro de los 5 días anteriores a ser incluidos en el estudio se consideró un criterio de exclusión. Otros tratamientos, tales como la heparina y los inhibidores de receptores GP IIb/IIIa, se administraron a criterio del médico. Aproximadamente un 40% de los pacientes (en cada grupo de tratamiento) recibió inhibidores GP IIb/IIIa como apoyo a la PCI (no existe información disponible con respecto al tipo de inhibidor GP IIb/IIIa utilizado). Aproximadamente el 98% de los pacientes (en cada grupo de tratamiento) recibió antitrombinas (heparina, heparina de bajo peso molecular, bivalirudina u otros agentes) directamente como apoyo a la PCI.
El principal parámetro de evaluación utilizado fue el tiempo transcurrido hasta el primer evento de muerte cardiovascular (CV), infarto miocárdico no mortal (IM), o accidente vascular cerebral no mortal. El análisis del parámetro de evaluación final compuesto en toda la población de síndrome coronario agudo (cohortes combinadas de angina inestable/infarto miocárdico sin elevación del segmento ST e infarto miocárdico con elevación del segmento ST) fue consistente en mostrar la superioridad estadística de clorhidrato de prasugrel frente a clopidogrel en la cohorte de angina inestable/infarto miocárdico sin elevación del segmento ST (p < 0.05).
Todas las poblaciones con síndrome coronario agudo: EFFIENT® mostró una eficacia superior comparado con clopidogrel en la reducción de eventos del parámetro primario compuesto de eficacia, así como de los eventos pre-especificados del parámetro secundario de eficacia, incluyendo trombosis del stent (ver tabla 1). El beneficio del clorhidrato de prasugrel fue aparente dentro de los 3 primeros días y persistió hasta el final del estudio. La eficacia superior estuvo acompañada de un incremento en sangrado mayor (ver Precauciones generales y Reacciones secundarias y adversas). La población de los pacientes fue caucásica en un 92%, el 26% fueron mujeres y el 39% tuvo ³ 65 años. Los beneficios asociados con clorhidrato de prasugrel fueron independientes del empleo de otras terapias cardiovasculares agudas y de largo plazo, incluyendo heparina/heparina de bajo peso molecular, bivalirudina, inhibidores intravenosos de receptores GP IIb/IIIa, hipolipemiantes, beta-bloqueadores e inhibidores de la enzima convertidora de angiotensina. La eficacia del clorhidrato de prasugrel fue independiente de la dosis de ácido acetilsalicílico (75 mg a 325 mg una vez al día). En el estudio TRITON-TIMI 38 no se permitió el uso de anticoagulantes orales, de medicamentos antiplaquetarios no relacionados con el mismo y de agentes antiinflamatorios no esteroideos (AINEs) crónicos. En toda la población de síndrome coronario agudo, el clorhidrato de prasugrel se asoció con una incidencia más baja de muerte cardiovascular, infarto miocárdico no mortal o de accidente vascular cerebral no mortal, comparado con clopidogrel, independientemente de las características basales de edad, género, peso corporal, región geográfica, uso de inhibidores GP IIb/IIIa y del tipo de stent.
Este beneficio se debió principalmente a la disminución significativa de infarto miocárdico no-mortal (ver tabla 1). Los sujetos con diabetes tuvieron disminuciones significativas en el parámetro de evaluación primario compuesto y en todos los parámetros de evaluación secundarios.
El beneficio de clorhidrato de prasugrel observado en pacientes ³ 75 años fue menor que el observado en pacientes < 75 años. Los pacientes ³ 75 años presentaron un aumento del riesgo de sangrado, incluyendo sangrado mortal (véase Precauciones generales y Reacciones secundarias y adversas). Los pacientes ³ 75 años en los que el beneficio con clorhidrato de prasugrel fue más evidente, incluían a aquellos con diabetes, infarto miocárdico con elevación del segmento ST, mayor riesgo de trombosis del stent o con eventos recurrentes.
Los pacientes con antecedentes de isquemia cerebral transitoria o con antecedentes de accidente vascular cerebral isquémico de más de 3 meses antes del comienzo del tratamiento con clorhidrato de prasugrel no mostraron una reducción en el parámetro final compuesto de eficacia.
En la población de todos los síndromes coronarios agudos, el análisis de cada parámetro final de evaluación secundario mostró un beneficio significativo (p < 0.001) para clorhidrato de prasugrel comparado con clopidogrel.
Estos parámetros de evaluación incluyeron trombosis del stent probable o definitiva al final del estudio (0.9% vs. 1.8%; HR 0.498; IC 0.364; 0.683); muerte cardiovascular, IM no mortal, o revascularización urgente del vaso blanco a los 30 días (5.9% vs. 7.4%; HR 0.784; IC 0.688; 0.894); muerte por cualquier causa, IM no mortal, o accidente vascular cerebral no mortal hasta el final del estudio (10.2% vs. 12.1%; HR 0.831; IC 0.751; 0.919); muerte CV, IM no mortal, accidente vascular cerebral no mortal o re-hospitalización por un evento isquémico cardiaco hasta el final del estudio (11.7% vs. 13.8%; HR 0.838; IC 0.762; 0.921).
El análisis de los casos de muerte por cualquier causa no mostró ninguna diferencia significativa entre el clorhidrato de prasugrel y el clopidogrel en la población de todos los síndromes coronarios agudos (2.76% vs. 2.90%), en la población con angina inestable/infarto miocárdico sin elevación del segmento ST (2.58% vs. 2.4%) ni en la población con infarto miocárdico con elevación del segmento ST (3.28% vs. 4.31%).
Tabla 1. Pacientes con eventos en el análisis primario del estudio TRITON-TIMI 38
|
Eventos |
Prasugrel + AAS |
Clopidogrel + AAS |
Índice de riesgo (HR) (95% CI) |
Valor-p |
|
Población de todos los síndromes coronarios agudos |
(N = 6.813) % |
(N = 6.795) % |
||
|
Eventos del parámetro primario compuesto de eficacia |
||||
|
Muerte cardiovascular (CV), IM no mortal o accidente vascular cerebral no mortal |
9.4 |
11.5 |
0.812 (0.732; 0.902) |
< 0.001 |
|
Eventos individuales del parámetro primario compuesto de eficacia |
||||
|
Muerte CV |
2.0 |
2.2 |
0.886 (0.701; 1.118) |
0.307 |
|
IM no mortal |
7.0 |
9.1 |
0.757 (0.672; 0.853) |
< 0.001 |
|
Accidente vascular cerebral no mortal |
0.9 |
0.9 |
1.016 (0.712; 1.451) |
0.930 |
|
Población con angina inestable/infarto miocárdico sin elevación del segmento ST |
(N = 5.044) % |
(N = 5.030) % |
||
|
Eventos del parámetro primario compuesto de eficacia |
||||
|
Muerte cardiovascular (CV), IM no mortal o accidente vascular cerebral no mortal |
9.3 |
11.2 |
0.820 (0.726; 0.927) |
0.002 |
|
Muerte CV |
1.8 |
1.8 |
0.979 (0.732; 1.309) |
0.885 |
|
IM no mortal |
7.1 |
9.2 |
0.761 (0.663; 0.873) |
< 0.001 |
|
Accidente vascular cerebral no mortal |
0.8 |
0.8 |
0.979 (0.633; 1.513) |
0.922 |
|
Población con infarto miocárdico con elevación del segmento ST |
(N = 1.769) % |
(N = 1.765) % |
||
|
Eventos del parámetro primario compuesto de eficacia |
||||
|
Muerte cardiovascular (CV), IM no mortal o accidente vascular cerebral no mortal |
9.8 |
12.2 |
0.793 (0.649; 0.968) |
0.019 |
|
Muerte CV |
2.4 |
3.3 |
0.738 (0.497; 1.094) |
0.129 |
|
IM no mortal |
6.7 |
8.8 |
0.746 (0.588; 0.948) |
0.016 |
|
Accidente vascular cerebral no mortal |
1.2 |
1.1 |
1.097 (0.590; 2.040) |
0.770 |
El clorhidrato de prasugrel se asoció con una reducción del 50% en trombosis del stent a lo largo de los 15 meses del periodo de seguimiento.
La reducción de la trombosis del stent con clorhidrato de prasugrel se observó tanto con stents metálicos como con stents medicados, tanto de manera temprana como después de los 30 días.
En un análisis de los pacientes que sobrevivieron a un evento isquémico, clorhidrato de prasugrel se asoció con una reducción en la incidencia de eventos finales primarios subsecuentes (7.8% para prasugrel vs. 11.9% para clopidogrel).
Aunque el sangrado se incrementó con clorhidrato de prasugrel, un análisis del parámetro final compuesto de muerte debida a cualquier causa, infarto miocárdico no-mortal, accidente vascular cerebral no mortal y sangrado TIMI mayor no relacionado con cirugía de revascularización coronaria, favoreció al clorhidrato de prasugrel en comparación con clopidogrel (Índice de riesgo, 0.87; 95% IC, de 0.79 a 0.95; p = 0,004). En el estudio TRITON-TIMI 38, de cada 1,000 pacientes tratados con clorhidrato de prasugrel, hubo 22 pacientes menos con infarto miocárdico, y 5 más con sangrado TIMI mayor no relacionado con cirugía de revascularización coronaria en comparación con pacientes tratados con clopidogrel.
En el estudio TRITON-TIMI 38, el clorhidrato de prasugrel redujo los eventos isquémicos (principalmente los infartos miocárdicos no fatales e incrementó los eventos de sangrado [ver Reacciones secundarias y adversas]) comparado con clopidogrel. Esos hallazgos son consistentes con la mayor inhibición de la agregación plaquetaria alcanzada con clorhidrato de prasugrel a las dosis utilizadas en el estudio.
Sin embargo; hay una explicación alterna: tanto clorhidrato de prasugrel como clopidogrel son pro-drogas que deben ser metabolizadas a sus metabolitos activos.
Mientras que la farmacocinética del metabolito activo de prasugrel se sabe no es afectado por las variaciones genéticas en CYP2B6, CYP2C9, CYP2C19, o CYP3A5, la farmacocinética del metabolito activo de clopidogrel es afectada por el genotipo CYP2C19, y aproximadamente un 30% de los caucásicos tienen reducción de su metabolismo. Lo que es más, ciertos medicamentos inhibidores de la bomba de protones, que se utilizan ampliamente en la población de pacientes con Síndrome Coronario Agudo y que fueron utilizados en el estudio TRITON-TIMI 38, inhiben al CYP2C19, disminuyendo aún más la formación del metabolito activo de clopidogrel. Por lo tanto, el estado de reducción del metabolismo y el uso de inhibidores de la bomba de protones pueden disminuir la actividad del clopidogrel en una fracción de la población, y pueden haber contribuido al mayor efecto del tratamiento con clorhidrato de prasugrel y a la mayor tasa de sangrado en el estudio TRITON-TIMI 38. El grado en que estos factores fueron operacionales se desconoce.
Farmacocinética: El clorhidrato de prasugrel es una prodroga y es rápidamente metabolizado in vivo a un metabolito activo y a metabolitos inactivos. La exposición del metabolito activo (AUC) tiene una variabilidad de moderada a baja entre sujetos (27%) y dentro del sujeto (19%). La farmacocinética del clorhidrato de prasugrel es similar en sujetos sanos, pacientes con enfermedad ateroesclerótica estable y pacientes sometidos a intervención coronaria percutánea.
Absorción: La absorción y el metabolismo del clorhidrato de prasugrel son rápidos, con un pico de concentración plasmática (Cmax.) del metabolito activo aproximadamente a los 30 minutos. La exposición al metabolito activo (área bajo la curva [AUC]) aumenta de manera proporcional por encima del rango de dosis terapéutica. En un estudio en sujetos sanos, el AUC del metabolito activo no se vio afectado por la ingesta de una comida rica en grasas y altamente calórica, pero la (Cmax.) disminuyó en un 49% y el tiempo para alcanzar la concentración máxima en plasma (Tmax.) se incrementó de 0.5 a 1.5 horas. El clorhidrato de prasugrel se administró independientemente de las comidas en el estudio TRITON-TIMI 38. Por lo tanto, EFFIENT® puede administrarse independientemente de las comidas; sin embargo, la administración de una dosis de carga de prasugrel en estado de ayuno podría producir un inicio de acción mucho más rápido.
Distribución: La unión del metabolito activo a la albúmina sérica humana (4% de solución amortiguada) fue de un 98%.
Metabolismo: Prasugrel no se detecta en plasma después de su administración oral. Es hidrolizado rápidamente en el intestino a una tiolactona, la cual es convertida en el metabolito activo mediante un paso único de metabolismo por el citocromo P450, principalmente por los CYP3A4 y CYP2B6 y en menor medida por CYP2C9 y CYP2C19. El metabolito activo es metabolizado nuevamente a dos compuestos inactivos por S-metilación o por conjugación con cisteína.
En sujetos sanos, en pacientes con aterosclerosis estable y en pacientes con síndrome coronario agudo que recibieron clorhidrato de prasugrel, no hubo ningún efecto relevante sobre la farmacocinética de prasugrel o su inhibición de la agregación plaquetaria por la variación genética en CYP3A5, CYP2B6, CYP2C9 o CYP2C19.
Eliminación: Aproximadamente el 68% de la dosis de clorhidrato de prasugrel se excreta por la orina, y 27% en las heces, como metabolitos inactivos. El metabolito activo tiene una vida media de eliminación de aproximadamente 7.4 horas (rango de 2 a 15 horas).
Poblaciones especiales:
Pacientes de edad avanzada: En un estudio en sujetos sanos de edades comprendidas entre los 20 y 80 años, la edad no tuvo un efecto significativo sobre la farmacocinética de clorhidrato de prasugrel o sobre su inhibición de la agregación plaquetaria. En el estudio clínico TRITOB-TIMI 38, la exposición media estimada (AUC) del metabolito activo fue un 19% más alta en pacientes muy ancianos (³ 75 años de edad) comparado con sujetos < 75 años de edad. Clorhidrato de prasugrel debe administrarse con precaución en pacientes ³ 75 años debido al riesgo potencial de sangrado en esa población.
Peso corporal: La exposición media (AUC) del metabolito activo de clorhidrato de prasugrel es de aproximadamente un 30 a un 40% más alta en sujetos sanos y en pacientes con un peso corporal de < 60 kg comparado con aquellos pacientes que pesan ³ 60 kg. Clorhidrato de prasugrel debe administrarse con precaución en pacientes con un peso corporal de < 60 kg debido al riesgo potencial de sangrado de esa población.
Insuficiencia hepática: No es necesario un ajuste de dosis en pacientes con insuficiencia hepática de leve a moderada (Child-Pugh clase A y B). La farmacocinética del clorhidrato de prasugrel y su inhibición de la agregación plaquetaria fue similar en aquellos sujetos con insuficiencia hepática de leve a moderada comparada con sujetos sanos. No se ha estudiado la farmacocinética y la farmacodinamia de clorhidrato de prasugrel en pacientes con insuficiencia hepática grave. El clorhidrato de prasugrel no deberá ser utilizado en pacientes con insuficiencia hepática grave.
Insuficiencia renal: No es necesario realizar un ajuste de la dosis en pacientes con insuficiencia renal, incluidos aquellos que presentan insuficiencia renal en fase terminal. La farmacocinética del clorhidrato de prasugrel y su inhibición de la agregación plaquetaria en pacientes con insuficiencia renal moderada (IFG 30 a < 50 ml/min) y en sujetos sanos son similares. La inhibición de la agregación plaquetaria producida por el clorhidrato de prasugrel fue también similar en pacientes con insuficiencia renal terminal que requerían de hemodiálisis en comparación con sujetos sanos, aunque la Cmax. y el AUC del metabolito activo disminuyeron en 51% y 42%, respectivamente, en pacientes con insuficiencia renal terminal.
Raza: En estudios de farmacología clínica, después de ajustar por peso corporal, el AUC del metabolito activo fue aproximadamente 19% más alta en sujetos chinos, japoneses y coreanos en comparación con los caucásicos, relacionada principalmente con una exposición más elevada en sujetos asiáticos < 60 kg de peso. No existe ninguna diferencia en la exposición entre sujetos chinos, japoneses y coreanos. La exposición en sujetos de ascendencia africana o hispana es comparable con la de los sujetos caucásicos. No se recomienda un ajuste de dosis basada únicamente en el origen étnico.
Género: En sujetos sanos y en pacientes, la farmacocinética del clorhidrato de prasugrel es similar en hombres y en mujeres.
Pacientes pediátricos y adolescentes: La farmacocinética y la farmacodinamia del clorhidrato de prasugrel no se han evaluado en la población pediátrica.
CONTRAINDICACIONES: Hipersensibilidad al principio activo o a alguno de los excipientes.
Sangrado patológico activo.
Antecedentes de accidente vascular cerebral o de isquemia cerebral transitoria.
Insuficiencia hepática grave (clase C de la escala de Child-Pugh).
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: No se han llevado a cabo estudios clínicos en mujeres embarazadas o en mujeres en período de lactancia. Los estudios en animales no indicaron efectos dañinos directos sobre el embarazo, desarrollo embrional/fetal, parto o desarrollo postnatal. Debido a que los estudios de reproducción en animales no son siempre predictivos de la respuesta en humanos, clorhidrato de prasugrel deberá usarse durante el embarazo sólo que el beneficio potencial para la madre justifique el riesgo potencial para el feto.
Los estudios en animales han mostrado que clorhidrato de prasugrel se excreta en la leche materna. Se desconoce si en humanos clorhidrato de prasugrel se excreta en la leche materna. Debido a que muchos medicamentos se excretan en la leche materna en humanos y debido al potencial de eventos adversos graves en los lactantes, se debe decidir si suspender la lactancia o suspender el medicamento tomando en consideración el beneficio del mismo para la madre.
REACCIONES SECUNDARIAS Y ADVERSAS: La seguridad en pacientes con síndrome coronario agudo sometidos a intervención coronaria percutánea fue evaluada en un estudio controlado con clopidogrel (TRITON-TIMI 38) en el cual 6,741 pacientes fueron tratados con clorhidrato de prasugrel (dosis de carga de 60 mg y dosis de mantenimiento una vez al día de 10 mg) durante una mediana de 14.5 meses (5,802 pacientes fueron tratados durante más de 6 meses, 4,136 pacientes fueron tratados durante más de 1 año).
La tasa de discontinuación del medicamento en estudio debido a eventos adversos fue del 7.2% para clorhidrato de prasugrel y del 6.3% para clopidogrel. De éstos, el sangrado fue la reacción adversa más frecuente que condujo a la suspensión del medicamento en estudio para ambos medicamentos (2.5% para clorhidrato de prasugrel y 1.4% para clopidogrel).
Sangrado:
Sangrado no relacionado con cirugía de revascularización de la arteria coronaria: En la tabla 2 se muestra la frecuencia de pacientes que sufrieron sangrado no relacionado con cirugía de revascularización de la arteria coronaria en el estudio TRITON-TIMI 38. La incidencia de sangrado TIMI mayor no relacionado con cirugía de revascularización de la arteria coronaria, incluyendo aquellos sangrados que pusieron en peligro la vida y las que resultaron fatales, al igual que el sangrado TIMI menor, fue mayor, de manera estadísticamente significativa, en sujetos tratados con clorhidrato de prasugrel comparado con clopidogrel en las poblaciones con angina inestable/infarto miocárdico sin elevación del segmento ST y en la de todos los síndromes coronarios agudos. No se observó ninguna diferencia significativa en la población con infarto miocárdico con elevación del segmento ST. El lugar de sangrado espontáneo más frecuente fue el tracto gastrointestinal (tasa del 1.7% con clorhidrato de prasugrel y del 1.3% con clopidogrel); el lugar de sangrado provocado más frecuente fue el de la zona de punción arterial (tasa del 1.3% con clorhidrato de prasugrel y del 1.2% con clopidogrel).
Tabla 2: Incidencia de sangrado no relacionado con cirugía de revascularización de la arteria coronariaa (% de pacientes)
|
Evento |
Todos los SCA |
UA/NSTEMI |
STEMI |
|||
|
Clorhidrato |
Clopidogrelb + AAS (N = 6,716) |
Clorhidrato de prasugrelb + AAS (N = 5,001) |
Clopidogrelb + AAS (N = 4,980) |
Clorhidrato de prasugrelb + AAS (N = 1,740) |
Clopidogrelb + AAS (N = 1,736) |
|
|
Sangrado TIMI mayorc |
2.2 |
1.7 |
2.2 |
1.6 |
2.2 |
2.0 |
|
Puso en peligro la vidad |
1.3 |
0.8 |
1.3 |
0.8 |
1.2 |
1.0 |
|
Mortal |
0.3 |
0.1 |
0.3 |
0.1 |
0.4 |
0.1 |
|
Hemorragia intracraneal sintomáticae |
0.3 |
0.3 |
0.3 |
0.3 |
0.2 |
0.2 |
|
Requirió inotrópicos |
0.3 |
0.1 |
0.3 |
0.1 |
0.3 |
0.2 |
|
Requirió intervención |
0.3 |
0.3 |
0.3 |
0.3 |
0.1 |
0.2 |
|
Requirió transfusión (³ 4 unidades) |
0.7 |
0.5 |
0.6 |
0.3 |
0.8 |
0.8 |
|
Hemorragia TIMIf menor |
2.4 |
1.9 |
2.3 |
1.6 |
2.7 |
2.6 |
a Eventos centralmente adjudicados definidos de acuerdo con los criterios del Grupo de Estudio de Thrombolysis in Myocardial Infarction (TIMI).
b Otros tratamientos estándar fueron utilizados según se consideraron apropiados. El protocolo del estudio TRITON-TIMI 38 requirió que todos los pacientes recibieran ácido acetilsalicílico.
c Cualquier hemorragia intracraneal o cualquier sangrado clínicamente aparente asociado con un descenso de hemoglobina ³ 5 g/dl.
d Sangrado que puso en peligro la vida es un subconjunto de sangrado TIMI mayor e incluye los distintos tipos mencionados más abajo. Los pacientes pudieron ser contabilizados en más de una hilera.
e HIC = hemorragia intracraneal.
f Sangrado clínicamente aparente asociado con un descenso de hemoglobina ³ 3 g/dl pero < 5 g/dl.
SCA = síndromes coronarios agudos; AAS = ácido acetilsalicílico; UA/NSTEMI = angina inestable/infarto miocárdico sin elevación del segmento ST; STEMI = infarto miocárdico con elevación del segmento ST.
En el estudio TRITON-TIMI 38, las tasas de sangrado TIMI mayor o menor no relacionado con cirugía de revascularización de la arteria coronaria en pacientes separados en dos grupos por edad, fueron:
|
Edad |
C. de prasugrel |
Clopidogrel |
|
³ 75 años |
9.0% (1.0% mortal) |
6.9% (0.1% mortal) |
|
< 75 años |
3.8% (0.2% mortal) |
2.9% (0.1% mortal) |
En el estudio TRITON-TIMI 38, las tasas de sangrado TIMI mayor o menor no relacionado con cirugía de revascularización de la arteria coronaria en pacientes separados en dos grupos según el peso, fueron:
|
Peso |
C. de prasugrel |
Clopidogrel |
|
< 60 kg |
10.1% (0% mortal) |
6.5% (0.3% mortal) |
|
³ 60 kg |
4.2% (0.3% mortal) |
3.3% (0.1% mortal) |
En pacientes con ³ 60 kg y < 75 años, las tasas de sangrado TIMI mayor o menor no relacionado con cirugía de revascularización de la arteria coronaria fueron del 3.6% para clorhidrato de prasugrel y del 2.8% para clopidogrel; las tasas de sangrado que produjeron la muerte fueron del 0.2% para clorhidrato de prasugrel y del 0.1% para clopidogrel.
Sangrado relacionado con cirugía de revascularización de la arteria coronaria: En el estudio clínico TRITON-TIMI 38, 437 pacientes fueron sometidos a cirugía de revascularización de la arteria coronaria durante el transcurso del estudio. En esos pacientes, la tasa de sangrado TIMI mayor o menor relacionada con cirugía de revascularización de la arteria coronaria fue del 14.1% en el grupo de clorhidrato de prasugrel y del 4.5% en el grupo de clopidogrel. El mayor riesgo de eventos de sangrado en sujetos tratados con clorhidrato de prasugrel persistió hasta un máximo de 7 días a partir de la administración de la dosis más reciente del medicamento en estudio.
En el caso de los pacientes a los que se les administró la tienopiridina en el intervalo de 3 días anteriores a ser sometidos a cirugía de revascularización de la arteria coronaria, la frecuencia de sangrado TIMI mayor o menor fue de 26.7% (12 de 45 pacientes) en el grupo de clorhidrato de prasugrel, comparado con 5.0% (3 de 60 pacientes) en el grupo de clopidogrel.
En aquellos pacientes a los que se les administró la última dosis de tienopiridina dentro del intervalo de 4 a 7 días antes de ser sometidos a cirugía de revascularización de la arteria coronaria, la frecuencia disminuyó hasta 11.3% (9 de 80 pacientes) en el grupo de clorhidrato de prasugrel y 3.3% (3 de 90 pacientes) en el grupo de clopidogrel. Pasados 7 días después de interrumpir el tratamiento, se observaron tasas de sangrado relacionado con cirugía de revascularización de la arteria coronaria similares entre los grupos de tratamiento.
Eventos adversos: La tabla 3 resume los eventos adversos hemorrágicos y no hemorrágicos en el estudio TRITON-TIMI 38 clasificados por frecuencia y según la clasificación por órganos y sistemas.
Las distintas frecuencias se definen de la siguiente manera: Muy frecuentes (³ 10%), frecuentes (³ 1% y < 10%), poco frecuentes (³ 0.1% y < 1%), raras (³ 0.01% y < 0.1%), muy raras (< 0.01%).
Tabla 3. Eventos adversos hemorrágicos y no hemorrágicos
|
Clasificación de sistema orgánico/ |
Frecuentes |
Poco frecuentes |
Raros |
|
Hemorrágicos |
|||
|
Trastornos oculares |
Hemorragia ocular |
||
|
Trastornos vasculares |
Hematoma |
||
|
Trastornos respiratorios, torácicos y mediastinales |
Epistaxis |
Hemoptisis |
|
|
Trastornos gastrointestinales |
Hemorragia gastrointestinal |
Hemorragia retroperitoneal |
|
|
Trastornos de la piel y del tejido subcutáneo |
Equimosis |
||
|
Trastornos renales y urinarios |
Hematuria |
||
|
Trastornos generales y alteraciones en el sitio |
Hematoma en el lugar de punción del vaso Hemorragia en el lugar de punción |
||
|
Lesiones, intoxicaciones y complicaciones |
Contusión |
Hemorragia postintervención Hematoma subcutáneo |
|
|
No hemorrágicos |
|||
|
Trastornos de la piel y del tejido subcutáneo |
Erupción cutánea |
||
|
Trastornos de la sangre y del sistema linfático |
Anemia |
Trombocitopenia (cuenta plaquetaria £ 50 x 109/L) |
|
La incidencia de accidente vascular cerebral en el estudio TRITON-TIMI 38 en pacientes con o sin antecedentes de isquemia cerebral transitoria o accidente vascular cerebral previo, fue la siguiente:
|
Antecedentes de isquemia cerebral transitoria o accidente vascular cerebral |
Clorhidrato de prasugrel |
Clopidogrel |
|
Sí (N = 518) |
6.5% (2.3% ICH*) |
1.2% (0% ICH*) |
|
No (N = 13,090) |
0.9% (0.2% ICH*) |
1.0% (0.3% ICH*) |
* ICH = hemorragia intracraneal.
Datos espontáneos: La lista siguiente de efectos indeseables (eventos adversos) se basa en los reportes espontáneos posteriores a la comercialización, y se proporcionan las tasas correspondientes.
|
Clase de sistema orgánico/ evento adverso |
Frecuentes |
Poco frecuentes |
Raros |
Muy raros |
|
Trastornos de la sangre y del sistema linfático |
Púrpura trombocitopénica trombótica |
|||
|
Trastornos del sistema inmune |
Hipersensibilidad incluyendo angioedema |
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Los datos de los estudios no clínicos no mostraron riesgos especiales para los seres humanos con base en los estudios convencionales de farmacología de seguridad, toxicidad de dosis repetidas, genotoxicidad, potencial carcinogénico o toxicidad para la reproducción. Únicamente se observaron efectos en los estudios no clínicos con exposiciones consideradas como excesivas a la exposición máxima en humanos, lo que indica poca relevancia para su uso clínico.
No se observaron tumores relacionados con el compuesto en un estudio de 2 años de duración en ratas con exposiciones a clorhidrato de prasugrel dentro de un rango de exposición mayor a 75 veces la exposición terapéutica recomendada en humanos (con base en exposiciones plasmáticas a los metabolitos humanos circulantes activo y principales). Hubo un incremento en la incidencia de tumores (adenomas hepatocelulares) en ratones expuestos durante 2 años a dosis altas (> 75 veces la exposición en humanos), pero esto fue considerado secundario a la inducción enzimática inducida por clorhidrato de prasugrel. Está bien documentada la asociación específica en roedores de tumores hepáticos e inducciones enzimáticas producidas por el medicamento. El aumento de tumores hepáticos con la administración de clorhidrato de prasugrel en ratones no se considera represente un riesgo relevante en humanos. Clorhidrato de prasugrel no tuvo ningún efecto sobre la fertilidad de las ratas macho y ratas hembra a dosis orales de hasta 300 mg/kg por día (exposición de hasta 240 veces la dosis de mantenimiento humana diaria recomendada (basadas en mg/m2).
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: A continuación se detallan las interacciones de EFFIENT® con otros medicamentos:
Warfarina: No se ha estudiado la administración concomitante de EFFIENT® con otros derivados cumarínicos distintos a la warfarina. Debido al aumento potencial del riesgo de sangrado, warfarina (u otros derivados cumarínicos) y clorhidrato de prasugrel deben ser coadministrados con precaución.
Medicamentos antiinflamatorios no esteroideos (AINEs): No se ha estudiado la administración concomitante crónica de AINEs.
Debido al potencial del aumento del riesgo de sangrado, los AINEs crónicos (incluyendo inhibidores de la COX-2) y clorhidrato de prasugrel deben ser coadministrados con precaución.
EFFIENT® puede administrarse de forma concomitante con medicamentos metabolizados por las enzimas del citocromo P450 (incluyendo estatinas), o medicamentos inductores o inhibidores de las enzimas del citocromo P450. EFFIENT® también puede administrarse de forma concomitante con ácido acetilsalicílico, heparina, digoxina, y medicamentos que elevan el pH gástrico, incluyendo inhibidores de la bomba de protones y antagonistas de los receptores H2. Aunque no se han realizado estudios específicos de interacción, el clorhidrato de prasugrel ha sido coadministrado en estudios clínicos de fase 3 con heparina de bajo peso molecular, bivalirudina e inhibidores de los receptores GP IIb/IIIa (no existe información disponible que haga referencia al tipo de inhibidor GP IIb/IIIa empleado) sin evidencia de interacciones adversas clínicamente significativas.
Efectos de otros medicamentos sobre EFFIENT®:
Ácido acetilsalicílico: EFFIENT® debe administrarse de forma concomitante con ácido acetilsalicílico. Aunque es posible que se produzca una interacción farmacodinámica con el ácido acetilsalicílico que lleve a un aumento del riesgo de sangrado, la demostración de la eficacia y seguridad del clorhidrato de prasugrel proviene de pacientes tratados en forma concomitante con ácido acetilsalicílico.
Heparina: Una dosis única administrada en inyección intravenosa en bolo de heparina no fraccionada (100 U/kg) no modificó de forma significativa la inhibición de la agregación plaquetaria mediada por clorhidrato de prasugrel.
Asimismo, clorhidrato de prasugrel no modificó de forma significativa el efecto de la heparina sobre los parámetros de coagulación. Por lo tanto, ambos medicamentos pueden administrarse de forma concomitante.
Es posible que se dé un incremento del riesgo de sangrado cuando EFFIENT® es coadministrado con heparina.
Estatinas: La atorvastatina (80 mg diarios) no modificó la farmacocinética del clorhidrato de prasugrel ni su inhibición de la agregación plaquetaria. Por lo tanto, no se prevé que las estatinas, que son sustratos del CYP3A, tengan un efecto sobre la farmacocinética de EFFIENT® o sobre su inhibición de la agregación plaquetaria.
Medicamentos que elevan el pH gástrico: La coadministración diaria de ranitidina (un antagonista de los receptores H2) o lansoprazol (un inhibidor de la bomba de protones) no modificó el área bajo la curva (AUC) ni el Tmax. del metabolito activo del clorhidrato de prasugrel, pero disminuyó la Cmax. en un 14 y un 29%, respectivamente. En el estudio TRITON-TIMI 38, EFFIENT® se administró sin tener en cuenta la coadministración de un inhibidor de la bomba de protones o de un antagonista de receptores H2. La administración de una dosis de carga de clorhidrato de prasugrel de 60 mg sin la administración concomitante de inhibidores de la bomba de protones podría permitir un inicio de actividad mucho más rápida.
Inhibidores del CYP3A: El ketoconazol (400 mg diarios), un inhibidor potente y selectivo del CYP3A4 y CYP3A5, no afectó la inhibición de la agregación plaquetaria mediada por EFFIENT® o el AUC y el Tmax. del metabolito activo del clorhidrato de prasugrel, pero disminuyó la Cmax. entre un 34 y un 46%. Por lo tanto, no se considera que los inhibidores del CYP3A tales como los antifúngicos azoles, inhibidores de la proteasa del VIH, claritromicina, telitromicina, verapamilo, diltiazem, indinavir, ciprofloxacina ni el jugo de toronja tengan un efecto significativo sobre la farmacocinética del metabolito activo.
Inductores de los citocromos P450: La rifampicina (600 mg diarios), un potente inductor del CYP3A y del CYP2B6, y un inductor del CYP2C9, CYP2C19 y del CYP2C8, no modificó de forma significativa la farmacocinética del clorhidrato de prasugrel. Por lo tanto, no se prevé que los inductores del CYP3A conocidos, tales como rifampicina, carbamacepina y otros inductores del citocromo P450, tengan un efecto significativo sobre la farmacocinética del metabolito activo.
Efectos de EFFIENT® sobre otros medicamentos:
Digoxina: Clorhidrato de prasugrel no tiene ningún efecto clínicamente significativo sobre la farmacocinética de la digoxina.
Medicamentos metabolizados por el CYP2C9: Clorhidrato de prasugrel no inhibe el CYP2C9, ya que no afectó la farmacocinética de la S-warfarina. Debido al aumento potencial del riesgo de sangrado, la warfarina y EFFIENT® deben de coadministrarse con precaución.
Medicamentos metabolizados por el CYP2B6: Clorhidrato de prasugrel es un inhibidor débil del CYP2B6. En sujetos sanos, el clorhidrato de prasugrel disminuyó la exposición a la hidroxibupropiona, un metabolito de la bupropiona mediada por el CYP2B6, en un 23%. Es probable que este efecto sea de importancia clínica únicamente cuando el clorhidrato de prasugrel se coadministre con medicamentos para los que el CYP2B6 es la única vía metabólica y tengan un estrecho margen terapéutico (por ejemplo, ciclofosfamida, efavirenz).
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: No se han descrito alteraciones en las pruebas de laboratorio relacionadas con el uso de clorhidrato de prasugrel.
PRECAUCIONES GENERALES:
Riesgo de sangrado: En el estudio clínico TRITON-TIMI 38, los principales criterios de exclusión incluyeron el incremento del riesgo de sangrado, anemia, trombocitopenia y antecedentes de hallazgos intracraneales patológicos. Los pacientes con síndrome coronario agudo que iban a ser sometidos a una intervención coronaria percutánea (PCI), tratados con clorhidrato de prasugrel y ácido acetilsalicílico mostraron un aumento del riesgo de sangrado mayor y menor, según el sistema de clasificación del Grupo de Estudio de Thrombolysis in Myocardial Infarction (TIMI). Por lo tanto, solamente debe considerarse el uso del clorhidrato de prasugrel en pacientes con incremento en el riesgo de sangrado cuando se considere que los beneficios en términos de prevención de eventos isquémicos sean mayores que el riesgo de sangrado grave. Esto aplica especialmente a pacientes:
• ³ 75 años.
• Con propensión a sangrado (debido a trauma reciente, cirugía reciente, sangrado gastrointestinal reciente o recurrente, enfermedad ulcerosa péptica activa o insuficiencia hepática severa).
• Con un peso corporal < 60 kg. En estos pacientes no se recomienda la dosis de mantenimiento de 10 mg. Se debe emplear una dosis de mantenimiento de 5 mg.
• Con la administración concomitante de medicamentos que pueden incrementar el riesgo de sangrado, incluyendo anticoagulantes orales, clopidogrel, medicamentos antiinflamatorios no esteroideos y fibrinolíticos.
Puede ser apropiada la transfusión plaquetaria en pacientes con sangrado activo en los que se requiere la reversión de los efectos farmacológicos del clorhidrato de prasugrel. Sospeche sangrado activo en cualquier paciente que esté hipotenso y que haya sido sometido recientemente a angiografía coronaria, intervención coronaria percutánea, cirugía de revascularización coronaria o a algún otro procedimiento quirúrgico aun cuando el paciente no manifieste signos evidentes de sangrado.
En general, no se recomienda el uso de clorhidrato de prasugrel en pacientes ³ 75 años de edad y únicamente deberá administrarse con precaución después de que una evaluación minuciosa de riesgo/beneficio individual realizada por el médico tratante, indique que los beneficios en términos de prevención de eventos isquémicos son mayores que el riesgo de sangrado grave. En el estudio TRITON-TIMI 38, esos pacientes presentaron mayor riesgo de sangrado, incluyendo sangrado mortal, comparado con pacientes < 75 años de edad. Si se prescribe el medicamento, deberá emplearse una dosis menor de mantenimiento de 5 mg; no se recomienda administrar una dosis de mantenimiento de 10 mg (ver Dosis y vía de administración y Reacciones secundarias y adversas). La experiencia terapéutica con clorhidrato de prasugrel en pacientes con insuficiencia renal (incluyendo insuficiencia renal en etapa terminal) y en pacientes con insuficiencia hepática moderada, es limitada. Estos pacientes pueden presentar un mayor riesgo de sangrado. Por lo tanto, clorhidrato de prasugrel deberá emplearse con precaución en esos pacientes. Se debe comunicar a los pacientes que cuando estén tomando clorhidrato de prasugrel (en combinación con ácido acetilsalicílico), puede ser que los sangrados tarden un poco más de lo normal en detenerse, y que deben notificar al médico cualquier sangrado inusual (tanto por el lugar como por la duración).
Cirugía: Antes de someterse a cualquier intervención quirúrgica y antes de iniciar cualquier otro medicamento, los pacientes deberán informar a sus médicos y dentistas de que están tomando clorhidrato de prasugrel.
Si un paciente se va a someter a una intervención quirúrgica programada y no se desea un efecto antiplaquetario, el tratamiento con clorhidrato de prasugrel se debe suspender cuando menos 7 días antes de la intervención. Puede ocurrir un aumento en la frecuencia (hasta 3 veces) y en la gravedad del sangrado en pacientes sometidos a cirugía de revascularización coronaria dentro de los 7 días posteriores a la interrupción del tratamiento con clorhidrato de prasugrel. Los beneficios y los riesgos del clorhidrato prasugrel deberán de considerarse cuidadosamente en aquellos pacientes en los que no se ha definido la anatomía coronaria y la cirugía de revascularización de la arteria coronaria urgente es una posibilidad.
No inicie el clorhidrato de prasugrel en pacientes en los que es probable se realice una cirugía de revascularización coronaria.
Hipersensibilidad incluyendo angioedema: Se ha reportado hipersensibilidad incluyendo angioedema en pacientes que reciben prasugrel, incluyendo a pacientes con antecedentes de reacciones de hipersensibilidad a otras tienopiridinas.
Púrpura trombocitopénica trombótica (PTT): Se ha reportado PTT con el uso de prasugrel y otras tienopiridinas. La PTT es una patología grave y requiere de tratamiento inmediato.
Cuadros previos de isquemia cerebral transitoria o accidente vascular cerebral: EFFIENT® está contraindicado en pacientes con antecedentes de isquemia cerebral transitoria o accidente vascular cerebral. En el estudio TRITON-TIMI 38, lo pacientes tratados con clorhidrato de prasugrel con antecedentes de haber presentado isquemia cerebral transitoria o accidente vascular cerebral en un periodo mayor a 3 meses antes de iniciar el tratamiento, tuvieron un mayor incidencia de accidente vascular cerebral isquémico o hemorrágico sin reducción en el parámetro final compuesto de eficacia comparados con los pacientes tratados con clopidogrel.
Los pacientes con antecedentes de isquemia cerebral transitoria o accidente vascular cerebral dentro de los 3 meses anteriores al inicio del tratamiento fueron excluidos de dicho estudio clínico.
Los pacientes que experimenten isquemia cerebral transitoria o accidente vascular cerebral mientras reciben EFFIENT® deberán suspenderlo. No se ha estudiado sin ácido acetilsalicílico en pacientes con antecedentes de isquemia cerebral transitoria o accidente vascular cerebral.
Lactosa: Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa tipo Lapp o mala absorción de glucosa o galactosa no deberán tomar clorhidrato de prasugrel.
DOSIS Y VÍA DE ADMINISTRACIÓN: Se debe iniciar el tratamiento con EFFIENT® con una dosis única de carga de 60 mg y posteriormente se continúa con una dosis de mantenimiento de 10 mg una vez al día. Los pacientes que tomen EFFIENT® deberán a su vez tomar ácido acetilsalicílico (AAS) diariamente (de 75 mg a 325 mg). Se recomienda un tratamiento de mantenimiento hasta por 12 meses, a menos que esté clínicamente indicada la suspensión del tratamiento.
En pacientes con síndrome coronario agudo que son tratados mediante una intervención coronaria percutánea, la suspensión prematura de cualquier agente antiplaquetario, incluido EFFIENT® podría resultar en un aumento del riesgo de trombosis, infarto miocárdico o muerte debida a la enfermedad subyacente del paciente.
Pacientes > 75 años: Por lo general, no se recomienda el uso de EFFIENT® en pacientes ³ 75 años. Si después de una evaluación minuciosa del riesgo/beneficio individual realizada por el médico tratante, el tratamiento se considera necesario en pacientes ³ 75 años de edad, se deberá prescribir una dosis de carga de 60 mg y una menor dosis de mantenimiento de 5 mg.
Los pacientes de ³ 75 años de edad tienen una sensibilidad mayor al sangrado y una mayor exposición al metabolito activo de prasugrel. La evidencia para la dosis de mantenimiento de 5 mg está basada únicamente en análisis farmacodinámico/farmacocinético y actualmente no existen datos clínicos acerca de la seguridad de esa dosis en el grupo de pacientes ³ 75 años (ver Precauciones generales y Farmacocinética y farmacodinamia).
Pacientes con peso < 60 kg: EFFIENT® debe administrarse como una dosis única de carga de 60 mg y posteriormente debe continuarse con una dosis de mantenimiento de 5 mg una vez al día. La dosis de mantenimiento de 10 mg no está recomendada en este grupo. Esto se debe a un aumento en la exposición al metabolito activo de clorhidrato de prasugrel, y a un aumento del riesgo de sangrado en pacientes con un peso corporal < 60 kg comparado con pacientes ³ 60 kg cuando se administra una dosis de 10 mg una vez al día. No se ha evaluado de forma prospectiva la eficacia y seguridad de la dosis de 5 mg (ver Precauciones generales, Reacciones secundarias y adversas y Farmacocinética y farmacodinamia).
Insuficiencia renal: No es necesario realizar un ajuste de dosis en pacientes con insuficiencia renal, incluidos aquellos que presenten una enfermedad renal en fase terminal. La experiencia terapéutica en pacientes con insuficiencia renal es limitada (ver Precauciones generales).
Insuficiencia hepática: No es necesario realizar un ajuste de dosis en sujetos con insuficiencia hepática de leve a moderada (clase A o B de la escala Child-Pugh). La experiencia terapéutica en pacientes con disfunción hepática de leve a moderada es limitada (ver Precauciones generales).
Niños y adolescentes: EFFIENT® no está recomendado para uso en niños menores de 18 años debido a la ausencia de datos sobre seguridad y eficacia.
Forma de administración: EFFIENT® debe administrarse por vía oral. Puede administrarse con o sin alimentos. La administración de una dosis de carga de 60 mg de clorhidrato de prasugrel en ayunas puede proporcionar un inicio de actividad mucho más rápido. No parta ni triture la tableta.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: La sobredosis de EFFIENT® puede provocar prolongación del tiempo de sangrado y complicaciones posteriores por sangrado. No hay datos disponibles sobre la reversión del efecto farmacológico del clorhidrato de prasugrel; sin embargo, si se requiere una corrección rápida de la prolongación del tiempo de sangrado, puede considerarse la transfusión de plaquetas y/u otros productos sanguíneos.
PRESENTACIONES:
Caja con 14 y 28 tabletas de 5 mg.
Caja con 14 y 28 tabletas de 10 mg.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a temperatura ambiente a no más de 30°C y en lugar seco.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. Consérvese en su envase original. No se deje al alcance de los niños. Literatura exclusiva para médicos.
Hecho en Estados Unidos por:
Eli Lilly and Company, Lilly Technology Center
Indianápolis, Indiana 46221, EUA.
Acondicionado por:
Lilly, S. A.
Avda. de la Industria, 30, 28108 Alcobendas,
Madrid, España.
Distribuido por:
ELI LILLY Y COMPAÑÍA DE MÉXICO, S. A. de C. V.
Calz. de Tlalpan No. 2024, Col. Campestre Churubusco, Deleg. Coyoacán, C.P. 04200 México, D.F.
Reg. Núm. 036M2010, SSA IV
113300415D0263, 113501EL820106
® Marca registrada