
ISCOVER
CLOPIDOGREL
Tabletas
1 Caja,1 Envase(s) de burbuja,14 Tabletas,75 mg
1 Caja,1 Envase(s) de burbuja,28 Tabletas,75 mg
1 Caja,1 Envase(s) de burbuja,56 Tabletas,75 mg
1 Caja,1 Envase(s) de burbuja,4 Tabletas,300 mg
1 Caja,1 Envase(s) de burbuja,30 Tabletas,300 mg
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA contiene:
Bisulfato de clopidogrel (polimorfo, forma 2) equivalente a 75 mg, 300 mg de clopidogrel
Excipiente cbp 1 tableta
INDICACIONES TERAPÉUTICAS: ISCOVER® está indicado para la prevención secundaria de los siguientes eventos aterotrombóticos:
• IM Reciente, EVC Reciente; o Enfermedad Arterial Periférica establecida: Para pacientes con historia de infarto del miocardio (IM) reciente, evento vascular cerebral (EVC) reciente o enfermedad arterial periférica establecida, clopidogrel ha demostrado que reduce la tasa de un punto final combinado de un nuevo evento vascular cerebral isquémico (fatal o no), de un nuevo IM (fatal o no), y de muerte por otra causa vascular.
• Síndrome Coronario Agudo: Para pacientes con síndrome coronario agudo sin elevación del segmento ST (angina inestable/infarto del miocardio sin elevación del segmento ST) incluyendo pacientes que son manejados médicamente, o aquellos que son manejados con intervención coronaria percutánea (ICP) (con o sin stent), o cirugía de revascularización coronaria (CABG), clopidogrel ha demostrado que disminuye la frecuencia de un punto final combinado de muerte cardiovascular, infarto del miocardio (IM), o evento vascular cerebral (EVC), así como la frecuencia de un punto final combinado de muerte cardiovascular, IM, EVC o isquemia refractaria.
Para pacientes con infarto agudo de miocardio con elevación del segmento ST, se ha demostrado que clopidogrel reduce la frecuencia de muerte por cualquier causa, y la frecuencia de un punto final combinado de muerte, reinfarto o EVC.
Clopidogrel está indicado en adultos para la prevención de eventos aterotrombóticos y tromboembólicos en:
• Fibrilación auricular: En pacientes con fibrilación auricular (FA) con riesgo incrementado de eventos vasculares quiénes pueden tomar antagonistas de vitamina K (AVK), se ha observado que los AVK están asociados a un beneficio clínico mejor que AAS solo o en combinación con clopidogrel y AAS para la reducción de EVC.
En pacientes con FA con al menos un factor de riesgo para evento vascular y que no pueden tomar AVK, clopidogrel está indicado en combinación con AAS para la prevención de eventos aterotrombóticos o tromboembólicos, incluyendo EVC. Clopidogrel en combinación con AAS a demostrado una reducción del riesgo del punto combinado de EVC, infarto del miocardio, embolismo sistémico no en SNC, o muerte vascular, a través de una reducción de EVC.
FARMACOCINÉTICA Y FARMACODINAMIA:
Farmacocinética:
Absorción: Después de la administración de una dosis única o de dosis repetidas de 75 mg por día, clopidogrel es rápidamente absorbido. Niveles plasmáticos máximos promedios de clopidogrel no han cambiado, (aproximadamente 2.2-2.5 ng/mL después de una dosis oral de 75 mg), aproximadamente 45 minutos posterior a la dosis. La absorción es al menos 50%, con base a la excreción urinaria de los metabolitos de clopidogrel.
Distribución: Clopidogrel y su principal metabolito circulante (inactivo) se unen reversiblemente in vitro a las proteínas plasmáticas en el humano (98% y 94%, respectivamente). La unión no es saturable in vitro hasta una concentración de 100 mg/L.
Metabolismo: Clopidogrel es metabolizado extensamente en el hígado. In vitro e in vivo clopidogrel tiene dos vías metabólicas principales: una dominada por esterasas y guiada por hidrólisis con la formación de un metabolito carboxílico inactivo (85% del metabolito circulante) y uno mediado por múltiples citocromos P450. Clopidogrel es primero metabolizado a metabolito intermedio 2-oxo-clopidogrel. El metabolismo subsecuente del metabolito intermedio 2-oxo-clopidogrel da como resultado la formación del metabolito activo, un derivado tiólico de clopidogrel. El metabolito activo se forma principalmente por la CYP2C19 con aportes de varias enzimas CYP, incluyendo, CYP1A2 CYP2B6 y CYP3A4. El metabolito tiólico activo el cual ha sido aislado in vitro, se une rápida e irreversiblemente al receptor plaquetario inhibiendo la agregación plaquetaria.
La Cmax del metabolito activo es el doble en potencia seguido de una dosis de carga de 300 mg de clopidogrel como posterior a cuatro días con dosis de mantenimiento de 75 mg. Cmax ocurre aproximadamente 30 a 60 minutos posterior a la dosificación.
Eliminación: Después de la administración de una dosis oral de clopidogrel radiomarcado con C14, aproximadamente el 50% de la dosis se excretó a través de la orina y el 46% en las heces, dentro de las primeras 120 horas de su dosificación. Después de una dosis de 75 mg, clopidogrel tiene una vida media aproximada de 6 horas. La vida media de eliminación del principal metabolito (inactivo) circulante fue de 8 horas después de la administración de dosis únicas y repetidas.
Farmacogenética: El CYP2C19 está involucrado en la formación tanto del metabolito activo como del metabolito intermedio 2 oxo-clopidogrel. La farmacocinética y efectos antiplaquetarios del metabolito activo de clopidogrel, es medido ex vivo por ensayos de agregación plaquetaria, y difiere de acuerdo al genotipo CY2C19. El alelo CYP2C19*1 corresponde al metabolismo funcional completo y los alelos CYP2C19*2 y CYP2C19*3 son no funcionales. Los alelos CYP2C19*2 y CYP2C19*3 corresponden a la mayoría de alelos con una función reducida en caucásicos (85%) y en Asiáticos (99%) pobres metabolizadores. Otros alelos asociados con la ausencia o reducción de metabolismo son menos frecuentes e incluyen, pero no están limitados a, CYP2C19*4, *5, *6, *7 y *8. Un paciente con estado metabolizador pobre tendrá 2 alelos con pérdida de la función como se define más adelante. Publicaciones frecuentes para metabolizadores pobres de genotipos CYP2C19 son de aproximadamente 2% para población caucásica, 4% para población de color y 14% para población china. Existen pruebas para determinar el genotipo de CYP2C19 de los pacientes.
En un estudio cruzado con 40 sujetos sanos, 10 de ellos en 4 grupos de metabolizadores de CYP2C19 (ultrarrápidos, extenso, intermedio y pobre) fue evaluada la farmacocinética y la respuesta antiplaquetaria utilizando dosis de 300 mg seguidas por 75 mg/día y 600 mg seguidos de 150 mg/día, cada uno con un total de cinco días (estado estable). No se observaron diferencias sustanciales en la exposición de metabolito activo, ni en la inhibición de agregación plaquetaria promedio (IAP) fue observada entre metabolizadores ultrarrápidos, amplia e intermedios. En los metabolizadores pobres, la exposición del metabolito activo estuvo disminuida en un 63-71% comparados con los metabolizadores extensos. Posterior a un régimen de dosis de 300 mg/75 mg, la respuesta antiplaquetaria estuvo disminuida en los pobres metabolizadores con un promedio de IAP (5 μM ADP) de 24% (24 horas) y 37% (día 5) en comparación a IAP de 39% (24 horas) y 58% (día 5) en los metabolizadores extensos y 37% (24 horas) y 60% (día 5) en los metabolizadores intermedios. Cuando los metabolizadores intermedios recibieron 600 mg/150 mg, la exposición de metabolito activo fue mayor que con 300 mg/75 mg. Adicionalmente, IAP fue del 32% (24 horas) y 61% (día 5) la cual fue mayor que en los metabolizadores que recibieron 300 mg/75 mg, y fueron similares a los otros grupos de metabolizadores CYP2C19 que recibieron una dosificación de 300 mg/75 mg. Un régimen de dosificación apropiado para esta población de pacientes no ha sido establecido en ensayos clínicos.
Farmacocinética del Metabolito Activo y Respuesta Antiplaquetaria por Metabolizadores CYP2C19
|
Dosis |
Ultrarrápidos (n=10) |
Extensos (n=10) |
Intermedios (n=10) |
Pobres (n=10) |
|
|
ABClast (ng• h/mL) |
300 mg (Día 1) |
33 (11) |
39 (24) |
31 (14) |
14 (6) |
|
600 mg (Día 1) |
56 (22) |
70 (46) |
56 (27) |
23 (7) |
|
|
75 mg (Día 5) |
11 (5) |
12 (6) |
9.9 (4) |
3.2 (1) |
|
|
150 mg (Día 5) |
18 (8) |
19 (8) |
16 (7) |
7 (2) |
|
|
IAP (%)a |
300 mg (24 h) |
40 (21) |
39 (28) |
37 (21) |
24 (26) |
|
600 mg (24 h) |
51 (28) |
49 (23) |
56 (22) |
32 (25) |
|
|
75 mg (Día 5) |
56 (13) |
58 (19) |
60 (18) |
37 (23) |
|
|
150 mg (Día 5) |
68 (18) |
73 (9) |
74 (14) |
61 (14) |
Los valores son en media (DE).
ª Inhibición de la agregación plaquetaria con 5 μM ADP; valores elevados indican mayor inhibición plaquetaria.
Consistentemente con los resultados anteriores, en un metaanálisis que incluyó 6 estudios con 335 sujetos tratados con clopidogrel en estado estable, se observó que la exposición del metabolito activo disminuyó 28% en metabolizadores intermedios y 72% en metabolizadores pobres, mientras que la inhibición de la agregación plaquetaria (5 μM ADP) se vio disminuida con diferencias en la IAP de 5.9% y 21.4% respectivamente, con relación a los metabolizadores extensos.
La influencia de los resultados clínicos con el genotipo CYP2C19 en pacientes tratados con clopidogrel no han sido evaluados en estudios prospectivos aleatorizados y controlados; sin embargo, existen análisis retrospectivos para evaluar este efecto en pacientes tratados con clopidogrel para los cuales hay resultados de genotipo: CURE (n=2721), CHARISMA (n=2428), CLARITY-TIMI 28 (n=227), TRITON-TIMI 38 (n=1477) ACTIVE-A (n=601), así como algunos estudios de cohortes publicados.
En TRITON-TIMI 38 y en 3 estudios de cohortes (Collet, Sibbing, Giusti), el grupo de pacientes combinados con un estatus de metabolizador pobre o intermedio tuvieron un rango alto de eventos cardiovasculares (muerte, infarto de miocardio, y EVC) o trombosis del stent comparados con metabolizadores extensos.
En CHARISMA y en un estudio de cohorte (Simon) un riesgo de eventos incrementados fue observado solo en los metabolizadores pobres cuando se comparó con metabolizadores extensos.
En CURE, CLARITY, ACTIVE-A y en un estudio de cohorte (Trenk) no se observó ninguna tasa de eventos incrementados con relación a los pobres metabolizadores.
Ninguno de estos análisis tiene una muestra adecuada para detectar diferencias en los resultados de los pobres metabolizadores.
Poblaciones especiales: La farmacocinética del metabolito activo de clopidogrel no es conocida en estas poblaciones especiales.
Género: En un estudio con una población pequeña que comparó a hombres y mujeres, hubo menor inhibición de la agregación plaquetaria inducida por bloqueo del receptor ADP en mujeres, pero no hubo diferencia en la prolongación del tiempo de sangrado. En un extenso estudio clínico controlado (clopidogrel vs AAS en pacientes en Riesgo de Eventos Isquémicos; CAPRIE), la incidencia de los resultados de los eventos clínicos, otros eventos adversos clínicos, y resultados anormales de los estudios de laboratorio, fueron similares entre hombres y mujeres.
Pacientes geriátricos: En ancianos voluntarios (≥75 años) comparativamente con voluntarios jóvenes sanos; no hubo diferencias en la agregación plaquetaria y tiempo de sangrado. El ajuste de dosis no es necesario en la población geriátrica.
Pacientes pediátricos: La seguridad y eficacia en poblaciones pediátricas no ha sido establecida (ver Farmacocinética y farmacodinamia, Eficacia clínica/ Estudios clínicos).
Insuficiencia hepática: Después de dosis de 75 mg/día durante 10 días en pacientes con insuficiencia hepática severa, la inhibición de la agregación plaquetaria inducida por ADP fue similar a la observada en sujetos sanos. El tiempo de sangrado fue similar en ambos grupos.
Insuficiencia renal: Después de la administración de dosis repetidas de 75 mg/día de clopidogrel, en sujetos con insuficiencia renal severa (con depuración de creatinina de 5 a 15 ml/min) la inhibición de la agregación plaquetaria inducida por ADP fue menor (25%) que la observada en sujetos sanos, sin embargo, la prolongación del tiempo de sangrado fue similar al observado en sujetos sanos que recibieron 75 mg/día de clopidogrel.
Grupo étnico: La prevalencia del alelo CYP2C19 que resulta de un metabolismo intermedio y pobre de CYP2C19 difiere de acuerdo al grupo étnico. De la literatura, datos limitados en poblaciones asiáticas están disponibles para evaluar la implicación clínica de genotipos de CYP en resultados de eventos clínicos.
Farmacodinamia:
Mecanismo de acción/Propiedades farmacodinámicas: Clopidogrel es un profármaco, cuyo uno de sus metabolitos es un inhibidor de la agregación plaquetaria. Clopidogrel debe ser metabolizado por la vía enzimática CYP450 que produce el metabolito activo que inhibe la agregación plaquetaria. El metabolito activo de clopidogrel inhibe selectivamente la unión del difosfato de adenosina (ADP) al receptor plaquetario P2Y12, impidiendo la activación del complejo GPIIb-IIIa, mediado por el ADP, con lo cual se inhibe la agregación plaquetaria. Debido a la unión irreversible, las plaquetas expuestas son afectadas por el resto de su vida, y la recuperación de la función plaquetaria normal tiene lugar en forma consistente con el recambio plaquetario (aproximadamente 7 a 10 días). La agregación plaquetaria inducida por otros agonistas ADP son también inhibidos por bloqueo de la activación plaquetaria amplificada por liberación de ADP.
Debido a que el metabolito activo es formado por enzimas del CYP450, algunos de los cuales son polimórficos o sujetos a inhibición de otros medicamentos, no todos los pacientes tendrán una inhibición plaquetaria adecuada.
Clopidogrel en dosis repetidas de 75 mg/día, produce desde el primer día de su administración, una inhibición sustancial de la agregación plaquetaria inducida por ADP; la inhibición alcanza un nivel de estabilidad entre los días 3 y 7. En estado estable, el porcentaje promedio de inhibición con una dosis de 75 mg/día oscila entre el 40% y el 60%. La agregación plaquetaria y el tiempo de sangrado retornan gradualmente a los valores basales dentro de los 5 días posteriores a la interrupción del tratamiento.
Eficacia clínica/Estudios clínicos: La evidencia clínica de la eficacia de clopidogrel deriva de cinco estudios doble ciego, que han incluido más de 88,000 pacientes: el estudio CAPRIE (clopidogrel vs AAS en Pacientes en Riesgo de Eventos Isquémicos), una comparación de clopidogrel con AAS, y el estudio CURE (clopidogrel en Angina Inestable para Prevenir Eventos Isquémicos Recurrentes), CLARITY-TIMI 28 (clopidogrel como Terapia Adjunta de Reperfusión-Trombólisis en Infarto del Miocardio), el estudio COMMIT/CCS-2 (clopidogrel y metoprolol en un estudio de Infarto del Miocardio/Segundo Estudio Cardiaco en China), y el estudio ACTIVE-A (estudio de clopidogrel con irbersartán en prevención de eventos vasculares por fibrilación auricular), los cuales compararon a clopidogrel con placebo, ambos en combinación con AAS y otras terapias estándar.
Infarto del Miocardio (IM) reciente, Evento Vascular Cerebral (EVC) reciente o Enfermedad Arterial Periférica (EAP) establecida: El estudio internacional CAPRIE incluyó a 19,185 pacientes, de 304 centros, fue internacional, aleatorizado, doble ciego, de grupos paralelos, que comparó a clopidogrel (75 mg al día) con AAS (Ácido Acetilsalicílico) (325 mg al día). Los pacientes aleatorizados tuvieron: 1) historia reciente de infarto del miocardio (últimos 35 días); 2) historia reciente de EVC isquémico (últimos 6 meses), con al menos una semana de signos neurológicos residuales; o 3) enfermedad arterial periférica objetivamente establecida. Los pacientes recibieron tratamiento aleatorizado por un promedio de 1.6 años (máximo de 3 años).
El resultado primario consistió en la presentación de un nuevo EVC isquémico (fatal o no), nuevo infarto del miocardio (fatal o no) o muerte vascular por otra causa. Las muertes no fácilmente atribuibles a causas no vasculares, fueron todas clasificadas como vasculares (ver Tabla 1).
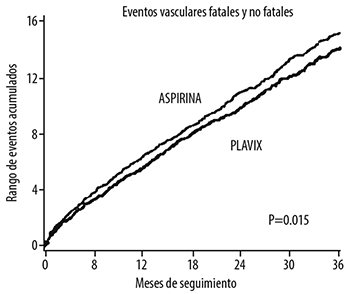
Como se muestra en la Tabla 1, la administración de clopidogrel se relacionó con una menor incidencia de todo tipo de eventos. La reducción de riesgo global (9.8% vs 10.6%) fue de 8.7%, p=0.045. Se obtuvieron resultados similares cuando se evaluaron la mortalidad por todas las causas y mortalidad por EVC, en lugar de mortalidad vascular y EVC isquémicos (reducción de riesgo de 6.9%). En pacientes que sobrevivieron a un EVC, o a un infarto del miocardio durante el estudio, nuevamente la incidencia de eventos subsecuentes fueron menores en el grupo con clopidogrel.
En la Figura 1 se muestran los gráficos del rango total de eventos. Las curvas de los eventos se separaron tempranamente y continuaron con esta tendencia a lo largo de los 3 años de seguimiento.
Aunque la significancia estadística que favorece a clopidogrel sobre AAS fue marginal (p=0.045), y representa el resultado de un solo estudio clínico que no se ha replicado, el fármaco comparador, AAS, por sí mismo, es efectivo (vs placebo) en la reducción de eventos cardiovasculares en pacientes con infarto del miocardio reciente o EVC. De esta manera, la diferencia entre clopidogrel y placebo, aunque no medida directamente, es sustancial.
El estudio CAPRIE incluyó a una población que fue aleatorizada con base en 3 criterios de inclusión. La eficacia de clopidogrel sobre AAS fue heterogénea entre estos subgrupos aleatorizados (p=0.043). No está claro si esta diferencia es real o si ocurre por casualidad. Aunque el estudio CAPRIE no se diseñó para evaluar el beneficio relativo de clopidogrel sobre AAS en los subgrupos individuales de pacientes, este beneficio parece ser mayor en pacientes que fueron reclutados por enfermedad arterial periférica (especialmente aquellos también con historia de infarto del miocardio), y más débil en pacientes con EVC. En pacientes que fueron reclutados en el estudio solo con base en un infarto del miocardio reciente, clopidogrel no fue numéricamente superior que AAS.
En un metaanálisis de estudios que evaluó AAS vs placebo en pacientes similares a los del estudio CAPRIE, la administración de AAS se asoció con una reducción en la incidencia de eventos trombóticos. Se sugirió también una heterogeneidad en estos estudios, con un efecto mayor en pacientes con historia de infarto de miocardio, más débil en pacientes con historia de EVC, y no discernible en los pacientes con historia de EAP. Con respecto a la comparación inferida de clopidogrel con placebo, no existe indicación de heterogeneidad.
Tabla 1. Resultado de los eventos en el análisis primario de CAPRIE
|
Pacientes |
Clopidogrel 9,599 |
Ácido acetilsalicílico 9,586 |
|
EVC isquémico (fatal o no) |
438 (4.6%) |
461 (4.8%) |
|
IM (fatal o no) |
275 (2.9%) |
333 (3.5%) |
|
Muerte por otra causa vascular |
226 (2.4%) |
226 (2.4%) |
|
Total |
939 (9.8%) |
1,020 (10.6%) |
Figura 1. Eventos vasculares fatales y no fatales en el estudio CAPRIE
Síndrome coronario agudo: El estudio CURE incluyó a 12,562 pacientes con síndrome coronario agudo sin elevación del segmento ST (angina inestable o infarto del miocardio sin elevación del ST), que se presentaron dentro de las primeras 24 horas de inicio del más reciente episodio de dolor torácico, o de síntomas consistentes con isquemia. Fue necesario que los pacientes tuvieran cambios en el ECG compatibles con un nuevo evento de isquemia (sin elevación del segmento ST) o elevación de las enzimas cardiacas, o troponina I o T al menos de dos veces el valor del límite superior normal. La población de pacientes fue principalmente de tipo caucásico (82%) e incluyó a 38% de mujeres, el 52% de los pacientes fue ≥65 años de edad.
Se aleatorizó a los pacientes para recibir clopidogrel (dosis de carga de 300 mg, seguido de 75 mg/día) o placebo, y continuaron su tratamiento hasta por un año. Los pacientes también recibieron AAS (75-325 mg una vez al día) y otros tratamientos estándar, como heparina. No se permitió el uso de inhibidores de la GP IIb/IIIa durante los 3 días previos a la aleatorización.
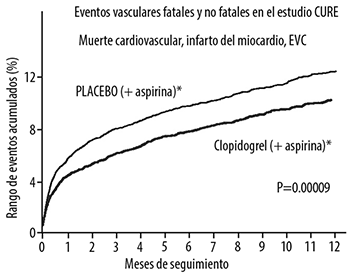
El número de pacientes que alcanzó el punto final primario (muerte CV, IM o EVC) fue de 582 (9.30%) en el grupo que fue tratado con clopidogrel y de 719 (11.41%) en el grupo que fue tratado con placebo, correspondiente a una reducción de riesgo relativo del 20% (IC 95% de 10%-28%; p = 0.00009) para el grupo de pacientes tratados con clopidogrel (ver Tabla 2).
Al final de los 12 meses, el número de pacientes que experimentaron el resultado co-primario (muerte CV, IM, EVC o isquemia refractaria) fue de 1,035 (16.54%) en el grupo en tratamiento con clopidogrel, y de 1,187 (18.83%) en el grupo con placebo, correspondiente a una reducción de riesgo relativo del 14% (IC 95% de 6%-21%, p=0.0005) para el grupo de tratamiento con clopidogrel (ver Tabla 2).
En el grupo tratado con clopidogrel, cada parámetro de los dos resultados primarios (muerte CV, IM, EVC, isquemia refractaria) ocurrió con menor frecuencia que en el grupo que recibió placebo.
Los beneficios de clopidogrel (bisulfato de clopidogrel), se conservaron durante todo el estudio (hasta los 12 meses) (ver Figura 2).
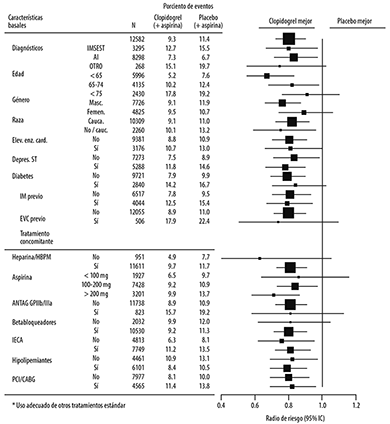
En el estudio CURE, el uso de clopidogrel se relacionó con una menor incidencia de muerte CV, IM o EVC en poblaciones de pacientes con diferentes características, como se muestra en la Figura 2. Los beneficios asociados con el uso de clopidogrel fueron independientes del uso de otros tratamientos cardiovasculares a corto y a largo plazo, incluyendo heparina/HBPM (heparina de bajo peso molecular), inhibidores de la glucoproteína IIb/IIIa (GP IIb/IIIa) por vía intravenosa, hipolipemiantes, beta bloqueadores, e inhibidores de la ECA.
La eficacia de clopidogrel se observó independientemente de la dosis de AAS (75-325 mg una vez al día). El uso de anticoagulantes orales, medicamentos antiplaquetarios no incluidos en el estudio y AINES, no se permitió en el estudio CURE.
El uso de clopidogrel en el estudio CURE se relacionó con una disminución en el uso de terapia trombolítica (71 pacientes [1.1%] en el grupo con clopidogrel, 126 pacientes [2.0%] en el grupo con placebo; con una reducción de riesgo relativo de 43%, p=0.0001), y de inhibidores de la GP IIb/IIIa (369 pacientes [5.9%] en el grupo con clopidogrel, 454 pacientes [7.2%] en el grupo con placebo, con una reducción del riesgo relativo del 18%, p=0.003). El uso de clopidogrel en el estudio CURE, no tuvo impacto sobre el número de pacientes tratados con cirugía de revascularización coronaria o ICP (con o sin colocación de un stent), (2,253 pacientes [36.0%] en el grupo con clopidogrel, 2,324 pacientes [36.9%] en el grupo con placebo; reducción del riesgo relativo de 4.0%, p=0.1658).
Tabla 2. Resultado de los eventos en el análisis primario del estudio CURE
|
Resultado |
Clopidogrel (+ AAS)a (n=6,259) |
Placebo (+ AAS)a (n=6,303) |
Reducción de Riesgo Relativo (%) (IC 95%) |
|
Resultado primario (muerte CV, IM, EVC) |
582 (9.3%) |
719 (11.4%) |
20% (10.3, 27.9) p=0.00009 |
|
Resultado co-primario (muerte CV, IM, EVC, isquemia refractaria) |
1,035 (16.5%) |
1,187 (18.8%) |
14% (6.2, 20.6) p=0.00052 |
|
Todos los eventos de los resultados individualesb |
|||
|
Muerte CV |
318 (5.1%) |
345 (5.5%) |
7% (-7.7, 20.6) |
|
IM |
324 (5.2%) |
419 (6.6%) |
23% (11.0, 33.4) |
|
EVC |
75 (1.2%) |
87 (1.4%) |
14% (-17.7, 36.6) |
|
Isquemia refractaria |
544 (8.7%) |
587 (9.3%) |
7% (-4.0, 18.0) |
a Otras terapias estándar, en uso cuando sea indicado.
b Los componentes individuales no representan un desglose de los resultados primario y co-primario, sino más bien el número total de sujetos que tuvieron algún evento durante el curso del estudio.
Figura 2. Muerte cardiovascular, infarto del miocardio y EVC en el estudio CURE
* Otras terapias estándar cuando esté indicado.
Figura 3. Radio de Riesgos para las características basales de los pacientes y medicamentos concomitantes/intervenciones durante el estudio CURE
En pacientes con infarto agudo de miocardio con elevación del segmento ST se han evaluado la seguridad y la eficacia de clopidogrel en dos estudios aleatorizados, controlados con placebo, con diseño doble ciego, el estudio COMMIT -un estudio con una numerosa población realizado en China- y el estudio CLARITY -un estudio internacional de apoyo, con marcadores surrogados.
El estudio CLARITY, aleatorizado, doble ciego, controlado con placebo, incluyó a 3,491 pacientes, dentro de las primeras 12 horas del inicio de un infarto del miocardio con elevación del segmento ST, en los que se tenía planeado efectuar una terapia trombolítica. Se aleatorizó a los pacientes con clopidogrel (dosis de carga de 300 mg, seguidos de 75 mg/día) o con placebo, hasta la angiografía, alta hospitalaria, o día 8. También se les administró AAS (150 a 325 mg como dosis de carga, seguidos de 75 a 162 mg/día), un agente fibrinolítico y, cuando estuviese indicado heparina durante 48 horas. Se dio seguimiento a los pacientes por 30 días. El punto final primario fue la presentación de un compuesto de una arteria culpable ocluida (definido mediante un Flujo TIMI 0 ó 1) en la angiografía previa al alta o muerte, o infarto del miocardio recurrente al tiempo del inicio de la angiografía coronaria.
La población de pacientes fue principalmente caucásica (89.5%) e incluyó a 19.7% del género femenino, a 29.2% de pacientes con edad ≥65 años. Al 99.7% de los pacientes se les administraron fibrinolíticos (fibrino específicos: 68.7%, no fibrino específicos: 31.1%), 89.5% heparina, 78.7% beta bloqueadores, 54.7% inhibidores de la ECA y 63% estatinas.
El número de pacientes que alcanzó el punto final primario fue de 262 (15%) en el grupo con clopidogrel, y 377 (21.7%) en el grupo con placebo, pero la mayoría de los eventos se relacionaron con el marcador surrogado de permeabilidad vascular (ver Figura 4 y Tabla 3).
El estudio COMMIT fue aleatorizado, doble ciego, controlado con placebo, con un diseño factorial 2 x 2, e incluyó a 45,852 pacientes dentro de las primeras 24 horas del inicio de síntomas sospechosos de infarto de miocardio, con demostración de alteraciones en el ECG (elevación del segmento ST, depresión del segmento ST, o bloqueo de rama izquierda). Se aleatorizó a los pacientes para la administración de clopidogrel (75 mg al día) o placebo, en combinación con AAS (162 mg/día), durante 28 días o hasta su alta hospitalaria, lo que ocurriese primero.
Los puntos finales co-primarios consistieron en muerte por cualquier causa y la presencia de reinfarto, EVC o muerte.
La población de pacientes incluyó 28% de mujeres, 58% de pacientes con edad ≥60 años (26% ≥70 años) y 55% de pacientes que recibieron trombolíticos, 68% recibieron inhibidores de la ECA, y sólo el 3% tuvo una intervención coronaria percutánea (ICP).
Como se muestra en la Tabla 4 en las Figuras 5 y 6 más adelante clopidogrel redujo significativamente el riesgo relativo de muerte por cualquier causa en 7% (p=0.029), y el riesgo relativo de la combinación de reinfarto, EVC o muerte en 9% (p=0.002).
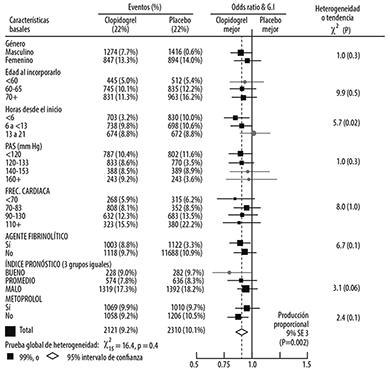
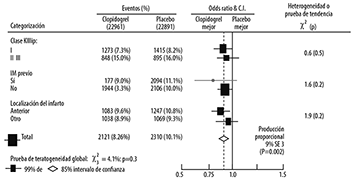
Como se muestra en la Figura 7, el efecto de clopidogrel no difirió significativamente en varios grupos pre-especificados. Adicionalmente, el efecto fue similar en los subgrupos no pre-especificados, incluyendo aquellos basados en la localización del infarto, la clase Killip, o historia previa de IM (ver Figura 8). Los resultados de estos subgrupos deben ser analizados muy cuidadosamente.
Figura 4. Tasa de eventos del punto final primario compuesto del estudio CLARITY
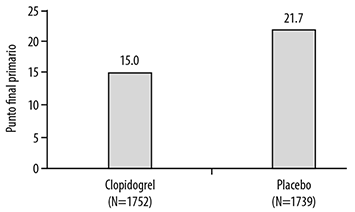
Con base en las probabilidades de arteria ocluida relacionada con el infarto (TFG 0/1), muerte o IM por angiografía para clopidogrel versus placebo (OR: 0.64 [0.53 a 0.76]; p<0.01).
Tabla 3. Rango de eventos para el punto final primario combinado en el estudio CLARITY
|
Clopidogrel 1,752 |
Placebo 1,739 |
Momio de probabilidad |
95% IC |
|
|
Número (%) de pacientes que tuvieron el punto final compuesto |
262 (15%) |
377 (21.7%) |
0.64 |
0.53, 0.76 |
|
Oclusión de vaso culpable |
||||
|
N (sujetos con angiografía) |
1,640 |
1,634 |
||
|
N (%) pacientes que tuvieron el punto final |
192 (11.7%) |
301 (18.4%) |
0.59 |
0.48, 0.72 |
|
Muerte |
||||
|
N (%) pacientes que tuvieron el punto final |
45 (2.6%) |
38 (2.2%) |
1.18 |
0.76, 1.83 |
|
IM recurrente |
||||
|
N (%) pacientes que tuvieron el punto final |
44 (2.5%) |
62 (3.6%) |
0.69 |
0.47, 1.02 |
* El número total de pacientes con un componente del evento (vaso culpable ocluido, muerte o IM recurrente) es mayor que el número de pacientes con un evento combinado, debido a que algunos pacientes tuvieron más de un componente del evento.
Tabla 4. Resultado de los eventos en el análisis COMMIT
|
Evento |
Clopidogrel (+ AAS) (n=22,961) |
Placebo (+ AAS) (n=22,891) |
Momio de probabilidad (95% IC) |
p |
|
Punto final compuesto: muerte, IM o EVCa |
2,121 (9.2%) |
2,310 (10.1%) |
0.91 (0.86, 0.97) |
0.002 |
|
Muerte |
1,726 (7.5%) |
1,845 (8.1%) |
0.93 (0.87, 0.99) |
0.029 |
|
IM no fatalb |
270 (1.2%) |
330 (1.4%) |
0.81 (0.69, 0.95) |
0.011 |
|
EVC no fatalb |
127 (0.6%) |
142 (0.6%) |
0.89 (0.70, 1.13) |
0.33 |
a La diferencia entre el punto final compuesto y la suma de muerte + IM no fatal + EVC no fatal indica que 9 pacientes (2 con clopidogrel y 7 con placebo) sufrieron tanto de un EVC no fatal y de un IM no fatal.
b IM no fatal y EVC no fatal, excluye a pacientes que fallecieron (por cualquier causa).
Figura 5. Incidencia de eventos acumulados para muerte en el estudio COMMIT
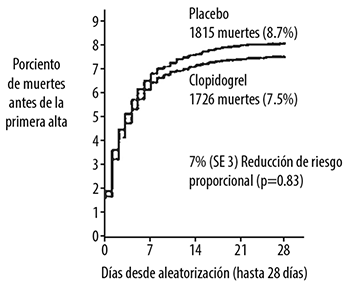
* Todos los pacientes fueron tratados con ácido acetilsalicílico.
Figura 6. Incidencia de eventos acumulados para los puntos finales combinados de reinfarto, EVC o muerte en el estudio COMMIT*.
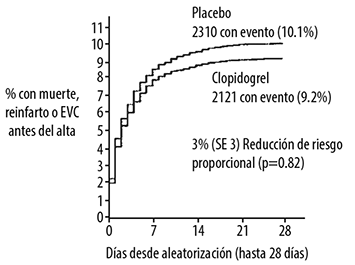
Figura 7. Efectos de la adición de clopidogrel a ácido acetilsalicílico en los subgrupos no pre-especificados del estudio COMMIT
Tres grupos índice pronósticos de tamaño similar fueron basados en riesgo absoluto o un compuesto primario de desenlaces calculados de variables pronósticas basales (excluyendo tratamientos asignados) con un modelo de regresión logística de Cox.
Figura 8. Efectos de la adición de clopidogrel a ácido acetilsalicílico en los subgrupos no pre-especificados del estudio COMMIT
Disminución ajustada de la dosis de agentes inhibidores del receptor P2Y12 en SICA: El cambio de un inhibidor del receptor P2Y12t más potente a clopidogrel en asociación con aspirina después de la fase aguda en SICA ha sido evaluado en dos estudios aleatorizados patrocinados por un investigador (ISS por sus siglas en inglés) -TOPIC y TROPICAL-ACS- con los datos de resultado clínico.
El beneficio clínico proporcionado por los inhibidores del receptor P2Y12 más potentes, ticagrelor y prasugrel, en sus estudios fundamentales se relaciona con una reducción significativa de eventos isquémicos recurrentes (incluyendo trombosis del stent (TS) aguda y subaguda, infarto de miocardio (IM) y revascularización urgente). Aunque el beneficio isquémico fue constante durante el primer año, se observó una mayor reducción en la recurrencia isquémica después del SICA durante los días iniciales posteriores al inicio del tratamiento. Por el contrario, los análisis post hoc demostraron aumentos estadísticamente significativos en el riesgo de hemorragia con los inhibidores más potentes del receptor P2Y12, que se producen predominantemente durante la fase de mantenimiento, después del primer mes post-SICA. Los estudios TOPIC y TROPICAL-ACS se diseñaron para estudiar cómo mitigar los eventos hemorrágicos mientras se mantiene la eficacia.
Estudio TOPIC (Momento de la inhibición plaquetaria después del síndrome coronario agudo): Este estudio abierto, aleatorizado y patrocinado por el investigador incluyó pacientes con SICA que requieren ICP. A los pacientes tratados con aspirina y un bloqueador del receptor P2Y12 más potente y sin eventos adversos al mes se les asignó cambiar a dosis fija de aspirina más clopidogrel (Desescalada de la terapia antiplaquetaria dual (TAD)) o continuar su régimen farmacológico (TAD sin cambios).
En general, se analizaron 645 de 646 pacientes con infarto agudo al miocardio con elevación del segmento ST (IAMCEST) o infarto agudo al miocardio sin elevación del segmento ST (IAMSEST) o angina inestable (Desescalada de la TAD (n=322), TAD sin cambios (n=323)). Se realizó un seguimiento a un año para 316 pacientes (98.1%) en el grupo con TAD desescalada y 318 pacientes (98.5%) en el grupo con TAD sin cambios. La mediana de seguimiento para ambos grupos fue de 359 días. Las características de la cohorte estudiada fueron similares en los 2 grupos.
El resultado primario, un compuesto de muerte cardiovascular, ECV, revascularización urgente y BARC (Bleeding Academic Research Consortium) hemorragia ≥2 a 1 año después de un SICA, se produjo en 43 pacientes (13.4%) en el grupo con TAD desescalada y en 85 pacientes (26.3%) en el grupo con TAD sin cambios (p<0.01). Esta diferencia estadísticamente significativa se debió principalmente a un menor número de episodios de hemorragia, sin diferencias en los puntos finales isquémicos (p=0.36), mientras que la hemorragia BARC ≥2 ocurrió con menor frecuencia en el grupo con TAD desescalada (4.0%) frente al 14.9% en el grupo con TAD sin cambios (p<0.01). Los eventos hemorrágicos definidos como todos los BARC ocurrieron en 30 pacientes (9.3%) en el grupo con TAD desescalada y en 76 pacientes (23.5%) en el grupo con TAD sin cambios (p<0.01).
TROPICAL-ACS (Capacidad de respuesta a la inhibición plaquetaria del tratamiento antiplaquetario crónico para síndromes coronarios agudos): El estudio abierto aleatorizado, patrocinado por el investigador incluyó 2,610 pacientes con SICA positivos a biomarcadores después de una ICP exitosa. Los pacientes fueron aleatorizados para recibir prasugrel 5 o 10 mg/día (días 0-14) (n=1306), o prasugrel 5 o 10 mg/día (días 0-7) luego se desescaló a clopidogrel 75 mg/día (días 8-14) (n=1304), en combinación con ASA (<100 mg/día). En el día 14, se realizó una prueba de función plaquetaria (PFT por sus siglas en inglés). Los pacientes con prasugrel solo, continuaron con prasugrel durante 11.5 meses.
Los pacientes bajo tratamiento desescalado se sometieron a pruebas de alta reactividad plaquetaria (HPR por sus siglas en inglés). Si las unidades HPR ≥46, los pacientes se volvieron a escalar a prasugrel 5 o 10 mg/día durante 11,5 meses; si HPR <46 unidades, los pacientes continuaron con clopidogrel 75 mg/día durante 11.5 meses. Por lo tanto, el brazo guiado desescalado tenía pacientes con prasugrel (40%) o clopidogrel (60%). Todos los pacientes continuaron con aspirina y fueron monitoreados durante un año.
El punto final primario fue la incidencia combinada de muerte CV, infarto de miocardio, ECV y grado de sangrado BARC ≥2 a los 12 meses. El estudio cumplió su objetivo principal de mostrar la no inferioridad: 95 pacientes (7%) en el grupo de desescalamiento guiado y 118 pacientes (9%) en el grupo control (p no inferior=0.0004) tuvieron un evento. El desescalamiento guiado no resultó en un aumento del riesgo combinado de eventos isquémicos (2.5% en el grupo desescalado frente al 3.2% en el grupo control, p no inferior=0.0115), ni en el punto final secundario clave de la hemorragia BARC ≥2 ((5%) en el grupo de ajuste de disminución guiada frente al 6% en el grupo control (p=0.23)).
La incidencia acumulada de todos los eventos hemorrágicos (BARC clase 1 a 5) fue del 9% (114 eventos) en el grupo de desescalamiento guiado frente al 11% (137 eventos) en el grupo control (p=0.14).
Fibrilación auricular: Los estudios ACTIVE-W y ACTIVE-A estudios separados del programa ACTIVE, incluyeron pacientes con fibrilación auricular quienes tenían al menos un factor de riesgo para eventos vasculares. Con base en los criterios de enrolamiento, médicos enrolaron pacientes en ACTIVE-W si eran candidatos a tratamiento con antagonistas de vitamina K; el estudio de ACTIVE-A incluyó pacientes que no podían recibir tratamiento con antagonistas de vitamina K.
El estudio ACTIVE-W demostró que el tratamiento con antagonistas de vitamina K fue más efectivo que clopidogrel y AAS.
El estudio ACTIVE-A (N 7,554) fue multicéntrico, aleatorizado, doble ciego, placebo controlado donde se comparó 75 mg diarios de clopidogrel + AAS (N=3,772), vs placebo + AAS (N=3,782). La dosis recomendada para AAS fue 75 mg a 100 mg diarios. Estos pacientes fueron tratados por cinco años.
Los pacientes fueron aleatorizados en el programa ACTIVE donde se documentó FA, ya fuera FA permanente o al menos dos episodios de FA intermitente en los últimos 6 meses, y que tuvieran al menos uno de los siguientes factores de riesgo: edad ≥75 años o edad de 55 a 74 años y ya sea con diabetes mellitus bajo tratamiento médico, o infarto previo documentado o enfermedad arterial coronaria documentada; tratados por hipertensión; EVC previo, AIT, o embolismo sistémico no en SNC; disfunción ventricular izquierda con fracción de eyección del ventrículo izquierdo menor 45%; o enfermedad vascular periférica documentada. El puntaje promedio CHADS2 fue 2.0 (rango de 0-6).
Setenta y tres por ciento (73%) de los pacientes enrolados en el estudio ACTIVE-A no tomaron antagonistas de vitamina K debido a la decisión médica basada en incapacidad de apego a monitoreo con INR, predisposición a caídas o trauma en cabeza, riesgo específico de sangrado; para 26% de los pacientes, la decisión médica fue basada con la negativa de los pacientes para tomar antagonistas de vitamina K.
La población de pacientes incluyo 41.8% mujeres. La edad promedio fue 71 años, 41.6% de los pacientes eran ≥ a 75 años. Un total de 23% pacientes recibieron antiarrítmicos, 52.1% beta bloqueadores, 54.6% IECA y 25.4% estatinas.
El número de pacientes que alcanzó el punto final primario (primer evento de EVC, IM, embolismo sistémico no a SNC o muerte vascular) fue 832 (22.1%) en el grupo tratado con clopidogrel + AAS y 924 (24.4%) en el grupo de placebo + AAS (ver Tabla 5).
Tabla 5. Resumen de la frecuencia adjudicada de resultados de eventos primarios
|
Objetivos primariosa |
No. (%) de eventos |
|||
|
Clopidogrel + AAS (n=3772) |
Palcebo + AAS (n=3782) |
Reducción de riesgo relativo % (95% IC) |
Valor P |
|
|
IM/EVC/Embolismo sistémico no SNC/muerte CV |
832 (22.06) |
924 (24.43) |
11.1 (2.4 a 19.1) |
0.0133 |
|
IM (fatal o no) |
84 (2.23) |
105 (2.78) |
||
|
EVC (fatal o no) |
285 (7.56) |
391 (10.34) |
||
|
Embolismo sistémico no a SNC |
50 (1.33) |
48 (1.127) |
||
|
Muerte vascular |
413 (10.95) |
380 (10.05) |
||
a Solo el primer evento fue tomado en cuenta.
SNC sistema nervioso central, IM infarto de miocardio.
El beneficio de clopidogrel + AAS fue observado tempranamente y se mantuvo a través de la duración del estudio por 5 años; el riesgo de eventos primarios fue consistentemente menor en el grupo de clopidogrel + AAS comparados con el grupo de placebo + AAS.
La reducción en el riesgo de eventos vasculares mayores en el grupo clopidogrel + AAS fue primeramente debido a la reducción de la incidencia de EVC. Los EVC ocurrieron en 296 pacientes (7.8%) en el grupo clopidogrel + AAS y 408 (10.8%) en el grupo de placebo + AAS (ver Tabla 6 y Figura 9).
La tasa de riesgo de eventos sistémicos fue significativamente menor en el grupo de clopidogrel + AAS en comparación a placebo + AAS. (6.2% vs 9.1%; reducción de riesgos relativo, 32.4%; 95% IC, 20.2% a 42.7%). (ver Tabla 7).
El riesgo de EVC en cualquier severidad fue menor con el uso de clopidogrel + AAS. Adicionalmente, 46 menos EVCs poco incapacitantes y 69 menos EVCs incapacitantes o fatales fueron reportados con clopidogrel + AAS en comparación con placebo + AAS. Hubo una tendencia en la reducción de riesgo en infartos de miocardio en el grupo tratados con clopidogrel + AAS (reducción de riesgo relativo 21.9%; 95% IC, menos 3% a 40.7%; p=0.08) el rango de embolismos sistémico no en SNC y muerte de causa vascular fue similar entre ambos grupos (ver Tabla 6).
Tabla 6. Resumen de la frecuencia de resultados secundarios y otros resultados (ITT resultados de eventos adjudicad os)
|
Resultados |
No. (%) de eventos |
|||
|
Clopidogrel + AAS (n=3772) |
Placebo + AAS (n=3782) |
Reducción de riesgo relativo (%) (95% IC) |
Valor p |
|
|
EVC (fatal o no) |
296 (7.85) |
408 (10.79) |
28.4 (16.8 a 38.3) |
0.00001 |
|
EVC isquémico |
235 (6.23) |
343 (9.07) |
32.4 (20.2 a 42.7) |
|
|
EVC hemorrágico |
30 (0.80) |
22 (0.58) |
-36.3 (-136 a 21.4) |
|
|
EVC incierto |
41 (1.09) |
51 (1.35) |
19.6 (-21.4 a 46.7) |
|
|
Muerte total |
825 (21.87) |
841 (22.24) |
1.9 (-8 a 10.9) |
0.6958 |
|
IM (fatal o no) |
90 (2.39) |
115 (3.04) |
21.9 (-3 a 40.7) |
0.0789 |
|
Muerte vascular |
600 (15.91) |
599 (15.84) |
-0.2 (-12.2 a 10.5) |
0.9759 |
|
Embolismo sistémico no SNC |
54 (1.43) |
56 (1.48) |
3.5 (-40.3 a 33.6) |
0.8521 |
La eficacia de clopidogrel + AAS fue notada tempranamente y fue mantenida a lo largo del estudio de 5 años; el riesgo de EVC fue consistentemente menor en el grupo de clopidogrel + AAS comparado con el grupo de placebo más de AAS. Clopidogrel + AAS redujo el número total de días hospitalarios por causas cardiovasculares. El número total de días de hospitalización por causas cardiovasculares fue 30,276 en el grupo clopidogrel + AAS y 34,813 en el grupo de placebo + AAS. El efecto de clopidogrel + AAS en los resultados primarios y EVC fue consistente en los dos grupos (ver Figuras 10 y 11).
Figura 9. Rango de eventos sobre el tiempo para EVC (resultado de eventos adjudicados)
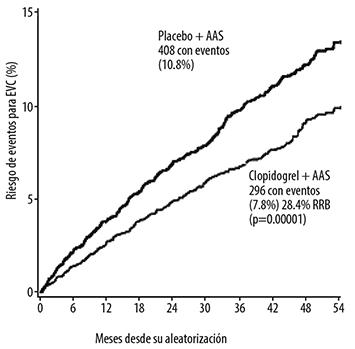
Figura 10. Riesgos relativos de varios datos y subgrupos de enfermedades de acuerdo al tratamiento de resultados en eficacia primaria en ACTIVE A
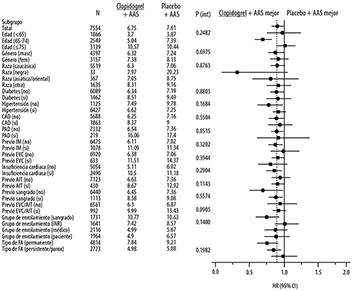
Nota: (factores agrupados post hoc) riesgo de sangrado específico incluye cualquiera de los siguientes: Predisposición a caídas o trauma en cabeza, elevación de la presión arterial persistente a más de 160/100 mmHg, sangrado serio previa ingesta de anticoagulantes orales, historia de abuso de alcohol severo, insuficiencia renal crónica, úlcera péptica documentada en el último año, trombocitopenia, o uso crónico AINES. Incapacidad en el apego de monitoreo de INR incluye riesgo de sangrado. Evaluación médica incluye la no administración de anticoagulantes orales.
Figura 11. Riesgos relativos de varios datos y subgrupos de enfermedades de acuerdo al tratamiento de resultados en eficacia primaria en ACTIVE A
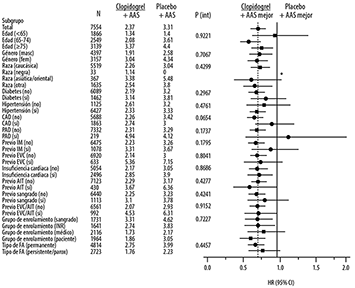
* El IC más alto está más allá del último valor en el eje de X. El IC más alto para pacientes con PAD (enfermedad arterial periférica por sus siglas en inglés) es 2.46.
Nota: (factores agrupados post hoc) riesgo de sangrado específico incluye cualquiera de los siguientes: Predisposición a caídas o trauma en cabeza, elevación de la presión arterial persistente a más de 160/100 mmHg, sangrado serio previa ingesta de anticoagulantes orales, historia de abuso de alcohol severo, insuficiencia renal crónica, úlcera péptica documentada en el último año, trombocitopenia, o uso crónico AINES. Incapacidad en el apego de monitoreo de INR incluye riesgo de sangrado. Evaluación médica incluye la no administración de anticoagulantes orales.
Estudios en Población Pediátrica: Un estudio aleatorizado, controlado con placebo (CLARINET) no demostró un beneficio clínico de clopidogrel en recién nacidos y lactantes con cardiopatía congénita cianótica paliada con fístula arterial sistémico-pulmonar. En este estudio, 906 pacientes pediátricos fueron distribuidos aleatoriamente para recibir clopidogrel 0,2 mg/kg/día (n=467) o placebo (n=439) después de la cirugía, tan pronto como fuera posible, hasta que el punto final primario fuera alcanzado. El tiempo medio entre la cirugía y la primera administración del medicamento del estudio fue de 20 días.
Aproximadamente el 88% de los pacientes recibieron concomitantemente AAS (1 a 23 mg/kg/día). No hubo diferencia significativa entre los grupos en relación al punto final primario compuesto por muerte, trombosis de la fístula o intervención cardiaca relacionada, antes de 120 días de edad, después de un evento considerado de naturaleza trombótica (89 [19,1%] para el grupo de clopidogrel y 90 [20.5%] para el grupo placebo) (ver Dosis y vía de administración, Poblaciones especiales).
La hemorragia fue la reacción adversa más frecuente en ambos grupos clopidogrel y placebo; sin embargo, no hubo diferencia significativa en la tasa de sangrado entre los grupos.
CONTRAINDICACIONES: Hipersensibilidad a clopidogrel o a cualquiera de los componentes de la fórmula. En pacientes con sangrado patológico activo, por ejemplo, úlcera péptica y hemorragia intracraneal.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: Se han realizado estudios de reproducción en ratas con dosis de clopidogrel de 500 mg/kg/día y en conejos con dosis hasta de 300 mg/kg/día. Dichas pruebas no han evidenciado ningún efecto en fertilidad o daño fetal. En humanos no existen estudios adecuados y bien controlados en mujeres embarazadas.
En consecuencia, debido a que los estudios de reproducción en animales no siempre son predictivos de la respuesta en seres humanos, este medicamento solamente deberá utilizarse en el embarazo si a criterio del médico, el fármaco resulta claramente necesario.
Lactancia: Estudios llevados a cabo en ratas han demostrado que el clopidogrel y/o sus metabolitos son excretados en la leche materna; sin embargo, no se conoce si el fármaco es excretado en la leche humana. Debido a que muchos fármacos son excretados en la leche humana y en virtud del potencial de eventos adversos serios en niños lactando se deberá decidir si se suspende la lactancia o si se interrumpe la administración del fármaco, tomando en cuenta la importancia del medicamento en mujeres en periodo de lactancia.
REACCIONES SECUNDARIAS Y ADVERSAS:
Experiencia en estudios clínicos: Se ha evaluado la seguridad de clopidogrel en más de 44,000 pacientes, incluyendo cerca de 12,000 que recibieron tratamiento por 1 año o más. Clopidogrel, a la dosis de 75 mg/día, fue bien tolerado comparativamente con AAS en dosis de 325 mg/día, de acuerdo con los resultados del estudio CAPRIE. La tolerabilidad general de clopidogrel en el estudio fue similar a la de AAS, independientemente de la edad, género y raza. A continuación se describe la importancia clínica de los eventos adversos observados en los estudios CAPRIE, CURE, CLARITY, COMMIT y ACTIVE-A como se describe abajo.
Trastornos hemorrágicos: En CAPRIE, la incidencia general de sangrado con clopidogrel y AAS fue la misma (9.3%). La incidencia de eventos severos fue 1.4% y 1.6% en los grupos con clopidogrel y con AAS, respectivamente.
En los pacientes a los que se les administró clopidogrel, hubo hemorragia gastrointestinal con una frecuencia del 2.0%, y requirió de hospitalización en el 0.7%. En los pacientes que recibieron AAS las frecuencias fueron de 2.7% y 1.1%, respectivamente.
La incidencia general de otras alteraciones hemorrágicas fue mayor en el grupo con clopidogrel (7.3%) comparativamente con AAS (6.5%). Sin embargo, la incidencia de eventos severos fue similar en ambos grupos de tratamiento (0.6% vs 0.4%). Los eventos adversos que se reportaron con mayor frecuencia fueron púrpura/equimosis y epistaxis. Otros eventos adversos que se reportaron con menor frecuencia fueron hematoma, hematuria y hemorragia ocular (principalmente conjuntival).
La incidencia de hemorragia intracraneal fue de 0.4% con clopidogrel, comparativamente con 0.5% con ácido acetilsalicílico (AAS).
En CURE, hubo un incremento en el sangrado mayor y menor en el grupo clopidogrel + AAS, comparativamente con el grupo placebo + AAS (frecuencia de eventos 3.7% vs 2.7%, para sangrado mayor, respectivamente, y de 5.1% vs 2.4% para sangrado menor). Los principales sitios de sangrado fueron gastrointestinal y en los sitios de punción arterial.
El incremento en la incidencia de sangrados que ponen en peligro la vida en el grupo de clopidogrel + AAS, comparativamente con el grupo de placebo + AAS no fue estadísticamente significativo (2.2% vs 1.8%). No hubo diferencia entre los dos grupos en la incidencia de sangrado fatal (0.2% en ambos grupos).
La incidencia de sangrados mayores que no ponen en peligro la vida fue significativamente mayor en el grupo de clopidogrel + AAS comparativamente con el grupo de placebo + AAS (1.6% vs 1%) y la incidencia de hemorragia intracraneal fue de 0.1% en ambos grupos.
La mayor incidencia de sangrado para clopidogrel + AAS fue dependiente de la dosis de AAS (<100 mg: 2.6%; 100-200 mg: 3.5%; >200 mg: 4.9%), como la incidencia mayor de sangrado para placebo + AAS (<100 mg: 2.0%; 100-200 mg: 2.3%; 200 mg: 4.0%).
No hubo exceso de sangrados mayores dentro de los 7 días después de la cirugía de revascularización coronaria en aquellos pacientes que interrumpieron el tratamiento por más de cinco días antes de la cirugía (frecuencia de eventos 4.4% clopidogrel + AAS vs 5.3% placebo + AAS). En los pacientes que continuaron con el tratamiento dentro de los cinco días de la cirugía de revascularización coronaria, la frecuencia de eventos fue de 9.6% para clopidogrel + AAS, y de 6.3% para placebo + AAS.
La incidencia global de sangrado se describe en la Tabla 7 para pacientes que recibieron clopidogrel y AAS en el estudio CURE.
El 92% de los pacientes en el estudio CURE recibieron heparina/heparina de bajo peso molecular, y la frecuencia de sangrado en estos pacientes fue similar a los resultados globales.
Tabla 7. Incidencia de complicaciones de sangrado en estudio CURE (% de pacientes)
|
Evento |
Clopidogrel + AASa (n=6,259) |
Placebo (+ AAS)a (n = 6,303) |
p |
|
Sangrado mayorb |
3.7c |
2.7d |
0.001 |
|
Sangrado que pone en peligro la vida |
2.2 |
1.8 |
0.13 |
|
Fatal |
0.2 |
0.2 |
|
|
5 g/dL de pérdida de hemoglobina |
0.9 |
0.9 |
|
|
Requirieron de intervención quirúrgica |
0.7 |
0.7 |
|
|
EVC hemorrágico |
0.1 |
0.1 |
|
|
Requirió de inotrópicos |
0.5 |
0.5 |
|
|
Requirió de transfusión (≥4 unidades) |
1.2 |
1.0 |
|
|
Otros sangrados mayores |
1.6 |
1.0 |
0.005 |
|
Significativamente discapacitante |
0.4 |
0.3 |
|
|
Hemorragia intraocular con pérdida significativa de la visión |
0.05 |
0.03 |
|
|
Requirió de 2-3 unidades de sangre |
1.3 |
0.9 |
|
|
Sangrado menor¶ |
5.1 |
2.4 |
<0.001 |
a Se usaron otras terapias estándar cuando estuvo indicado.
b Sangrado que pone en peligro la vida y otro sangrado mayor.
c Frecuencia de evento de sangrado mayor para clopidogrel + AAS que fue dependiente de la dosis de AAS: <100 mg = 2.6%; 100-200 mg = 3.5%; >200 mg = 4.9%.
Las tasas de sangrado mayor para clopidogrel + AAS en relación con la edad fueron: <65 años=2.5%, ≥65 a <75 años=4.1%, ≥75 años=5.9%.
d Frecuencia de evento de sangrado mayor para placebo + AAS, que fue dependiente de la dosis de AAS: <100 mg=2.0%; 100-200 mg=2.3%; >200 mg=4.0%.
Las tasas de sangrado mayor para placebo + AAS en relación con la edad fueron: <65 años=2.1%, ≥65 a <75 años=3.1%, ≥75 años=3.6% que dio lugar a interrumpir la administración del medicamento AAS:AAS.
En el estudio CLARITY, la incidencia de sangrado mayor (definido como hemorragia intracraneal, o sangrado con disminución de la hemoglobina > 5 g/dl) fue similar entre los grupos (1.3% vs 1.1%, respectivamente en los grupos clopidogrel + AAS y placebo + AAS). Este hallazgo fue consistente entre todos los subgrupos de pacientes definidos por las características basales, y el tipo de fibrinolítico o de heparina utilizada. La incidencia de sangrado fatal (0.8% vs 0.6%, en el grupo de clopidogrel + AAS y en el grupo de placebo + AAS, respectivamente) y de hemorragia intracraneal (0.5% vs 0.7%, respectivamente) fue bajo y similar entre ambos grupos.
La incidencia global de sangrado mayor no cerebral o de sangrado cerebral en el estudio COMMIT fue baja y similar en ambos grupos, como se muestra en la Tabla 8.
Tabla 8. Número (%) de pacientes con eventos de sangrado en el estudio COMMIT
|
Tipo de sangrado |
Clopidogrel (+ AAS) (N=22,961) |
Placebo (+ AAS) (N=22,891) |
p |
|
Mayora no cerebral o cerebralb |
134 (0.6%) |
125 (0.5%) |
0.59 |
|
Mayor no cerebral |
82 (0.4%) |
73 (0.3%) |
0.48 |
|
Fatal |
36 (0.2%) |
37 (0.2%) |
0.90 |
|
EVC hemorrágico |
55 (0.2%) |
56 (0.2%) |
0.91 |
|
Fatal |
39 (0.2%) |
41 (0.2%) |
0.81 |
|
Otro sangrado no cerebral (no mayor) |
831 (3.6%) |
721 (3.1%) |
0.005 |
|
Cualquier tipo de sangrado no cerebral |
896 (3.9%) |
777 (3.4%) |
0.004 |
a Sangrado mayor y sangrado cerebral o no cerebral, que se supone que ocasionó la muerte o que se requirió de transfusión.
b La frecuencia relativa de sangrado mayor no cerebral y de sangrado cerebral fue independiente de la edad. La incidencia de eventos para clopidogrel + AAS por edad fue: <60 años=0.3%, ≥60 a 70 años=0.7%, ≥70 años=0.8%. La incidencia con placebo + AAS por edad fue: <60 años=0.4%, ≥60 a <70 años=0.6%, ≥70 años = 0.7%.
En el estudio ACTIVE-A, el riesgo de sangrado mayor fue más en el grupo de clopidogrel + AAS que en el grupo de placebo + AAS (6.7% contra 4.3%). El sangrado mayor fue en su mayoría de origen extracraneal en ambos grupos (5.3% en el grupo de clopidogrel + AAS; 3.5% en el grupo de placebo + AAS), principalmente en el aparato digestivo (3.5% contra 1.8%). Hubo un mayor sangrado intracraneal en el grupo tratado con clopidogrel + AAS comparado con el grupo de placebo + AAS (1.4% contra 0.8% respectivamente).
No hubo una diferencia estadísticamente significativa en los riesgos de sangrado fatal y eventos vasculares cerebrales hemorrágicos (0.8% contra 0.6%, respectivamente) entre los grupos (ver Tabla 9).
Tabla 9. Número de pacientes (%) con eventos de sangrado en ACTIVE Ac
|
Sangrado |
No (%) con eventos |
Hazard Ratio (%) (95% IC) |
Valor de p |
|
|
Clopidogrel + AAS (n 3,772) |
Placebo + AAS (n 3,782) |
|||
|
Mayora,b |
251 (6.7) |
162 (4.3) |
1.6 (1.3 a 1.9) |
<0.0001 |
|
Severoa,b |
190 (5.0) |
122 (3.2) |
1.6 (1.3 a 2.0) |
<0.0001 |
|
Fatal |
42 (1.1) |
27 (0.7) |
1.6 (1.0 a 2.5) |
0.0680 |
|
HICa,b |
54 (1.4) |
29 (0.8) |
1.9 (1.2 a 2.9) |
0.0056 |
|
Menor |
408 (10.8) |
175 (4.6) |
2.4 (2.0 a 2.9) |
<0.0001 |
|
Cualquierab |
1014 (26.9) |
651 (17.2) |
1.7 (1.5 a 1.8) |
<0.0001 |
a Como se adjudica.
b Incluye 1 paciente con un EVC isquémico adjudicado a hemorrágico, pero sin sangrado.
HIC=Hemorragia intracraneal incluye EVC hemorrágico y hematoma subdural.
c Evento de sangrado mayor para clopidogrel + AAS: <65 años=3.3% ≥65 a <75 años=7.1% ≥75 años=8.3%.
Evento de sangrado mayor para AAS únicamente por edad; <65 años=1.9% ≥65 a <75 años=3.9% ≥75 años=6.0%.
Trastornos hematológicos: En el estudio CAPRIE se observó neutropenia severa (<0.450 g/L) en 4 pacientes (0.04%) con clopidogrel, y en 2 pacientes (0.02%) con AAS. Dos de los 9,599 pacientes a los que se les administró clopidogrel, y ninguno de los 9,586 pacientes a los que se les administró AAS tuvieron cuentas de neutrófilos de cero. Aunque el riesgo de mielotoxicidad con clopidogrel parece ser más bajo, debe considerarse esta posibilidad cuando un paciente al que se le administra clopidogrel tiene fiebre o alguna otra manifestación de infección.
Se ha informado de un caso de anemia aplásica con clopidogrel.
La incidencia de trombocitopenia severa (<80 g/L) fue de 0.2% con clopidogrel y de 0.1% con AAS; muy rara vez se ha informado de casos de cuentas plaquetarias ≤30 g/L.
En los estudios CURE y CLARITY, el número de casos de trombocitopenia o de neutropenia fue similar en ambos grupos.
A continuación se presentan otras reacciones adversas de trascendencia clínica de las bases de datos de los estudios CAPRIE, CURE, CLARITY, COMMIT y ACTIVE-A con una incidencia ≥0.1%, así como todos los eventos adversos serios y de importancia clínica con una incidencia <0.1%.
Cuando aplique se usará la escala CIOMS de frecuencia: Muy común ≥10%; Común ≥1 y <10%; Poco común ≥0.1% y <1%; Raro ≥0.01% y <0.1%; Muy raro <0.01%, Desconocido (No puede ser estimado con los datos disponibles).
Trastornos del sistema nervioso central y periférico:
• Poco común: cefalea, mareos, parestesias.
• Raro: vértigo.
Trastornos del sistema gastrointestinal:
• Común: dispepsia, dolor abdominal, diarrea.
• Poco común: náuseas, gastritis, flatulencias, estreñimiento, vómitos, úlcera gástrica, úlcera duodenal.
Plaquetas, sangrado y trastornos de la coagulación:
• Poco común: prolongación del tiempo de sangrado, trombocitopenia.
Piel y anexos:
• Poco común: erupciones cutáneas, prurito.
Leucocitos y sistema reticuloendotelial:
• Poco común: leucopenia, disminución de neutrófilos, eosinofilia.
Experiencia post-comercialización: Las reacciones secundarias fueron clasificadas por órganos y sistemas. Las frecuencias de las siguientes reacciones adversas no se conocen (no pudieron estimarse de los datos disponibles).
Trastornos sanguíneos y del sistema linfático:
• Casos graves de hemorragia, principalmente cutánea, músculo-esquelética, ocular (conjuntival, retiniano), y sangrado del tracto respiratorio, epistaxis, hematuria y hemorragia de heridas quirúrgicas; casos de sangrado con resultados fatales (especialmente intracraneal, gastrointestinal y retroperitoneal).
• Agranulocitosis, anemia aplásica/pancitopenia, púrpura trombocitopénica trombótica (PTT) y hemofilia A adquirida.
Trastornos cardiacos:
• Síndrome de Kounis (angina alérgica vasoespástica/infarto alérgico del miocardio) en el contexto de una reacción de hipersensibilidad debido a clopidogrel.
Trastornos inmunológicos:
• Reacciones anafilactoides, enfermedad del suero.
• Reacción cruzada entre tienopiridinas hipersensibilidad al medicamento (como ticlopidina, prasugrel). (ver Precauciones generales).
• Síndrome de hipoglucemia autoinmune, que puede llevar a hipoglucemia severa, especialmente en pacientes con subtipo HLA DRA4 (más frecuente en la población japonesa).
Trastornos psiquiátricos:
• Confusión, alucinaciones.
Trastornos del sistema nervioso:
• Alteraciones del gusto, ageusia.
Trastornos vasculares:
• Vasculitis, hipotensión.
Trastornos respiratorios, torácicos y mediastinales:
• Broncoespasmo, neumonitis intersticial, neumonía eosinofílica.
Trastornos gastrointestinales:
• Colitis (incluyendo colitis ulcerativa y colitis linfocítica), pancreatitis, estomatitis.
Trastornos hepato-biliares:
• Hepatitis (no infecciosa), insuficiencia hepática aguda.
Trastornos de piel y anexos:
• Erupción maculopapular eritematosa o exfoliativa, urticaria, prurito, angioedema, dermatitis bulosa (eritema multiforme, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, pustulosis exantemática aguda generalizada, síndrome de hipersensibilidad inducido por fármacos, erupción cutánea con eosinofilia y síntomas sistémicos, eczema, liquen plano.
Trastornos músculo-esqueléticos, de tejido conectivo y óseo:
• Artralgia, artritis, mialgia.
Trastornos renales y urinarios:
• Glomerulopatía.
Trastornos del sistema reproductivo y glándula mamaria:
• Ginecomastia.
Trastornos generales y en el sitio de administración:
• Fiebre.
Trastornos en estudios de investigación:
• Resultados anormales de las pruebas de funcionamiento hepático, elevación de la creatinina sanguínea.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Clopidogrel no dio lugar a efectos carcinogénicos cuando fue administrado a ratones durante 78 semanas y a ratas durante 104 semanas en dosis de 100 mg/kg/día, los cuales son equivalentes a exposiciones plasmáticas >25 veces a las que se observan en humanos con la dosis diaria recomendada de 75 mg.
Clopidogrel ha sido evaluado en estudios de genotoxicidad in vitro e in vivo y no se han encontrado pruebas de actividad genotóxica.
Se observó que clopidogrel no provocó efecto alguno sobre la fertilidad en ratas macho y hembra o en conejos (con dosis equivalentes a 52 veces la dosis recomendada en humanos, en base a mg/m2).
Cuando se administró a ratas lactando, clopidogrel causó un ligero retraso en el desarrollo de la progenie.
Estudios específicos de farmacodinamia desarrollados con clopidogrel radiomarcado han demostrado que el metabolito principal o sus metabolitos son excretados en la leche. Consecuentemente un efecto directo (toxicidad ligera), o un efecto indirecto (baja palatibidad) no pueden ser excluidos.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Medicamentos asociados con riesgo de hemorragia: Existe un mayor riesgo de hemorragia debido al efecto aditivo potencial. La administración concomitante de fármacos asociados con el riesgo de hemorragia debe realizarse con precaución.
Trombolíticos: Se evaluó la seguridad de la administración concomitante de clopidogrel, trombolíticos y heparina en pacientes con infarto agudo de miocardio. La incidencia de sangrado clínicamente significativo fue similar al observado cuando se administraron trombolíticos y heparina simultáneamente con AAS.
Inhibidores de la glucoproteína llb/IIIa: Es posible una interacción farmacodinámica entre clopidogrel y los inhibidores de la glucoproteína IIb/IIIa, su uso simultáneo debe realizarse con precaución.
Anticoagulantes inyectables: En un estudio clínico realizado en individuos sanos, la administración de clopidogrel no requirió de modificación de la dosis de heparina, ni alteró el efecto de ésta sobre la coagulación. La administración concomitante de heparina no tiene ningún efecto sobre la inhibición de la agregación plaquetaria inducida por clopidogrel. Como es posible una interacción farmacodinámica entre clopidogrel y heparina, su uso simultáneo debe realizarse con precaución.
Anticoagulantes orales: Se recomienda precaución con la administración concomitante de clopidogrel con warfarina debido a que puede incrementar el riesgo de sangrado.
Ácido acetilsalicílico (AAS): El AAS no modificó la inhibición mediada por clopidogrel de la agregación plaquetaria inducida por ADP, pero clopidogrel potenció el efecto del AAS en la agregación plaquetaria inducida por colágeno. Sin embargo, la administración concomitante de 500 mg de AAS dos veces al día durante un día no aumentó significativamente la prolongación del tiempo de sangrado inducido por la toma de clopidogrel. Como es posible una interacción farmacodinámica entre clopidogrel y el AAS, su uso simultáneo debe considerarse con precaución. No obstante, se han administrado AAS 75-325 mg una vez al día y clopidogrel concomitantemente hasta por un año.
Antiinflamatorios no esteroideos (AINEs): En un estudio clínico realizado en voluntarios sanos, la administración concomitante de clopidogrel y naproxeno aumentó la pérdida oculta de sangre gastrointestinal. Sin embargo, debido a la falta de estudios de interacción con otros AINEs, en la actualidad no es claro si existe un riesgo mayor de sangrado gastrointestinal con todos los AINEs. En consecuencia, la administración de clopidogrel y AINEs debe realizarse con precaución.
Inhibidores selectivos de la recaptación de serotonina (ISRS): Debido a que los ISRS afectan la activación plaquetaria e incrementan el riesgo de sangrado, la administración concomitante de ISRS con clopidogrel debe ser tomada con precaución.
Otros tratamientos concomitantes: Dado que clopidogrel es metabolizado a su metabolito activo particularmente por CYP2C19, el uso de medicamentos que inhiben la actividad de esta enzima puede esperarse como resultado una reducción de los niveles del metabolito activo de clopidogrel. La relevancia clínica de esta interacción es incierta. El uso concomitante de inhibidores potentes y moderados de CYP2C19 (p-ej. Omeprazol) deberá ser desalentada. Si se tiene que utilizar un inhibidor de bomba de protones concomitantemente con clopidogrel, considerar usar uno con menor actividad inhibitoria de CYP2C19, como pantoprazol.
Inhibidores de bomba de protones: En un estudio clínico cruzado, clopidogrel (dosis de carga de 300 mg seguido por 75 mg) solo con omeprazol (80 mg al mismo tiempo que clopidogrel) fueron administrados por 5 días. La exposición del metabolito activo de clopidogrel fue reducido en 45% (día 1) y 40% (día 5) cuando clopidogrel y omeprazol fueron administrados juntos. La inhibición de la agregación plaquetaria promedio con 5 μM ADP disminuyó 39% (24 hrs) y 21% (día 5) cuando clopidogrel y omeprazol fueron administrados juntos.
En un segundo estudio de interacción con omeprazol 80 mg administrados aparte de la dosis estandar de clopidogrel, los resultados fueron similares, indicando que la administración de clopidogrel y omeprazol en tiempos diferentes no previenen su interacción que es probable sea debido al efecto inhibitorio de omeprazol sobre CYP2C19.
En un tercer estudio de interacción con omeprazol 80 mg administrados con dosis altas de clopidogrel (dosis de carga de 600 mg seguidos de 150 mg diarios), el grado de interacción observado fue similar a los otros estudios de interacción con omeprazol. Sin embargo la formación del metabolito activo y la agregación plaquetaria estuvieron al mismo nivel que clopidogrel administrado solo como el régimen de dosis estándar.
En un estudio clínico cruzado en sujetos sanos donde se administró clopidogrel (dosis de carga 300 mg seguidos de 75 mg) solo y con pantoprazol (80 mg al mismo tiempo que clopidogrel), por 5 días, la exposición de metabolito activo de clopidogrel disminuyó 20% (día 1) y 14% (día 5) cuando clopidogrel y pantoprazol se administraron juntos. La inhibición media de agregación plaquetaria disminuyó un 15% (24 horas) y 11% (día 5) cuando clopidogrel y pantoprazol se administraron juntos. Estos resultados indican que clopidogrel puede ser administrado con pantoprazol.
El estudio CURRENT comparó 2 regímenes de dosis de clopidogrel (dosis de carga de 600 mg, luego 150 mg por 6 días seguidos de 75 mg hasta por 30 días contra dosis de carga de 300 mg seguidos por 75 mg diarios hasta por 30 días). En un subanálisis (n=18,432) se correlacionó el uso de IBP (principalmente omeprazol y pantoprazol) al aleatorizar al paciente y al alta hospitalaria y no se demostró la interacción entre clopidogrel e IBP en el resultado del punto final primario de eficacia (muerte cardiovascular, infarto o EVC) o cualquier punto secundario, incluyendo la trombosis intra-stent.
En varios estudios conducidos con clopidogrel y otros medicamentos concomitantes para investigar el potencial de interacción famacodinámica y farmacocinética, no se han observado interacciones farmacodinámicas clínicamente significativas cuando se ha administrado clopidogrel con atenolol o nifedipino, o ambos en combinación. Además, la actividad farmacodinámica de clopidogrel no se ve influenciada significativamente por la administración conjunta de fenobarbital, cimetidina o estrógenos.
No se observó modificación en la farmacocinética de digoxina o teofilina por la coadministración de clopidogrel. Los antiácidos no modificaron el grado de absorción de clopidogrel.
Aunque la administración de 75 mg diarios de clopidogrel no modifica la farmacocinética de S-warfarina (substrato de CYP2C9) o el INR en pacientes recibiendo tratamiento a largo plazo, la coadministración de clopidogrel con warfarina incrementa el riesgo de sangrado por efectos independientes en la hemostasia. Sin embargo, altas concentraciones in vitro, clopidogrel inhibe el CYP2C9. Es poco probable que clopidogrel pueda interferir en el metabolismo de medicamentos como fenitoína y tolbutamida, AINES, los cuales son metabolizados por el citocromo P450 2C9. Datos del estudio CAPRIE indican que la fenitoína y la tolbutamida pueden ser seguras con la administración de clopidogrel.
Sustrato de CYP2C8: Se ha demostrado que el clopidogrel aumenta la exposición a repaglinida en voluntarios sanos. Los estudios in vitro han demostrado que el aumento en la exposición a repaglinida se debe a la inhibición de CYP2C8 por el metabolito glucurónido de clopidogrel. Debido al riesgo de aumento de las concentraciones plasmáticas, la administración concomitante de clopidogrel y fármacos eliminados por metabolismo de CYP2C8 (por ejemplo, repaglinida, paclitaxel) debe realizarse con precaución.
Aparte de la información descrita anteriormente sobre interacciones medicamentosas específicas, los pacientes que ingresaron a estudios clínicos (CAPRIE y CURE) recibieron una variedad de medicamentos concomitantes incluyendo diuréticos, betabloqueadores, IECAS, calcio antagonistas, medicamentos para la reducción del colesterol, vasodilatadores coronarios, medicamentos antidiabéticos (incluyendo insulina), agentes antiepilépticos, antagonistas de glucoproteína IIb/IIIa y terapia de reemplazo hormonal, sin evidencia clínica de interacciones adversas.
Al igual que con otros inhibidores orales de P2Y12, la administración concomitante de agonistas opioides tiene el potencial de retrasar y reducir la absorción de clopidogrel, presumiblemente debido a un vaciamiento gástrico lento. La relevancia clínica es desconocida. Considere el uso de un agente antiplaquetario parenteral en pacientes con síndrome coronario agudo que requieren la administración concomitante de morfina u otros agonistas opioides.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: A la fecha, no se ha descrito alteración alguna en pruebas de laboratorio.
PRECAUCIONES GENERALES:
Sangrado y desórdenes hematológicos: Debido al riesgo de sangrado y de efectos hematológicos indeseables, se debe considerar de inmediato tomar una determinación de la cuenta de células sanguíneas y/o aquellos estudios que estén indicados cuando haya síntomas clínicos sospechosos durante el tratamiento (ver Reacciones secundarias y adversas). Debido a que el riesgo de sangrado se incrementa, la administración concomitante de warfarina y clopidogrel deberá ser realizada con precaución.
Al igual que otros agentes antiplaquetarios, clopidogrel debe usarse con precaución en pacientes que tengan un riesgo incrementado de sangrado secundario a trauma, cirugía, o a otras condiciones patológicas y en pacientes que están recibiendo tratamiento con ácido acetilsalicílico, heparina, inhibidores de glucoproteína llb/llla, antiinflamatorios no esteroideos (AINEs) o inhibidores selectivos de la recaptación de serotonina (ISRS). Si un paciente ha de someterse a un procedimiento quirúrgico electivo y no se desea un efecto antiplaquetario, es necesario interrumpir la administración de clopidogrel de 5 a 7 días antes de la cirugía.
Clopidogrel prolonga el tiempo de sangrado y debe emplearse con precaución en pacientes que tengan lesiones con tendencia a sangrar (particularmente gastrointestinal e intraocular). Medicamentos que produzcan lesiones gastrointestinales (como AAS y antiinflamatorios no esteroideos) deberán ser utilizados con precaución si están tomando clopidogrel.
Se le debe informar a los pacientes que con este tratamiento les puede tomar más tiempo del habitual para que se les controle el sangrado cuando estén tomando clopidogrel solo o en combinación con AAS; asimismo que deben informar a su médico cualquier sangrado fuera de lo común. Los pacientes deben informar a sus médicos y dentistas que están tomando clopidogrel y/u otro producto que afecte el sangrado antes de cualquier cirugía programada, y antes de que se les prescriba un nuevo medicamento.
EVC isquémico reciente: En pacientes con ataque isquémico transitorio o EVC con un alto riesgo de eventos isquémicos recurrentes, la combinación con AAS y clopidogrel ha demostrado incrementar el sangrado mayor. De ahí que esta combinación deberá ser utilizada con precaución fuera de situaciones clínicas donde la combinación haya probado ser benéfica.
Púrpura trombocitopénica trombótica: Muy rara vez se ha reportado Púrpura Trombocitopénica Trombótica (PTT) después del uso de clopidogrel, algunas veces después de una breve exposición. Se caracteriza por trombocitopenia y anemia hemolítica microangiopática acompañada de alteraciones neurológicas, disfunción renal o fiebre. La PTT es una condición seria que puede ser fatal y que requiere de tratamiento urgente, inclusive plasmaféresis (recambio de plasma).
Hemofilia adquirida: Se ha reportado hemofilia adquirida después del uso de clopidogrel. En los casos confirmados aislados de prolongación del tiempo de tromboplastina parcial activado (TTPA) con o sin sangrado. La hemofilia adquirida debe ser considerada. Los pacientes con un diagnóstico confirmado de hemofilia adquirida deben ser manejados y tratados por especialistas y se debe de suspender clopidogrel.
Citocromo P4502C19 (CYP2C19):
Farmacogenética: En pacientes que son pobres metabolizadores de CYP2C19 para clopidogrel en las dosis recomendadas se forma menos metabolito activo del clopidogrel y tiene un efecto menor sobre la función plaquetaria. En pacientes pobres metabolizadores con síndrome coronario agudo o sometidos a intervención percutánea tratados con clopidogrel, la dosis recomendada puede presentar riesgo de eventos cardiovasculares altos que en pacientes con una función CYP2C19 normal.
Reacción cruzada entre tienopiridinas: Los pacientes deben ser evaluados sobre antecedentes de hipersensibilidad a otra tienopiridina (por ej., ticlopidina, prasugrel) ya que se han reportado reacciones cruzadas entre tienopiridinas. Las tienopiridinas pueden causar reacciones alérgicas leves a severas como rash, angioedema o reacciones hematológicas como trombocitopenia y neutropenia. Los pacientes que desarrollaron una reacción alérgica previa y/o reacción hematológica a una tienopiridina pudieran tener un riesgo incrementado de desarrollar la misma u otra reacción a otra tienopiridina. El monitoreo de reacciones cruzadas es aconsejable.
Insuficiencia renal: Clopidrogrel no debe usarse en pacientes con insuficiencia renal severa. La experiencia es limitada en pacientes con insuficiencia renal leve a moderada. Por lo tanto ISCOVER® debe utilizarse con precaución en estos pacientes.
Insuficiencia hepática: ISCOVER® no debe usarse en pacientes con insuficiencia hepática severa. La experiencia es limitada en pacientes con insuficiencia hepática grave que pueden sufrir diátesis hemorrágicas. Clopidogrel por lo tanto debe utilizarse con precaución en esta población.
Excipientes: Los pacientes con problemas hereditarios raros de intolerancia a la galactosa, deficiencia de lactasa Lapp o mala absorción de glucosa-galactosa no deben tomar este medicamento.
Conducción de vehículos y uso de maquinaria: Después de la administración de clopidogrel no se ha observado disminución en la capacidad para conducir vehículos y/o maquinaria pesada, ni en el comportamiento psicométrico.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Oral.
IM reciente, EVC reciente o enfermedad arterial periférica establecida: La dosis diaria recomendada de clopidogrel es de 75 mg.
Síndrome coronario agudo: Para pacientes con síndrome coronario agudo sin elevación del segmento ST (angina inestable/infarto del miocardio sin elevación del ST) se debe iniciar clopidogrel con una dosis de carga única de 300 mg, y continuar con una dosis de 75 mg una vez al día. Se debe iniciar y continuar con ácido acetilsalicílico (desde 75 hasta 325 mg una vez al día) en combinación con clopidogrel. En el estudio CURE, a la mayoría de los pacientes con síndrome coronario agudo, también se les administró heparina en la fase aguda.
Para pacientes con infarto agudo de miocardio con elevación del segmento ST, la dosis recomendada de clopidogrel es de 75 mg una vez al día, administrado en combinación con AAS, con o sin trombolíticos. Se puede comenzar con o sin una dosis de carga de clopidogrel (en el estudio CLARITY se emplearon 300 mg).
Fibrilación auricular: Clopidogrel debe ser administrado con una dosis diaria de 75 mg. La administración del AAS (75-100 mg diarios) deberá ser iniciada y continuada en combinación con clopidogrel.
Farmacogenética: Se ha observado que aquellos pacientes con un metabolismo pobre de CYP2C19 están asociados a una disminución en la respuesta antiplaquetaria de clopidogrel. Un régimen a altas dosis (600 mg como dosis de carga seguido por 150 mg diarios) en metabolizadores pobres incrementa la respuesta antiplaquetaria; sin embargo, el régimen de dosis óptima en metabolizadores pobres aún no se ha determinado.
Clopidogrel puede ser administrado con o sin alimentos.
Poblaciones especiales:
Niños: No se han determinado ni la seguridad ni la eficacia de clopidogrel en población pediátrica.
Ancianos: No es necesario ajustar la dosis en pacientes ancianos.
Insuficiencia hepática: No es necesario ajustar la dosis (ver Precauciones generales).
Insuficiencia renal: No es necesario ajustar la dosis (ver Precauciones generales).
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: La sobredosis de clopidogrel puede producir prolongación del tiempo de sangrado y las complicaciones subsecuentes por el sangrado. Debe tomarse en consideración un tratamiento adecuado en caso de hemorragia. No se ha encontrado un antídoto específico para la actividad farmacológica de clopidogrel. En caso de ser necesaria una rápida corrección para la prolongación del tiempo de sangrado, una transfusión plaquetaria puede revertir los efectos de clopidogrel.
PRESENTACIONES:
Caja con 14, 28 o 56 tabletas de 75 mg en envase de burbuja.
Caja con 4 o 30 tabletas de 300 mg en envase de burbuja.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a no más de 30°C.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Su venta requiere receta médica. No se deje al alcance de los niños. El uso de este medicamento durante el embarazo y lactancia queda bajo responsabilidad del médico.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx
SANOFI AVENTIS WINTHROP, S.A. de C.V.
Acueducto del Alto Lerma No. 2 Local B,
Zona Industrial Ocoyoacac,
C.P. 52740, Ocoyoacac, México, México.
Reg. Núm. 429M98, SSA IV
®Marca registrada
Clave interna: MX-IPPA-ISCOVER-Tab-(CCDS- V26.1)